2. 烟台大学海洋学院 山东 烟台 264005;
3. 中国水产科学院黄海水产研究所 农业农村部海洋渔业可持续发展重点实验室 山东 青岛 266071
2. School of Ocean, Yantai University, Yantai, Shandong 264005, China;
3. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Key Laboratory of Marine Fisheries Sustainable Development, Ministry of Agriculture and Rural Affairs, Qingdao, Shandong 266071, China
近海水产养殖是人类利用近海资源开展贝类、藻类、鱼类等海产种类的养殖活动,是人类动物蛋白供给的有效途径之一,也是海洋经济的重要组成部分(Jiang et al, 2017)。随着近海养殖规模逐渐增大,其造成的环境问题备受关注。国内外有关水产养殖环境影响方面的研究已开展多年,并取得了一系列进展。不同养殖活动的环境影响模式并不相同。研究表明,贝类通过直接摄食或间接地改变营养物质的流动以及周围水体中悬浮物的密度来影响浮游植物(张莉红, 2005; 张继红, 2008)。基于现场调查发现,贝类养殖能显著影响浮游植物群落结构、丰度和粒径特征(Riisgård, 1988; Frau et al, 2016; Jiang et al, 2016; 赵文等, 2000)。而大型藻在生长和繁殖过程中会大量吸收水体中的营养盐,降低富营养化程度,从而调节和优化海洋生态环境(Harlin et al, 1979)。
贝类和藻类相结合的多营养级综合养殖是国内外广泛推广的养殖模式之一。桑沟湾是我国北方重要的半封闭型海湾规模化海水养殖示范区,也是联合国粮食及农业组织推荐的贝藻类综合养殖模式的典型案例(张继红等, 2012; 夏斌等, 2013; 徐东会等, 2017)。目前,养殖生物主要包括海带(Laminaria japonica)、龙须菜(Gracilaria lemaneiformis)、长牡蛎(Crassostrea gigas)、栉孔扇贝(Chlamys farreri)、虾夷扇贝(Patinopecten yessoensis)等(Zhang et al, 2009; 赵燕楚等, 2018)。在多营养级综合养殖模式下,浮游植物组成和数量以及营养元素的地球化学循环过程都发生了改变(唐启升等, 2013; 李瑞环, 2014)。近年来,研究人员已对桑沟湾浮游植物的种类组成、数量分布、季节变化、多样性特征等进行了研究(宋洪军等, 2007; 慕建东等, 2009; 史洁等, 2010; 李超伦等, 2010; 刘萍等, 2019)。研究表明,大规模海水养殖已经对浮游植物的群落结构产生了较大影响(李超伦等, 2010);桑沟湾海域养殖活动的季节性变化使无机氮营养盐和浮游植物生物量增加(史洁等, 2010);扇贝养殖规模的扩大与密度的增加使浮游植物α-多样性下降(宋洪军等, 2007)。另外,刘萍等(2019)研究发现,桑沟湾不同养殖类型海域浮游植物存在较大差异,海带养殖区浮游植物细胞丰度高于贝类养殖区,物种多样性则是贝类养殖区高于海带养殖区。但总体来讲,以往研究多集中在养殖海域的现场调查,基于天然水体受控条件下(例如围隔实验等)不同养殖模式对浮游植物种群结构影响的研究尚相对缺乏。
显微镜法是传统上最常用于研究浮游植物群落的技术,该方法繁琐且耗时耗力,对操作人员的专业要求也较高,同时,对小粒径(如微微型和部分微型浮游植物)和易破碎或变形的浮游植物难以进行鉴定(Paerl et al, 2003; Abad et al, 2016; Wollschlager et al, 2015)。近年来,利用高效液相色谱(HPLC)对光合色素进行分析的方法已日趋完善,浮游植物化学分类法也得到了快速发展(Wong et al, 2003; 胡俊等, 2011)。化学分类法建立的基础是浮游植物含有的某些光合色素具有生物标志性,如叶绿素a (chlorophyll a,Chl a)作为所有浮游植物(除原绿球藻外)主要的光吸收色素(Margalef, 1967),岩藻黄素(fucoxanthin)仅由硅藻(Diatom)、金藻(Chrysophyceae)和定鞭金藻(Chrysomonas sp.)产生,多甲藻素(peridinin)、别藻黄素(alloxanthin)和青绿素(prasinoxanthin)分别仅由甲藻(Dinoflagellate)、隐藻(Cryptophyta)和青绿藻(Picoprasinophytes)产生。利用光合色素化学分类方法,既能快速高效地得到浮游植物种群结构特征,还能较好地处理小粒径以及难以固定的浮游植物种群结构和生物量。本研究基于受控条件下(围隔实验),采用显微镜检和HPLC色素分析的联合应用,结合2种方法的优势,进而研究贝类和藻类养殖对浮游植物种群结构的影响,揭示高密度贝类和藻类在较短时间内(60 h)造成的浮游植物丰度和群落结构的变化趋势,为不同类型生物养殖的环境影响研究提供思路,也为多营养级综合养殖模式的区域规划和布局提供参考。
1 材料与方法 1.1 实验设计2015年10月在桑沟湾游艇码头(37°02′05″ N, 122°32′59″ E)进行围隔实验,共设置3个组,即空白对照组、贝类实验组、大型藻实验组,每组设置3个平行。贝类和大型藻分别以虾夷扇贝和龙须菜作为实验材料。实验共取样6次,每次间隔12 h,取样时间为06:00和18:00,实验持续时间为60 h。围隔实验装置为600 L的透明PVC塑料袋,采用抽水泵灌满表层海水,并将各实验生物(贝类和藻类)悬放于实验装置中,并采集0 h样品。具体实验设计见表 1。
|
|
表 1 围隔实验设计方案 Tab.1 Design of enclosure experiments |
样品采集前,首先对实验装置内的水体进行缓慢搅拌,以保证样品采集的均匀性。利用YSI 1556型多参数水质分析仪(美国)现场测定温度、盐度和溶解氧(DO)等环境因子。采用有机玻璃采水器采集表层水样,经200 μm筛绢除去大的浮游动物和杂质,在弱真空(< 0.03 MPa)下经玻璃纤维膜(0.7 μm, GF/F, Whatman)过滤。滤膜置于液氮中保存,直至HPLC分析,滤液用塑料小瓶保存于–20℃冰箱,带回实验室后测定样品营养盐。取1 L海水加入15 mL鲁哥氏液固定,样品静置48 h吸去上清液,最终浓缩至5~15 mL,进行浮游植物显微镜分析。
1.2.1 浮游植物样品分析水样采集参照《海洋调查规范—海洋生物调查》(GB/T12763-2007),并完成浮游植物样品的处理和分析;使用显微镜(OLYMPUS BX51, 日本)对浮游植物进行分类鉴定和数量统计(中国科学院中国孢子植物志委员会, 2003; 金德祥等, 1965)。
1.2.2 营养盐分析按照《海洋调查规范—海洋生物调查》(GB/T12763-2007),分别采用萘乙二胺分光光度法、镉柱还原法、次溴酸盐氧化法和磷钼蓝分光光度法测定亚硝酸氮(NO2–-N)、硝酸氮(NO3–-N)、氨氮(NH4+-N)和磷酸盐(PO43–-P)。溶解性无机氮(DIN)为亚硝酸盐、硝酸盐和铵盐三者之和。因0 h水体样品保存不当,营养盐数据异常,本文不做统计。
1.2.3 光合色素分析利用HPLC对样品进行色素测定,相关操作参考Zapata等(2000)的方法。将色素滤膜从–80℃冰箱取出剪碎,加入3mL 95%甲醇萃取,冰水浴超声8 min,采用PTFE针筒滤器(0.22 μm孔径)过滤,得到色素提取液。将200 μL色素提取液与67 μL超纯水混合均匀后于高效液相色谱仪上测定即可。以上操作均于低温避光条件下操作,防止色素降解。HPLC分析采用Agilent 1200系列,配置1315C二极管阵列检测器,于440 nm波长条件下检出色谱峰。色素标准品共包括22种:Mg DVP (Magnesium divinyl pheoporphyrin a5 monomethyl ester)、二乙烯基叶绿素a (divinyl chlorophyll a)、脱镁叶绿酸a (pheophorbide a)、脱镁叶绿素a (pheophythin a)、Chl a、叶绿素b (chlorophyll b)、叶绿素c2 (chlorophyll c2)、叶绿素c3 (chlorophyll c3)、岩藻黄素、19′-己酰基氧化岩藻黄素(19′-hexanoyloxyfucoxanthin)、β-胡萝卜素(β-carotene)、多甲藻素、19′-丁酰基氧化岩藻黄素(19′-butanoyloxyfucoxanthin)、硅甲藻黄素(diadinoxanthin)、别藻黄素、硅藻黄素(diatoxanthin)、叶黄素(lutein)、甲藻黄素(dinoxanthin)、紫黄质(violaxanthin)、新黄素(neoxanthin)、玉米黄素(zeaxanthin)和青绿黄素,由丹麦DHI公司生产。
1.3 生物多样性计算方法浮游植物多样性指数、物种均匀度指数采用以下公式计算:
物种多样性指数采用香农–威尔多样性指数(H′,Shannon-Weaver index) (Shannon et al, 1949):
| $ H' = -\sum\limits_{i = 1}^S {Pi{{\log }_2}Pi\; \; \; \; \; (Pi = Ni/N)} $ |
物种均匀度指数采用Pielou指数(J) (Pielou, 1969):
| $ J = \frac{{H'}}{{{{\log }_2}S}} $ |
式中,N为某个样品中所有物种的总个体数;Pi为某个样品中第i种的个体数与该样品个体数的比值;S为某个样品中的总物种数;Ni为所有样品中第i种的总个体数。
1.4 数据统计方法采用Microsoft Excel 2010软件进行数据处理和分析,采用Origin 2013软件作图,采用SPSS 17.0软件对物理、化学和生物参数的变化特征进行单因素方差分析(one-way ANOVA)和双因素方差分析(two-way ANOVA)。
2 结果与分析 2.1 环境因素变化特征实验期间,受寒流影响,0~36 h水体温度平均值从17.62℃降到15.73℃,随后有所回升;各实验组之间的温度和盐度无显著差异(P > 0.05)(图 1A和图 1C)。DO在0~12 h内变化较小,各实验组之间无显著差异。但从24 h开始大型藻实验组DO含量显著高于贝类实验组和对照组(P < 0.05),贝类实验组仅在60 h时DO含量显著低于对照组(P < 0.05)(图 1B)。
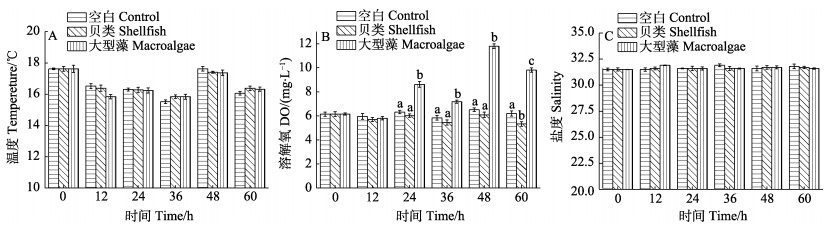
|
图 1 桑沟湾围隔实验水体环境参数变化特征 Fig.1 Variations of environmental parameters in enclosure experiments in Sanggou Bay 不同小写字母表示差异显著(P < 0.05),下同 Different letters indicated significant differences (P < 0.05). The same as below |
实验期间(12~60 h) PO43–-P浓度变化不大,各实验组之间无显著差异(P > 0.05) (图 2A)。DIN浓度则呈现出一定的波动(图 2B),即24、48和60 h时,贝类实验组均明显高于其他实验组(P < 0.05),在48 h达到最高值(6.17 μmol/L);而大型藻实验组则是在24和48 h显著低于空白对照组(P < 0.05)。
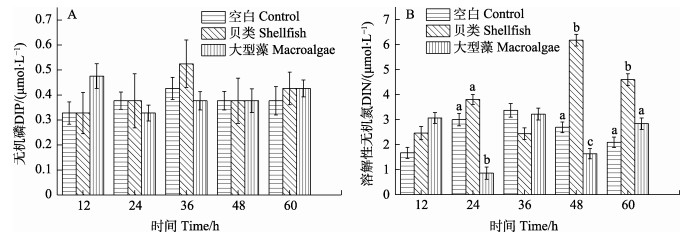
|
图 2 桑沟湾围隔实验营养盐变化特征 Fig.2 Variations of nutritive salts in enclosure experiments in Sanggou Bay |
本研究共鉴定出浮游植物硅藻门(Bacillariophyta)、甲藻门(Pyrrophyta)、蓝藻门(Cyanophyta)和金藻门(Chrysophyta)等4个门类,共计28属32种,浮游植物种类组成以硅藻为主,甲藻次之。浮游植物丰度变化范围为427~2185 cells/L。从采样时间来看,60 h时浮游植物丰度较高,平均值为1463 cells/L,36 h时浮游植物丰度较低,平均值为743 cells/L。从各实验组来看,12 h后空白实验组浮游植物丰度显著高于贝类和大型藻实验组(P < 0.05) (图 3A)。总体来讲,不同浮游植物物种多样性指数变化不大,但48 h后大型藻实验组显著低于其他实验组(P < 0.05) (图 3C),而各实验组的均匀度无显著差异(P > 0.05) (图 3B)。
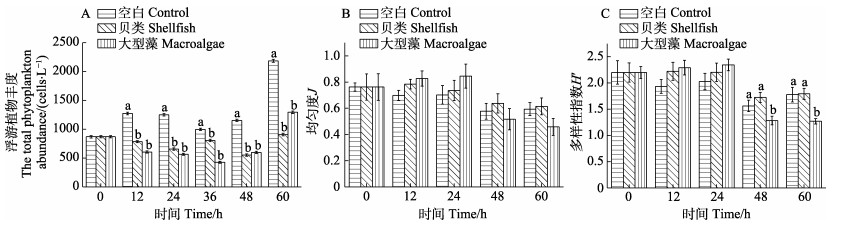
|
图 3 桑沟湾围隔实验浮游植物丰度、多样性指数与均匀度 Fig.3 Abundance, diversity indexes and evenness indexes of phytoplankton in enclosure experiments in Sanggou Bay |
水体中优势种主要包括柔弱拟菱形藻(Pseudonitzschia delicatissima)、双菱藻(Surirella sp.)、菱形藻(Nitzschia spp.)、针杆藻(Synedra spp.)等。柔弱拟菱形藻是主要优势种,其丰度变化范围为114~1133 cells/L。在实验12 h后,空白实验组柔弱拟菱形藻丰度显著高于其他实验组(P < 0.05),在48~60 h时,贝类实验组则显著低于大型藻实验组(P < 0.05) (图 4A)。双菱藻在实验初期丰度较低,但在24 h后,空白实验组水体中丰度迅速增加,并显著高于其他实验组(P < 0.05)。在12 h时,空白对照组菱形藻显著高于其他实验组(P < 0.05),但36 h后,贝类实验组丰度呈增加趋势,贝类与空白对照组相比无显著差异(P > 0.05),且二者显著高于大型藻实验组(P < 0.05) (图 4C)。针杆藻在各实验组的时间变化特征与菱形藻相似,但24 h后大型藻实验组针杆藻丰度显著低于空白对照组和贝类实验组(图 4D)。
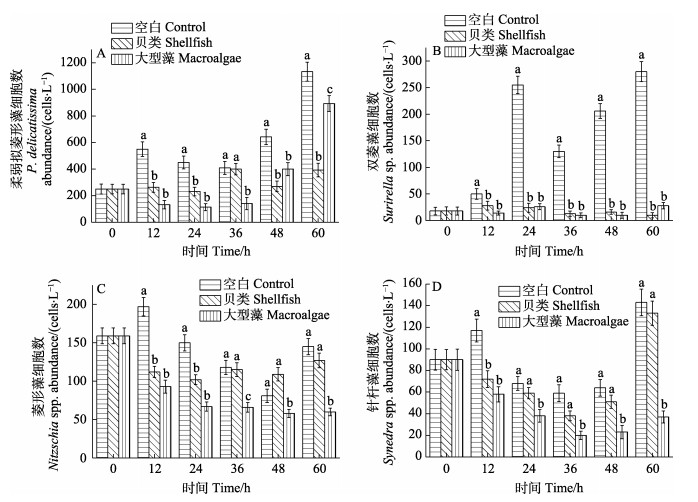
|
图 4 主要浮游植物物种的丰度变化 Fig.4 Abundance variations of main phytoplankton species |
在实验36 h后,贝类实验组Chl a浓度显著低于空白对照组(P < 0.05)(图 5A),而大型藻实验组Chl a含量仅在36~48 h低于空白对照组。在实验36 h后,贝类实验组和大型藻实验组的岩藻黄素浓度显著低于空白实验组(P < 0.05) (图 5B),但前二者并无显著差异。在36 h内,各实验组的青绿素浓度无显著差异,但48 h后,贝类实验组显著高于空白实验组和大型藻实验组(P < 0.05) (图 5C)。各实验组的别藻黄素总浓度变化均呈先降低再升高、到48 h后又降低的趋势(图 5D)。在实验12 h内,各实验组间的别藻黄素无显著差异,但24 h后,贝类实验组别藻黄素浓度就显著低于空白对照组(P < 0.05);在48~60 h时,贝类实验组别藻黄素浓度也显著低于大型藻实验组(P < 0.05),但大型藻实验组与空白对照组之间无显著差异(P > 0.05)。
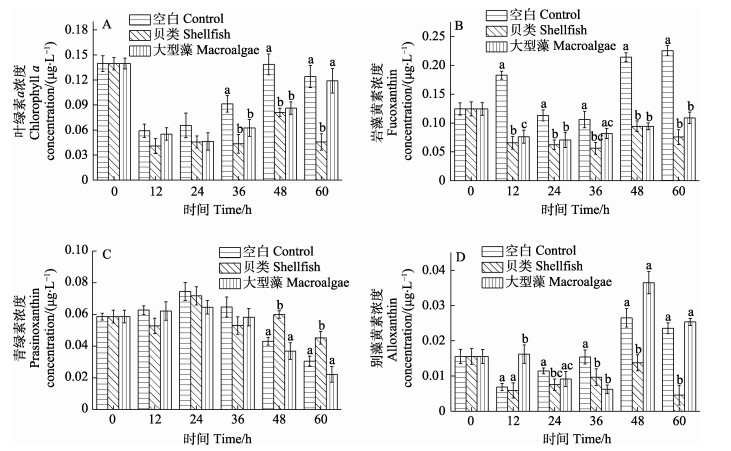
|
图 5 桑沟湾围隔实验主要浮游植物物种特征色素变化 Fig.5 Changes of pigment characteristic of main phytoplankton species floating in enclosure experiments in Sanggou Bay |
对时间、养殖生物以及时间×养殖生物进行相关性分析(表 2),结果显示,时间、养殖生物和时间×养殖生物均与DO、溶解性硅(DSi)、DIN、丰度、柔弱拟菱形藻、双菱藻、菱形藻、针杆藻、Chl a、岩藻黄素、多甲藻素、别藻黄素呈极显著正相关(P < 0.01);时间、时间×养殖生物与温度、DIP、H´呈极显著正相关(P < 0.01),与盐度呈显著正相关(P < 0.05),而时间也与J呈极显著正相关(P < 0.01),时间×养殖生物与J呈显著正相关(P < 0.05);养殖生物与H´呈显著正相关(P < 0.05),而与温度、盐度、DIP、J无显著相关关系(P > 0.05)。
|
|
表 2 不同时间不同实验组各变量差异显著性的双因素方差分析 Tab.2 Two-way analysis of variance of the significant difference of variables in different experimental groups at different time |
温度和盐度是水体的基本特征,是影响浮游植物生长与分布的重要影响因素之一。在本研究开始12 h,由于寒流来袭,水体温度迅速下降,在36 h水体温度达到最低值,平均值为15.73℃,水体温度的突然下降,导致不同实验组浮游植物丰度明显降低(图 1A),这应该是温度与时间、时间×养殖生物呈极显著相关关系的原因(P < 0.01; 表 2)。水体总溶解氧(DO)浓度与时间、养殖生物、时间×养殖生物均呈极显著相关关系(P < 0.01),其中,受不同实验生物影响较大,主要体现在24 h后大型藻类实验组显著升高(P < 0.05),贝类实验组则小幅下降(图 1B, 表 2),大型藻类光合作用和贝类呼吸作用是造成这种现象的主要原因。贝类和藻类养殖对水体中的营养盐浓度也造成一定影响。不同养殖生物种类对DIN、DSi呈极显著相关关系(P < 0.01),尤其对DIN的影响最大,但对磷酸盐浓度影响较小,而多元方差分析结果中不同养殖生物种类对DIP无显著相关关系(P > 0.05)也体现了这一点(图 2B, 表 2)。贝类向水体排放营养物质主要包括直接释放和粪便间接释放2种方式。贝类排泄的粪便以及假粪会产生大量氮,从而在贝类养殖海域形成营养物库,间接促进了碎屑食物链的循环以及藻类的生长(Tenore et al, 1973; Hatcher et al, 1994; 张继红, 2008)。但大型藻类对DIN的影响却时有变化,可能与大型藻的生理状态有关,如60 h时可能由于碎屑类物质的腐烂,导致营养盐浓度回升。
本研究表明,高密度贝类和藻类养殖能显著降低浮游植物生物量(图 3A, 图 5A)。不同实验组水体中环境因素(温度、盐度等)变化不大,而多元分析结果中养殖生物与温度和盐度也都无显著相关关系(P > 0.05) (图 1A、图 1C和表 2),且贝类养殖增加了DIN浓度,从而推断贝类和藻类实验组中,浮游植物生物量降低应该与贝类滤食和大型藻的化感作用抑制了浮游植物生长相关(Sanna et al, 2004; Ward et al, 2004; Jiang et al, 2016; 潘玉龙等, 2019)。Ward等(2004)研究表明,贝类滤食行为会对海洋环境中的浮游植物分布、营养物质循环和食物链产生很大影响,进而影响水体初级生产力水平和环境质量状况。在本研究中,营养盐竞争和化感作用是龙须菜在浮游植物竞争中发挥作用的重要因素。张善东等(2005)研究也显示,龙须菜对营养盐的吸收能力远远高于微藻,这使得龙须菜在共培养体系中占据优势的同时,抑制了微藻的生长。另外,龙须菜能分泌克生物质,抑制多种藻华生物生长,这种化感作用在营养盐充足的状态下依然存在(Yang et al, 2015; 黄银爽等, 2017)。
研究表明,双壳贝类对浮游植物的摄食具有一定选择性,即使对同一个门类(主要是硅藻)不同种间也存在摄食选择性(张莉红, 2005; Bougrier et al, 1997; Mafra et al, 2009)。许多双壳贝类难以消化某些硅藻物种,或者这些硅藻对其是不利的食物来源,贝类似乎更倾向于摄食甲藻和其他鞭毛藻类(Ward et al, 2004; Mafra et al, 2009)。Shumway等(1985)研究发现,与同样大小的硅藻和隐藻相比,欧洲平牡蛎(Ostrea edulis)更加倾向于选择性摄食甲藻。Rouillon等(2005)研究表明,甲藻在海水中不占优势,但在贻贝胃中的比例却达25%~30%。另外,张莉红等(2008)研究结果也表明,栉孔扇贝对东海原甲藻(Prorocentrum donghaiense)的摄食率高于中肋骨条藻(Skeletonema costatum)和小角毛藻(Chaetoceros minutissimus)。本研究表明,贝类实验组水体中的别藻黄素在24 h后显著低于空白对照组(图 5D),而别藻黄素是隐藻的特征色素(Pan et al, 2020),说明贝类对隐藻的滤食效果非常显著。Loret等(2000)研究发现,尽管隐藻在水中的含量相对较低,但跟与其粒径相似的绿藻相比,欧洲大扇贝(Pecten maximus)还是会选择性摄食隐藻。而关于贝类对硅藻的摄食,Bougrier等(1997)用3~4种不同的浮游植物混合饵料喂养长牡蛎发现,新月菱形藻(Nitzschia closterium)、牟氏角毛藻(Chaetoceros muelleri)和中肋骨条藻被优先以假粪的形式排出。本研究进一步证实了虾夷扇贝对不同种类的硅藻存在摄食选择性,对4种硅藻的滤除效果差异较大,例如,对拟菱形藻和双菱藻有较大的滤除效应,但对菱形藻和针杆藻却影响不大(图 4)。但在本研究中,硅藻种类和丰度相对较小,相关研究仍值得深入探索。
浮游植物的粒径差异也是影响双壳贝类选择性摄食的主要因素,双壳贝类会优先选择粒径较大的浮游植物(> 3 μm)滤食,且滤食效率随食物粒径的增加呈非线性增加至最大值(Ward et al, 2004; Pan et al, 2020)。牡蛎对粒径 > 3 μm的颗粒有效截留率能达50%,而对粒径 > 7 μm的颗粒有效截留率则可达100% (Cranford et al, 2011; Pan et al, 2020);斑马贻贝(Dreissena polymorpha)可滤食粒径 > 7~100 μm的浮游植物,且对粒径为71~95 μm的藻类选择性更高(Naddafi et al, 2007)。Jiang等(2019)研究也发现,海湾扇贝(Argopecten irradians)相对于小型和微型浮游植物,较少摄食微微型浮游植物,微微型浮游植物特征色素玉米黄素和青绿素在其消化腺中的比重低于其在海水中的比重。贝类的摄食器官难以捕获小粒径浮游植物,尤其是微微型浮游植物,或者对其滤除率较低(Cranford et al, 2008),因此,微微型浮游植物对贝类饵料的贡献价值不高(Dupuy et al, 2000; 李凤雪等, 2020)。本研究结果显示,48 h后水体中青绿素浓度显著高于对照组和大型藻实验组(图 5C)。Pras是青绿藻的特征色素,桑沟湾海域水体中青绿素粒径范围主要集中在3 μm以下(微微型浮游植物)(数据未发表)。本研究进一步证实了贝类养殖对微微型藻类的生长有明显促进作用,这与Jiang等(2016)的研究结果相似。高密度贝类养殖导致水体中小型和微型浮游植物及浮游动物丰度显著降低,减少了微微型浮游植物的营养竞争者和捕食者,进而导致微微型浮游植物在贝类养殖区繁盛(Petersen et al, 2008; Cranford et al, 2011; 白美娜等, 2019)。但与贝类养殖相比,大型藻类养殖则对微微型青绿藻生物量无显著影响(图 5C),进一步揭示了2种不同类型的养殖模式对浮游植物种群影响显著不同。
ABAD D, ALBAINA A, AGUIRRE M, et al.. Is metabarcoding suitable for estuarine plankton monitoring? A comparative study with microscopy. Marine Biology, 2016, 163: 149 DOI:10.1007/s00227-016-2920-0 |
BAI M N, JIANG T, CHEN F Y, et al.. The temporal and spatial distribution of autotrophic picoplankton and community in the oyster culture area and its adjacent waters of Dapeng Cove, Guangdong, China. Oceanologia et Limnologia Sinica, 2019, 50(1): 129-138 [大亚湾大鹏澳牡蛎养殖临近海域自养微微型浮游生物种群分布特征. 海洋与湖沼, 2019, 50(1): 129-138] |
BOUGRIER S, HAWKINS A J S, HÉRAL M.. Preingestive selection of different microalgal mixtures in Crassostrea gigas and Mytilus edulis, analysed by flow cytometry. Aquaculture, 1997, 150(1/2): 123-134 |
CRANFORD P J, LI W, STRAND Ø, et al. Phytoplankton depletion by mussel aquaculture: High resolution mapping, ecosystem modeling, and potential indicators of ecological carrying capacity. ICES, 2008
|
CRANFORD P J, WARD J E, SHUMWAY S E. Bivalve filter feeding: Variability and limits of the aquaculture biofilter. In: SHUMWAY S E. Shellfish aquaculture and the environment. Oxford, UK: Wiley-Blackwell, 2011, 81– 124
|
DUPUY C, VAQUER A, LAM-HOAI T, et al.. Feeding rate of the oyster Crassostrea gigas in a natural planktonic community of the Mediterranean Thau Lagoon. Marine Ecology Progress Series, 2000, 205(1): 171-184 |
FRAU D, MOLINA F R, MAYORA G. Feeding selectivity of the invasive mussel Limnoperna fortunei (Dunker, 1857) on a natural phytoplankton assemblage: What really matters? Limnology, 2016, 17(1): 47–57
|
HARLIN M M, THORNE-MILLER B, THURSBY G B.. Ammonium uptake by Gracilaria sp.(Florideophyceae) and Ulva lactuca (Chlorophyceae) in closed system fish culture. Proceedings of International Seaweed Symposium Control, 1979, 285-292 |
HATCHER A J, GRANT J, Schofield B.. Effects of suspended mussel culture (Mytilus spp.) on sedimentation, benthic respiration and sediment nutrient dynamics in a coastal bay. Marine Ecology Progress Series, 1994, 115: 219-235 DOI:10.3354/meps115219 |
HU J, LIU X, WANG L, et al.. RP-HPLC determination of photosynthetic pigments. Marine Sciences, 2011, 35(11): 19-28 [应用反相高效液相色谱定性和定量浮游植物光合色素. 海洋科学, 2011, 35(11): 19-28] |
HUANG Y S, OU L J, YANG Y F.. Nutrient competition between macroalgae Gracilaria lemaneiformis and phytoplankton in coastal waters of Nan'Ao Island, Guangdong. Oceanologia et Limnologia Sinica, 2017, 48(4): 806-813 [广东南澳岛大型海藻龙须菜与浮游植物对营养盐的竞争利用. 海洋与湖沼, 2017, 48(4): 806-813] |
JIANG T, CHEN F Y, YU Z H, et al.. Size-dependent depletion and community disturbance of phytoplankton under intensive oyster mariculture based on HPLC pigment analysis in Daya Bay, South China Sea. Environmental Pollution, 2016, 219(16): 804-814 |
JIANG T, WANG L H, ZHANG F C, et al.. Selective feeding of bay scallop Argopecten irradians on phytoplankton community revealed by HPLC analysis of phytopigments in Bohai Sea, China. Journal of Oceanology and Limnology, 2019, 37(5): 1746-1755 DOI:10.1007/s00343-019-8280-0 |
JIANG T, YU Z H, QI Z H, et al.. Effects of intensive mariculture on the sediment environment as revealed by phytoplankton pigments in a semi-enclosed bay, South China Sea. Aquaculture Research, 2017, 48(4): 1923-1935 DOI:10.1111/are.13030 |
JIN D X, CHEN J H, HUANG K G. Diatoms floating in the Chinese Ocean. Shanghai: Shanghai Science and Technology Press, 1965 [金德祥, 陈金环, 黄凱歌. 中国海洋浮游硅藻类. 上海: 上海科学技术出版社, 1965]
|
LI C L, ZHANG Y S, SUN S, et al.. Species composition, density and seasonal variation of phytoplankton in Sanggou Bay, China. Progress in Fishery Sciences, 2010, 31(4): 1-8 [桑沟湾浮游植物种类组成、数量分布及其季节变化. 渔业科学进展, 2010, 31(4): 1-8 DOI:10.3969/j.issn.1000-7075.2010.04.001] |
Li F X, Jiang Z J, Gao Y P, et al.. Distribution of sizefractionated phytoplankton and its relationship with environmental variables in Sanggou Bay. Progress in Fishery Sciences, 2020, 41(1): 31-40 [桑沟湾浮游植物粒径结构及其与环境因子的关系. 渔业科学进展, 2020, 41(1): 31-40] |
LI R H. Nutrient dynamics under the impact of eco-aquaculture——A case study in Sanggou Bay. Doctoral Dissertation of Ocean University of China, 2014 [李瑞环. 生态养殖活动下营养盐动力学研究——以桑沟湾为例. 中国海洋大学博士研究生学位论文, 2014]
|
LIU P, SUN P, SONG H J, et al.. Spatio-temporal distribution of phytoplankton community in different aquaculture areas in the Sanggou Bay. Advances in Marine Science, 2019, 37(4): 673-680 [桑沟湾不同养殖区浮游植物群落时空变化特征. 海洋科学进展, 2019, 37(4): 673-680] |
LORET P, PASTOUREAUD A, BACHER C, et al.. Phytoplankton composition and selective feeding of the pearl oyster Pinctada margaritifera in the Takapoto lagoon (Tuamotu Archipelago, French Polynesia): In situ study using optical microscopy and HPLC pigment analysis. Marine Ecology Progress Series, 2000, 199(1): 55-67 |
MAFRA L L, BRICELJ V M, OUELLETTE C, et al.. Mechanisms contributing to low domoic acid uptake by oysters feeding on Pseudo-nitzschia cells. I. Filtration and pseudofeces production. Aquatic Biology, 2009, 6(1/2/3): 201-212 |
MARGALEF R.. Some concepts relative to the organization of plankton. Oceanography and Marine Biology: An Annual Review, 1967, 5: 257-289 |
MU J D, DONG W, CHENG B J, et al.. Ecological characteristics of phytoplankton in Sanggou Bay. Progress in Fishery Sciences, 2009, 30(3): 91-96 [桑沟湾浮游植物生态特征. 渔业科学进展, 2009, 30(3): 91-96 DOI:10.3969/j.issn.1000-7075.2009.03.016] |
NADDAFI R, PETTERSSON K, EKLÖV P.. The effect of seasonal variation in selective feeding by zebra mussels (Dreissena polymorpha) on phytoplankton community composition. Freshwater Biology, 2007, 52(5): 823-842 DOI:10.1111/j.1365-2427.2007.01732.x |
PAERL H W, VALDES L M, PINCKNEY J L, et al.. Phytoplankton photopigments as indicators of estuarine and coastal eutrophication. BioScience, 2003, 53(10): 953-964 DOI:10.1641/0006-3568(2003)053[0953:PPAIOE]2.0.CO;2 |
PAN H Z, LI A F, CUI Z G, et al.. A comparative study of phytoplankton community structure and biomass determined by HPLC-CHEMTAX and microscopic methods during summer and autumn in the central Bohai Sea, China. Marine Pollution Bulletin, 2020, 155: 111172 DOI:10.1016/j.marpolbul.2020.111172 |
PAN Y L, LIU X, SHA J J, et al.. Influence of environmental factors on phytoplankton community structure and its relationship with coastal aquaculture in the waters adjacent to Rongcheng. Progress in Fishery Sciences, 2019, 40(5): 26-33 [荣成近岸养殖海域浮游植物群落结构及与环境因子的关系. 渔业科学进展, 2019, 40(5): 26-33] |
PETERSEN J K, NIELSEN T G, DUREN L V, et al.. Depletion of plankton in a raft culture of Mytilus galloprovincialis in Ría de Vigo, NW Spain. Ⅰ. Phytoplankton. Aquatic Biology, 2008, 4(2): 113-125 |
PIELOU E C. An introduction to mathematical ecology. New York: Wiley Interscience, 1969
|
RIISGÅRD H.. Efficiency of particle retention and filtration rate in 6 species of Northeast American bivalves. Marine Ecology Progress Series, 1988, 45(3): 217-223 |
ROUILLON G, RIVAS J G, OCHOA N, et al.. Phytoplankton composition of the stomach contents of the mussel Mytilus edulis L. from two populations: Comparison with its food supply. Journal of Shellfish Research, 2005, 24(1): 5-14 |
SHI J, WEI H, ZHAO L, et al.. Study on ecosystem model of multi-species culture in Sanggou Bay: Ⅱ Simulation of ecosystem and the circulation of nutrients. Progress in Fishery Sciences, 2010, 31(4): 36-42 [桑沟湾多元养殖生态模型研究: Ⅱ生态环境模拟与生源要素循环. 渔业科学进展, 2010, 31(4): 36-42 DOI:10.3969/j.issn.1000-7075.2010.04.005] |
SHUMWAY S E, CUCCI T L, NEWELL R C, et al.. Particle selection, ingestion, and absorption in filter-feeding bivalves. Journal of Experimental Marine Biology and Ecology, 1985, 91(1/2): 77-92 |
SONG H J, LI R X, WANG Z L, et al.. Interannual variations in phytoplankton diversity in the Sanggou Bay. Advances in Marine Science, 2007, 25(3): 332-339 [桑沟湾浮游植物多样性年际变化. 海洋科学进展, 2007, 25(3): 332-339 DOI:10.3969/j.issn.1671-6647.2007.03.011] |
Spore Flora Committee of Chinese Academy of Sciences. Algae of China. Vol. 5, Diatoms. Volume 1, Central class. Beijing: Science Press, 2003 [中国科学院中国孢子植物志编辑委员会. 中国海藻志. 第五卷, 硅藻门. 第一册, 中心纲. 北京: 科学出版社, 2003]
|
SUIKKANEN S, FISTAROL G O, GRANÉLI E.. Allelopathic effects of the Baltic cyanobacteria Nodularia spumigena, Aphanizomenon flos-aquae and Anabaena lemmermannii on algal monocultures. Journal of Experimental Marine Biology and Ecology, 2004, 308(1): 85-101 DOI:10.1016/j.jembe.2004.02.012 |
TANG Q S, FANG J G, ZHANG J H.. Impacts of multiple stressors on coastal ocean ecosystems and integrated multi-trophic aquaculture. Progress in Fishery Sciences, 2013, 34(1): 1-11 [多重压力胁迫下近海生态系统与多营养层次综合养殖. 渔业科学进展, 2013, 34(1): 1-11 DOI:10.3969/j.issn.1000-7075.2013.01.001] |
TENORE K R, DUNSTAN W M.. Comparison of feeding and biodeposition of three bivalves at different food levels. Marine Biology, 1973, 21(3): 190-195 DOI:10.1007/BF00355249 |
WARD J E, SHUMWAY S E.. Separating the grain from the chaff: Particle selection in suspension and depositfeeding bivalves. Journal of Experimental Marine Biology and Ecology, 2004, 300(1/2): 83-130 |
WOLLSCHLÄGER J, WILTSHIRE K H, PETERSEN W, et al.. Analysis of phytoplankton distribution and community structure in the German Bight with respect to the different size classes. Journal of Sea Research, 2015, 99: 83-96 DOI:10.1016/j.seares.2015.02.005 |
WONG C K, WONG C K.. HPLC pigment analysis of marine phytoplankton during a red tide occurrence in Tolo Harbour, Hong Kong. Chemosphere, 2003, 52(9): 1633-1640 DOI:10.1016/S0045-6535(03)00503-4 |
XIA B, CHEN B J, CUI Y, et al.. Distribution and source of organic carbon in Sanggou Bay in summer. Progress in Fishery Sciences, 2013, 34(1): 44-49 [夏季桑沟湾养殖水域有机碳的平面分布特征及其来源分析. 渔业科学进展, 2013, 34(1): 44-49 DOI:10.3969/j.issn.1000-7075.2013.01.007] |
XU D H, CHENG BJ, JIANG T, et al.. Temporal and spatial variation characteristics of water nutrients and eutrophication evaluation in aquaculture water areas of Sanggou Bay. Progress in Fishery Sciences, 2017, 38(3): 1-11 [桑沟湾养殖海域营养盐时空分布特征及富营养化评价. 渔业科学进展, 2017, 38(3): 1-11] |
YANG Y F, LIU Q, CHAI Z Y, et al.. Inhibition of marine coastal bloom-forming phytoplankton by commercially cultivated Gracilaria lemaneiformis (Rhodophyta). Journal of Applied Phycology, 2015, 27(6): 2341-2352 DOI:10.1007/s10811-014-0486-0 |
ZAPATA M, RODRÍGUEZ F, GARRIDO J L.. Separation of chlorophylls and carotenoids from marine phytoplankton: A new HPLC method using a reversed phase C8 column and pyridine-containing mobile phases. Marine Ecology Progress Series, 2000, 195(3): 29-45 |
ZHANG J H, HANSEN P K, FANG J G, et al.. Assessment of the local environmental impact of intensive marine shellfish and seaweed farming-Application of the MOM system in the Sungo Bay, China. Aquaculture, 2009, 287(3/4): 304-310 |
ZHANG J H, WANG W, HAN T T, et al.. The distributions of dissolved nutrients in spring of Sungo Bay and potential reason of outbreak of red tide. Journal of Fisheries of China, 2012, 36(1): 132-139 [桑沟湾春季营养盐分布特征及赤潮暴发诱因. 水产学报, 2012, 36(1): 132-139] |
ZHANG J H. Effect of filter feeding shellfish mariculture on the ecosystem and the evaluation of ecology carrying capacity. Doctoral Dissertation of Graduate School of Chinese Academy of Sciences (Institute of Oceanology), 2008 [张继红. 滤食性贝类养殖活动对海域生态系统的影响及生态容量评估. 中国科学院研究生院(海洋研究所)博士研究生学位论文, 2008]
|
ZHANG L H, ZHANG X L, ZHU M Y.. Preliminary study on selective feeding of the scallop (Chlamys farreri) on Dirtom and Dinoflagellate cells. Advances in Marine Science, 2008, 26(3): 372-376 [栉孔扇贝对硅藻和甲藻细胞的选择性摄食初探. 海洋科学进展, 2008, 26(3): 372-376 DOI:10.3969/j.issn.1671-6647.2008.03.013] |
ZHANG L H. A preliminary study of the impacts of scallop culture on phytoplankton community. Master´s Thesis of Ocean University of China, 2005 [张莉红. 扇贝养殖对浮游植物群落影响的初步研究. 中国海洋大学硕士研究生学位论文, 2005]
|
ZHANG S D, SONG X X, WANG Y, et al.. Competition on nutrients between Gacilaria lemaneiformis and Scrippsiella trochoidea (Stein) loeblich Ⅲ. Oceanologia et Limnologia Sinica, 2005, 36(6): 556-561 [大型海藻龙须菜与锥状斯氏藻间的营养竞争研究. 海洋与湖沼, 2005, 36(6): 556-561 DOI:10.3321/j.issn:0029-814X.2005.06.010] |
ZHAO W, DONG S L, ZHANG Z Q, et al.. The effects of tilapia (Orecohromis niloticus) biomass on the community structure of plankton in saline-alkaline water microcosms. Journal of Ocean University of Qingdao, 2000, 30(3): 435-440 [罗非鱼放养量对盐碱水微型生态系统浮游生物群落的影响. 青岛海洋大学学报(自然科学版), 2000, 30(3): 435-440 DOI:10.3969/j.issn.1672-5174.2000.03.026] |
ZHAO Y C, ZHAO L, ZHANG W C, et al.. Seasonal variation of the abundance and biomass of picoplankton in the Sanggou Bay. Marine Sciences, 2018, 42(5): 145-154 [桑沟湾微微型浮游生物丰度和生物量分布的季节变化. 海洋科学, 2018, 42(5): 145-154] |



