 放流群体的可行性研究
放流群体的可行性研究
2. 天津市海洋牧场技术工程中心 天津 300457;
3. 中国水产科学研究院淡水渔业研究中心 江苏 无锡 214081
 (Liza haematocheila)增殖放流群体识别的可行性,以体长5 cm左右的
(Liza haematocheila)增殖放流群体识别的可行性,以体长5 cm左右的 幼鱼为研究对象,将其养殖海水中Sr2+的质量浓度分别调至50、100、200和400 mg/L,以自然海水(Sr2+质量浓度为7.9 mg/L)为对照组,人为改变
幼鱼为研究对象,将其养殖海水中Sr2+的质量浓度分别调至50、100、200和400 mg/L,以自然海水(Sr2+质量浓度为7.9 mg/L)为对照组,人为改变 幼鱼生存环境中Sr2+的质量浓度标记48 h。同时开展双环标记实验(在
幼鱼生存环境中Sr2+的质量浓度标记48 h。同时开展双环标记实验(在 3 cm幼鱼时进行Sr2+质量浓度200 mg/L海水96 h标记,待其长至5 cm幼鱼时进行Sr2+质量浓度100 mg/L海水48 h标记)。实验结果显示,Sr2+质量浓度50~400 mg/L的海水48 h标记的
3 cm幼鱼时进行Sr2+质量浓度200 mg/L海水96 h标记,待其长至5 cm幼鱼时进行Sr2+质量浓度100 mg/L海水48 h标记)。实验结果显示,Sr2+质量浓度50~400 mg/L的海水48 h标记的 耳石Sr/Ca比均出现一个显著的上升阶段且面分析出现明显的“高Sr2+标记环”。综合本研究结果和标记效率,推荐采用Sr2+质量浓度为50 mg/L的海水进行
耳石Sr/Ca比均出现一个显著的上升阶段且面分析出现明显的“高Sr2+标记环”。综合本研究结果和标记效率,推荐采用Sr2+质量浓度为50 mg/L的海水进行 耳石Sr2+标记。双环标记实验
耳石Sr2+标记。双环标记实验 耳石Sr2+元素面分布结果出现层次分明的双环,且双环标记组
耳石Sr2+元素面分布结果出现层次分明的双环,且双环标记组 耳石2条不同标记环的线性分析结果与其相对应的单环标记组基本一致,这表明通过Sr2+标记次数来进行不同放流群体识别是可行的。
耳石2条不同标记环的线性分析结果与其相对应的单环标记组基本一致,这表明通过Sr2+标记次数来进行不同放流群体识别是可行的。 耳石 Sr2+标记 Sr2+质量浓度 双环标记
耳石 Sr2+标记 Sr2+质量浓度 双环标记 2. Center for Marine Ranching Engineering Science Research of Tianjin, Tianjin 300457, China;
3. China Freshwater Fisheries Research Center, Chinese Academy of Fishery Sciences, Wuxi, Jiangsu 214081, China
鱼类在生长发育过程中,水体中的CaCO3在耳石上沉积的同时,其他微量元素也被沉积在耳石中,由于它的非细胞性和代谢惰性,一般不会发生分解或重吸收,这种元素的信息可以一直保存下来,成为记录鱼类生活史的元素指纹(elemental fingerprints)(李秀启等, 2017)。目前,在鱼类耳石中已检测出的元素种类有50多种(熊瑛等, 2015),且主要来源于鱼类生活的水环境和食物(郭弘艺等, 2015; 熊瑛等, 2015)。水环境或食物的元素通过吸收进入血液,再由血液进入内耳淋巴液;最终通过结晶作用将元素沉积在耳石中(Sturrock et al, 2012)。但由于各种元素的性质不同,耳石对不同环境元素的响应有所差别(郭弘艺等, 2015; 熊瑛等, 2015)。锶(Sr2+)作为一种硬酸元素,水体环境中和耳石中Sr2+的浓度具有显著的正相关性(Walther et al, 2006)。因此,耳石Sr/Ca比分析一直以来被作为鱼类生境重建和种群鉴定的重要技术手段(王玉堃等, 2016; 李孟孟等, 2017a),并逐步在增殖放流效果评估中得以研究应用(李秀启等, 2017; 司飞等, 2019a)。
目前,增殖放流鱼类标记方法中,挂牌标记和被动整合式雷达标要求鱼苗体长较大且适合小规模标记(Waldman et al, 1990; Navarro et al, 2007; 周辉霞等, 2017),而分子标记需要清晰的亲本遗传信息(童爱萍等, 2015)。但目前国内鱼类增殖放流的现状是放流的苗种以小规格苗种为主,放流数量较大、放流企业较多且存在鱼苗遗传背景信息不清的情况。而耳石Sr2+标记具有成本低、标记方法简便易操作、对苗种无损伤、一旦标记不受外界影响, 可以对小规格苗种进行大规模标记等优点,是鱼类标记放流技术研究的一个新热点问题(司飞等, 2019a)。
与淡水及河口鱼类耳石Sr/Ca比和生境中的Sr/Ca比直接相关不同,海水中的Sr/Ca比不是影响海水鱼类耳石Sr/Ca比的主要因素(Brown et al, 2009),海水鱼类耳石Sr/Ca比可能受到海水环境中的Sr和Ca的相对浓度、鱼类种类特性、水温、盐度和鱼类生理状态的影响(熊瑛等, 2015)。因此,海水中的Sr2+浓度对海水鱼类耳石Sr/Ca比的影响,需分种类加以区别研究。





实验用鱼为河北省黄骅市宏润水产养殖有限公司繁育的体长为3 cm左右的
通过向海水中添加SrCl2·6H2O将海水中Sr2+质量浓度分别提升至50、100、200和400 mg/L,其中Sr2+质量浓度为400 mg/L的海水Sr2+浓度处于过饱和状态,海水呈乳白色。
将Sr2+质量浓度为50、100、200和400 mg/L的海水分别注入50 L的实验水族箱中,作为不同Sr2+质量浓度标记组,分别以L5M50、L5M100、L5M200和L5M400表示;同时,将无添加SrCl2·6H2O的自然海水单独注入1个50 L的实验水族箱,作为对照组,用L5M0表示。
挑选体长为5 cm左右健康的幼鱼500条,均匀分配到4个标记组和一个对照组,开始实验。整个标记期间,不换水,每天正常投喂2~3次。标记48 h后,分别将每个处理组中全部幼鱼单独转移到一个网箱中进行后期饲养。网箱规格为1.5 m×1.5 m×1.3 m。待幼鱼长至约10 cm左右时,每个处理组随机挑选5尾用于耳石微化学分析。后期饲养期间,养殖用水和养殖管理同暂养,每天观察幼鱼的死亡状况,并记录。
1.3 双环标记实验实验开始前,海水中Sr2+质量浓度经电感耦合等离子质谱仪(ICP MS)测定,为7.9 mg/L。通过向海水中添加SrCl2·6H2O将海水中Sr2+质量浓度分别提升至100和200 mg/L。
将Sr2+质量浓度为200 mg/L的海水注入到2个50 L的实验水族箱中,并随机挑选体长为3 cm左右健康的幼鱼200尾,均分到2个实验水族箱中。幼鱼在Sr2+质量浓度为200 mg/L的海水中标记96 h后,将所有标记幼鱼转移到2个网箱中继续暂养。标记幼鱼的暂养网箱规格同1.2,网箱置于养殖池中,网箱为透水网衣,网箱中的海水可与养殖池的海水自由交换。标记幼鱼暂养条件同其他幼鱼暂养一致。暂养30 d后,标志幼鱼长至5 cm左右,开始第2次标记。将Sr2+质量浓度为100 mg/L的海水注入2个50 L的实验水族箱中,并随机从第1次标记的幼鱼中挑选体长为5 cm左右健康幼鱼100尾,移入其中一个实验水族箱中进行二次48 h标记;同时挑选体长为5 cm左右未进行标记的健康幼鱼100尾,移入另一个实验水族箱中标记48 h。将200 mg/L的海水标记、双环标记和100 mg/L的海水标记幼鱼分别单独转移到一个网箱中继续暂养。分别用SL3、DL3-5和SL5表示200 mg/L的海水标记、双环标记和100 mg/L的海水标记。整个标记期间,不换水,每天正常投喂2~3次。待幼鱼长至约为10 cm左右时,随机挑选5尾用于耳石微化学分析。
1.4 耳石检测方法 1.4.1 耳石摘取及前处理利用剪刀、尖头镊等工具将一对矢耳石取出,剔除有机质,分别用去离子水、无水乙醇清洗,置于48孔盒中干燥备用。从一对矢耳石中随机选取一块用于前处理和微化学分析,前处理参照李孟孟等(2017b)的方法。先将耳石用Epofix环氧树脂进行固定包埋,38℃烘干12 h以上。然后,将包埋块用AB胶粘贴于干净的载玻片上,凝固2 h后,使用金刚石磨轮的碾磨机(Discoplan-TS型,Struers公司, 丹麦)切割碾磨。粗磨阶段用500目金刚砂轮碾磨至耳石微露,接着用1200目砂纸精磨至耳石核心暴露,然后用磨抛机(Labo Pol-35, 丹麦Struers公司)装备织布机抛光盘配合抛光液抛光,至耳石表面无明显划痕。最后,将样品放入Milli-Q水中超声清洗5 min后,自然条件下晾干24 h,完全干燥后,使用真空镀膜机(JEE-420, 日本电子株式会社)蒸镀碳膜(36A, 25 s)。
1.4.2 耳石的EPMA分析耳石的电子探针显微分析(electron probe microanalysis, EPMA)参考司飞等(2019a)和杨健等(2010)的方法,利用X射线电子探针微区分析仪((JXA-8100型EPMA,日本电子株式会社)从耳石核心沿耳石最长径至耳石边缘呈直线进行耳石Sr2+元素定量线分析。标准样品使用CaCO3和SrTiO3。定量线分析EPMA的参数设定:加速电压为15 kV,电子束电流为2.0×10–8 A;束斑直径为3 μm,每点驻留时间为15 s;以间距10 μm连续进行打点测定。所有耳石线分析完后,用电子束在耳石矢状面表面扫描进行面分析。其EPMA加速电压和电子束电流分别为15 kV和5.0×10–7 A,束斑直径为3 μm,像素为6 μm×6 μm,每点驻留时间为30 ms。由于耳石中Sr含量远小于Ca含量,按照国际惯例将Sr/Ca比标准化,即统一用Sr含量/Ca含量×103表示。
1.5 数据处理采用Excel 2010和SPSS 19.0软件对数据进行统计分析,采用单因素方差分析(one-way ANOVA)或χ2检验,P < 0.05表示差异显著;利用Excel 2010和SigmaPlot 1.0软件作图。
2 结果与分析 2.1
对50、100、200和400 mg/L浸泡组和对照组Sr2+元素在

|
图 1 不同Sr2+浓度处理后 |

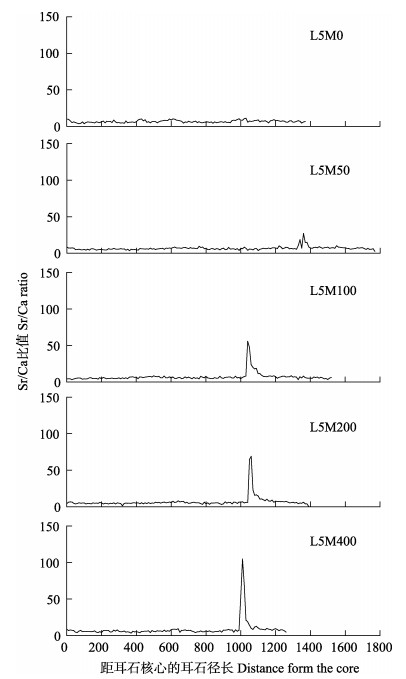
通过定量线分析可知,50、100、200和400
mg/L浸泡组的Sr/Ca比均在距核1100 μm附近出现增高阶段(图 2)。线性分析结果显示,Sr2+质量浓度为50~400 mg/L,标记时长为48 h,
|
图 2 不同处理组 |
将




|
|
表 1 不同处理组 |






|
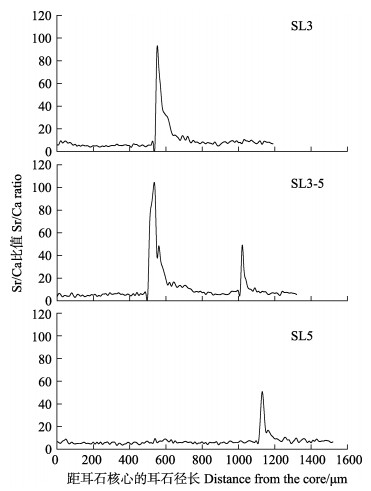
图 3 双环标记实验 |
线性分析结果显示,Sr2+质量浓度为200 mg/L,标记时长为96
h,体长为3 cm的

|
图 4 双环实验 |
将





|
|
表 2 双环标记实验 |
由于耳石是一种具有新陈代谢惰性的钙化结构(Campana et al, 1985),沉积在耳石中的生境元素能永久性保存,其可很好地记录鱼类生境的变迁(Elsdon et al, 2008)。因此,耳石微化学分析一直以来均作为一种重要的技术手段,用于鱼类的生境重建和种群鉴定(王玉堃等, 2016; 李孟孟等, 2017a)。随着学者们对大规模小规格鱼类标记方法的探索,耳石Sr2+标记技术逐步由标记淡水鱼类(李秀启等, 2017)向标记海水鱼类(张辉等, 2015; 司飞等, 2019a)发展。本研究中,4个标记浓度处理组





鱼类的耳石随着鱼类的生长而不断生长(邓维德等, 2010),随着耳石的总重量不断增加,一些特定环境如Sr2+标记在耳石中沉积的特定元素相对含量逐渐下降(Yamada et al, 1979; Schroder et al, 1995)。由于原子吸收光谱法(AAS)和电感耦合等离子体质谱(ICP-MS)等检测方法只能检测均一化后的整体耳石样品(司飞等, 2019b),故非常容易出现Sr2+标记随着鱼类生长而消失的假象。与之相比,EPMA可精确分析耳石剖面上不同位置的Sr2+含量沉积情况,从而不受标记鱼生长等限制,可避免上述局限,同时也为开展小规格


外源Sr2+在耳石内沉积量响应性变化存在着一定时滞性(邱晨等, 2019),不同的标记实验其时滞性有所不同(王臣等, 2015; 李秀启等, 2017; 邱晨等, 2019)。本研究中,2次实验间隔时间约为20 d,2次标记环之间层次分明。但双环标记时间是否可以进一步缩短,需要结合时滞现象与耳石结构、Sr2+沉积机制及鱼体生长阶段特征等相关性进一步深入研究。
综上所述,耳石Sr2+标记技术可实现小规格
BROWN R J, SEVERIN K P. Otolith chemistry analyses indicate that water Sr: Ca is the primary factor influencing otolith Sr: Ca for freshwater and diadromous fish but not for marine fish. Canadian Journal of Fisheries and Aquatic Sciences, 2009, 66(10): 1790-1808 DOI:10.1139/F09-112 |
CAMPANA S E, NEILSON J D. Microstructure of fish otoliths. Canadian Journal of Fisheries and Aquatic Sciences, 1985, 42(5): 1014-1032 DOI:10.1139/f85-127 |
DENG W D, ZHAO Y H, KANG B, et al. Application of otolith in studies on fish age and growth. Chinese Journal of Zoology, 2010, 45(2): 171-180 [邓维德, 赵亚辉, 康斌, 等. 耳石在鱼类年龄与生长研究中的应用. 动物学杂志, 2010, 45(2): 171-180] |
ELSDON T S, WELLS B K, CAMPANA S E, et al. Otolith chemistry to describe movements and life-history parameters of fishes: Hypotheses, assumptions, limitations and inferences. Oceanography and Marine Biology, 2008, 46: 297-330 |
GUO H Y, ZHANG Y, TANG W Q, et al. Analysis of otolith microchemistry and screening of environmental indicator elements in early life history of Japanese eels (Anguilla japonica). Journal of Fisheries of China, 2015, 39(10): 1467-1478 [郭弘艺, 张亚, 唐文乔, 等. 日本鳗鲡幼体的耳石微化学分析及其环境指示元素筛选. 水产学报, 2015, 39(10): 1467-1478] |
LI M M, JIANG T, CHEN T T, et al. Otolith microchemistry of the estuarine tapertail anchovy Coilia nasus from the Anqing section of the Yangtze River and its significance for migration ecology. Acta Ecologica Sinica, 2017b, 37(8): 2788-2795 [李孟孟, 姜涛, 陈婷婷, 等. 长江安庆江段刀鲚耳石微化学及洄游生态学意义. 生态学报, 2017b, 37(8): 2788-2795] |
LI M M, JIANG T, KHUMBANYIWA D D, et al. Reconstructing habitat history of Coilia nasus from the Hexian section of the Yangtze River in Anhui Province by otolith microchemistry. Acta Hydrobiologica Sinica, 2017a, 41(5): 1054-1061 [李孟孟, 姜涛, Khumbanyiwa, 等. 基于耳石微化学的长江安徽和县江段刀鲚生境履历重建. 水生生物学报, 2017a, 41(5): 1054-1061]
|
LI X Q, CONG X R, SHI J H, et al. Feasibility analysis of releasing individuals of Aristichthys nobilis identification based on otolith Sr markers. Journal of Lake Sciences, 2017, 29(4): 914-922 [李秀启, 丛旭日, 师吉华, 等. 耳石锶标记在识别鳙(Aristichthys nobilis)放流个体的可行性. 湖泊科学, 2017, 29(4): 914-922] |
LIU L, LIN L, LI C H, et al. Effect assessment of marine fishery stock enhancement: A review of the literature. Guangdong Agricultural Sciences, 2014, 11061106(2): 133-137, 143 [刘璐, 林琳, 李纯厚, 等. 海洋渔业生物增殖放流效果评估研究进展. 广东农业科学, 2014, 11061106(2): 133-137, 143 DOI:10.3969/j.issn.1004-874X.2014.02.032] |
LUO G, ZHANG Z D. Problems and countermeasures of aquatic organisms proliferation and release in China. China Fisheries, 2015, 11061106(3): 32-34 [罗刚, 张振东. 我国水生生物增殖放流存在的问题及对策建议. 中国水产, 2015, 11061106(3): 32-34 DOI:10.3969/j.issn.1002-6681.2015.03.005] |
NAVARRO A A, AFONSO J M, OLIVA V, et al. Evaluation of PIT system as method to tag fingerling of gilthead seabream (Sparus auratus L.): Effects on growth, mortality and tag loss. Aquaculture, 2007, 272(S1): S294 |
QIU C, JIANG T, CHEN X B, et al. Effectiveness of otolith strontium marking for juvenile Cyprinus carpio. Chinese Journal of Applied Ecology, 2019, 30(6): 2093-2100 [邱晨, 姜涛, 陈修报, 等. 鲤稚鱼耳石锶标记效果. 应用生态学报, 2019, 30(6): 2093-2100] |
SCHRODER S L, KNUDSEN C M, VOLK E C. Marking salmon fry with strontium chloride solutions. Canadian Journal of Fisheries and Aquatic Sciences, 1995, 52: 1141-1149 DOI:10.1139/f95-111 |
SI F, REN J G, WANG Q L, et al. Strontium marking on otoliths of Paralichthys olivaceus based on immersion experiments. Journal of Fishery Sciences of China, 2019a, 26(3): 534-545 [司飞, 任建功, 王青林, 等. 基于浸泡法的牙鲆耳石锶标记技术研究. 中国水产科学, 2019a, 26(3): 534-545] |
SI F, WANG Q L, YU Q H, et al. Use of strontium chloride in otolith marking of Japanese flounder. Progress in Fishery Sciences, 2019b, 40(4): 65-72 [司飞, 王青林, 于清海, 等. 基于投喂法的牙鲆耳石锶标记. 渔业科学进展, 2019b, 40(4): 65-72] |
STURROCK A M, TRUEMAN C N, DARNAUDE A M, et al. Can otolith elemental chemistry retrospectively track migrations in fully marine fishes?. Journal of Fish Biology, 2012, 81(2): 766-795 DOI:10.1111/j.1095-8649.2012.03372.x |
TONG A P, SI F, LIU H J, et al. Application of mtDNA and microsatellite markers to distinguish the released or non- released Japanese flounder Paralichthys olivaceus. Journal of Fishery Sciences of China, 2015, 22(4): 630-637 [童爱萍, 司飞, 刘海金, 等. mtDNA和微卫星标记在放流牙鲆和非放流牙鲆鉴定中的应用. 中国水产科学,, 2015, 22(4): 630-637] |
WALDMAN J R, DUNNING D J, MATTSON M T. Notes: A morphological explanation for size-dependent anchor tag loss from striped bass. Transactions of the American Fisheries Society, 1990, 119(10): 920-923 |
WALTHER B D, THORROLD S R. Water, not food, contributes the majority of strontium and barium deposited in the otoliths of a marine fish. Marine Ecology Progress Series, 2006, 311(8): 125-30 |
WANG C, LIU W, ZHAN P R, et al. Exogenous Sr2+ sedimentation on otolith of chum salmon embryos. Chinese Journal of Applied Ecology, 2015, 26(10): 3189-3194 [王臣, 刘伟, 战培荣, 等. 外源Sr2+在大麻哈鱼胚胎耳石上的沉积. 应用生态学报, 2015, 26(10): 3189-3194] |
WANG Y K, HUANG J S, DAI F Q, et al. Insights into population structure of juvenile small yellow croaker (Larimichthys polyactis) in the Yellow Sea and the Bohai Sea from otolith elemental fingerprints. Haiyang Xuebao, 2016, 38(6): 32-40 [王玉堃, 黄建生, 戴芳群, 等. 黄、渤海小黄鱼耳石元素指纹分析及其在种群补充群体识别中的应用. 海洋学报, 2016, 38(6): 32-40 DOI:10.3969/j.issn.0253-4193.2016.06.004] |
XIONG Y, LIU H B, TANG J H, et al. Application of otolith microchemistry on reconstruction of migratory patterns and stock discrimination in marine fishes. Chinese Bulletin of Life Sciences, 2015, 27(7): 953-959 [熊瑛, 刘洪波, 汤建华, 等. 耳石微化学在海洋鱼类洄游类型和种群识别研究中的应用. 生命科学, 2015, 27(7): 953-959] |
YAMADA S B, MULLIGAN T J, FAIRCHILD S J. Strontium marking of hatchery-reared coho salmon (Oncorhynchus kisutch, Walbaum). Journal of Fish Biology, 1979, 14(3): 267-275 DOI:10.1111/j.1095-8649.1979.tb03518.x |
YANG J, LIU H B. Otolith microchemistry of grey mullet Mugil cephalus from Chongming water in the Yangtze River estuary, China. Journal of Fishery Sciences of China, 2010, 17(4): 853-858 [杨健, 刘洪波. 长江口崇明水域鲻鱼耳石元素微化学分析. 中国水产科学, 2010, 17(4): 853-858] |
YANG W B, LI J L, ZHANG B, et al. Ecological service function and species selection of living aquatic resources enhancement. Chinese Fisheries Economics, 2009, 27(4): 88-96 [杨文波, 李继龙, 张彬, 等. 水生生物资源增殖的服务功能分析和品种选择. 中国渔业经济, 2009, 27(4): 88-96 DOI:10.3969/j.issn.1009-590X.2009.04.014] |
ZHANG H, JIANG Y Z, YUAN X W, et al. Strontium labeling technique for otoliths of Pseudosciaena crocea. Journal of Fishery Sciences of China, 2015, 22(6): 1270-1277 [张辉, 姜亚洲, 袁兴伟, 等. 大黄鱼耳石锶标志技术. 中国水产科学, 2015, 22(6): 1270-1277] |
ZHOU H X, GAN W X. Advances in fish labeling technology and its application in artificial proliferation and release. Hubei Agricultural Sciences, 2017, 56(7): 1206-1210 [周辉霞, 甘维熊. 鱼类标记技术研究进展及在人工增殖放流中的应用. 湖北农业科学, 2017, 56(7): 1206-1210] |



