微藻在水产养殖中应用广泛,可作为鲜活饵料、调水剂、功能性饲料添加剂等(张国维等, 2020)。我国是世界水产养殖第一大国,对饵料微藻的需求量巨大。小球藻(Chlorella)是一类单细胞绿藻,环境适应能力强、生长速度快,细胞内含有丰富的蛋白质、脂质、叶绿素、维生素等营养成分(严佳琦等, 2011)。与世界卫生组织(WHO)和联合国粮农组织(FAO)于1973年发布的其他食物蛋白的标准蛋白质氨基酸模式(氨基酸的含量、比例和可用性)相比,小球藻蛋白质中的氨基酸模式更有利于实现畜禽等对氨基酸的平衡摄入。此外,鱼类以小球藻为饵料进行培养时,具有较高的生物利用率和消化率(Becker, 2007; Lai et al, 2019)。蛋白核小球藻(Chlorella pyrenoidosa)是最常见的小球藻品种,2012年已被卫生部批准为新资源食品(Yu et al, 2018),其细胞内的蛋白质含量可高达细胞干重的59.8% (Li et al, 2019),在水产养殖业具有广阔的应用前景。何海生等(2019)研究发现,在水产养殖水体中接种蛋白核小球藻可去除水体中的氮和磷,改善水质;同时,可提高养殖动物的特定生长率、成活率及免疫酶活性。
目前,蛋白核小球藻在我国水产养殖业的应用仍存在许多技术瓶颈。例如,微藻鲜活制品在实际应用中常常会出现供应不及时、保质期过短、营养品质和卫生指标大幅下降等问题,不仅会增加育苗成本,也可能带来病害导致育苗失败(俞建中等, 2013)。为控制微藻制品中的细菌数量,在保藏前对其进行杀菌处理可有效延长微藻保质期。目前,用于微藻液体杀菌的方法通常是巴氏杀菌及过滤除菌法(李元广等, 2014)。此外,微藻常用的保藏方法是藻种低温保藏法,但需要添加不同种类的保护剂,如二甲基亚砜、甲醇等(Chellappan et al, 2020; Saadaoui et al, 2016),一方面会增加保藏成本,另一方面也可能会在水产养殖食物链中存在潜在毒性。因此,微藻浓缩制品的直接保藏成为近些年的研究热点。研究发现,4℃直接保藏2个月的螺旋藻(Spirulina platensis)藻液浓缩制品仍保持较高的细胞活力(刘恒恒等, 2020);微拟球藻(Nannochloropsis sp.)和杜氏藻(Dunaliella tertiolecta)浓缩藻液在4℃条件下保藏2个月,其脂肪酸成分及蛋白质含量无显著变化(Welladsen et al, 2014)。如何有效保持微藻鲜活制品的相对细胞活性、营养品质并延长货架期,对于微藻在水产养殖业的商业化应用至关重要。
本研究以实验室光发酵后得到的蛋白核小球藻浓缩藻膏和浓缩藻液为研究对象,考察巴氏杀菌处理以及不同保藏温度条件下,细胞内的天然色素、蛋白质和细胞活性在连续避光保藏15 d过程中的变化规律,为开发具有实际应用价值的保藏技术提供一定的理论基础。
1 材料与方法 1.1 实验材料蛋白核小球藻(15-2070)由北京大学陈峰教授惠赠,采用Basal培养基(Ogbonna et al, 1997)进行斜面转接保藏,保藏温度为4℃。
1.2 实验方法 1.2.1 蛋白核小球藻光发酵藻液的制备用接种环从实验室保存的蛋白核小球藻藻种斜面上挑取一小环,转接到无菌Basal液体培养基中(121℃高压灭菌15 min,含10 g/L葡萄糖和1.25 g/L硝酸钠),置于温度为30℃、光照为10 μmol/(m2·s)的摇床中培养3~ 5 d。随后,将藻液转接至带有LED外光照系统的5 L光发酵罐中。为降低细胞密度增长带来的遮蔽效应对生长的影响,在培养过程中采用逐步调光策略,光照强度范围为120~560 μmol/(m2·s),pH为6.50±0.05,温度为(30±2)℃,搅拌转速为150~200 r/min,通气量为2.5~10 L/min,消泡剂浓度为0.3% (W/V),培养3~ 5 d (骆小英等, 2020)。
1.2.2 蛋白核小球藻浓缩制品的制备浓缩藻膏制备:取光发酵后藻液于4000 r/min离心10 min,弃上清液后加蒸馏水进行漩涡混合洗涤,离心后弃上清液,再加BG11培养基进行洗涤,离心弃去上清液,得到的离心沉淀即浓缩藻膏(细胞密度为8×1010 cells/mL),直接装入15 mL无菌离心管,装满并排除管内空气用于后续实验。
浓缩藻液制备:采用BG11培养基悬浮稀释浓缩藻膏,得到细胞密度为1×108 cells/mL的浓缩藻液。装入15 mL无菌离心管,装满后用于后续实验。
1.2.3 蛋白核小球藻浓缩制品的巴氏杀菌巴氏杀菌处理参考李元广等(2014):将制备好的浓缩藻膏和浓缩藻液离心管放入恒温水浴锅中,于85℃连续加热15 min,加热过程中多次手动混匀。冷却至室温后进行后续实验。
1.2.4 蛋白核小球藻浓缩制品的保藏将未经巴氏杀菌处理和经巴氏杀菌处理的浓缩制品(藻膏及藻液)分别置于室温(18℃~25℃)或者低温(4℃)条件下避光保藏15 d,每组3个平行。保藏起始时,取0.5 mL样品用于细胞活性测定;保藏过程中,每3 d取样1次,每次取样2 mL,经–40℃真空冷冻干燥后测定藻粉中的色素及蛋白质含量。
1.3 分析测试 1.3.1 蛋白质含量取100 mg冻干藻粉至消化管中,加入6.40 g混合还原性催化剂及12 mL浓硫酸,静置过夜后,于消化炉中150℃保持40 min,随后420℃保持120~150 min,至消化管中的液体呈现透明的绿色,停止消化。冷却至室温后,置于半自动凯氏定氮仪(2300,FOSS,美国)上实现自动加液、蒸馏(使用前加入400 g/L NaOH溶液以及20 g/L硼酸溶液),以甲基红–溴甲酚绿作混合指示剂,用HCl标准溶液(0.10 mol/L)滴定,粗蛋白含量(%)采用下列公式计算(Wang et al, 2020)。
| $ \text { 蛋白质含量 } \%=\frac{\left(V_{2}-V_{1}\right) \times 0.10 \times \frac{14}{1000} \times 6.25}{m \times \frac{V^{\prime}}{V}} \times 100 $ |
式中,V1和V2分别是滴定空白和滴定样品所消耗盐酸标准滴定溶液的体积(mL);m是样品质量(g);V′是样品消煮液总体积(mL);V是蒸馏用消煮液总体积(mL)。
1.3.2 色素含量测定称取冻干藻粉10 mg于2 mL冻存管中,加入适量的陶瓷珠及1 mL 90%丙酮溶液,经研磨仪(Tissuelyser-24,净信,上海)振荡后在液氮中迅速冷冻,离心收集上清液。反复多次提取至藻粉呈现白色后,合并所有上清液并定容到10 mL。经6000 r/min离心10 min后,再次吸取上清液定容至10 mL。利用紫外分光光度计(UV2300,天美,上海)测定470、646和663 nm下的吸光度,利用下列公式计算叶绿素a (Chl.a)、叶绿素b (Chl.b)和类胡萝卜素(Car)的浓度(mg/L) (Chen et al, 2013)。
| $ \begin{gathered} C_{a}=12.21 \times A_{663 \mathrm{~nm}}-2.81 \times A_{646 \mathrm{~nm}} \\ C_{b}=20.12 \times A_{646 \mathrm{~nm}}-5.03 \times A_{663 \mathrm{~nm}} \\ C_{t}=\left(1000 \times A_{470 \mathrm{~nm}}-3.27 \times C_{a}-10^{4} \times C_{b}\right) / 198 \end{gathered} $ |
| $ \begin{aligned} &\text { 色素含量 }(\mathrm{mg} / \mathrm{g})=[\text { 色素浓度 }(\mathrm{mg} / \mathrm{L}) \times \\ &\text { 提取液体积 }(\mathrm{L}) \times \text { 稀释倍数 }] / \text { 样品干重 }(\mathrm{g}) \end{aligned} $ |
式中,Ca、Cb、Ct分别为Chl.a、Chl.b和Car的浓度,A为吸光度。
1.3.3 细胞活性的测定利用无碳Basal培养基将收获的蛋白核小球藻细胞数梯度稀释至1×103~2.4× 106 cells/mL,用于后续实验。
配制荧光探针染料:称取4.16 mg二醋酸荧光素(FDA),用丙酮定容至10 mL,配成1.0 mmoL/L的母液,置于–20℃冰箱中保存。
细胞活性检测方法:每5 mL梯度稀释藻液分别加入0、5、20、40、60、80、100、120和140 μmol的FDA,充分振荡后于室温下避光放置30 min。按每孔100 μL加样于96孔板上,利用多功能酶标仪(Synergy Neo2,BioTek,美国)在525 nm下检测其荧光值(FDA激发波长为488 nm,最大发射波长为525 nm),每组3个平行,结果以平均值±标准差(Mean±SD)表示。保藏前、后细胞相对活性用下列公式计算(吴瑞珊, 2008)。
| $ \text { 细胞相对活性(%)= } \\ \left(1-\frac{\text { 保藏前荧光值 }-\text { 保藏后荧光值 }}{\text { 保藏前荧光值 }}\right) \times 100 \% $ |
采用Microsoft Origin 2018软件进行绘图,使用SPSS Statistics 24软件通过单因素方差分析(one-way ANOVA)进行统计学分析,显著性水平为P < 0.05或P < 0.01。
2 结果与讨论 2.1 保藏前、后浓缩藻膏和浓缩藻液的感官变化在实验过程中,不同保藏条件下蛋白核小球藻浓缩藻膏和浓缩藻液的颜色和气味等感官特征变化很大。新鲜制备的蛋白核小球藻藻膏和浓缩藻液均呈正常的浓墨绿色;而经巴氏杀菌处理后则呈不同程度的褐色,这与前人的研究结果一致。小球藻的颜色在115℃加热15 min后出现褐变(Castelló et al, 2018)。这是因为在高温条件下,小球藻细胞内的色素体受到破坏,从而导致叶绿素大量降解(Morist et al, 2001)。保藏到第3天时,藻膏和浓缩藻液在室温条件下均产生刺鼻的腥味,膏体变稀,出现腐败的迹象;而在4℃直接保藏的藻膏和浓缩藻液均未出现明显变化。随着保藏时间的延长,未经巴氏杀菌处理的藻膏和浓缩藻液的颜色在室温条件下逐渐由鲜绿色变成褐色;而在4℃连续保藏15 d后,藻膏和浓缩藻液的颜色均保持为浓墨绿色。此外,保藏在所有条件下的蛋白核小球藻藻膏和浓缩藻液均随着保藏时间的延长逐渐产生刺鼻的腥味。这种腥味产生是因为高密度藻细胞在常温下代谢旺盛,而保藏条件下营养有限,部分藻细胞死亡并发生酸败,产生了一些具有刺鼻性气味的胺类、醛、酮、脂肪聚合物、过氧化氢和烃类等(陈炜等, 2012)。
2.2 不同保藏条件下藻膏的营养品质评价图 1为蛋白核小球藻藻膏在不同保藏条件下细胞内色素含量随保藏时间的变化。结果发现,巴氏杀菌后未开始保藏前,藻膏中叶绿素的含量与巴氏杀菌前相比无明显变化。室温条件下,无论是否经过巴氏杀菌处理,藻膏在保藏第3天时总叶绿素含量均显著下降(P < 0.01) (图 1a和图 1b),直接室温保藏和巴氏杀菌后室温保藏的叶绿素损失量分别达到41.11%和34.76%;而在4℃条件下,未经巴氏杀菌处理的藻膏中总叶绿素含量无明显下降,而经巴氏杀菌处理的藻膏总叶绿素含量下降了42.92% (P < 0.01)。这一结果与藻膏在保藏过程中出现的颜色变化呈正相关,说明4℃条件下未经巴氏杀菌处理的蛋白核小球藻的藻膏中细胞内色素含量随保藏时间的延长未出现明显变化,且在保藏结束时细胞内色素含量基本与保藏前相同。
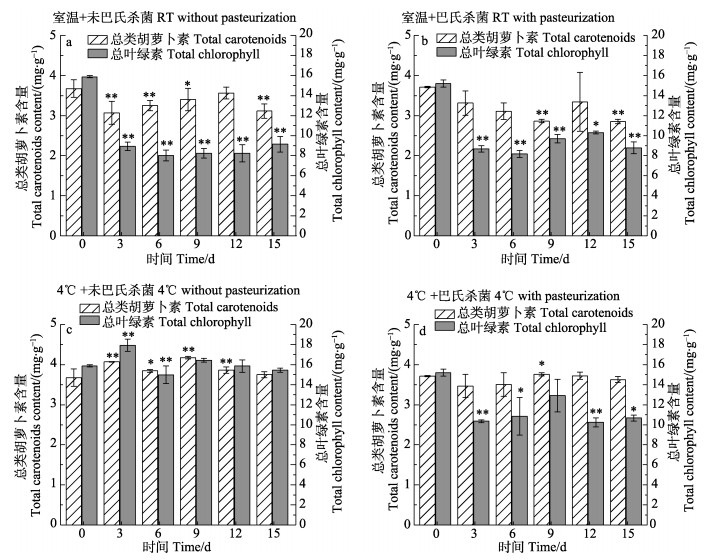
|
图 1 在不同保藏条件下藻膏中色素含量的变化 Fig.1 Changes of pigments contents in algal paste under different preservation conditions 保藏第0天时为对照组,*表示差异显著(P < 0.05),**表示差异极显著(P < 0.01)。下同 The zero day was set as control group. * represents significant difference (P < 0.05), ** represents highly significant difference (P < 0.01). The same as below |
蛋白核小球藻藻膏在不同保藏条件下,细胞内蛋白质含量随保藏时间的变化见图 2。由图 2可知,经巴氏杀菌处理的藻膏中蛋白质含量与未经巴氏杀菌处理相比,略有下降。随着保藏时间的延长,藻膏中蛋白质含量出现波动。经巴氏杀菌处理后,在室温条件和4℃条件下保藏结束时,藻膏蛋白质含量与第0天相比均显著提高(P < 0.05),这可能是巴氏杀菌并不彻底,导致浓缩藻膏腐败变稀,在凯氏定氮时造成测量误差;二是由于微生物滋生,菌体蛋白可能被测定计入,导致数据偏高;而直接保藏条件下的则无显著差异。与此相似的是,细胞密度为8×1010 cells/mL的微拟球藻浓缩制品在4℃条件下弱光保存2个月后,其蛋白质含量未出现显著性变化(Welladsen et al, 2014)。
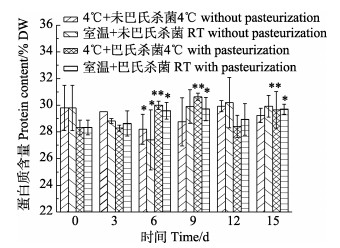
|
图 2 在不同保藏条件下藻膏中蛋白质含量的变化 Fig.2 Changes of protein contents in algal paste under different preservation conditions |
综上,未经巴氏杀菌处理的蛋白核小球藻藻膏在4℃下连续避光保藏15 d,细胞内色素及蛋白质含量无明显下降(P > 0.05),其总叶绿素含量、总类胡萝卜素含量及蛋白质含量分别为保藏前的97.20%、100.00%和98.20%。
2.3 不同保藏条件下浓缩藻液的营养品质评价蛋白核小球藻浓缩藻液在不同保藏条件下细胞内色素含量随保藏时间的变化情况见图 3。由图 3可知,经过巴氏杀菌处理后,浓缩藻液中的总类胡萝卜素和总叶绿素含量分别为2.93和11.77 mg/g,比未经巴氏杀菌处理的藻液分别下降了15.32%和24.06%。研究表明,加热温度越高,越容易使细胞内的色素降解,且产生的褐变程度越高;同时,巴氏杀菌时间越长,细胞内的总叶绿素含量下降越多(Morist et al, 2001)。与藻膏相比,浓缩藻液经巴氏杀菌处理后总叶绿素损失率更高,这可能是因为浓缩藻液的密度更低,传热效率高,受热更均匀,导致其叶绿素降解更严重。在室温条件下,当保藏时间延长到第3天时,直接保藏和巴氏杀菌保藏的浓缩藻液中总叶绿素含量分别下降到10.59和9.26 mg/g,损失率分别为31.68%和21.33%。培养结束时,叶绿素含量在室温条件下均极显著低于初始水平(P < 0.01)。与藻膏(图 1a和图 1b)不同的是,在室温条件下浓缩藻液胞内的总类胡萝卜素含量随保藏时间的延长而下降。保藏结束时,未经巴氏杀菌处理和经巴氏杀菌处理的浓缩藻液中总类胡萝卜素含量分别为保藏前的51.16%和72.03%。由图 3c和图 3d可知,在4℃条件下保藏的浓缩藻液尽管在保藏过程中色素含量出现波动,但保藏结束时,其总叶绿素和总类胡萝卜素含量未出现显著性降低。
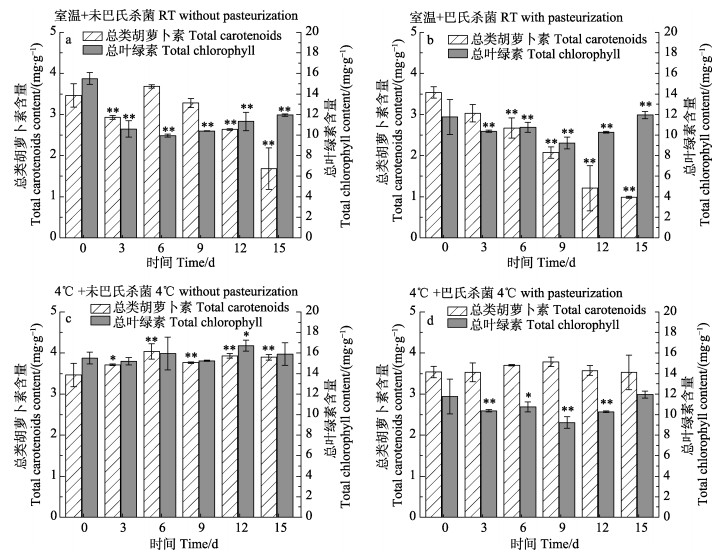
|
图 3 在不同保藏条件下浓缩藻液色素含量的变化 Fig.3 Changes of pigments contents in concentrated fluid in different preservation conditions |
不同保藏条件下,蛋白核小球藻浓缩藻液蛋白质含量随保藏时间的变化见图 4。由图 4可知,在室温条件下,未经巴氏杀菌处理的浓缩藻液蛋白质含量随保藏时间的延长而显著上升(P < 0.01),这可能是因为未经巴氏杀菌处理的藻液中细菌活动旺盛,可以利用BG11培养基中的氮素及腐败藻体维持代谢,而在利用凯氏定氮法测定蛋白质含量时无法分离藻体和菌体,菌体蛋白可能被测定计入,从而导致测定的蛋白质含量数据偏高。而经巴氏杀菌处理后再保藏的浓缩藻液的蛋白质含量随保藏时间的延长而显著下降(P < 0.01),这可能是由于小球藻体在巴氏杀菌后裂解死亡,从而导致蛋白质含量下降。在4℃条件下直接保藏的浓缩藻液的蛋白质含量在保藏结束时未有明显变化。这与Welladsen等(2014)的研究结果类似,杜氏藻(4.38×108 cells/mL)在4℃条件下保藏2个月后,蛋白质含量无显著变化。

|
图 4 在不同保藏条件下浓缩藻液蛋白质含量的变化 Fig.4 Changes of protein contents in concentrated fluid under different preservation conditions |
综上表明,未经巴氏杀菌处理的蛋白核小球藻浓缩藻液在4℃连续避光保藏15 d,细胞内的色素和蛋白质含量无显著变化,均为保藏前的100%。
尽管在连续保藏15 d后的蛋白核小球藻藻膏和浓缩藻液中蛋白质含量无显著变化,但本研究中采用凯氏定氮法无法区分样品中的蛋白态氮、多肽氮和氨基酸态氮。研究表明,微拟球藻在4℃保藏过程中蛋白质总量及必需氨基酸含量未出现显著下降,而亮氨酸和缬氨酸含量呈显著上升的趋势(P < 0.05)。因此,要获得保藏过程中细胞内蛋白质含量的准确变化,需要采取更精确的分析方法,如利用氨基酸分析仪测定氨基酸等。
2.4 细胞相对活性的分析 2.4.1 荧光探针法分析细胞相对活性不同细胞密度下FDA浓度对蛋白核小球藻染色效果的影响见图 5。根据吴瑞珊(2008)的方法,设定蛋白核小球藻的浓度梯度为1.5×103、1.4×104、2.6×105和2.4×106 cells/mL。如图 5所示,利用荧光探针法分析可知,最适细胞密度为2.6×105 cells/mL。在过高或过低的细胞密度下,其荧光值几乎持平。这是因为在过高的细胞密度下,FDA不易渗入细胞而影响染色效果;而细胞密度过低会导致荧光值较低,超出检测下限而无法检测到。在细胞密度为2.6×105 cells/mL时,检测所得的荧光强度随FDA浓度的上升而上升,并在60 μmoL/L时达到最大值,而后随着FDA浓度的进一步增加,荧光值下降并趋于平缓。因此,根据本研究的结果,建立了检测细胞相对活性的最佳检测条件:细胞浓度为2.6×105 cells/mL,FDA终浓度为60 μmoL/L,染色时间为30 min。这与吴瑞珊(2008)利用FDA检测眼点拟微球藻(Nannochloropisis oculata)的细胞活性所采用的浓度相一致。
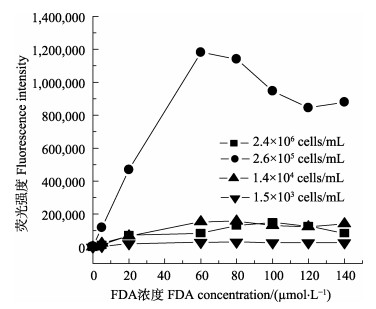
|
图 5 不同细胞密度下FDA浓度对蛋白核小球藻染色效果的影响 Fig.5 Effects of FDA concentration on the cell staining of C. pyrenoidosa at different cell densities |
由2.1可知,在4℃条件下,未经巴氏杀菌处理的蛋白核小球藻藻膏和浓缩藻液在连续保藏15 d后,颜色始终保持为鲜亮的绿色。针对这2个组别,利用2.4.1中建立的检测细胞相对活性的最优条件,检测其保藏前后的细胞相对活性。结果显示,蛋白核小球藻藻膏保藏前后样品的荧光值分别为7.74×1010和3.73×1010,细胞相对活性为保藏前的48.26%;浓缩藻液保藏前后样品的荧光值分别为6.91×106和4.24×106,细胞相对活性为保藏前的61.36%。Montaini等(1995)研究发现,四肩突四鞭藻(Tetraselmis suecica)的细胞活力在保藏过程中会随着其浓度的升高而下降,这与本研究结果一致。但微拟球藻(Nannochloropsis gaditana)在不同初始保藏浓度下(5和150 g/L)经6个月的4℃避光保藏,其细胞活性均保持在90%以上(Camacho-Rodríguez et al, 2016),这与本研究结果不同,可能是微藻的不同特性所致。
3 结论本研究主要针对蛋白核小球藻离心浓缩和重悬工艺得到的藻膏(8×1010 cells/mL)和浓缩藻液(1×108 cells/mL)的保藏条件(是否巴氏杀菌处理及不同保藏温度)进行了系统评价,证实了新鲜浓缩制品在4℃条件下保藏15 d品质最好。藻膏中的相对细胞活性、总叶绿素、总类胡萝卜素和蛋白含量分别为保藏前的48.26%、97.20%、100.00%和98.20%;浓缩藻液中的相对细胞活性、总叶绿素、总类胡萝卜素和蛋白含量分别为保藏前的61.36%、100.00%、100.00%和100.00%。本研究中蛋白核小球藻浓缩制品直接保藏15 d的时间还相对较短,在今后的研究中,应对更长保藏时间下的保藏效果及卫生指标变化进行更深入的研究,以提高实际应用的可操作性。
BECKER E W. Micro-algae as a source of protein. Biotechnology Advances, 2007, 25(2): 207-210 DOI:10.1016/j.biotechadv.2006.11.002 |
CAMACHO-RODRÍGUEZ J, CERÓN-GARCÍA M C, MACÍAS-SÁNCHEZ M D, et al. Long-term preservation of concentrated Nannochloropsis gaditana cultures for use in aquaculture. Journal of Applied Phycology, 2016, 28(1): 299-312 DOI:10.1007/s10811-015-0572-y |
CASTELLÓ M L, PARIENTE G, ANDRES A, et al. Evaluation of strategies for preservation of microalgae Chlorella. Journal of Food Processing and Preservation, 2018, 42(2): e13518 DOI:10.1111/jfpp.13518 |
CHELLAPPAN A, THANGAMANI P, MARKOSE S, et al. Long-term preservation of micro-algal stock for fish hatcheries. Aquaculture Reports, 2020, 17: 100329 DOI:10.1016/j.aqrep.2020.100329 |
CHEN W, WANG X F, BAI Y A, et al. Effects of concentrate and storage condition on fatty acid in alga Chlorella pyrenoidesa paste. Journal of Dalian Ocean University, 2012, 27(1): 1-5 [陈炜, 王秀芬, 白永安, 等. 浓缩方法及保存条件对小球藻藻膏脂肪酸的影响. 大连海洋大学学报, 2012, 27(1): 1-5 DOI:10.3969/j.issn.1000-9957.2012.01.001] |
CHEN Y M, VAIDYANATHAN S. Simultaneous assay of pigments, carbohydrates, proteins and lipids in microalgae. Analytica Chimica Acta, 2013, 776: 31-40 DOI:10.1016/j.aca.2013.03.005 |
HE H S, YUAN J L, LIU M, et al. Preliminary study on effects of Chlorella vulgaris and Ipomoea auatica regulation on the water quality and growth of Penaeus vannamei. Freshwater Fisheries, 2019, 49(3): 102-107 [何海生, 原居林, 刘梅, 等. 蛋白核小球藻与水蕹菜调控对南美白对虾养殖水体及其生长影响的初步研究. 淡水渔业, 2019, 49(3): 102-107 DOI:10.3969/j.issn.1000-6907.2019.03.017] |
LAI Y C, CHANG C H, CHEN C Y, et al. Towards protein production and application by using Chlorella species as circular economy. Bioresource Technology, 2019, 289: 121625 DOI:10.1016/j.biortech.2019.121625 |
LI H K, ZHONG Y M, LU Q, et al. Co-cultivation of Rhodotorula glutinis and Chlorella pyrenoidosa to improve nutrient removal and protein content by their synergistic relationship. RSC Advances, 2019, 9(25): 14331-14342 DOI:10.1039/C9RA01884K |
LI Y G, ZHANG L, SUN B Y, et al. Method for controlling microbes in algae powder by combination of pasteurization and spray drying. China, CN103990155A, 2014 [李元广, 张林, 孙炳耀, 等. 一种联用巴氏杀菌与喷雾干燥控制藻粉中微生物的方法. 中国, CN103990155A, 2014]
|
LIU H H, WU Z J, DONG S R, et al. Evaluation of the viability of trehalose-preserved microalgae based on the SLogistic model. Food Research and Development, 2020, 41(18): 195-201 [刘恒恒, 吴子健, 董世瑞, 等. 基于微藻SLogistic模型的海藻糖保藏藻种活力评价. 食品研究与开发, 2020, 41(18): 195-201] |
LUO X Y, CHEN J H, WEI D. High efficient assimilation of NO3--N with coproduction of microalgal proteins by Chlorella pyrenoidosa. Chinese Journal of Biotechnology, 2020, 36(6): 1150-1161 [骆小英, 陈俊辉, 魏东. 蛋白核小球藻高效同化硝态氮联产微藻蛋白. 生物工程学报, 2020, 36(6): 1150-1161] |
MONTAINI E, ZITTELLI G C, TREDICI M R, et al. Long-term preservation of Tetraselmis suecica: Influence of storage on viability and fatty acid profile. Aquaculture, 1995, 134(1): 81-90 |
MORIST A, MONTESINOS J L, CUSIDÓ J A, et al. Recovery and treatment of Spirulina platensis cells cultured in a continuous photobioreactor to be used as food. Process Biochemistry, 2001, 37(5): 535-547 DOI:10.1016/S0032-9592(01)00230-8 |
OGBONNA J C, MASUI H, TANAKA H. Sequential heterotrophic/autotrophic cultivation-An efficient method of producing Chlorella biomass for health food and animal feed. Journal of Applied Phycology, 1997, 9(4): 359-366 DOI:10.1023/A:1007981930676 |
SAADAOUI I, AL EMADI M, BOUNNIT T, et al. Cryopreservation of microalgae from desert environments of Qatar. Journal of Applied Phycology, 2016, 28(4): 2233-2240 DOI:10.1007/s10811-015-0743-x |
WANG Q K, YU Z Y, WEI D. High-yield production of biomass, protein and pigments by mixotrophic Chlorella pyrenoidosa through the bioconversion of high ammonium in wastewater. Bioresource Technology, 2020, 313: 123499 DOI:10.1016/j.biortech.2020.123499 |
WELLADSEN H, KENT M, MANGOTT A, et al. Shelf-life assessment of microalgae concentrates: Effect of cold preservation on microalgal nutrition profiles. Aquaculture, 2014, 430: 241-247 DOI:10.1016/j.aquaculture.2014.04.016 |
WU R S. Study on low temperature storage technology of marine microalgae concentrate. Masterxs Thesis of South China University of Technology, 2008 [吴瑞珊. 海洋微藻浓缩液低温保藏技术研究. 华南理工大学硕士研究生学位论文, 2008]
|
YAN J Q, HUANG X X, HUANG Z Z, et al. Effect of different trophic modes on the growth performance and nutrition of Chlorella sp. Progress in Fishery Sciences, 2011, 32(4): 77-85 [严佳琦, 黄旭雄, 黄征征, 等. 营养方式对小球藻生长性能及营养价值的影响. 渔业科学进展, 2011, 32(4): 77-85 DOI:10.3969/j.issn.1000-7075.2011.04.013] |
YU J Z, LIANG X X, CHEN F, et al. Evaluation of the preservation methods for two microalgal concentrates. Modern Food Science and Technology, 2013, 29(5): 948-952 [俞建中, 梁欣欣, 陈峰, 等. 两种微藻浓缩液保藏效果的比较. 现代食品科技, 2013, 29(5): 948-952] |
YU Z Y, LIU L, CHEN J H, et al. Effect of crude glycerol on heterotrophic growth of Chlorella pyrenoidosa and Coccomyxa subellipsoidea C-169. Journal of Applied Phycology, 2018, 30(6): 2989-2996 DOI:10.1007/s10811-018-1551-x |
ZHANG G W, LI Q S, SHAO D H, et al. Advances in the research and application of microalgae in aquaculture. China Fisheries, 2020(2): 72-74 [张国维, 李勤慎, 邵东宏, 等. 微藻在水产养殖中的研究应用进展. 中国水产, 2020(2): 72-74] |



