2. 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 山东 青岛 266071
2. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao, Shandong 266071, China
中国近海渔业资源种类丰富,鱼类和虾类资源在渔业生态系统中占据着重要地位(唐启升, 2006; 吴强等, 2012)。自20世纪80年代以来,受过度捕捞、气候变化、环境污染等多重压力的影响,黄东海生态系统发生明显的变化,传统经济鱼类资源出现一定程度的衰退,包括虾类在内的甲壳类资源所占比例明显升高(Jin et al, 2013; Tang et al, 2016; Wu et al, 2018)。近期的相关研究表明,受人类海洋活动日趋频繁和全球气候变化加剧的影响,渔业资源种群演变更加复杂(Ramos et al, 2018; Baltar et al, 2019; Ward et al, 2019; Walworth et al, 2020)。除捕捞因素外,近海甲壳类动物的生物量还受水深、底层温度、盐度、经纬度、底质类型和离岸距离等因子的影响(Gribble et al, 2007; 黄庆洋等, 2009; 逄志伟等, 2015; 赵静等, 2017; 张孝民等, 2018)。虾类作为海洋生态系统中重要的次级生产者,是构建食物网结构、解析能量流动和物质循环过程中必不可缺的关键环节(陈小庆等, 2010; 梁金玲, 2015)。因此,探讨海洋中虾类生物量变化及其影响因素对近海生物种群动态和海洋生态学研究有重要意义。
20世纪80年代以来,对虾养殖业在世界多国蓬勃兴起,为经济发展和优质动物蛋白供应做出了突出贡献(余云军, 2006)。然而,与全球对虾养殖业快速发展相伴的是多种病毒性疫病不断出现,并对养殖产业造成冲击(李建军等, 1998)。其中,对虾白斑综合征病毒(white spot syndrome virus, WSSV)是已报道的对虾病毒性疫病中危害严重且流行区域最广的一类病原(Lightner, 1996; 何建国等, 1999; 雷质文等, 2002、2003; 闫冬春, 2004; 李钫, 2009)。池塘养殖对虾感染WSSV后2~7 d内的累计死亡率可达100% (雷质文等, 2003)。除了感染养殖对虾外,近年来陆续有WSSV感染近海甲壳类动物的报道。如Chapman等(2004)通过PCR、组织病理学和组织原位杂交实验证实捕获自南大西洋湾的凡纳滨对虾(Litopenaeus vannamei)样品中存在WSSV感染。Mijangos-Alquisires等(2006)从墨西哥加利福尼亚湾采集的近海虾类样品中检测到WSSV较低阳性率(0.8%)的感染。Orosco等(2017)通过PCR检测表明,采集自菲律宾近岸水域的虾类中有WSSV阳性检出。Gholamhosseini等(2020)通过PCR、组织病理学实验和透射电子显微镜技术确定了伊朗近海印度明对虾(Penaeus indicus)中存在WSSV。鉴于WSSV对甲壳类的广泛致病性,近海甲壳类样品中存在WSSV流行不免引发其可能危害野生虾类种群动态的担忧。
基于此,本研究于2016—2018年每年8月对WSSV在黄海和东海北部虾类中的流行情况进行系统调查,通过构建梯度随机森林模型(gradient random forest model, GFM)和广义加性混合模型(generalized additive mixed models, GAMM),评估WSSV流行情况及相关环境因子与调查海域虾类生物量的相关性,以期为揭示水产养殖疫病病原对海洋甲壳类资源的影响提供新的视角。
1 材料与方法 1.1 样品采集2016、2017和2018年8月(休渔期),搭乘中国水产科学研究院黄海水产研究所“北斗号”渔业调查船赴黄海和东海北部海域进行3个航次的调查,并利用底拖网采集虾类样品。根据临近站位间的距离和实时海况,在预设的120个站点中选择站点进行取样(图 1)。根据底拖网所获虾的种类和生物量,每个采样站点随机取样4~6尾。取样时,将样本个体的头胸甲剖开涂抹于FTA®卡片上,自然晾干后保存于–20℃冰箱,以备后续检测。调查网具参数见单秀娟等(2011),拖速为3.0~3.5 nmile/h,拖网时间0.5~1 h。记录各站点捕获虾的种类和数量,将不同种虾分别标准化为每小时的数量(个/h)作为其种群生物量(陈云龙等, 2013)。
|
图 1 2016—2018年黄海和东海北部设置的采样站点 Fig.1 Sampling sites in the Yellow Sea and the northern East China Sea from 2016 to 2018 |
按照马芳等(2016)报道的方法,使用WSSV现场快速高灵敏检测试剂盒对涂抹于FTA®卡片上的样品进行LAMP检测。为避免检测过程中出现假阳性和假阴性,采用2套不同引物制作的WSSV现场快速高灵敏检测试剂盒对同一样品进行重复检测和复核。
1.3 海洋环境数据各航次站点的底层温度、底层盐度、深度数据通过SBE25plus自容式CTD (SeaBird公司,美国)进行现场采集。底质类型(BST)参考石学法(2014)报道的方法进行分类,并考虑到各底质类型的站点数量,所有调查站点被概括为4种类型:砂质(包括砂、砂质粉砂和中砂)、粉砂质砂、粉砂(包括粉砂和粉砂质黏土)和黏土质砂(包括黏土质粉砂和黏土质砂)。
1.4 模型的构建 1.4.1 模型的假设以WSSV阳性虾类总生物量作为模型的响应因子;考虑到虾类总生物量数据呈正偏态分布(官文江, 2015),以虾类总生物量的对数(ln_Abu)作为响应变量。选取WSSV阳性检出率(P_rate)作为模型的解释变量,并假设WSSV阳性虾类被WSSV感染的概率一致,即虾类总阳性样品数量=阳性检出率×虾类总生物量,并将阳性样品量进行对数处理,得到的阳性样品量的对数(ln_posi)作为模型的解释变量。
1.4.2 模型影响因子的选取除了P_rate和ln_posi以外,根据已发表的环境因子对虾类生物量影响的研究报道(Gribble et al, 2007; 黄庆洋等, 2009; 逄志伟等, 2015; 赵静等, 2017),选取水深、底层温度、盐度、经纬度、底质类型和离岸距离等相关因子作为模型的解释变量。
1.4.3 虾类生物量影响因子的初步评价采用梯度随机森林模型筛选因子,并初步评价各环境因子对虾类资源密度分布的影响。GFM是一种机器学习方法,建立在随机森林的基础上,通过整合各响应变量上的单个随机森林分析来捕获潜在相关预测因子和多个响应变量之间的复杂关系(Ellis et al, 2012)。从本质上讲,随机森林是一种回归树,它将响应变量按每个预测因子p的特定分割值划分为2组,以最大化同质性。与其他措施一起,梯度森林提供了每个响应变量f的拟合优度Rf2以及Rf2加权的重要性。对梯度森林进行1000次运行,获得Rf2的变异度,并使用总体性能最高的模型(即拟合优度R2最大)进行进一步分析。
1.4.4 利用GAMM模型评价环境因子对虾类分布的影响考虑到解释能力和预测能力的潜在差异,采用广义加性混合模型对可能影响虾类生物量的时空分布因子、环境因子和WSSV阳性检出率等进行分析(Derville et al, 2018)。在建模之前,首先对数据进行初步分析、检验以选择合适的模型,主要进行异常值的剔除以及检查解释变量之间的共线性。采用方差膨胀因子(VIF)度量多重共线性的程度,并对选取的初始因子进行多重共线性检验,筛选可纳入模型的因子(Shono, 2008)。VIF越高,多重共线性的影响越严重,以VIF > 5作为判断是否存在多重共线性的标准。解释变量中底质类型(BST)作为随机效应。模型的连接函数为“identity”(Kabacoff, 2015)。利用F检验评估解释变量的显著性。将不同环境因子进行组合,生成多个候选GAMM模型。
采用赤池信息准则(Akaike information criterion,AIC)和方差解释率(deviance explained)来比较候选模型的性能(周慧敏等, 2014)。在分析中将不显著变量(P≥ 0.1)从初始模型中逐一剔除,最终得到最优模型。主要步骤:1)剔除解释偏差最小的不显著变量;2)拟合简化的GAMM到数据;3)重复步骤1和步骤2,直到AIC值最小化(deLeeuw, 1992; Burnham et al, 2003)。数据分析和模型构建的过程中分别使用R软件中的“car”,“gradient Forest”和“mgcv”进行(R Core Team, 2017)。
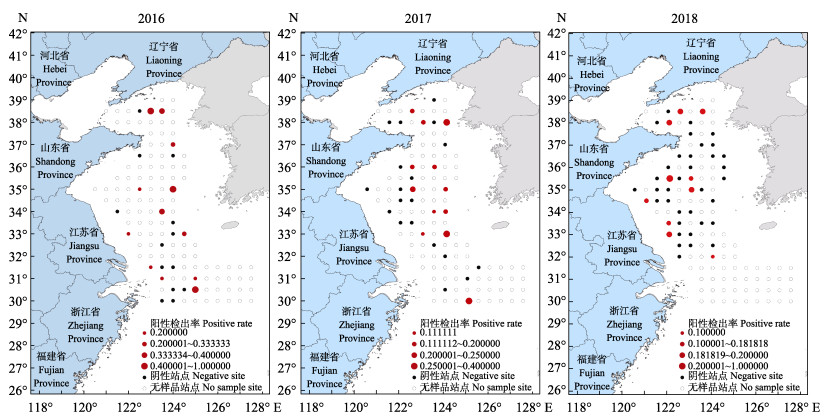
2 结果 2.1 WSSV在黄海与东海北部虾类中的流行情况在2016、2017和2018年8月对黄海和东海北部的调查中,从73个采样点共采集517份虾类样品(图 2,表 1)。LAMP检测结果显示,2016、2017和2018年所涉及的25、31和46个采样站点中,WSSV阳性采样站点的比例分别达48.40%、38.75%和21.74% (图 2、图 3),且3个年度样品中WSSV阳性检出率分别为16.86%、9.60%和4.80%(图 3);上述3个年度所采集样品包括26种虾类,其中,脊腹褐虾(Crangon affinis)、葛氏长臂虾(Palaemon gravieri),哈氏仿对虾(Parapenaeopsis harbwickii)、日本囊对虾(Penaeus japonicus)、戴氏赤虾(Metapenaeopsis dale)、中国毛虾(Acetes chinensis)和海蜇虾(Latreutes anoplonyx)等11种虾类样品中均有WSSV阳性检出,除样品量较少(少于10尾)的滑脊等腕虾(Heterocarpoides laevicarina)、细螯虾(Leptochela gracilis stimpson)和刀额仿对虾(P. acultrirostris)外,中华安乐虾(Eualus siensis)、海蜇虾、葛氏长臂虾和脊腹褐虾中WSSV阳性检出率皆在10%以上(表 1)。
|
图 2 2016—2018年黄海和东海北部虾类中WSSV的流行范围和流行率 Fig.2 The prevalence scopes and prevalence rates of WSSV in the shrimps of the Yellow Sea and the northern East China Sea (2016—2018) 空心圆表示未采集到样品的站点;黑色实心圆表示该站点采集到样品、但无WSSV阳性检出的站点;红色实心圆表示该站点采集到样品且有WSSV的阳性检出,红色圆圈越大,代表该站点WSSV的阳性检出率越高 The hollow spots represent that no samples were collected at the sampling site; The black solid spots represent that no WSSV positive samples were found at the sampling site. The red solid spots represent that WSSV positive samples were found at the sampling site. The bigger of the red solid spots means the higher of the WSSV prevalence rate at the sampling site |
|
|
表 1 2016—2018年在黄海和东海北部采集的不同虾类样品数量及样品中WSSV的阳性检出率 Tab.1 Number and WSSV positive rates in different shrimps collected from Yellow Sea and the northern East China Sea (2016—2018) |

|
图 3 2016—2018年黄海和东海北部WSSV阳性采样站点检出率和阳性样品检出率 Fig.3 WSSV positive rate in the sampling sites and the collected samples of the Yellow Sea and the northern East China Sea (2016—2018) |
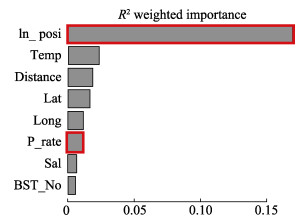
利用GFM模型对虾类生物量相关影响因子的初步评价结果显示,ln_posi(阳性样品数的对数)重要性最高,其次是温度(Temp)、离岸距离(Distance)、纬度(Lat)、经度(Long)、阳性率(P_rate)、盐度(Sal)和底质类型(BST)(图 4)。
|
图 4 不同解释变量在GFM模型中的重要性分析 Fig.4 Importance analysis of different predictor variables from the gradient forest ln_posi:阳性样品数的对数;Temp:温度;Distance:离岸距离;Lat:纬度;Long:经度;P_rate:阳性率;Sal:盐度;BST_No:底质类型 ln_posi: Logarithm of the number of positive samples; Temp: Temperature; Distance: Distance from shore; Lati: Latitude; Long: Longitude; P_rate: Positive rate; Sal: Salinity; BST_No: Bottom sediment types |
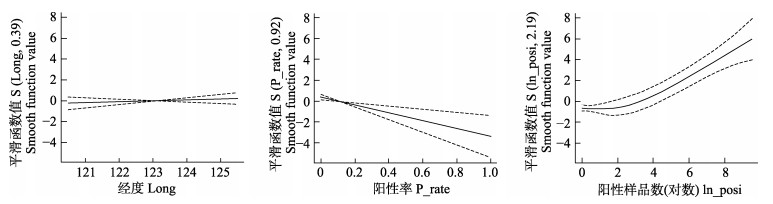
通过VIF对初始影响因子进行多重共线性检验,发现初始影响因子之间存在共线性现象。将P_number和深度2个因子排除后,各因子的VIF值均小于5。因此,选取ln_posi、Temp、Distance、Lat、Long、P_rate、Sal、BST_No作为构建GAMM模型的备选影响因子(表 2)。根据AIC最小原则,通过逐步剔除非重要因子,得到最优模型为Model 6:ln_Abu~P_rate+ln_posi+Long。P_rate和ln_posi是Model 6中的极显著相关因子(P < 0.001)。ln_Abu随着P_rate的升高而降低,而ln_posi也会随着ln_Abu的升高而升高(图 5)。
|
|
表 2 备选GAMM模型的拟合效果 Tab.2 Fitting effect of candidate GAMMs |
|
图 5 最优模型中显著因子与虾类生物量对数(ln_Abu)的关系 Fig.5 The relationship between significant variables and abundance of shrimps for the final generalized additive mixed models |
WSSV可引起养殖对虾白斑综合征,该病毒在1992年首次发现于我国台湾(Chou et al, 1995),此后迅速蔓延到日本、韩国、东南亚各国以及南北美洲、欧洲等地,给全球对虾养殖业造成了巨大的损失(Nakano et al, 1994; Inouye et al, 1994; Momoyama et al, 1994; Takahashi et al, 1994; Wang et al, 1995; Lightner, 1999)。研究发现,在墨西哥、菲律宾和伊朗等国近岸海域捕获的野生虾类中存在WSSV感染(Chapman et al, 2004; Mijangos-Alquisires et al, 2006; Orosco et al, 2017; Gholamhosseini et al, 2020),但WSSV是否也在远离陆地海域的虾类中流行尚未见报道。本研究对黄海和东海北部海域虾类中WSSV流行情况的调查结果显示,WSSV在我国上述海域的流行范围比较广、流行率也较高;特别是2016年,WSSV阳性采样站点和阳性样品的比率分别高达48.395%和16.86%,其中,样品阳性率高于同年我国养殖对虾中WSSV的阳性检出率(12.9%)(农业部渔业渔政管理局等, 2017)。在采集到的26种虾类中,除已证实可被WSSV感染的日本囊对虾和中国毛虾(雷质文等, 2003)外,还有9种虾类样品中有WSSV阳性检出,这提示WSSV经由上述虾类传播扩散的风险不容忽视。2016、2017和2018年黄海和东海北部WSSV的阳性样品检出率和阳性站点检出率均呈不断下降的趋势,推测可能与渔业主管部门和对虾养殖从业者加大了苗种检疫力度,海洋环境监测部门加强了养殖废水排放监管,进而降低了WSSV由近岸养殖池塘向近海传播有关。
本研究引入梯度随机森林模型(GFM)和广义加性混合模型(GAMM)评估了WSSV对调查海域虾类生物量的潜在影响。对GFM模型中各解释变量的分析显示,ln_posi (WSSV阳性样品数的对数)对响应变量虾类生物量的对数(ln_Abu)的重要性最高。根据AIC最小原则筛选出的GAMM最优模型显示,ln_posi和P_rate是虾类生物量的极显著影响因子,并且虾类生物量随WSSV阳性率的增高而下降。上述GFM和GAMM模型的分析结果均表明,WSSV流行对黄海和东海虾类生物量存在潜在影响,野生虾类感染WSSV后,可能会导致其生物量减少。黄东海是我国重要的渔业水域,甲壳类资源丰富,许多虾类除了是重要的捕捞对象外,更是诸多头足类、鱼类和哺乳类等动物的主要捕食对象(韦晟等, 1992; 程济生等, 1997)。如WSSV阳性检出率较高的脊腹褐虾,为黄东海的优势种类,是众多底层和近底层鱼类的主要饵料生物(唐启升, 2006),其资源变动将会进一步影响主要经济鱼类的生物量和近海生态系统的稳定。
限于目前尚无WSSV对野生虾类致病性的相关数据,本研究为便于模型分析,假设WSSV对呈现WSSV阳性虾类的感染和危害风险相同,这一假设可能与实际情况存在偏差:有些虾类对WSSV较为敏感,染病个体会出现病理变化甚至会死亡,而有些阳性检出的种类或仅是WSSV的载体,并不一定会发病或死亡,仅在WSSV的水平传播中起重要作用(Rajendran et al, 1999)。因此,将来可通过进一步研究WSSV对近海虾类致病性及其在群体中的传播方式,为模型分析提供更多参数,以便提出更加合理的假设,进而提高模型的评估准确性和预测能力。
本研究的流行病学调查表明,黄海和东海北部虾类优势种——脊腹褐虾、葛氏长臂虾和日本囊对虾等基本都携带了WSSV或被WSSV感染。为探讨病毒传播对近海虾类生物量的影响,本研究把WSSV LAMP检测呈阳性的虾类总生物量作为模型响应因子,这有别于传统的物种分布模型。传统的物种分布模型一般评估海域温度、盐度和深度等环境因子对单一种群时空分布的影响,个别环境因子对种群分布的影响往往较大。而本研究模型的被解释变量是虾类生物量,包含虾的种类较多,其环境适应性更广,对单一虾类存在影响的环境因子对虾类生物量的解释率不会被高估,这在客观上更有利于分析WSSV传播流行对虾类生物量的影响。
从总体上看,观测数据积累和基础研究成果可为模型模拟或预测提供更多或更适合的因子与参数,并有利于提高响应变量对解释变量的响应能力和预测能力。此外,构建模型时关注诸如残差异质性、空间自相关、因子间交互作用等因素可有助于提高模型的预测能力。本研究仅是运用统计模型探索水产养殖动物病毒影响近海野生群体资源动态的初步尝试,待完成更长时间、更大空间尺度上的调查数据积累,获得养殖虾类病毒对野生虾类致病特性等信息,并进一步优化模型因子后,将会更准确地解释和预测养殖动物病原传播对近海生物种群、生态系统影响的规律和趋势。
致谢: 中国水产科学研究院黄海水产研究所“北斗号”渔业科考船上科研人员与工作人员在本研究的调查和样品采集过程中给予了大力帮助,谨致谢忱!
BALTAR F, BAYER B, BEDNARSEK N, et al. Towards integrating evolution, metabolism, and climate change studies of marine ecosystems. Trends in Ecology and Evolution, 2019, 34(11): 1022-1033 DOI:10.1016/j.tree.2019.07.003 |
BURNHAM K P, ANDERSON D R. Model selection and multimodel inference: A practical information-theoretic approach (2nd ed). Dordrecht: Springer, 2003, 1–454
|
CHAPMAN R W, BROWDY C L, SAVIN S, et al. Sampling and evaluation of white spot syndrome virus in commercially important Atlantic penaeid shrimp stocks. Diseases of Aquatic Organisms, 2004, 59(3): 179-185 |
CHEN X Q, YU C G, SONG H T, et al. Structural characteristics and spatial distribution of the shrimp population in the mid-north East China Sea. Journal of Marine Sciences, 2010, 28(4): 50-58 [陈小庆, 俞存根, 宋海棠, 等. 东海中北部海域虾类群聚结构特征及空间分布. 海洋学研究, 2010, 28(4): 50-58 DOI:10.3969/j.issn.1001-909X.2010.04.007] |
CHEN Y L, SHAN X J, DAI F Q, et al. Relative stock density and distribution of hairtail Trichiurus lepturus and its spawning stock structure in coastal waters of the East China Sea. Progress in Fishery Sciences, 2013, 34(4): 8-15 [陈云龙, 单秀娟, 戴芳群, 等. 东海近海带鱼群体相对资源密度、空间分布及其产卵群体的结构特征. 渔业科学进展, 2013, 34(4): 8-15 DOI:10.3969/j.issn.1000-7075.2013.04.002] |
CHENG J S, ZHU J S. Study on the feeding characteristics and nutritional levels of the main economic invertebrates in the Yellow Sea. Acta Oceanologica Sinica, 1997, 19(6): 102-108 [程济生, 朱金声. 黄海主要经济无脊椎动物摄食特征及其营养层次的研究. 海洋学报, 1997, 19(6): 102-108] |
CHOU H Y, HUANG C Y, WANG C H, et al. Pathogenicity of a baculovirus infection causing white spot syndrome in cultured penaeid shrimp in Taiwan. Diseases of Aquatic Organisms, 1995, 23(3): 165-173 |
DELEEUW J. Introduction to Akaike (1973) information theory and an extension of the maximum likelihood principle. In: KOTZ S, JOHNSON N L (Eds. ). Breakthroughs in statistics. Springer Series in Statistics (Perspectives in Statistics). New York: Springer, 1992, 599–609
|
Derville S, TORRES L G, Iovan C, et al. Finding the right fit: Comparative cetacean distribution models using multiple data sources and statistical approaches. Diversity and Distributions, 2018, 24(11): 1657-1673 DOI:10.1111/ddi.12782 |
ELLIS N, SMITH S J, PITCHER C R. Gradient forests: Calculating importance gradients on physical predictors. Ecology, 2012, 93(1): 156-168 DOI:10.1890/11-0252.1 |
Fishery and Fishery Administration of the Ministry of Agriculture, National Fisheries Technology Extension Center. Analysis of important aquatic animal diseases in China in 2016. Beijing: China Agriculture Press, 2017 [农业部渔业渔政管理局, 全国水产技术推广总站. 2016年我国水生动物重要疫病病情分析. 北京: 中国农业出版社, 2017]
|
GHOLAMHOSSEINI A, MOHAMMADI A, AKBARI S, et al. Molecular, histopathologic and electron microscopic analysis of white spot syndrome virus in wild shrimp (Fenneropenaeus indicus) in the coastal waters of Iran. Archives of Virology, 2020, 165(6): 1433-1440 DOI:10.1007/s00705-020-04625-3 |
GRIBBLE N A, WASSENBERG T J, BURRIDGE C. Factors affecting the distribution of commercially exploited penaeid prawns (shrimp) (Decapod: Penaeidae) across the northern Great Barrier Reef, Australia. Fisheries Research, 2007, 85(1/2): 174-185 |
GUAN W J. Application of R language in marine fisheries. Beijing: Ocean Press, 2015 [官文江. R语言在海洋渔业中的应用. 北京: 海洋出版社, 2015]
|
HE J G, ZHOU H M, YAO B. White spot syndrome baculovirus (WSBV) host range and transmission route. Acta Scientiarum Naturalium Universitatis Sunyatseni, 1999, 38(2): 65-69 [何建国, 周化民, 姚伯. 白斑综合症杆状病毒的感染途径和宿主种类. 中山大学学报(自然科学版), 1999, 38(2): 65-69 DOI:10.3321/j.issn:0529-6579.1999.02.015] |
HUANG Q Y, LING J Z, LI S F. Composition and distribution of shrimps in the coastal area of the northern East China Sea in summer. Marine Fisheries, 2009, 31(3): 237-242 [黄庆洋, 凌建忠, 李圣法. 东海北部近海夏季虾类组成及其数量分布. 海洋渔业, 2009, 31(3): 237-242 DOI:10.3969/j.issn.1004-2490.2009.03.003] |
INOUYE K, MIWA S, OSEKO N, et al. Mass mortalities of cultured kuruma shrimp Penaeus japonicus in Japan in 1993: Electron microscopic evidence of the causative virus. Fish Pathology, 1994, 29(2): 149-158 DOI:10.3147/jsfp.29.149 |
JIN X S, SHAN X J, LI X S, et al. Long-term changes in the fishery ecosystem structure of Laizhou Bay, China. Science China: Earth Sciences, 2013, 56: 366-374 |
KABACOFF R. R in action: Data analysis and graphics with R. Manning Publications Co., 2015
|
LEI Z W, HUANG J, SHI C Y, et al. Investigation into the hosts of white spot syndrome virus (WSSV). Oceanologia et Limnologia Sinica, 2002, 33(3): 250-258 [雷质文, 黄倢, 史成银, 等. 白斑综合症病毒(WSSV)的宿主调查. 海洋与湖沼, 2002, 33(3): 250-258 DOI:10.3321/j.issn:0029-814X.2002.03.005] |
LEI Z W, LI W C, KOU Y T, et al. Current status of molecular epidemiology of white spot syndrome (WSS). Inspection and Quarantine Science, 2003, 13(2): 11-13 [雷质文, 李伟才, 寇运同, 等. 白斑综合症(WSS)的分子流行病学研究现状. 检验检疫科学, 2003, 13(2): 11-13 DOI:10.3969/j.issn.1674-5354.2003.02.005] |
LI F. Research on the immediate early genes of white spot syndrome virus. Doctoral Dissertation of Xiamen University, 2009 [李钫. 对虾白斑综合症病毒极早期基因的研究. 厦门大学博士研究生学位论文, 2009]
|
LI J J, TIAN E J, LI Y S. Comprehensive control strategies for shrimp viral diseases. Fisheries Science, 1998, 17(3): 41-43 [李建军, 田恩金, 李云珊. 对虾病毒性疾病的综合防治对策. 水产科学, 1998, 17(3): 41-43] |
LIANG J L. The study of structure characteristics of shrimp and crab community in the Ma'an Archipelago Special Reserve. Masterxs Thesis of Shanghai Ocean University, 2015 [梁金玲. 马鞍列岛海洋特别保护区虾蟹类群落结构特征研究. 上海海洋大学硕士研究生学位论文, 2015]
|
LIGHTNER D V. A handbook of shrimp pathology and diagnostic procedures for diseases of cultured penaeid shrimp. World Aquaculture Society, Baton Rouge, LA. 1996
|
LIGHTNER D V. The penaeid shrimp viruses TSV, IHHNV, WSSV, and YHV: Current status in the Americas, available diagnostic methods, and management strategies. Journal of Applied Aquaculture, 1999, 9(2): 27-52 DOI:10.1300/J028v09n02_03 |
MA F, ZHANG Q L, WAN X Y, et al. Validation of the LAMP-based high sensitive detection kit for rapid use on field for white spot syndrome virus. Chinese Journal of Preventive Veterinary Medicine, 2016, 38(4): 316-321 [马芳, 张庆利, 万晓媛, 等. 基于LAMP技术的对虾白斑综合征病毒现场快速高灵敏度检测试剂盒的评价. 中国预防兽医学报, 2016, 38(4): 316-321 DOI:10.3969/j.issn.1008-0589.2016.04.14] |
MIJANGOS-ALQUISIRES Z, QUINTERO-ARREDONDO N, CASTRO-LONGORIA R, et al. White spot syndrome virus (WSSV) in Litopenaeus vannamei captured from the Gulf of California near an area of extensive aquaculture activity. Diseases of Aquatic Organisms, 2006, 71(1): 87-90 |
MOMOYAMA K, HIRAOKA M, NAKANO H, et al. Mass mortalities of cultured kuruma shrimp, Penaeus japonicus, in Japan in 1993: Histological study. Fish Pathology, 1994, 29(2): 141-148 DOI:10.3147/jsfp.29.141 |
NAKANO H, KOUBE H, UMEZAWA S, et al. Mass mortalities of cultured kuruma shrimp, Penaeus japonicus, in Japan in 1993: Epizootiological survey and infection trials. Fish Pathology, 1994, 29(2): 135-139 DOI:10.3147/jsfp.29.135 |
OROSCO F L, LLUISMA A O. Prevalence, diversity and co-occurrence of the white spot syndrome virus, monodon baculovirus and Penaeus stylirostris densovirus in wild populations of Penaeus monodon in the Philippines. Diseases of Aquatic Organisms, 2017, 125(3): 199-206 DOI:10.3354/dao03150 |
PANG Z W, LI X S, YING Y P, et al. Shrimp community structure and its relationships with environmental factors in the Yellow Sea in summer. Chinese Journal of Applied Ecology, 2015, 26(11): 3509-3515 [逄志伟, 李显森, 应一平, 等. 黄海夏季虾类群落结构及其与环境因子的关系. 应用生态学报, 2015, 26(11): 3509-3515] |
R Core Team. R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Australia, 2017
|
RAJENDRAN K V, VIJAYAN K K, SANTIAGO T C, et al. Experimental host range and histopathology of white spot sydrome virus (WSSV) infection in shrimp, prawns, crabs and lobsters from India. Journal of Fish Diseases, 1999, 22(3): 183-191 DOI:10.1046/j.1365-2761.1999.00162.x |
RAMOS J E, PECL G T, MOLTSCHANIWSKYJ N A, et al. Population genetic signatures of a climate change driven marine range extension. Scientific Reports, 2018, 8(1): 9558 DOI:10.1038/s41598-018-27351-y |
SHAN X J, LI Z L, DAI F Q, et al. Seasonal and annual variations in biological characteristics of small yellow croaker Larimichthys polyactis in the central and southern Yellow Sea. Progress in Fishery Science, 2011, 32(6): 7-16 [单秀娟, 李忠炉, 戴芳群, 等. 黄海中南部小黄鱼种群生物学特征的季节变化和年际变化. 渔业科学进展, 2011, 32(6): 7-16 DOI:10.3969/j.issn.1000-7075.2011.06.002] |
SHI X F. China's offshore oceans: Marine sediments. Beijing: Ocean Press, 2014 [石学法. 中国近海海洋——海洋底质. 北京: 海洋出版社, 2014]
|
SHONO H. Application of the Tweedie distribution to zero-catch data in CPUE analysis. Fisheries Research, 2008, 93(1/2): 154-162 |
TAKAHASHI Y, ITAMI T, KONDO M, et al. Electron microscopic evidence of bacilliform virus infection in kuruma shrimp (Penaeus japonicus). Fish Pathology, 1994, 29(2): 121-125 DOI:10.3147/jsfp.29.121 |
TANG Q S, YING Y P, WU Q. The biomass yields and management challenges for the Yellow Sea large marine ecosystem. Environmental Development, 2016, 17(S1): 175-181 |
TANG Q S. Marine biological resources and habitat in exclusive economic zone in China. Beijing: Science Press, 2006, 899-900 [唐启升. 中国专属经济区海洋生物资源与栖息环境. 北京: 科学出版社, 2006, 899-900 DOI:10.3969/j.issn.1001-5965.2006.08.006] |
WALWORTH N G, ZAKEM E J, DUNNE J P, et al. Microbial evolutionary strategies in a dynamic ocean. Proceedings of the National Academy of Sciences of the United States of America, 2020, 117(11): 5943-5948 DOI:10.1073/pnas.1919332117 |
WANG C H, LO C F, LEU J H, et al. Purification and genomic analysis of baculovirus associated with white spot syndrome (WSBV) of Penaeus monodon. Diseases of Aquatic Organisms, 1995, 23(3): 239-242 |
WARD B A, COLLINS S, DUTKIEWICZ S, et al. Considering the role of adaptive evolution in models of the ocean and climate system. Journal of Advances in Modeling Earth Systems, 2019, 11(11): 3343-3361 DOI:10.1029/2018MS001452 |
WEI S, JIANG W M. Study on food web of fishes in the Yellow Sea. Oceanologia et Limnologia Sinica, 1992, 23(2): 182-192 [韦晟, 姜卫民. 黄海鱼类食物网的研究. 海洋与湖沼, 1992, 23(2): 182-192] |
WU Q, WANG J, LI Z Y, et al. Spatial variations of crustacean community structure in Yellow Sea and Bohai Sea in spring. Journal of Fisheries of China, 2012, 36(11): 1685-1693 [吴强, 王俊, 李忠义, 等. 黄渤海春季甲壳类群落结构的空间变化. 水产学报, 2012, 36(11): 1685-1693] |
WU Q, YING Y P, TANG Q S. Changing states of the food resources in the Yellow Sea large marine ecosystem under multiple stressors. Deep-Sea Research Part Ⅱ: Topical Studies in Oceanography, 2019, 163(5): 29-32 |
YAN D C. White spot syndrome virus (WSSV) PCR detection optimization and zooplankton mid-host investigation. Doctoral Dissertation of Ocean University of China, 2004 [闫冬春. 白斑综合症病毒(WSSV)的PCR检测条件优化及浮游动物中间宿主的调查研究. 中国海洋大学博士研究生学位论文, 2004]
|
YU Y J. The sustainability of shrimp aquaculture. Masterxs Thesis of Ocean University of China, 2006 [余云军. 对虾养殖业的可持续发展研究. 中国海洋大学硕士研究生学位论文, 2006]
|
ZHAO J, LIANG J L, ZHOU X J, et al. Research on relationship between dominant crustacean species and environmental factors based on GAM. Southern Fisheries Science, 2017, 13(3): 26-35 [赵静, 梁金玲, 周曦杰, 等. 基于GAM模型的马鞍列岛海域优势甲壳类与环境因子的关系研究. 南方水产科学, 2017, 13(3): 26-35 DOI:10.3969/j.issn.2095-0780.2017.03.004] |
ZHOU H M, FENG J F, ZHU L. Effects of environmental factors on the chlorophyll a in central Bohai Sea with GAM. Marine Environmental Science, 2014, 33(4): 531-536 [周慧敏, 冯剑丰, 朱琳. 基于GAM的渤海中部水体叶绿素a环境因子影响分析. 海洋环境科学, 2014, 33(4): 531-536] |




