2. 中国水产科学研究院淡水渔业研究中心 中国水产科学研究院内陆渔业生态环境与资源重点开放实验室 江苏 无锡 214081
2. Key Laboratory of Fishery Ecological Environment Assessment and Research Conservation in Middle and Lower Reaches of the Yangtze River, Freshwater Fisheries Research Center, Chinese Academy of Fishery Sciences, Wuxi, Jiangsu 214081, China
种群指在一定时间内生活在一定自然空间区域内的同种生物的所有个体的集合。种群生态学是主要研究种群的数量变化、分布特征以及种群与环境相互关系(包括种群与栖息环境的非生物因素以及环境中其他生物之间的相互作用)的一门学科(Begon et al, 1996; 吴祖立等, 2018)。在种群生态学领域内,破解鱼类种群的数量特征、生境利用、种群结构和动态变化等种群属性是保护和合理开发渔业资源的基础(Larsson et al, 2015; Arthington et al, 2016)。目前,已有耳石微结构、耳石微化学、分子生物学标记、物理标记、电子/卫星标记、声学遥测技术、分布与数量数据、形态学特征和器官比率特征等大量的生物及其他学科技术被应用于鱼类种群生态学的研究中(Tanner et al, 2014; Bardarson et al, 2017; Tzadik et al, 2017)。
耳石作为具有可持续生长及代谢惰性特点(Campana, 1999; Campana et al, 2001; Thomas et al, 2019)的生物钙化结构,能够提供鱼类个体在其一生中所经历栖息地环境的信息(Tanner et al, 2014; Teichert et al, 2018; Watson et al, 2018)。耳石的生长增量可以每日为时间尺度加以计量(称为“日轮”);在更大的时间尺度上,其生长带的季节性变化导致明显轮纹交替而形成“年轮”。这使耳石成为一种较为可靠的年龄鉴定材料,可以获取从仔幼鱼到成鱼阶段的日龄/年龄和生长等生物学信息(Campana et al, 2001)。耳石可持续生长且很难代谢的特性也决定了耳石中特定位置的元素含量及组成能反映鱼类在形成该部分耳石期间所经历的环境元素状况(Campana, 1999; Izzo et al, 2018)。因此,耳石具有优良的时空动态“记录器”特性,可记录鱼类个体从出生到死亡的全部生活史的生境变化规律。随着检测技术的发展和检测成本的下降,对耳石元素组成细微变化的分辨能力得到了极大提高。目前,耳石微化学分析技术越来越多地被用于阐明鱼类的洄游生活史(Soeth et al, 2020)及用于定义种群结构、评估资源鱼群的构成和破解种群关联性等鱼类种群生态学研究领域(Radigan et al, 2018; Burns et al, 2020; Swanson et al, 2020)。
本文将着重阐述以耳石微化学分析方法进行的鱼类种群生态学研究,从耳石元素的组成特征以及耳石元素与环境、生理等因素的关系等方面归纳耳石微化学分析应用于鱼类种群生态学的理论基础;通过对国内外文献的综述,介绍耳石微化学分析在解决鱼类的生活史特征、种群结构、种群关联性及生境履历等种群生态学问题方面的进展,并展望今后应用耳石微化学分析技术来研究鱼类种群生态学问题的发展趋势以及需要关注的科学问题。
1 鱼类耳石元素组成的特征耳石是位于硬骨鱼类内耳半规管内的生物钙化结构,用来保持听力和平衡等感觉功能(Schulz-Mirbach et al, 2019)。耳石通常由碳酸钙(CaCO3)(约98%)和小部分有机物(0.1%~2.3%)(可溶性和不可溶性蛋白基质)及约45种微量元素组成(Campana, 1999; Sturrock et al, 2012)。
耳石元素主要来自周围环境,耳石元素的组成和含量主要与周围水化学元素的生物可利用浓度及其物理化学特性(如盐度和温度)有关(Campana, 1999; Izzo et al, 2018; Hüssy et al, 2020)。耳石是由复杂的多细胞生物产生的,其沉积面不直接与周围的水环境接触,耳石沉积的元素需要在通过多层的生理屏障后进入血浆,然后通过淋巴膜进入内淋巴。在进入内淋巴后,不同的元素沉积进入耳石的过程也不相同。元素沉积进入耳石的形式有3种:替代CaCO3耳石晶格内的Ca2+;作为晶格间隙中的夹杂物;与耳石的蛋白质成分相结合,沉积在有机质部分(图 1)(Campana, 1999; Izzo et al, 2016; Thomas et al, 2017; Hüssy et al, 2020)。

|
图 1 元素在耳石中积累的主要过程示意图(Campana, 1999; Hüssy et al, 2020) Fig.1 Schematic diagram of the main process of element accumulation in otolith (Campana, 1999; Hüssy et al, 2020) |
耳石作为鱼类生境示踪器和重建鱼类生活史水环境的指标基于以下2个基本假说:耳石化学反映了生境水化学特征;栖息地环境条件会影响耳石元素的沉积。目前的耳石微化学研究中,Sr和Ba是能够在耳石中直接替代Ca的最受关注的元素。Izzo等(2018)综合大量的实验室及野外研究的结果进行统合分析(meta-analysis)表明,耳石中Sr/Ca、Ba/Ca的值和周围水环境中这2个值呈正相关。当然,由于内在和外在因素影响耳石元素吸收,耳石Sr/Ca、Ba/Ca与水化学成分之间的相关程度在不同物种和不同研究状况中有所不同,但总体上能较好反映其在水环境中的浓度。在实验室可控养殖条件下,黄尾平口石首鱼(Leiostomus xanthurus)的耳石Sr/Ca与Ba/Ca与周围水环境中各自的比值呈正相关(Bath et al, 2000)。在饲养条件下,布氏棘鲷(Acanthopagrus butcheri)的耳石Sr/Ca与周围水体的Sr/Ca及暴露时间相关(Elsdon et al, 2005)。黒翅深水三鳍鳚(Forsterygion nigripenne)耳石Sr/Ca和Ba/Ca与水环境中其含量比值呈直接线性相关(Taddese et al, 2019)。剑鳠(Sperata aor)耳石Sr/Ca、Ba/Ca和Zn/Ca的元素含量比与其周围的水化学相应元素的含量比正相关(Nazir et al, 2019)。
研究表明,从河流、河口到海洋,水中Sr和Ca的浓度均随着盐度的升高而升高,但二者升高的幅度不同(He et al, 2016)。在不同的水域环境下,Sr/Ca值的变化趋势不同,有的与盐度呈线性相关(Arai et al, 2016),有的与盐度呈曲线相关(Walther et al, 2015; Nelson et al, 2020)。总的趋势是Sr/Ca值在海水中普遍较高且稳定;在淡水中普遍较低,但变化幅度较大(Walther et al, 2015; He et al, 2016; Nelson et al, 2020)。由于耳石与水体Sr/Ca值具有相关性,而水体Sr/Ca值与盐度之间又具有相关性,耳石Sr/Ca值常被用来重建鱼类所经历的盐度环境“履历”。许多耳石微化学研究验证了耳石Sr/Ca值与盐度的正相关性。例如,Arai等(2016)在实验室控制的盐度梯度(0、10、20和28)条件下,对花鳗鲡(Anguilla marmorata)进行养殖实验,结果表明花鳗鲡耳石中Sr/Ca值与盐度呈显著相关关系,为重建其自然水域洄游生活史提供了可靠的支撑。
水中Ba浓度的趋势与Sr相反,Ba在淡水中的浓度比海水中高,随着盐度的上升,水中Ba含量逐渐下降;而Ba/Ca值随盐度升高而显著下降(He et al, 2016; Nelson et al, 2020)。
另外,食物对耳石元素的沉积和含量组成也有贡献,但影响较小(Woodcock et al, 2012; Chang et al, 2013; Doubleday et al, 2013)。遗传因素(Clarke et al, 2011; Barnes et al, 2013)和生理因素(Sturrock et al, 2012; Grönkjær, 2016; Grammer et al, 2017)对耳石元素组成也有影响。这些因素在分析耳石元素组成、微化学特征及与栖息地关系时需进行更加客观的评估。
2 耳石微化学分析在鱼类种群生态学研究中的应用特定元素(如Sr等)在海水、淡水或水体不同地理位置中具有相当大的含量差异。另外,近海和内陆水域的元素含量变化比外海大得多(Campana, 1999)。在耳石中这些元素可按照生长时间序列得以记录和保存,故在鱼类种群生态学研究中,耳石微化学分析可以在反演鱼类生活史、评估种群结构、评估关联性、评估混合鱼群的构成与来源等方面发挥巨大的作用(Walther et al, 2012)。
2.1 反演资源种群的生活史和溯源关键栖息地鱼类生活史、不同生境利用模式及不同生活史过程的生境选择性等是鱼类生态学研究中关注的重点。传统的标记、跟踪等方法在一些活动范围广、鱼体较小的鱼类中明显受限。耳石微化学分析可以通过破解鱼类所跨越的水体不同元素的背景来研究鱼类生活史,且既可以有效重建单个个体的生活史,又可在对种群内大量个体进行分析的基础上,来确定鱼类种群的活动和生活史特征。
由于Sr/Ca值在淡水与海水间具有明显区别,而在淡水支流间精细的空间尺度上往往也存在差异,且耳石Sr/Ca与水化学成分以及盐度等环境因子之间具有相关性,因此,耳石Sr/Ca往往成为区分鱼类生活史中淡水和海洋栖息地的指标,成为分析孵化场盐度特性及判别鱼类是否进行淡–半咸水–海水间洄游的有力工具。例如,Möller等(2019)利用耳石Sr/Ca重建了波罗的海吕根岛周围海域的白斑狗鱼(Esox lucius)的生活史后发现,其资源群中6%的个体的早期生活史是淡水起源,而94%的个体孵化于半咸水,表明波罗的海南部咸水湾对狗鱼繁殖和资源补充具有不可或缺的重要性。Avigliano等(2018a)使用耳石Sr/Ca重建了拉普拉塔河河口的牙汉鱼(Odontesthes bonariensis)的生活史,发现其每年在淡水和河口半咸水之间洄游,没有发现定居或洄游进入海水环境的个体。
耳石生长特征(如日轮、年轮)与耳石微化学结果的联合分析可成为反演鱼类使用不同生境的持续时间和频率的有效手段。例如,Payne Wynne等(2015)利用耳石沿核心到边缘元素的直线分析,成功重建了美国缅因州沿岸不同河流的蓝背西鲱(Alosa aestivalis)的生活史。以淡水阶段对应的耳石半径与第1年轮对应的耳石半径的比例为淡水生境持续因子,发现不同河流的蓝背西鲱早期生活史阶段利用淡水生境的时间不同。发育至第1次进入高盐度水域前在淡水环境内生活的持续时间与淡水生境大小及淡水生境到河口外海水区域的距离呈正相关。Rohtla等(2014)利用Sr/Ca和Ba/Ca反演了江鳕(Lota lota)的生活史,也发现个体间利用淡水生境持续时间具有差异性。Schoen等(2016)首先根据黄金鲈(Perca flavescens)耳石边缘的耳石元素数据建立了海滨湿地和近岸栖息地之间的Sr/Ca和Ba/Ca指纹,然后将经过耳石核心一直到边缘的线上的每一个数据点判别到对应的生境类型(使用LA-ICP-MS分析),连续的数据点则对应生境使用的持续时间,从而还原了黄金鲈在北美大湖区(the Great Lakes)的生活史策略。Walsworth等(2015)对美国阿拉斯加地区的洄游型红大麻哈鱼(Oncorhynchus nerka)进行耳石元素线分析,基于Mn和Sr两种元素判别出了鱼类个体在早期生活史阶段选择利用Black River和Chignik Lake两处不同的淡水生境的情况及栖息时间。Teichert等(2018)利用耳石微化学多元素微化学特征判别了兔头瓢鳍虾虎鱼(Sicyopterus lagocephalus)资源的来源河流及使用不同河流栖息地的时间特征。
国内学者应用耳石微化学分析方法反演鱼类生活史的研究也取得了不少进展。特别是针对刀鲚(Coilia nasus)开展了大量相关研究,水域涉及瓯江(Jiang et al, 2014)、钱塘江(Khumbanyiwa et al, 2018)、长江口(Yang et al, 2006; Dou et al, 2012b)、长江不同江段(陈婷婷等, 2016a、b; 李孟孟等, 2017a、b)、鄱阳湖等长江及黄河沿线6个湖泊(Sokta et al, 2020)、洞庭湖(轩中亚等, 2020)、东海部分海区(Jiang et al, 2014)、黄海沿岸(Jiang et al, 2014)、黄河口及东平湖(丛旭日等, 2019、2022),日本有明海及其沿岸的筑后川、六角川(Liu et al, 2018)等。Jiang等(2014)发现刀鲚早期淡水生境生活史的持续时间及其在整个生活史中所占比例与其母河的长度相关。母河的长度越短,刀鲚早期生活史利用淡水生境的时间比例越小,并提出了淡水系数的概念(即个体早期淡水生活史占整个生活史的比例),为研究洄游鱼类对淡水生境的依存程度提供了一个可量化的指标。Khumbanyiwa等(2018)对刀鲚的生活史反演发现,在同一钱塘江内,不同刀鲚资源的淡水系数也有显著差异。另外,基于耳石从核心到边缘的Sr/Ca值变化特征,长江口的凤鲚(Coilia mystus)(杨琴等, 2019)、鲻(Mugil cephalus) (杨健等, 2010)、焦氏舌鳎(Cynoglossus joyneri)、皮氏叫姑鱼(Johnius belengerii)、

种群结构就是自然环境中的生物种群的一定的空间分布格局。物种种群结构的描述是种群生态学的中心目标之一,也是物种管理和保护的基础(Collins et al, 2013)。了解鱼类的种群结构可以为鱼类管理和保护的合适空间尺度的确定提供重要信息。遗传信息可以用来评估鱼群的种群结构,但遗传水平的差异需要多代积累,如果有迷航个体探索新栖息地,那么产生的种群间基因流也将抑制遗传结构的形成。因此,在一些种群间存在频繁的基因流的情况下,分子生物学方法对种群结构的评估灵敏性遭到挑战,而耳石微化学的发展为种群结构的研究提供了有力的支持。
研究发现,南美洲的洄游型鱼类玛丽鲮脂鲤(Prochilodus mariae)是一种多次生殖型鱼类,每年从安第斯河东坡的山脚下溪流洄游到季节性淹没的洪泛区产卵。Collins等(2013)从微卫星遗传结构和耳石微化学分析两方面对其种群结构进行了探索,尽管遗传分析未发现遗传结构,但耳石微化学分析的结果显示,来源自不同母河的个体耳石微化学信号不同,这说明亲鱼是来源于不同支流的繁殖种群。因此,要保证该鱼种渔业的可持续发展就需要针对不同的繁殖群体进行分别管理。虽然于悦等(2016)利用微卫星分子标记分析长江、赣江和鄱阳湖鲢(Hypophthalmichthys molitrix)群体遗传结构发现,这些水域的4个鲢野生群体的遗传一致性高,遗传距离小,遗传分化不显著;但潘静等(2018)对长江、赣江的鲢幼鱼耳石核区元素指纹特征进行分析的结果显示,Sr/Ca、Ba/Ca、Si/Ca和Mg/Ca等元素比值可以作为识别长江和赣江鲢群体的环境元素指纹(判别成功率在90%以上)。耳石微化学结果为进一步分析鄱阳湖鲢群体的来源以及探究长江、赣江鲢资源群体之间是否存在交流以及交流的程度提供了难得的信息。
对于溯河洄游型鱼类而言,其繁殖和孵化在淡水中进行,生长阶段则在海水环境中。开阔的海洋环境可使不同来源的幼鱼在相同的海洋区域生长,但到成鱼阶段可进行溯河洄游繁殖时,其是否具有起源地回归繁殖的特性将是塑造这类鱼种群结构的关键因素(McDowall, 2001)。在具有回归特性的洄游鱼类中,亲鱼以较高的精度回到其出生的产卵场繁殖,且其后代循环往复,则不同种群间在繁殖阶段形成了明显的空间分布格局,具有强烈的种群结构(McDowall, 2001; Kitanishi et al, 2018)。利用耳石核心及周边区域的元素微化学“指纹”,研究者可以重建鱼类早期生活史的生境履历,区分来源于不同产卵场的资源个体。如果精细对比特定水域及特定季节内的同种鱼的耳石核心元素,还能判断洄游型个体是否具有回归特性。Engstedt等(2014)分析了瑞典东南部相互临近的4条河流(4个河口位于半径50 km的范围内)的白斑狗鱼幼鱼和上溯回到母河的成鱼(第2年采样)的耳石核心元素,这些样本出生于同一年,耳石核心多元素特征证明狗鱼能够精确地回归到其出生的河流,使狗鱼种群形成了清晰的种群结构。由于这种回归产卵的行为导致了分离的亚种群,那么管理应该基于不同的亚种群,而不是将其视为一个匀质化的种群。Avigliano等(2018b)研究在河口和上游之间洄游的钝齿巨兔脂鲤(Megaleporinus obtusidens)的耳石核心的元素指纹,在Uruguay River、Paraná River以及它们共同的河口Río de la Plata Estuary等3处采样点,其耳石核心多元素具有显著差异,显示其早期生活史阶段生境的不同,构建了河流上游和河口的3个种群间的种群结构。
耳石微化学分析也可以给种群遗传结构的研究提供良好的支撑。在洄游鱼类上溯的过程中,洄游通道中往往存在许多来源于不同产卵场的资源种群,而特定产卵场也可能有本应回其他产卵场的迷航者。如果仅仅直接使用采样地点的样本作为资源种群基线(population baseline)有可能不可靠。因此,Martin等(2015)在使用耳石核心元素特征确定资源鱼的产卵场起源之后,把来自同一河流的个体集合在一起定义为一个种群基线,发现西鲱(Alosa alosa)亲鱼展现出较高水平的回归精度,种群结构比较清晰。然而,遗传分析显示这个物种的遗传结构较为微弱。这可能验证了耳石微化学分析所发现相邻河流产卵场间会出现少量迷航者的原因。Hughes等(2014)先使用耳石微化学分析确认了澳大利亚沿岸河流中的一种后鳍鲑属鱼类(Retropinna spp.)两侧洄游(amphidromous)的生活史类型,然后基于微卫星和mtDNA技术都发现了种群高度结构化。两侧洄游的鱼类在幼鱼阶段生活在河口或近海,对于某些两侧洄游鱼类而言,不同河流来源的幼鱼个体在近海区域生活,之后可能上溯到不同于其出生地的河流中生长和繁殖,这种混合导致遗传上的匀质化。Hughes等(2014)发现澳大利亚胡瓜鱼(Osmerus mordax)不同流域个体的耳石核心多元素特征具有巨大差异,判别分析表明这些胡瓜鱼都回到了出生的河流,据此推断,该种鱼类早期生活在河口,而不是更均匀的海洋环境中,从而避免了分散到不同的河流中,并形成了鲜明的遗传分化。这些实例进一步说明耳石微化学分析方法与分子遗传学方法的结合能更好地解析洄游鱼类的种群结构等信息。
迄今,国内学者利用耳石微化学分析进行鱼类种群结构的研究尚不多。Dou等(2012a)利用耳石核心元素指纹研究了中国沿岸刀鲚种群的结构。辽河口、海河口、黄河口、大沽河口及长江口等地的刀鲚耳石核心元素的判别分析结果表明,各河口间的元素指纹差异显著,总体判别成功率可达72.7%,显示了各个河口间刀鲚种群的空间结构。Jiang等(2016)基于耳石核心元素指纹的分析,发现长江口春季幼鱼来源于鄱阳湖,而长江口夏季和春季的刀鲚幼鱼来源于另外不同的产卵场。这些结果显示了长江流域的刀鲚起源与不同产卵场的情况复杂,具有种群结构。Xuan等(2021)结合耳石微化学与分子种群遗传学交叉的优势,在使用耳石微化学确认刀鲚样本生态型的基础上,对鄱阳湖、洞庭湖、长江干流等水域的刀鲚的长颌鲚类型和短颌鲚类型进行遗传分析,认为应将这2个类型视为2个处于早期物种形成时期的不同鲚属物种,而2个物种内部都有洄游生态型和淡水定居生态表型,并且物种内生态型之间缺乏遗传分化等一系列特征。
在一些物种内部存在生活史的多样性,即物种内部不存在一个稳定的洄游、定居型的区分,而可能是个体遵循溯河洄游行为的程度不同,在这些物种中,洄游和定居似乎反映了遗传、个体条件和环境影响之间的相互作用(Kendall et al, 2015; Baerwald et al, 2016)。因此,由于环境变化,个体条件不同或个体对特定环境刺激的敏感性,个体可以表现出生命史可塑性(Baerwald et al, 2016)。一些溯河洄游鱼类种群中包含一部分不迁移到海洋中而是在淡水中成熟产卵的个体,在一些情况下,它们的活动范围可能很小,通常它们和进行溯河洄游的同种之间可以繁殖,其后代也可能仍进行洄游活动。这为种群结构和种群遗传结构的研究带来了巨大的挑战。例如,Rodger等(2021)发现褐鳟(Salmo trutta)中同一地区的洄游型与定居型之间没有明显的遗传差异,差异主要是地理结构间的。该研究以溯河型褐鳟鱼的表皮上有银斑、身体细长(smolt期),非溯河褐鳟鱼表皮上没有银斑、仍保持幼鱼颜色为标准判断生态型,并在不同的季节采样尽量错开2种生态型。然而,这种方法并非完全可靠:褐鳟表现出的potamodromy (河流–河流和或湖泊–河流–河流迁移)也可能表现出银色(Ferguson et al, 2019),这就有可能产生误判,从而可能导致遗传分析产生混淆。对于北极红点鲑(Salvelinus alpinus),有的研究中洄游型与定居型分别是遗传上稳定的种群,不同生态型之间具有明显的遗传分化(Salisbury et al, 2017; Melnik et al, 2020);另有研究则在北极红点鲑(Moore et al, 2014)以及花羔红点鲑(Salvelinus malma malma)中发现同域分布的洄游和定居的生活史形式间没有遗传差异,洄游和定居型之间存在条件交配策略(conditional mating tactics) (Harris et al, 2015)。需要注意的是,上述定居型和洄游型种群遗传分化的研究都是根据形态或采样的季节来判断样本中的洄游型与定居型。上述基于生态型分化的遗传学研究,可能建立在不可靠的生态型鉴定方法上,这可能正是上述研究结果之间存在不一致的原因。在未来的研究中非常有必要在涉及洄游型与定居型之间的种群遗传学分析之前,首先使用耳石微化学分析来准确分辨样本的生态型。
2.3 评估资源种群的群体关联性鱼类关联性是指同一鱼种在仔鱼、幼鱼和成鱼等不同生活史阶段所分别利用栖息地生境之间的联系(Gibb et al, 2017; Pan et al, 2020)。对许多鱼类来说,产卵场、育幼场、索饵场等在空间上是分离的,而仔鱼、幼鱼阶段的扩散是连接生命历史各阶段的必经过程。不同生活史阶段的鱼类种群及生境之间的关联性往往是资源补充的前提。破解不同生活史阶段基本生境之间的关联性是鱼类管理的关键,因为它能为渔业评估和管理确定合适的空间尺度。由于幼鱼阶段鱼类个体较小、难以使用,限制了电子标签、遥测技术等追踪技术在鱼类生活史不同阶段的关联性上的使用。耳石微化学分析为这一问题的解决提供了可能。由于鱼类个体生长过程中获取的元素被保存在相应的个体发育时期形成的耳石微结构内,因此,对应位置的耳石元素特征可能反映相应的鱼体生长阶段鱼类经过的元素水化学性质不同的生境(Wright et al, 2018)。由于仔鱼阶段的高死亡率,直接通过追踪仔鱼的来源非常困难,然而,如果将已经进入到混合种群后的幼鱼或成鱼阶段的个体作为研究对象,使用耳石核心元素聚类分析来推测贡献于仔鱼补充的来源簇的数目,然后将不同混合种群中的来源簇数目及所占比例进行比较,即可有效推断出仔鱼扩散的空间范围及仔鱼来源与混合的生长种群间的关联性(Wright et al, 2018)。
来源于不同产卵场的幼鱼可能在生长区混合成大的混合鱼群,对于混合鱼群补充的来源和构成比例的了解是渔业资源评估与管理的基础。实际上,评估混合鱼群的不同来源本质上就是评估鱼类生长区与不同的繁殖地(产卵场)的关联性。Gibb等(2017)对在苏格兰海岸附近的海玉筋鱼(Ammodytes marinus)的耳石核心元素的聚类分析显示有3个可能的产卵场进行资源补充。孵化的仔鱼经过漂浮阶段后进入4个不同生长区。在这些生长区发育后,4个生长区之间鱼耳石的微化学元素成分(耳石边缘)已经大不相同,显示出不同的产卵场与生长区之间的关联性。Pan等(2020)对中国沿岸青岛、吕四、象山、福州等4个蓝点马鲛(Scomberomorus niphonius)产卵场资源鱼的耳石元素“指纹”进行分析,显示未成熟的蓝点马鲛在开阔的近海水域觅食和过冬时,在很大程度上混合在一起;而在同一产卵场产卵的亲鱼则会有多个产卵场起源。在青岛海域捕获的亲鱼甚至可能是来源于福州水域。对耳石核心附近的元素进行聚类分析,结果显示,仔鱼可有3个来源,即南部区域产卵的亲鱼以单个来源为主,北部区域以2~3个来源为主。黄海渔业所依赖的蓝点马鲛集群受到我国沿海水域所有产卵场孵化来源的共同补充,而不是各个产卵场资源各自分离。这体现出蓝点马鲛这种高度活动性的鱼类明显的种群关联性。加拿大魁北克省的萨格奈–圣·劳伦斯海洋公园保护区毛鳞鱼(Mallotus villosus)的保护也是耳石微化学分析评估鱼群构成和来源的例子。耳石微化学分析表明,在该保护区中生长的1+龄毛鳞鱼主要孵化起源于位于保护区边界之外的圣劳伦斯河口。由于其为保护区内许多海洋动物的关键饵料鱼,确保保护区内外毛鳞鱼上述关键栖息地的关联性十分重要(Lazartigues et al, 2016)。
作为一种洄游型鱼类,确定不同水域洄游型刀鲚仔鱼、幼鱼和成鱼间的资源关联性难度很大。Jiang等(2016)基于耳石核心元素指纹的分析,通过长江口春季刀鲚幼鱼耳石核心元素与鄱阳湖内定居的短颌鲚及进入鄱阳湖繁殖的刀鲚成鱼的耳石核心元素的综合比较,证实了长江口春季幼鱼与鄱阳湖成鱼的关联性,显示出长江口一些特定刀鲚资源的起源来自鄱阳湖内的产卵场。
3 耳石微化学方法的局限性及解决途径耳石微化学分析方法虽然在鱼类资源种群的关联性和种群结构的研究中发挥重要作用,但其可能的局限性也需注意。
第一,耳石微化学在记录水环境背景方面的优势显著,而同一地点的水环境中元素的组成可能会随时间发生变化,且水温、盐度等环境因素变化也可能影响到鱼耳石微化学“指纹”。耳石作为环境变化的自然标记物,准确区分其“指纹”变化是同一地点的水环境因素所导致,还是该鱼曾生活过另一不同水域的背景所导致仍非易事(Gillanders, 2005)。为了对耳石微化学分析结果进行正确解读,在使用耳石微化学特征研究鱼类生活史、不同地理区域鱼类的关联性和种群结构时,需要先对研究水域水环境化学特征的时序稳定性进行评估。Morissette等(2021)对加拿大圣劳伦斯河下游的支流和干流水体中的鱼类耳石常见元素(Sr、Ba、Mg和Mn)进行微化学分析,发现不同支流间水体的元素含量具有空间差异,且这种差异不受季节的影响,表明支流间水化学背景差异显著且稳定。基于此,圣劳伦斯河地区的鱼类耳石微化学数据在支流尺度上适用于重建鱼类生活史、判别鱼类补充来源和确定种群结构等研究。
由于同一水域不同年份的水环境变化也可能使不同年份孵化的鱼类的耳石微化学信号出现一些差异,这可能会导致在进行种群结构分析时将同一地点不同年份的补充群体误判为来源于不同的地理群体。要避免这种误判,需要对研究水域内不同年份鱼的耳石微化学背景进行调查。如果存在年际间差异,起源水域判别与种群关联性等研究只能限定用同一年份孵化的鱼类个体来进行。Pangle等(2010)对Erie湖水元素及黄金鲈(Perca flavescens)的耳石微化学比较研究表明,虽然不同地理水域鱼的耳石微量元素具有显著差异,但耳石元素特征的年际变化也较大,需要每年都建立不同地点的耳石微化学基础数据,以作为区分黄金鲈来源的依据。Reis-Santos等(2012)在葡萄牙沿岸几个河口于2年内的每年的3个季节(春、夏和秋)分别采集Platichthys flesus和Dicentrarchus labrax的耳石进行微化学分析,发现耳石元素在年际间和季节间均有差异,但将每一年不同季节的数据混在一起后,年与年之间的判别精度很高,因此,建议以同一年孵化的个体的耳石元素作为判别基线。之后,Reis-Santos等(2013)利用可以确定来源的0龄幼鱼作为河口的耳石元素基线(较早采样),使用耳石元素回顾性识别已移动到沿海生境的成鱼(与以上作为基线的0龄鱼于同一年孵化)的河口育幼场的使用情况,发现不同年份主要的补充种群来源自不同的河口。
值得注意的是,不少研究表明虽然观察到耳石元素特征在时序上的变化,但这种变化远小于地理空间上的差异,因此,对地理种群间的判别影响较小。Martin等(2013b)研究了法国南部Adour河流域的大西洋鲑(Salmo salar)幼鱼在早期淡水生活史阶段的耳石微化学和水化学特征,尽管观察到不同年际的耳石元素组成有变化,但这种变化与地理区域差异相比很小,不影响将幼鱼判别到其母河的能力。Schaffler等(2015)利用耳石核心元素可以将孵化自大坝上游和下游的阿拉巴马西鲱(Alosa alabamae)幼鱼准确地判别出来。虽然部分元素存在年际变化,但对判别结果无明显影响。Aschenbrenner等(2016)研究了河口和海岸的亚历山大笛鲷(Lutjanus alexandrei)的耳石微化学时空变化,发现河口的稚鱼和亚成体(sub-adult)的耳石元素构成连续3年之间无显著差异,沿岸的更大一些的个体的耳石元素年际间也相似,而河口与沿岸的耳石元素构成则具有显著差异,表明使用耳石元素判断亚历山大笛鲷利用河口与沿岸等不同生境的比例的可行性。总之,在使用耳石微化学进行鱼类的生活史、栖息地相关研究之前,尤其是进行种群结构分析之前,建议首先对不同年份孵化的鱼类样本进行微化学特征年际间稳定性的背景调查,从而确定分析方案,避免年际差异的干扰。
第二,尽管耳石微结构分析、耳石微化学分析及其结合使渔业科学发生重大变化,带来鱼类评估和渔业生态学的重大进展,然而使用耳石进行微化学分析也有不足。特别是从鱼体中取出耳石的过程是致死性的。对那些濒危及受保护的物种而言,这种分析方法的局限性非常明显,且鲟等软骨鱼耳石的砂粒状结构不太适合进行微化学分析。因此,探寻一些可以用来替代耳石的其他硬组织具有特别重要的价值。理论上,拥有结构内元素和稳定同位素值具有代谢惰性(或缺乏分子周转)的组织较为适合用于微化学研究(Tzadik et al, 2017)。鱼类鳍条的研究显示其作为替代耳石的硬组织的潜力。鳍条组织在研究铲鲟(Scaphirhynchus platorynchus)生活史中不同生境的连通性中发挥了重要作用(Pracheil et al, 2019)。姜涛等(2021)研究了刀鲚胸鳍条和耳石微化学“指纹”的相似性,证明刀鲚胸鳍条可以代替耳石进行洄游习性和生境履历等方面的研究。鳍条等硬组织作为耳石的非致死替代分析物质,在鱼类的生活史重建、种群结构评估、补充来源判别和栖息地关联性等方面将会具有广泛应用的价值,但至今相关研究仍较少,其应用特征仍需进一步探索(Tzadik et al, 2017)。
4 展望目前,随着耳石微化学研究的精度的进一步提升和检测成本的逐步下降,耳石微化学越来越多地被用于阐明鱼类的种群生态学。耳石微化学分析中一些新方法的应用需要得到高度关注。耳石87Sr/86Sr同位素比值可直接反映周围水化学构成(Kennedy et al, 2000; Martin et al, 2013a; Avigliano et al, 2020; Heckel et al, 2020),而水域内基岩的地球化学构成及地质构造的年龄决定解离到水中的Sr同位素比值(Hegg et al, 2013; Martin et al, 2013a; Garcez et al, 2015),因此,河流水化学的87Sr/86Sr比值稳定,经时变化很小(Brennan et al, 2015a; Garcez et al, 2015),这使耳石87Sr/86Sr值可以成为判断鱼类的出生来源、评估种群结构以及反演鱼类生活史的有力工具(Brennan et al, 2015b; Garcez et al, 2015; Avigliano et al, 2020; Heckel et al, 2020),可以作为耳石元素指纹方法的重要补充或在某些87Sr/86Sr值具有显著差异的地理环境中单独使用。目前,Wang等(2020)已经建立了中国境内第一个大尺度地区范围下的87Sr/86Sr比值背景地图,可为研究古代与当代的生物洄游及迁徙模式提供重要的基础资料。由于目前在国内耳石Sr同位素的研究仍属空白,未来宜结合栖息地水化学87Sr/86Sr同位素比值特征,将耳石87Sr/86Sr尽快引入国内鱼类种群生态学等研究中,以便在更广的时间和空间尺度上破解鱼类的生活史和栖息地规律。
同时,其他一些领域的研究拓展也需加强。
迄今对影响耳石微化学特征的因素的认识仍然有限,还需更深入地理解为什么物种间的耳石微化学特征具有差异,以及是否可预测这些种间的差异。这将有助于将栖息地环境对耳石微化学特征的影响更有效地应用到不同物种之间的比较之中(Nelson et al, 2019)。其次,在分析中应尽可能地在精细的尺度下分析耳石微化学特征,这对于根据耳石微化学特征重建环境特性变化时的空间和时间尺度非常重要。
如前文所述,基于非致死、低损伤取样的耳石替代组织(如鳍条等)还可以应用到鱼类洄游习性、生境履历、生活史不同生境的连通性等研究中。
上述耳石或其他生物硬组织研究中的化学元素“指纹”均为环境和生理作用结合的情况下自然沉积形成的天然标记。在鱼类生长的过程中,如果在其生活的水环境中添加Sr、Ba等元素,其耳石或其他硬组织上相应形成且易于分辨的标记区同样可作为人工标记(Thorrold et al, 2002)。这些将具有特殊的应用优势(Campana, 1999)。近期国内的相关研究已逐渐增多,如邱晨等(2019)利用Sr对鲤(Cyprinus carpio)仔鱼耳石进行标记,司飞等(2019)利用锶标记牙鲆(Paralichthys olivaceus)耳石,王硕等(2022)利用耳石锶标记识别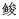
ARAI T, CHINO N. Influence of water salinity on the strontium: calcium ratios in otoliths of the giant mottled eel, Anguilla marmorata. Environmental Biology of Fishes, 2016, 100(3): 281-286 |
ARTHINGTON A H, DULVY N K, GLADSTONE W, et al. Fish conservation in freshwater and marine realms: Status, threats and management. Aquatic Conservation: Marine and Freshwater Ecosystems, 2016, 26(5): 838-857 DOI:10.1002/aqc.2712 |
ASCHENBRENNER A, FERREIRA B P, ROOKER J R. Spatial and temporal variability in the otolith chemistry of the Brazilian snapper Lutjanus alexandrei from estuarine and coastal environments. Journal of Fish Biology, 2016, 89(1): 753-769 DOI:10.1111/jfb.13003 |
AVIGLIANO E, MILLER N, VOLPEDO A V. Silversides (Odontesthes bonariensis) reside within freshwater and estuarine habitats, not marine environments. Estuarine, Coastal and Shelf Science, 2018a, 205: 123-130 DOI:10.1016/j.ecss.2018.03.014 |
AVIGLIANO E, PISONERO J, DOMÁNICO A, et al. Spatial segregation and connectivity in young and adult stages of Megaleporinus obtusidens inferred from otolith elemental signatures: Implications for management. Fisheries Research, 2018b, 204: 239-244 DOI:10.1016/j.fishres.2018.03.007 |
AVIGLIANO E, POUILLY M, BOUCHEZ J, et al. Strontium isotopes (87Sr/86Sr) reveal the life history of freshwater migratory fishes in the La Plata Basin. River Research and Applications, 2020, 36(10): 1985-2000 DOI:10.1002/rra.3727 |
BAERWALD M R, MEEK M H, STEPHENS M R, et al. Migration-related phenotypic divergence is associated with epigenetic modifications in rainbow trout. Molecular Biology, 2016, 25(8): 1785-1800 |
BARDARSON H, MCADAM B J, THORSTEINSSON V, et al. Otolith shape differences between ecotypes of Icelandic cod (Gadus morhua) with known migratory behaviour inferred from data storage tags. Canadian Journal of Fisheries and Aquatic Sciences, 2017, 74(12): 2122-2130 DOI:10.1139/cjfas-2016-0307 |
BARNES T C, GILLANDERS B M. Combined effects of extrinsic and intrinsic factors on otolith chemistry: Implications for environmental reconstructions. Canadian Journal of Fisheries and Aquatic Sciences, 2013, 70(8): 1159-1166 DOI:10.1139/cjfas-2012-0442 |
BATH G E, THORROLD S R, JONES C M, et al. Strontium and barium uptake in aragonitic otoliths of marine fish. Geochimica et Cosmochimica Acta, 2000, 64(10): 1705-1714 DOI:10.1016/S0016-7037(99)00419-6 |
BEGON M, MORTIMER M, THOMPSON D. Population ecology: A unified study of animals and plants. Blackwell Science, Cambridge, 1996
|
BRENNAN S R, FERNANDEZ D P, ZIMMERMAN C E, et al. Strontium isotopes in otoliths of a non-migratory fish (Slimy sculpin): Implications for provenance studies. Geochimica et Cosmochimica Acta, 2015a, 149: 32-45 DOI:10.1016/j.gca.2014.10.032 |
BRENNAN S R, ZIMMERMAN C E, FERNANDEZ D P, et al. Strontium isotopes delineate fine-scale natal origins and migration histories of Pacific salmon. Science advances, 2015b, 1(4): e1400124 DOI:10.1126/sciadv.1400124 |
BURNS N M, HOPKINS C R, BAILEY D M, et al. Otolith chemoscape analysis in whiting links fishing grounds to nursery areas. Communications Biology, 2020, 3(1): 1-12 DOI:10.1038/s42003-019-0734-6 |
CAMPANA S E, THORROLD S R. Otoliths, increments, and elements: Keys to a comprehensive understanding of fish populations?. Canadian Journal of Fisheries and Aquatic Sciences, 2001, 58(1): 30-38 DOI:10.1139/f00-177 |
CAMPANA S E. Chemistry and composition of fish otoliths: Pathways, mechanisms and applications. Marine Ecology Progress Series, 1999, 188: 263-297 DOI:10.3354/meps188263 |
CHANG M Y, GEFFEN A J. Taxonomic and geographic influences on fish otolith microchemistry. Fish and Fisheries, 2013, 14(4): 458-492 DOI:10.1111/j.1467-2979.2012.00482.x |
CHEN T T, JIANG T, LI M M, et al. Inversion of habitat history for the long-jaw ecotype Coilia nasus collected from Nanjing section of the Yangtze River. Journal of Fisheries of China, 2016a, 40(6): 882-892 [陈婷婷, 姜涛, 李孟孟, 等. 长江南京江段长颌鲚生境履历的反演. 水产学报, 2016a, 40(6): 882-892] |
CHEN T T, JIANG T, LU M J, et al. Microchemistry analysis of otoliths of Coilia nasus and Coilia brachygnathus from the Jingjiang section of the Yangtze River. Journal of Lake Sciences, 2016b, 28(1): 149-155 [陈婷婷, 姜涛, 卢明杰, 等. 基于耳石微化学的长江靖江段长颌鲚与短颌鲚生境履历重建. 湖泊科学, 2016b, 28(1): 149-155] |
CLARKE L M, THORROLD S R, CONOVER D O. Population differences in otolith chemistry have a genetic basis in Menidia menidia. Canadian Journal of Fisheries and Aquatic Sciences, 2011, 68(1): 105-114 DOI:10.1139/F10-147 |
COLLINS S M, BICKFORD N, MCINTYRE P B, et al. Population structure of a neotropical migratory fish: Contrasting perspectives from genetics and otolith microchemistry. Transactions of the American Fisheries Society, 2013, 142(5): 1192-1201 DOI:10.1080/00028487.2013.804005 |
CONG X R, LI X Q, DONG G C, et al. Anadromous tapertail anchovy Coilia nasus is still found in Dongping Lake. Chinese Journal of Fisheries, 2019, 32(5): 55-59 [丛旭日, 李秀启, 董贯仓, 等. 东平湖仍有洄游型刀鲚分布的实证研究. 水产学杂志, 2019, 32(5): 55-59 DOI:10.3969/j.issn.1005-3832.2019.05.009] |
CONG X R, LI X Q, DONG G C, et al. Preliminary investigations on Coilia nasus from the Kenli section of the Huanghe River based on otolith microchemistry. Progress in Fishery Sciences, 2022, 43(1): 31-37 [丛旭日, 李秀启, 董贯仓, 等. 基于耳石微化学的黄河垦利段刀鲚生活史初步研究. 渔业科学进展, 2022, 43(1): 31-37] |
DOU S Z, AMANO Y, YU X, et al. Elemental signature in otolith nuclei for stock discrimination of anadromous tapertail anchovy (Coilia nasus) using laser ablation ICPMS. Environmental Biology of Fishes, 2012a, 95(4): 431-443 DOI:10.1007/s10641-012-0032-3 |
DOU S Z, YOKOUCHI K, YU X, et al. The migratory history of anadromous and non-anadromous tapertail anchovy Coilia nasus in the Yangtze River estuary revealed by the otolith Sr : Ca ratio. Environmental Biology of Fishes, 2012b, 95(4): 481-490 DOI:10.1007/s10641-012-0042-1 |
DOUBLEDAY Z A, IZZO C, WOODCOCK S H, et al. Relative contribution of water and diet to otolith chemistry in freshwater fish. Aquatic Biology, 2013, 18(3): 271-280 DOI:10.3354/ab00511 |
ELSDON T S, GILLANDERS B M. Strontium incorporation into calcified structures: Separating the effects of ambient water concentration and exposure time. Marine Ecology Progress Series, 2005, 285: 233-243 DOI:10.3354/meps285233 |
ENGSTEDT O, ENGKVIST R, LARSSON P. Elemental fingerprinting in otoliths reveals natal homing of anadromous Baltic Sea pike (Esox lucius L.). Ecology of Freshwater Fish, 2014, 23(3): 313-321 DOI:10.1111/eff.12082 |
FERGUSON A, REED T E, CROSS T F, et al. Anadromy, potamodromy and residency in brown trout Salmo trutta: The role of genes and the environment. Journal of Fish Biology, 2019, 95(3): 692-718 DOI:10.1111/jfb.14005 |
GARCEZ R C S, HUMSTON R, HARBOR D, et al. Otolith geochemistry in young-of-the-year peacock bass Cichla temensis for investigating natal dispersal in the Rio Negro (Amazon- Brazil) River system. Ecology of Freshwater Fish, 2015, 24(2): 242-251 DOI:10.1111/eff.12142 |
GIBB F M, RÉGNIER T, DONALD K, et al. Connectivity in the early life history of sandeel inferred from otolith microchemistry. Journal of Sea Research, 2017, 119: 8-16 DOI:10.1016/j.seares.2016.10.003 |
GILLANDERS B M. Otolith chemistry to determine movements of diadromous and freshwater fish. Aquatic Living Resources, 2005, 18(3): 291-300 DOI:10.1051/alr:2005033 |
GRAMMER G L, MORRONGIELLO J R, IZZO C, et al. Coupling biogeochemical tracers with fish growth reveals physiological and environmental controls on otolith chemistry. Ecological Monographs, 2017, 87(3): 487-507 DOI:10.1002/ecm.1264 |
GRØNKJÆR P. Otoliths as individual indicators: A reappraisal of the link between fish physiology and otolith characteristics. Marine and Freshwater Research, 2016, 67(7): 881-888 DOI:10.1071/MF15155 |
HARRIS L N, BAJNO R, GALLAGHER C P, et al. Life-history characteristics and landscape attributes as drivers of genetic variation, gene flow, and fine-scale population structure in northern Dolly Varden (Salvelinus malma malma) in Canada. Canadian Journal of Fisheries and Aquatic Sciences, 2015, 72(10): 1477-1493 DOI:10.1139/cjfas-2015-0016 |
HE S, XU Y J. Spatiotemporal distributions of Sr and Ba along an estuarine river with a large salinity gradient to the Gulf of Mexico. Water, 2016, 8(8): 323 DOI:10.3390/w8080323 |
HECKEL J W, QUIST M C, WATKINS C J, et al. Life history structure of westslope cutthroat trout: Inferences from otolith microchemistry. Fisheries Research, 2020, 222(2): 105416 |
HEGG J C, KENNEDY B P, FREMIER A K. Predicting strontium isotope variation and fish location with bedrock geology: Understanding the effects of geologic heterogeneity. Chemical Geology, 2013, 360/361: 89-98 DOI:10.1016/j.chemgeo.2013.10.010 |
HUGHES J M, SCHMIDT D J, MACDONALD J I, et al. Low interbasin connectivity in a facultatively diadromous fish: Evidence from genetics and otolith chemistry. Molecular Ecology, 2014, 23(5): 1000-1013 DOI:10.1111/mec.12661 |
HÜSSY K, LIMBURG K E, DE PONTUAL H, et al. Trace element patterns in otoliths: The role of biomineralization. Reviews in Fisheries Science and Aquaculture, 2020, 29(1): 1-33 |
IZZO C, DOUBLEDAY Z A, GILLANDERS B M. Where do elements bind within the otoliths of fish?. Marine and Freshwater Research, 2016, 67(7): 1072-1076 DOI:10.1071/MF15064 |
IZZO C, REIS-SANTOS P, GILLANDERS B M. Otolith chemistry does not just reflect environmental conditions: A meta-analytic evaluation. Fish and Fisheries, 2018, 19(3): 441-454 DOI:10.1111/faf.12264 |
JIANG T, LIU H, LU M, et al. A possible connectivity among estuarine tapertail anchovy (Coilia nasus) populations in the Yangtze River, Yellow Sea, and Poyang Lake. Estuaries and Coasts, 2016, 39(6): 1762-1768 DOI:10.1007/s12237-016-0107-z |
JIANG T, LIU H, SHEN X, et al. Life history variations among different populations of Coilia nasus along the Chinese coast inferred from otolith microchemistry. Journal of the Faculty of Agriculture, Kyushu University, 2014, 59(2): 383-389 DOI:10.5109/1467650 |
JIANG T, LIU H B, XUAN Z Y, et al. Similarity of microchemical "fingerprints" between the pectoral fin ray and otolith of Coilia nasus. Progress in Fishery Sciences, 2021, 42(1): 100-107 [姜涛, 刘洪波, 轩中亚, 等. 刀鲚胸鳍条和耳石微化学"指纹"相似性研究. 渔业科学进展, 2021, 42(1): 100-107] |
JIANG T, YANG J, LIU H, et al. Life history of Coilia nasus from the Yellow Sea inferred from otolith Sr : Ca ratios. Environmental Biology of Fishes, 2012, 95(4): 503-508 DOI:10.1007/s10641-012-0066-6 |
KENDALL N W, MCMILLAN J R, SLOAT M R, et al. Anadromy and residency in steelhead and rainbow trout (Oncorhynchus mykiss): A review of the processes and patterns. Canadian Journal of Fisheries and Aquatic Sciences, 2015, 72(3): 319-342 DOI:10.1139/cjfas-2014-0192 |
KENNEDY B P, BLUM J D, FOLT C L, et al. Using natural strontium isotopic signatures as fish markers: Methodology and application. Canadian Journal of Fisheries and Aquatic Sciences, 2000, 57(11): 2280-2292 DOI:10.1139/f00-206 |
KHUMBANYIWA D D, LI M, JIANG T, et al. Unravelinghabitat use of Coilia nasus from Qiantang River of China by otolith microchemistry. Regional Studies in Marine Science, 2018, 18: 122-128 DOI:10.1016/j.rsma.2018.02.001 |
KITANISHI S, YAMAMOTO T, URABE H, et al. Hierarchical genetic structure of native masu salmon populations in Hokkaido, Japan. Environmental Biology of Fishes, 2018, 101(5): 699-710 DOI:10.1007/s10641-018-0730-6 |
LARSSON P, TIBBLIN P, KOCH-SCHMIDT P, et al. Ecology, evolution, and management strategies of northern pike populations in the Baltic Sea. Ambio, 2015, 44(Suppl. 3): S451-S461 |
LAZARTIGUES A V, PLOURDE S, DODSON J J, et al. Determining natal sources of capelin in a boreal marine park using otolith microchemistry. ICES Journal of Marine Science, 2016, 73(10): 2644-2652 DOI:10.1093/icesjms/fsw104 |
LI M M, JIANG T, KHUMBANYIWA D D, et al. Reconstructing habitat history of Coilia nasus from the Hexian section of the Yangtze River in Anhui Province by otolith microchemistry. Acta Hydrobiologica Sinica, 2017a, 41(5): 1054-1061 [李孟孟, 姜涛, KHUMBANYIWA D D, 等. 基于耳石微化学的长江安徽和县江段刀鲚生境履历重建. 水生生物学报, 2017a, 41(5): 1054-1061] |
LI M M, JIANG T, CHEN T T, et al. Otolith microchemistry of the estuarine tapertail anchovy Coilia nasus from the Anqing section of the Yangtze River and its significance for migration ecology. Acta Ecologica Sinica, 2017b, 37(8): 2788-2795 [李孟孟, 姜涛, 陈婷婷, 等. 长江安庆江段刀鲚耳石微化学及洄游生态学意义. 生态学报, 2017b, 37(8): 2788-2795] |
LIU H, JIANG T, YANG J. Unravelling habitat use of Coilia nasus from the Rokkaku River and Chikugo River estuaries of Japan by otolith strontium and calcium. Acta Oceanologica Sinica, 2018, 37(6): 52-60 DOI:10.1007/s13131-018-1190-8 |
LIU H B, JIANG T, CHEN X B, et al. Otolith microchemistry of two Triplophysa species in Tongtianhe River. Southwest China Journal of Agricultural Sciences, 2020, 33(9): 2132-2136 [刘洪波, 姜涛, 陈修报, 等. 通天河2种高原鳅星耳石锶和钙的微化学特征. 西南农业学报, 2020, 33(9): 2132-2137] |
LIU H B, JIANG T, QIU C, et al. Otolith microchemistry of four fish species from the Changjiang river estuary, China. Oceanologia et Limnologia Sinica, 2018, 49(6): 1358-1364 [刘洪波, 姜涛, 邱晨, 等. 长江口水域四种鱼类的耳石微化学研究. 海洋与湖沼, 2018, 49(6): 1358-1364] |
LU M J, LIU H B, JIANG T, et al. Preliminary investigations on otolith microchemistry of Odontamblyopus rubicundus in the Daliao River estuary, China. Marine Fisheries, 2015, 37(4): 310-317 [卢明杰, 刘洪波, 姜涛, 等. 大辽河口红狼牙  虎鱼耳石微化学的初步研究. 海洋渔业, 2015, 37(4): 310-317 DOI:10.3969/j.issn.1004-2490.2015.04.003] 虎鱼耳石微化学的初步研究. 海洋渔业, 2015, 37(4): 310-317 DOI:10.3969/j.issn.1004-2490.2015.04.003] |
MARTIN J, BAREILLE G, BERAIL S, et al. Persistence of a southern Atlantic salmon population: Diversity of natal origins from otolith elemental and Sr isotopic signatures. Canadian Journal of Fisheries and Aquatic Sciences, 2013a, 70(2): 182-197 DOI:10.1139/cjfas-2012-0284 |
MARTIN J, BAREILLE G, BERAIL S, et al. Spatial and temporal variations in otolith chemistry and relationships with water chemistry: A useful tool to distinguish Atlantic salmon Salmo salar parr from different natal streams. Journal of Fish Biology, 2013b, 82(5): 1556-1581 DOI:10.1111/jfb.12089 |
MARTIN J, ROUGEMONT Q, DROUINEAU H, et al. Dispersal capacities of anadromous Allis shad population inferred from a coupled genetic and otolith approach. Canadian Journal of Fisheries and Aquatic Sciences, 2015, 72(7): 991-1003 DOI:10.1139/cjfas-2014-0510 |
MCDOWALL R M. Diadromy, diversity and divergence: implications for speciation processes in fishes. Fish and Fisheries, 2001, 2(3): 278-285 DOI:10.1046/j.1467-2960.2001.00050.x |
MELNIK N O, MARKEVICH G N, TAYLOR E B, et al. Evidence for divergence between sympatric stone charr and Dolly Varden along unique environmental gradients in Kamchatka. Journal of Zoological Systematics and Evolutionary Research, 2020, 58(4): 1135-1150 DOI:10.1111/jzs.12367 |
MÖLLER S, WINKLER HM, KLÜGEL A, et al. Using otolith microchemical analysis to investigate the importance of brackish bays for pike (Esox lucius Linnaeus, 1758) reproduction in the southern Baltic Sea. Ecology of Freshwater Fish, 2019, 28(4): 602-610 DOI:10.1111/eff.12478 |
MOORE J S, LOEWEN T N, HARRIS L N, et al. Genetic analysis of sympatric migratory ecotypes of Arctic charr Salvelinus alpinus: Alternative mating tactics or reproductively isolated strategies?. Journal of Fish Biology, 2014, 84(1): 145-162 DOI:10.1111/jfb.12262 |
MORISSETTE O, SIROIS P. Flowing down the river: Influence of hydrology on scale and accuracy of elemental composition classification in a large fluvial ecosystem. Science of the Total Environment, 2021, 760: 143320 DOI:10.1016/j.scitotenv.2020.143320 |
NAZIR A, KHAN M A. Spatial and temporal variation in otolith chemistry and its relationship with water chemistry: Stock discrimination of Sperata aor. Ecology of Freshwater Fish, 2019, 28(3): 499-511 DOI:10.1111/eff.12471 |
NELSON T R, POWERS S P. Elemental concentrations of water and otoliths as salinity proxies in a Northern Gulf of Mexico estuary. Estuaries and Coasts, 2020, 43: 843-864 DOI:10.1007/s12237-019-00686-z |
NELSON T R, POWERS S P. Validation of species specific otolith chemistry and salinity relationships. Environmental Biology of Fishes, 2019, 102(5): 801-815 DOI:10.1007/s10641-019-00872-9 |
PAN J, SHEN J Z, SUN L D, et al. Analysis on the otolith core elemental fingerprint of young-of-the-year (YOY) silver carp from Yangtze River and Ganjiang River and its application in stock identification. Resources and Environment in the Yangtze Basin, 2018, 27(12): 2740-2746 [潘静, 沈建忠, 孙林丹, 等. 长江、赣江鲢幼鱼耳石核区元素指纹特征分析及其在群体识别中的应用研究. 长江流域资源与环境, 2018, 27(12): 2740-2746] |
PAN X, YE Z, XU B, et al. Population connectivity in a highly migratory fish, Japanese Spanish mackerel (Scomberomorus niphonius), along the Chinese coast, implications from otolith chemistry. Fisheries Research, 2020, 231(5): 105690 |
PANGLE K L, LUDSIN S A, FRYER B J. Otolith microchemistry as a stock identification tool for freshwater fishes: testing its limits in Lake Erie. Canadian Journal of Fisheries and Aquatic Sciences, 2010, 67(9): 1475-1489 DOI:10.1139/F10-076 |
PAYNE WYNNE M L, WILSON K A, LIMBURG K E. Retrospective examination of habitat use by blueback herring (Alosa aestivalis) using otolith microchemical methods. Canadian Journal of Fisheries and Aquatic Sciences, 2015, 72(7): 1073-1086 DOI:10.1139/cjfas-2014-0206 |
PRACHEIL B M, LYONS J, HAMANN E J, et al. Lifelong population connectivity between large rivers and their tributaries: A case study of shovelnose sturgeon from the Mississippi and Wisconsin rivers. Ecology of Freshwater Fish, 2019, 28(1): 20-32 DOI:10.1111/eff.12423 |
QIU C, JIANG T, CHEN X B, et al. Characteristics of otolith strontium marking and its time lags of larval Cyprinus carpio. Oceanologia et Limnologia Sinica, 2019, 50(4): 903-912 [邱晨, 姜涛, 陈修报, 等. 鲤(Cyprinus carpio) 仔鱼耳石锶(Sr)标记及其时滞特征的研究. 海洋与湖沼, 2019, 50(4): 903-912] |
RADIGAN W J, CARLSON A K, KIENTZ J L, et al. Species- and habitat-specific otolith chemistry patterns inform riverine fisheries management. River Research and Applications, 2018, 34(3): 279-287 DOI:10.1002/rra.3248 |
REIS-SANTOS P, GILLANDERS B M, TANNER S E, et al. Temporal variability in estuarine fish otolith elemental fingerprints: Implications for connectivity assessments. Estuarine, Coastal and Shelf Science, 2012, 112: 216-224 DOI:10.1016/j.ecss.2012.07.027 |
REIS-SANTOS P, TANNER S E, VASCONCELOS R P, et al. Connectivity between estuarine and coastal fish populations: Contributions of estuaries are not consistent over time. Marine Ecology Progress Series, 2013, 491: 177-186 DOI:10.3354/meps10458 |
RODGER J R, HONKANEN H M, BRADLEY C R, et al. Genetic structuring across alternative life-history tactics and small spatial scales in brown trout (Salmo trutta). Ecology of Freshwater Fish, 2021, 30(2): 174-183 DOI:10.1111/eff.12573 |
ROHTLA M, VETEMAA M, TAAL I, et al. Life history of anadromous burbot (Lota lota, Linneaus) in the brackish Baltic Sea inferred from otolith microchemistry. Ecology of Freshwater Fish, 2014, 23(2): 141-148 DOI:10.1111/eff.12057 |
SALISBURY S J, BOOKER C, MCCRACKEN G R, et al. Genetic divergence among and within Arctic char (Salvelinus alpinus) populations inhabiting landlocked and sea-accessible sites in Labrador, Canada. Canadian Journal of Fisheries and Aquatic Sciences, 2018, 75(8): 1256-1269 DOI:10.1139/cjfas-2017-0163 |
SCHAFFLER J J, YOUNG S P, HERRINGTON S, et al. Otolith chemistry to determine within-river origins of Alabama Shad in the Apalachicola-Chattahoochee-Flint River basin. Transactions of the American Fisheries Society, 2015, 144(1): 1-10 DOI:10.1080/00028487.2014.954056 |
SCHOEN L S, STUDENT J J, HOFFMAN J C, et al. Reconstructing fish movements between coastal wetland and nearshore habitats of the Great Lakes. Limnology and Oceanography, 2016, 61(5): 1800-1813 DOI:10.1002/lno.10340 |
SCHULZ-MIRBACH T, LADICH F, PLATH M, et al. Enigmatic ear stones: What we know about the functional role and evolution of fish otoliths. Biological Reviews, 2019, 94(2): 457-482 DOI:10.1111/brv.12463 |
SI F, WANG Q L, YU Q H, et al. Use of strontium chloride in otolith marking of Japanese flounder. Progress in Fishery Sciences, 2019, 40(4): 65-72 [司飞, 王青林, 于清海, 等. 基于投喂法的牙鲆耳石锶标记. 渔业科学进展, 2019, 40(4): 65-72] |
SOETH M, SPACH HL, DAROS F A, et al. Use of otolith elemental signatures to unravel lifetime movement patterns of Atlantic spadefish, Chaetodipterus faber, in the Southwest Atlantic Ocean. Journal of Sea Research, 2020, 158: 101873 DOI:10.1016/j.seares.2020.101873 |
SOKTA L, JIANG T, LIU H, et al. Loss of Coilia nasus habitats in Chinese freshwater lakes: An otolith microchemistry assessment. Heliyon, 2020, 6(8): e04571 DOI:10.1016/j.heliyon.2020.e04571 |
STURROCK A M, TRUEMAN C N, DARNAUDE A M, et al. Can otolith elemental chemistry retrospectively track migrations in fully marine fishes?. Journal of Fish Biology, 2012, 81(2): 766-795 DOI:10.1111/j.1095-8649.2012.03372.x |
SWANSON R G, GAGNON J E, MILLER L M, et al. Otolith microchemistry of common carp reflects capture location and differentiates nurseries in an interconnected lake system of the North American midwest. North American Journal of Fisheries Management, 2020, 40(5): 1100-1118 DOI:10.1002/nafm.10474 |
TADDESE F, REID M R, CLOSS G P. Direct relationship between water and otolith chemistry in juvenile estuarine triplefin Forsterygion nigripenne. Fisheries Research, 2019, 211: 32-39 DOI:10.1016/j.fishres.2018.11.002 |
TANNER S E, PÉREZ M, PRESA P, et al. Integrating microsatellite DNA markers and otolith geochemistry to assess population structure of European hake (Merluccius merluccius). Estuarine, Coastal and Shelf Science, 2014, 142: 68-75 DOI:10.1016/j.ecss.2014.03.010 |
TEICHERT N, TABOURET H, LAGARDE R, et al. Site fidelity and movements of an amphidromous goby revealed by otolith multi-elemental signatures along a tropical watershed. Ecology of Freshwater Fish, 2018, 27(3): 834-846 DOI:10.1111/eff.12396 |
THOMAS O R, GANIO K, ROBERTS B R, et al. Trace element-protein interactions in endolymph from the inner ear of fish: Implications for environmental reconstructions using fish otolith chemistry. Metallomics, 2017, 9(3): 239-249 DOI:10.1039/C6MT00189K |
THOMAS O R, SWEARER S E. Otolith biochemistry: A review. Reviews in Fisheries Science and Aquaculture, 2019, 27(4): 458-489 DOI:10.1080/23308249.2019.1627285 |
THORROLD S R, JONES G P, HELLBERG M E, et al. Quantifying larval retention and connectivity in marine populations with artificial and natural markers. Bulletin of Marine Science, 2002, 70(1): 291-308 |
TZADIK O E, CURTIS J S, GRANNEMAN J E, et al. Chemical archives in fishes beyond otoliths: A review on the use of other body parts as chronological recorders of microchemical constituents for expanding interpretations of environmental, ecological, and life-history changes. Limnology and Oceanography: Methods, 2017, 15(3): 238-263 DOI:10.1002/lom3.10153 |
WALSWORTH T E, SCHINDLER D E, GRIFFITHS J R, et al. Diverse juvenile life-history behaviours contribute to the spawning stock of an anadromous fish population. Ecology of Freshwater Fish, 2015, 24(2): 204-213 DOI:10.1111/eff.12135 |
WALTHER B D, LIMBURG K E. The use of otolith chemistry to characterize diadromous migrations. Journal of Fish Biology, 2012, 81(2): 796-825 DOI:10.1111/j.1095-8649.2012.03371.x |
WALTHER B D, NIMS M K. Spatiotemporal variation of trace elements and stable isotopes in subtropical estuaries: I. Freshwater endmembers and mixing curves. Estuaries and Coasts, 2015, 38(3): 754-768 DOI:10.1007/s12237-014-9881-7 |
WANG S, ZHANG B L, GUO B, et al. Study of the feasibility of identifying the group of released Liza haematocheila by using the strontium marking method in otoliths. Progress in Fishery Sciences, 2022, 43(1): 38-45 [王硕, 张博伦, 郭彪, 等. 耳石锶标记识别放流群体的可行性研究. 渔业科学进展, 2022, 43(1): 38-45] |
WANG X, TANG Z. The first large-scale bioavailable Sr isotope map of China and its implication for provenance studies. Earth-Science Reviews, 2020, 210: 103353 DOI:10.1016/j.earscirev.2020.103353 |
WATSON N M, PRICHARD C G, JONAS J L, et al. Otolith-chemistry-based discrimination of wild- and hatchery-origin steelhead across the Lake Michigan Basin. North American Journal of Fisheries Management, 2018, 38(4): 820-832 DOI:10.1002/nafm.10178 |
WOODCOCK S H, MUNRO A R, CROOK D A, et al. Incorporation of magnesium into fish otoliths: Determining contribution from water and diet. Geochimica et Cosmochimica Acta, 2012, 94: 12-21 DOI:10.1016/j.gca.2012.07.003 |
WRIGHT P J, RÉGNIER T, GIBB F M, et al. Identifying stock structuring in the sandeel, Ammodytes marinus, from otolith microchemistry. Fisheries Research, 2018, 199(1): 19-25 |
WU Z L, CUI X F, TANG F H, et al. Research on genecology of benthic macroalgae. Fishery Information and Strategy, 2018, 33(1): 36-44 [吴祖立, 崔雪森, 唐峰华, 等. 大型底栖海藻种群生态学研究概述. 渔业信息与战略, 2018, 33(1): 36-44] |
XUAN Z, JIANG T, LIU H, et al. Mitochondrial DNA and microsatellite analyses reveal strong genetic differentiation between two types of estuarine tapertail anchovies (Coilia) in Yangtze River Basin, China. Hydrobiologia, 2021, 848: 1409-1431 DOI:10.1007/s10750-021-04541-w |
XUAN Z Y, JIANG T, LIU H B, et al. Are there still anadromous the estuarine tapertail anchovies Coilia nasus in Dongting Lake?. Acta Hydrobiologica Sinica, 2020, 44(4): 838-843 [轩中亚, 姜涛, 刘洪波, 等. 洞庭湖中是否存在溯河洄游型刀鲚. 水生生物学报, 2020, 44(4): 838-843] |
YANG J, ARAI T, LIU H, et al. Reconstructing habitat use of Coilia mystus and Coilia ectenes of the Yangtze River estuary, and of Coilia ectenes of Taihu Lake, based on otolith strontium and calcium. Journal of Fish Biology, 2006, 69(4): 1120-1135 DOI:10.1111/j.1095-8649.2006.01186.x |
YANG J, LIU H B. Otolith microchemistry of grey mullet Mugil cephalus from Chongming water in the Yangtze River estuary, China. Journal of Fishery Sciences of China, 2010, 17(4): 853-858 [杨健, 刘洪波. 长江口崇明水域鲻鱼耳石元素微化学分析. 中国水产科学, 2010, 17(4): 853-858] |
YANG Q, ZHAO F, SONG C, et al. Habitathistory reconstruction of Coilia mystus from the Yangtze River estuary and its adjacent sea area. Journal of Fishery Sciences of China, 2019, 26(6): 1175-1184 [杨琴, 赵峰, 宋超, 等. 长江口及邻近海域凤鲚生境履历重建. 中国水产科学, 2019, 26(6): 1175-1184] |
YU Y, PANG M X, YU X M, et al. Population genetic structure of silver carp from Yangtze River, Ganjiang River and Poyang Lake based on microsatellite markers. Journal of Huazhong Agricultural University, 2016, 35(6): 104-110 [于悦, 庞美霞, 俞小牧, 等. 利用微卫星分子标记分析长江、赣江和鄱阳湖鲢群体遗传结构. 华中农业大学学报, 2016, 35(6): 104-110] |



