2. 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 山东 青岛 266071
2. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao, Shandong 266071, China)
半叶紫菜华北变种(Pyropia katadae var. hemiphylla)属于红藻门(Rhodophyta)、红毛菜目(Bangiales)、红毛菜科(Bangiaceae),通常简称华北半叶紫菜,主要分布于青岛至大连沿岸(汤晓荣等, 1999; 王云霞等, 2011)。华北半叶紫菜野生藻体大多是雌雄同体,雌区和雄区被一条分界线从基部到端部分成2个不等的部分(Tseng, 1983),自然生长在潮间带的低洼石沼处,一般不需经过周期性的干出,此自然习性暗示其可能较适应全浮动筏式栽培方式,是向外海区发展的潜在优良品种(Wang et al, 2016)。但是,目前华北半叶紫菜的苗种培育技术尚不成熟,限制了其在紫菜生产中的应用。
紫菜(Pyropia/Porphyra)具有较高的营养价值和经济价值(赵玲等, 2018),是我国最重要的栽培海藻之一。目前,条斑紫菜(Pyropia yezoensis)和坛紫菜(Pyropia haitanensis)是我国主要的紫菜栽培品种,其一般采用支柱式和半浮动筏式的栽培方式,这2种方式应用在潮间带附近海区,可让紫菜周期性干出,利于苗帘上杂藻的清除(何培民等, 2018)。近年来,随着紫菜产品需求增大,紫菜栽培业快速发展,适合紫菜栽培的浅滩或近岸海区日趋饱和。受经济利益驱使,有些海区进行高密度紫菜栽培,导致紫菜的质量和产量严重下降,并时常发生病害(张美如等, 2012)。为缓解紫菜栽培的空间问题,外海的全浮动筏式或翻板式栽培方式在紫菜生产上逐渐得到应用(黄惠珍, 2015; 赵春暖等, 2020),但其弊端在于紫菜网帘的干出时间受到限制,紫菜易受到杂藻的附着污染,进而影响养殖紫菜的产量和质量。为进一步推动紫菜养殖向离岸深水区发展,拓展紫菜养殖产业发展空间,除进一步完善栽培技术和设备外,开发新的紫菜栽培品种也是有效措施之一。
紫菜的苗种培育主要是进行丝状体的培养,而育苗用的丝状体通常在钙质固形物(如文蛤壳、牡蛎壳、河蚌壳等)上附着生长,在生产上可利用紫菜果孢子或自由丝状体钻入贝壳后在大水池进行贝壳丝状体的平面或者吊挂培养(赵素芬, 2012)。贝壳丝状体生长发育过程一般可分为4个阶段:藻丝营养生长阶段、孢子囊枝形成阶段、壳孢子形成阶段及壳孢子放散阶段(He et al, 2006; 赵素芬, 2012)。温度、盐度、光强、光周期、氮浓度和磷浓度等均是影响紫菜贝壳丝状体生长发育的关键生态因子(陈烨等, 2005; Frazer et al, 1995; He et al, 2006; Li et al, 2011; Lin et al, 2013; Lu et al, 2011; López-Vivas et al, 2015; Knoop et al, 2020; Monotilla et al, 2010; Pereira et al, 2004; 汤晓荣等, 1998)。一般认为,维持相对较低温度、增加光照时间(每天12 h以上)、适当增加氮肥可促进紫菜营养藻丝的生长,而适当提高温度、减少光照时间(每天10 h以下)、适当增加磷肥可促进紫菜营养藻丝向孢子囊枝转变(Frazer et al, 1995; He et al, 2006; Li et al, 2011; Monotilla et al, 2010; 赵素芬, 2012)。铁作为藻类生长发育所必需的微量元素之一,在光合作用、呼吸作用、叶绿素合成、蛋白质与核酸合成、营养盐的吸收等生理代谢过程中发挥着极为重要的作用(Geider et al, 1994; Hudson et al, 1990; Raven, 1988)。在多种植物必需矿物元素中,铁是需求量最大的(Kobayashi et al, 2012)。目前,有关大型海藻的铁营养及其代谢研究甚少(刘静雯等, 2004; Manley, 1981; Suzuki et al, 1995),涉及到紫菜栽培的铁营养研究也鲜有报道(Shen et al, 2005; 王素平等, 1983)。关于铁元素对紫菜贝壳丝状体孢子囊枝形成的影响及紫菜丝状体对不同铁浓度的生理生化响应还没有相关的文献报道。本研究以华北半叶紫菜丝状体为研究对象,探讨其生长、孢子囊枝形成、光合生理及生化组分对不同铁浓度的反应规律,以期探明适宜其生长、发育的铁浓度及其内在生理生化机制,进而为华北半叶紫菜苗种培育提供理论依据。
1 材料与方法 1.1 实验材料2019年3月,在山东省青岛市石老人海域收集野生的华北半叶紫菜,选择个体较大、色泽较深、成熟度较高的健康藻体作为种藻。用灭菌天然海水充分洗净,挤干水后把种藻摊放在竹帘上阴干,使之失去40%~50%的水分,经阴干刺激后的种藻放入盛有灭菌天然海水的容器内,不断搅拌海水促使果孢子放出。取水样镜检发现,果孢子放散量达到预定要求时即将种藻捞出,用150~300目的筛绢过滤,所得过滤液即为果孢子液。
用浮游植物计数框统计每毫升果孢子液中所含果孢子数,计算得到果孢子液浓度,根据实验贝壳的总面积,计算出所需要投放的果孢子总数以及果孢子液的用量,保证接种密度为150~250个果孢子/cm2贝壳。然后,用量筒量出所需的果孢子液并装进喷壶内,把果孢子液均匀地喷洒在已装满贝壳的塑料框中,使果孢子自然沉降到贝壳(文蛤壳)上。剩余的果孢子液分装至数个三角烧瓶中,充气悬浮培养获得自由丝状体,然后不断分瓶扩增以获得足够量的自由丝状体的营养藻丝进行后续实验。扩增条件:光合有效辐射(photosynthetically active radiation, PAR)为50~ 60 μmol photons/(m2·s),每天光照时间在12 h以上,添加营养盐(NO3–-N为10 mg/L,PO43–-P为1 mg/L),水温为20℃,每3 d换水1次。培养容器均置于智能光照培养箱(宁波江南仪器厂)中,充气培养。
在果孢子钻贝壳阶段,培养条件:PAR为30~ 50 μmol photons/(m2·s),添加营养盐(NO3–-N为2 mg/L,PO43–-P为0.2 mg/L),水温为20℃。采果孢子7 d后取样检查果孢子的萌发率,当果孢子萌发率达50%~70%时,换水、洗刷贝壳。在贝壳丝状体的藻丝营养生长阶段,其培养条件与上述悬浮培养的营养藻丝的培养条件一致。
采用标准铁母液[Fe(NO3)3,Fe3+浓度为1000 mg/L,由国家有色金属及电子材料分析测试中心提供]配制不同铁浓度(CFe=0.040、0.160、0.800 mg/L)的工作液,以不额外添加铁的天然灭菌海水作为对照。经PhotoLab多参数水质分析仪(WTW, 德国)测定,本研究所用天然海水的铁元素浓度为0.001 mg/L。以下各个处理组均添加氮/磷营养盐(NO3–-N: 10 mg/L,PO43–-P: 1 mg/L),且每3 d换水1次。
1.2 实验方法 1.2.1 自由丝状体营养藻丝的相对生长速率测定将华北半叶紫菜营养藻丝置于4个不同的铁浓度下(CFe= 0.001、0.040、0.160、0.800 mg/L)悬浮培养,其他培养条件:光周期为12D︰12L,PAR为50 μmol photons/(m2·s),温度为20℃。每个铁浓度组设置3个平行,各处理组的初始鲜重为(1.0±0.1) g,鲜重无显著差异(P > 0.05),培养液体积为2 L。每隔3 d换水1次,培养15 d后称量鲜重,计算相对生长速率(relative growth rate, RGR),计算公式如下:
| $ {\rm{RGR = [ln(}}{W_t}{\rm{/}}{W_{\rm{0}}}{\rm{)/}}t{\rm{]}} \times {\rm{100\% }} $ |
式中,W0为初始藻的鲜重(g),Wt为实验结束时藻的鲜重(g),t为实验持续的时间(d)。
1.2.2 自由丝状体营养藻丝的叶绿素荧光参数测定将营养藻丝置于1.2.1所述的4个不同的铁浓度条件下悬浮培养15 d后,采用调制叶绿素荧光成像系统(IMAGING-PAM, WALZ, 德国)测定其叶绿素荧光诱导曲线,获得4个叶绿素荧光参数:营养藻丝的光系统Ⅱ最大量子产量Fv/Fm、实际量子产量Y(Ⅱ)、调节性能量耗散的量子产量Y(NPQ)和非调节性能量耗散的量子产量Y(NO)。
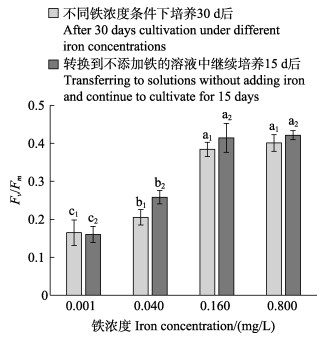
1.2.3 贝壳丝状体的叶绿素荧光参数测定采果孢子后第60天,贝壳丝状体的营养藻丝布满贝壳且部分变成不定形细胞,此时,把每个贝壳分别置于装有不同铁浓度的天然灭菌海水的无菌培养皿(直径12 cm)中。其他培养条件:光周期为10D︰14L,PAR为30 μmol photons/(m2·s),温度为20℃。以上每个铁浓度组设置8个培养皿,每个培养皿装1个贝壳。采用调制叶绿素荧光成像系统测定培养30 d后的贝壳丝状体的叶绿素荧光诱导曲线,获得叶绿素荧光参数Fv/Fm、Y(Ⅱ)、Y(NPQ)和Y(NO)。然后,每组随机选出4个贝壳转换到不添加铁元素的天然灭菌海水中继续培养15 d后,再次测定Fv/Fm值。每组剩余4个贝壳,用于后续孢子囊枝比例测定实验。
1.2.4 贝壳丝状体孢子囊枝比例测定首先对上述经铁处理30 d后的贝壳进行壳面颜色观察,然后采用柏兰尼液溶壳后进行营养藻丝和孢子囊枝的细胞颜色及孢子囊枝成熟度的显微观察。孢子囊枝细胞的长宽比越趋近1∶1,表明其成熟度越高。华北半叶紫菜营养藻丝细胞呈细长圆柱形,色素体为侧生带状,而孢子囊枝为营养藻丝明显增粗变为不定形细胞后再转变而成,孢子囊枝细胞色素体为深红色星状体,位于细胞中央。在400×视野下随机选取15个视野进行拍照,基于上述营养藻丝和孢子囊枝形态上的区别,结合ImageJ软件对图片进行处理,计算孢子囊枝比例(Varela-Alvarez et al, 2004),计算公式如下:
| $ 孢子囊枝比例=孢子囊枝面积/(营养藻丝面积+\\ \;\;\;\;\;\;\;\;\;\;\;\;\;孢子囊枝面积)×100% $ |
1.2.1中的藻丝在称重结束后,立刻用液氮将其快速冷冻并储存在超低温冰箱中,待进行生化指标的测定。本研究测定的指标包括超氧化物歧化酶(superoxide dismutase, SOD)、过氧化物酶(peroxidase, POD)、谷胱甘肽还原酶(glutathione reductase, GR)、超氧阴离子(superoxide anion, SA)、过氧化氢(hydrogen peroxide, H2O2)、叶绿素a (chlorophyll a, Chl-a)、类胡萝卜素(carotenoid, Car)、抗坏血酸(ascorbic acid, AsA)和脯氨酸(proline, Pro)。生化指标检测均采用酶联免疫吸附分析法(enzyme-linked immunosorbent assay, ELISA)。酶联免疫分析检测试剂盒购自上海酶联生物科技有限公司,严格按照试剂盒说明书进行各个指标的测定。每个测量实验均设4个平行。生化检测用到的主要仪器为:352型酶标仪(Labsystems Multiskan MS, 芬兰),AC8洗板机(Thermo Labsystems, 芬兰),电热恒温培养箱(武汉一恒苏净科学仪器有限公司)。
1.3 数据处理采用SPSS 19.0数据统计软件进行单因素方差分析(one-way ANOVA)、Duncan多重比较及Pearson相关性分析,P < 0.05为差异显著。
2 结果 2.1 不同铁浓度下营养藻丝的相对生长速率方差分析结果显示,铁浓度对营养藻丝的相对生长速率(RGR)有显著影响(P < 0.05)。图 1显示,在0.001~ 0.800 mg/L铁浓度范围内,随着铁浓度的升高,营养藻丝的RGR呈先升高后降低的趋势。营养藻丝在0.040 mg/L的铁浓度条件下,其RGR显著高于其他铁浓度组(P < 0.05)。
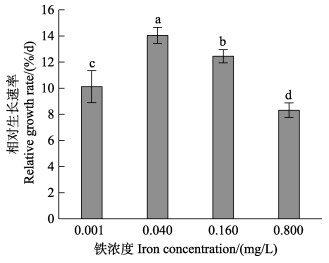
|
图 1 不同铁浓度条件下培养15 d后华北半叶紫菜营养藻丝的相对生长速率 Fig.1 Relative growth rate (RGR) of vegetative conchocelis of P. katadae var. hemiphylla cultivated for 15 days under different iron concentrations 不同字母表示差异显著(P < 0.05),下同 Different letters indicate significant difference (P < 0.05), the same as below |
图 2显示,在0.001~0.800 mg/L铁浓度范围内,随着铁浓度的升高,营养藻丝的Fv/Fm呈先升高后降低的趋势。0.040 mg/L铁浓度处理组的Fv/Fm显著高于其他铁浓度组(P < 0.05)。图 3显示,在0.040 mg/L的铁浓度下,营养藻丝呈现出较高的Y(NPQ)、Y(Ⅱ)和较低的Y(NO)。在低铁(0.001 mg/L)或高铁(0.160~ 0.800 mg/L)浓度条件下,Y(NPQ)均显著降低(P < 0.05)。Pearson相关性分析表明,营养藻丝的相对生长速率与Fv/Fm呈显著的正相关关系(P < 0.05)。
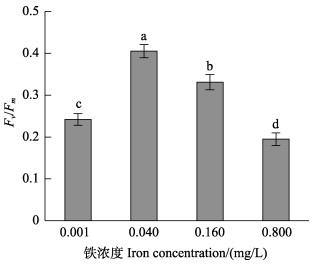
|
图 2 不同铁浓度条件下培养15 d后华北半叶紫菜营养藻丝的光系统Ⅱ最大量子产量(Fv/Fm) Fig.2 Maximum quantum yield of of PSⅡ(Fv/Fm) of vegetative conchocelis of P. katadae var. hemiphylla cultivated for 15 days under different iron concentrations |
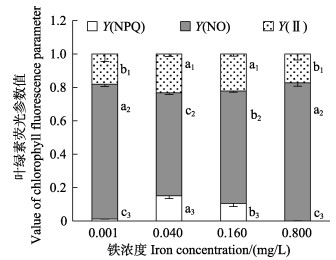
|
图 3 不同铁浓度条件下培养15 d后华北半叶紫菜营养藻丝的Y(NPQ)、Y(NO)和Y(Ⅱ) Fig.3 Y(NPQ), Y(NO) and Y(Ⅱ) of vegetative conchocelis of P. katadae var. hemiphylla cultivated for 15 days under different iron concentrations |
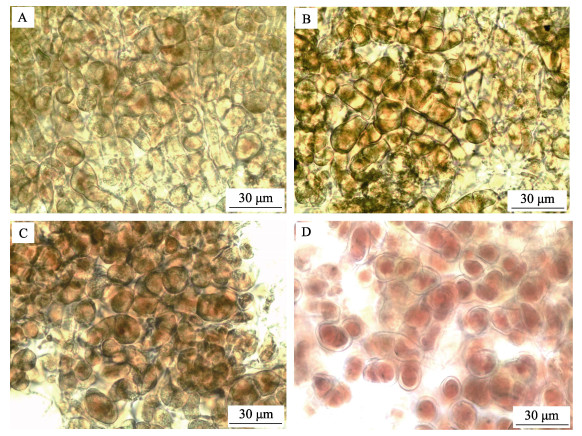
方差分析结果显示,铁浓度对贝壳丝状体的孢子囊枝比例有显著影响(P < 0.05)。图 4和图 5显示,在0.001~0.800 mg/L铁浓度范围内,随着铁浓度的升高,孢子囊枝形成率和孢子囊枝成熟度逐渐升高。0.040~ 0.800 mg/L的铁浓度组的孢子囊枝比例均显著大于对照组(P < 0.05)。随着贝壳丝状体营养藻丝不断发育形成孢子囊枝,壳面颜色逐渐加深(由鲜红变深红)。在壳面外观上,高铁浓度组壳面颜色较深且有明显的藻丝纹路或藻团。
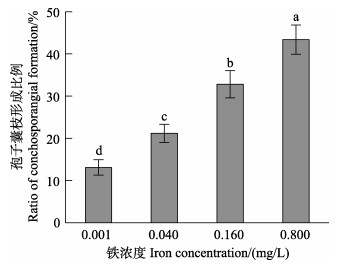
|
图 4 不同铁浓度条件下培养30 d后华北半叶紫菜贝壳丝状体的孢子囊枝形成比例 Fig.4 Ratio of conchosporangial formation of conchocelis of P. katadae var. hemiphylla cultivated for 30 days under different iron concentrations |
|
图 5 不同铁浓度条件下培养30 d后华北半叶紫菜贝壳丝状体形态特征 Fig.5 Morphological characteristics of conchocelis of P. katadae var. hemiphylla cultivated for 30 days under different iron concentrations A: CFe=0.001 mg/L; B: CFe=0.040 mg/L; C: CFe=0.160 mg/L; D: CFe=0.800 mg/L |
如图 6所示,0.160和0.800 mg/L铁浓度处理组的Fv/Fm之间无显著性差异(P > 0.05),而这2组的Fv/Fm均显著高于铁浓度≤0.040 mg/L的组(P < 0.05)。Pearson相关性分析表明,贝壳丝状体Fv/Fm与孢子囊枝比例呈显著的正相关关系(P < 0.05)。经铁处理30 d后的贝壳丝状体Fv/Fm,与其转换到不添加铁元素的溶液中继续培养15 d后的Fv/Fm的变化趋势相同,均呈现为高铁浓度组的Fv/Fm值较高。图 7显示,在0.160和0.800 mg/L铁浓度条件下,贝壳丝状体呈现出较高的Y(Ⅱ)、Y(NPQ)和较低的Y(NO)。
|
图 6 华北半叶紫菜贝壳丝状体的光系统Ⅱ最大量子产量(Fv/Fm) Fig.6 Maximum quantum yield of of PSⅡ(Fv/Fm) of conchocelis of P. katadae var. hemiphylla 柱状图上的字母下标为相同数字的作为同一组进行多重比较,同一组的不同字母表示在P < 0.05水平具有显著性差异,下同 The same subscript number of the letters represent the same group. The measured value in the same group were compared. Different letters in the same group represent significant difference (P < 0.05), the same as below |

|
图 7 不同铁浓度条件下培养30 d后华北半叶紫菜贝壳丝状体的Y(NPQ)、Y(NO)和Y(Ⅱ) Fig.7 Y(NPQ), Y(NO) and Y(Ⅱ) of conchocelis of P. katadae var. hemiphylla cultivated for 30 days under different iron concentrations |
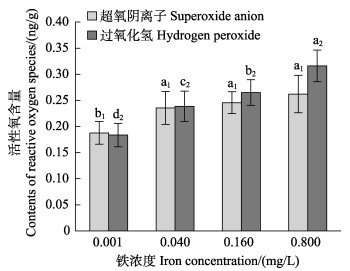
图 8显示,铁处理组的ROS (SA和H2O2)含量均显著高于对照组(P < 0.05)。在0.001~0.800 mg/L铁浓度范围内,随着铁浓度的升高,营养藻丝的H2O2含量呈逐渐升高的趋势。0.040~0.800 mg/L的铁浓度组的H2O2和SA含量均显著大于对照组(P < 0.05)。
|
图 8 不同铁浓度条件下培养15 d后华北半叶紫菜营养藻丝的活性氧含量 Fig.8 Reactive oxygen species contents of vegetative conchocelis of P. katadae var. hemiphylla cultivated for 15 days under different iron concentrations |
图 9显示,铁处理组的SOD、POD和GR等抗氧化酶活力均显著高于对照组(P < 0.05)。在0.001~0.800 mg/L铁浓度范围内,随着铁浓度的升高,POD活力呈逐渐升高的趋势。在0.040~0.800 mg/L的铁浓度范围内,SOD和GR活力均保持在较高水平,与对照组相比差异显著(P < 0.05)。Pearson相关性分析表明,抗氧化酶(SOD、POD和GR)活力与活性氧(SA和H2O2)含量均呈显著的正相关关系(P < 0.05)。

|
图 9 不同铁浓度条件下培养15 d后华北半叶紫菜营养藻丝的SOD、POD和GR活力 Fig.9 SOD, POD and GR activities of vegetative conchocelis of P. katadae var. hemiphylla cultivated for 15 days under different iron concentrations |
图 10显示,在0.001~0.800 mg/L铁浓度范围内,随着铁浓度的升高,类胡萝卜素含量呈逐渐升高的趋势,而叶绿素a含量呈逐渐降低的趋势。0.160 mg/L和0.800 mg/L铁浓度组的类胡萝卜素含量显著高于低铁浓度组(CFe≤0.040 mg/L) (P < 0.05)。0.040~0.800 mg/L铁浓度范围内的3个处理组的叶绿素a含量均显著低于对照组(P < 0.05)。Pearson相关性分析表明,类胡萝卜素含量与ROS含量呈显著的正相关关系(P < 0.05)。

|
图 10 不同铁浓度条件下培养15 d后华北半叶紫菜营养藻丝的类胡萝卜素和叶绿素a含量 Fig.10 Contents of carotenoid and chlorophyll a of vegetative conchocelis of P. katadae var. hemiphylla cultivated for 15 days under different iron concentrations |
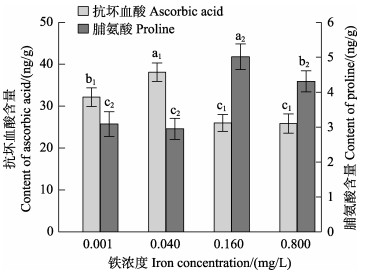
图 11显示,在0.001~0.800 mg/L铁浓度范围内,随着铁浓度的升高,AsA含量呈先升高后降低的趋势,而Pro含量呈逐渐升高的趋势。0.040 mg/L铁浓度组的AsA含量显著高于其他铁浓度组(P < 0.05)。0.160和0.800 mg/L铁浓度组的Pro含量显著高于低铁浓度组(CFe≤0.040 mg/L)(P < 0.05)。Pearson相关性分析表明,Pro含量与ROS含量呈显著的正相关关系(P < 0.05)。
|
图 11 不同铁浓度条件下培养15 d后华北半叶紫菜 Fig.11 Contents of ascorbic acid and proline of vegetative conchocelis of P. katadae var. hemiphylla cultivated for 15 days under different iron concentrations 营养藻丝的抗坏血酸和脯氨酸含量 |
光合能力的强弱与光合器官PSⅡ活性及电子传递有关,可由叶绿素荧光参数反映。经过充足暗适应后测出的Fv/Fm反映了当时所有的PSⅡ反应中心均处于开放态时的量子产量,即植物的潜在最大光合能力,是反映植物光能转换效率的指标(张守仁, 1999)。Y(NPQ)代表的是通过调节性的光保护机制耗散为热的能量,而Y(NO)代表的是被动的耗散为热量和发出荧光的能量,若Y(NPQ)较高,说明藻细胞具有较高的光保护能力(Klughammer et al, 2008)。图 1、图 2和图 3显示,在0.040 mg/L铁浓度条件下,华北半叶紫菜自由丝状体营养藻丝的RGR、Fv/Fm和Y(NPQ)相对较高,而Y(NO)相对较低。由此推测,0.040 mg/L铁浓度促进了营养藻丝的光能转换效率及光保护能力的提高,并利于其生长。图 7显示,在0.160~0.800 mg/L铁浓度范围内,华北半叶紫菜贝壳丝状体呈现较高的Y(NPQ)和较低的Y(NO),暗示该铁浓度范围下,贝壳丝状体可发挥调节性的光保护机制以减少过剩光能的伤害,而低铁条件下(CFe≤0.040 mg/L)的贝壳丝状体则是以非调节性能量耗散机制为主。图 6显示,无论是铁处理30 d后的贝壳丝状体(孢子囊枝比例显著增加),还是经铁处理30 d后再转换到不添加铁元素的溶液中继续培养15 d后的贝壳丝状体,其Fv/Fm的变化趋势相同,表明贝壳丝状体光能转换效率的高低与其孢子囊枝比例的大小呈正相关关系。对条斑紫菜自由丝状体的研究也发现(魏家慧等, 2020),条斑紫菜孢子囊枝的Fv/Fm及光合速率均显著高于营养藻丝。研究表明,相对于营养藻丝,孢子囊枝中的藻胆蛋白等捕光色素含量的显著增加及碳水化合物和蛋白质的比值明显上升(陈烨等, 2007),这可能是孢子囊枝光合性能显著提升的原因之一。
一方面,铁作为酶和氧化还原蛋白的辅助因子,在一些生物过程中起着重要的催化作用。植物缺铁时,许多酶的活性将受到影响,进而影响到植物体内的氧化还原反应、电子的传递、营养盐的吸收、呼吸作用、ATP合成等,最终影响植物的生长发育(Hudson et al, 1990; 金亚波等, 2007; Raven, 1988)。另一方面,过量的铁则可对植物造成伤害,这种伤害往往是由铁离子介导的ROS导致的,大量羟自由基可通过铁离子的相关反应(Fenton反应和Haber-Weiss反应)产生(Foundation, 1995; 汪洪等, 2006)。本研究中,随着铁浓度的升高,H2O2含量呈逐渐升高的趋势,超氧阴离子水平也维持在高水平,表明添加铁元素后华北半叶紫菜营养藻丝的活性氧水平显著升高。随着铁浓度的升高,营养藻丝的RGR呈先升高后降低的趋势,表明当铁离子浓度较低时,铁促进了藻丝的营养生长,而高铁浓度对营养藻丝形成了氧化胁迫,抑制其生长。植物的营养生长状态和发育状态之间存在着相互依存、相互制约的辩证统一关系(周德超, 1984)。对于华北半叶紫菜贝壳丝状体来说,其藻丝营养生长与孢子囊枝形成也存在拮抗关系。本研究发现,随着铁浓度的升高,贝壳丝状体孢子囊枝形成率逐渐升高。由此推测,高铁浓度促进了华北半叶紫菜贝壳丝状体由营养生长状态向发育状态的转变。在关于褐藻配子体发育的研究中也有类似发现(Lewis et al, 2013; Motomura et al, 1984; Suzuki et al, 1994; 王潇等, 2020),铁往往表现为促进褐藻配子体的发育,在铁限制时,不同的大型褐藻配子体发育率均有不同程度的下降,甚至维持在营养生长状态。值得一提的是,在实验周期内,0.160~0.800 mg/L的铁浓度未能促进华北半叶紫菜自由丝状体的营养藻丝向孢子囊枝转变,因此,铁元素对自由丝状体的发育诱导条件还有待进一步探索。另外,延长培养时间后发现,华北半叶紫菜贝壳丝状体孢子囊枝形成率可继续提高(60 d后,0.800 mg/L组孢子囊枝比例可达75%以上),而增加铁浓度至2.400 mg/L时,在同样培养条件下培养30 d后的孢子囊枝形成率与0.800 mg/L铁浓度组相比并无显著差异(数据未发表)。
ROS在植物的许多生命过程中均具有有害(导致细胞氧化损伤)和有利(信号转导、调控发育、防卫作用等)双重功能(Chen et al, 2014; 林植芳等, 2012; 薛鑫等, 2013)。发挥信号转导和调控发育的功能需要达到一定ROS浓度,如在植物种子休眠和萌发的大量研究中发现,在外因(如温度、水分)和内因(如激素与ROS等信号分子的交互应答)的共同作用下,种子才能萌发(Chen et al, 2014)。ROS浓度处于一定范围内是种子成功萌发所必需的条件,该ROS浓度范围被称为萌发的“氧化窗口”(Bailly et al, 2008)。研究发现,添加H2O2的氧化应激可促进条斑紫菜放散单孢子(Takahashi et al, 2017),表明ROS对于紫菜细胞由营养状态向发育状态的转变发挥着关键的作用。综上可推测,本研究中的贝壳丝状体藻丝在高铁浓度的作用下,由营养生长状态向发育状态的转变可能与铁介导的ROS密切相关,即铁介导的ROS可能开启了藻丝发育的“氧化窗口”。
在发育的“氧化窗口”内,ROS可能通过与激素信号通路相互作用或触发与ROS信号相关的细胞事件(如基因表达、钙离子的运动或氧化还原状态的控制)而发挥作用。“氧化窗口”之下(ROS过少),发育受到抑制,“氧化窗口”之上(ROS过多),细胞则可能发生氧化损伤,导致发育延迟(Bailly et al, 2008)。因此,需要严格调控贝壳丝状体营养藻丝向孢子囊枝转变过程来平衡ROS的产生和清除,而抗氧化系统是维持这种平衡的关键。抗氧化系统分为酶促抗氧化系统(抗氧化酶)和非酶促抗氧化系统(包括类胡萝卜素、抗坏血酸、脯氨酸、维生素E等抗氧化分子)(尹永强等, 2007)。SOD是生物体内特异清除超氧阴离子自由基(O2–)的酶,其与O2–反应产生H2O2和O2,是抗氧化的第1道保护层;POD是以H2O2为电子受体催化底物氧化的酶,即POD可消除H2O2;叶绿体中H2O2的清除主要是通过Halliwell-Asada途径进行的,该途径主要是由抗坏血酸过氧化物酶(APX)和GR等抗氧化酶发挥关键作用(阎成士等, 1999)。本研究中,SOD、POD和GR活力与活性氧(SA和H2O2)含量均呈显著的正相关关系,表明SOD、POD和GR等抗氧化酶对于华北半叶紫菜丝状体中清除活性氧从而降低氧化伤害发挥着关键作用。类胡萝卜素可直接猝灭单线态氧或通过猝灭三线态叶绿素而阻止单线态氧的形成,从而消除单线态氧对光合结构的破坏(郭连旺等, 1996; 尹永强等, 2007)。AsA也称维生素C,是植物中广泛存在的一种水溶性抗氧化有机小分子,可作为某些还原酶的辅因子参与还原反应(石永春等, 2015),还可参与植物光合结构保护、糖代谢和胁迫响应等多种生理调控过程(Garchery et al, 2013; Tóth et al, 2013)。Pro是水溶性最大的氨基酸,Pro的积累是藻类及高等动植物在各种生物和非生物胁迫下常见的生理反应,其可行使渗透调节、抗氧化和分子伴侣等生理功能(Delauney et al, 1993; Szabados et al, 2010)。另外,植物在从营养生长向生殖生长转变时可在不同的组织或器官中明显积累Pro,这时Pro可作为生长发育信号,促进细胞的分裂与分化(Lehmann et al, 2010; Szabados et al, 2010; 谢虹等, 2011)。本研究发现,当铁浓度升高到0.160 mg/L以上时,藻丝的类胡萝卜素和Pro含量均显著增加,且类胡萝卜素和Pro含量与ROS含量均呈显著的正相关关系,表明类胡萝卜素和Pro在藻丝适应高铁浓度胁迫过程中均发挥着关键的活性氧清除作用。AsA含量随着铁浓度的增加呈先升高后降低的趋势,表明较高铁浓度下可能不利于AsA发挥其生理功能。本研究中,添加铁后,藻丝中叶绿素a含量显著减少,一方面可能与ROS对叶绿体的破坏有关,另一方面也可能为了减少光吸收、避免光过量,从而降低光氧化伤害(Foyer et al, 1994)。综上可推测,华北半叶紫菜丝状体的酶促抗氧化系统和非酶促抗氧化系统均可对铁胁迫逆境作出积极应答,它们相互辅助并通过严格的调控来平衡ROS的产生和清除。
目前,为促进条斑紫菜或坛紫菜的贝壳丝状体从营养生长状态进入发育状态(孢子囊枝形成),一般需要升温(> 20℃)(何培民等, 2018; 赵素芬, 2012)。高温环境下的贝壳极易滋生细菌及发生杂藻附着等病害问题,需要经常洗刷贝壳及养殖池,耗费较多的人力、物力和财力。因此,从营养藻丝发育为孢子囊枝若能摆脱“升温”的限制且使孢子囊枝快速形成,将对紫菜贝壳丝状体人工育苗产生重要的经济意义。本研究探明了适宜华北半叶紫菜藻丝营养生长的铁浓度,及通过铁元素的诱导,营养藻丝在不升温的情况下短时间内同步形成孢子囊枝,该研究结果对华北半叶紫菜贝壳丝状体培育过程中铁营养的运用具有重要的指导意义。华北半叶紫菜营养藻丝的快速生长及孢子囊枝的快速形成,可保证及时获得足够量的藻丝应用于生产上的贝壳接种,并可适时获得发育同步的贝壳丝状体,从而提高华北半叶紫菜的采苗效率。
BAILLY C, EL-MAAROUF-BOUTEAU H, CORBINEAU F. From intracellular signaling networks to cell death: The dual role of reactive oxygen species in seed physiology. Comptes Rendus Biologies, 2008, 331(10): 806-814 DOI:10.1016/j.crvi.2008.07.022 |
CHEN C, TWITO S, MILLER G. New cross talk between ROS, ABA and auxin controlling seed maturation and germination unraveled in APX6 deficient Arabidopsis seeds. Plant Signaling and Behavior, 2014, 9(12): e976489 DOI:10.4161/15592324.2014.976489 |
CHEN Y, PEI L Q, YAN X J, et al. Changes of chemical components during sporangial branchlets formation of Porphyra haitanensis. Journal of Marine Sciences, 2007, 25(2): 23-28 [坛紫菜孢子囊枝形成过程中生化组分的变化. 海洋学研究, 2007, 25(2): 23-28 DOI:10.3969/j.issn.1001-909X.2007.02.003] |
CHEN Y, PEI L Q, YAN X J, et al. Effects of phosphorus on sporangial branchlets formation of Porphyra haitanensis. Journal of Aquaculture, 2005, 26(5): 1-4 [磷对坛紫菜孢子囊枝形成的影响. 水产养殖, 2005, 26(5): 1-4 DOI:10.3969/j.issn.1004-2091.2005.05.001] |
DELAUNEY A J, VERMA D P S. Proline biosynthesis and osmoregulation in plants. The Plant Journal, 1993, 4(2): 215-223 DOI:10.1046/j.1365-313X.1993.04020215.x |
FOUNDATION T B N. Iron. Netherlands: Springer, 1995
|
FOYER C H, LELANDAIS M, KUNERT K J. Photooxidative stress in plants. Physiologia Plantarum, 1994, 92(4): 696-717 DOI:10.1111/j.1399-3054.1994.tb03042.x |
FRAZER A W J, BROWN M T. Growth of the conchocelis phase of Porphyra columbina (Bangiales, Rhodophyta) at different temperatures and levels of light, nitrogen and phosphorus. Phycological Research, 1995, 43(4): 249-253 DOI:10.1111/j.1440-1835.1995.tb00031.x |
GARCHERY C, GEST N, DO P T, et al. A diminution in ascorbate oxidase activity affects carbon allocation and improves yield in tomato under water deficit. Plant, Cell and Environment, 2013, 36(1): 159-175 DOI:10.1111/j.1365-3040.2012.02564.x |
GEIDER R J, LA ROCHE J. The role of iron in phytoplankton photosynthesis, and the potential for iron-limitation of primary productivity in the sea. Photosynthesis Research, 1994, 39(3): 275-301 DOI:10.1007/BF00014588 |
GUO L W, SHEN Y G. Protective mechanisms against photodamage in photosynthetic apparatus of higher plants. Plant Physiology Communications, 1996, 32(1): 1-8 [高等植物光合机构避免强光破坏的保护机制. 植物生理学通讯, 1996, 32(1): 1-8] |
HE P M, YARISH C. The developmental regulation of mass cultures of free-living conchocelis for commercial net seeding of Porphyra leucosticta from Northeast America. Aquaculture, 2006, 257(1/2/3/4): 373-381 |
HE P M, ZHANG Z Y, ZHANG X C, et al. Seaweed cultivation. Beijing: Science Press, 2018 [何培民, 张泽宇, 张学成, 等. 海藻栽培学. 北京: 科学出版社, 2018]
|
HUANG H Z. Preliminary study on the turnover culture technique of Pyropia haitanensis. Journal of Fujian Fisheries, 2015, 37(3): 256-260 [坛紫菜翻转式养殖技术初探. 福建水产, 2015, 37(3): 256-260] |
HUDSON R J M, MOREL F M M. Iron transport in marine phytoplankton: Kinetics of cellular and medium coordination reactions. Limnology and Oceanography, 1990, 35(5): 1002-1020 DOI:10.4319/lo.1990.35.5.1002 |
JIN Y B, WEI J Y, WANG J. Research progress on the physiological and biochemical of iron nutrition in plants. Journal of Anhui Agricultural Sciences, 2007, 35(32): 10215-10219 [植物铁营养研究进展Ⅰ: 生理生化. 安徽农业科学, 2007, 35(32): 10215-10219 DOI:10.3969/j.issn.0517-6611.2007.32.016] |
KLUGHAMMER C, SCHREIBER U. Complementary PS Ⅱ quantum yields calculated from simple fluorescence parameters measured by PAM fluorometry and the saturation pulse method. PAM Application Notes, 2008, 1: 27-35 |
KNOOP J, GRIFFIN J N, BARRENTO S. Cultivation of early life history stages of Porphyra dioica from the British Isles. Journal of Applied Phycology, 2020, 32: 459-471 DOI:10.1007/s10811-019-01930-6 |
KOBAYASHI T, NISHIZAWA N K. Iron uptake, translocation, and regulation in higher plants. Annual Review of Plant Biology, 2012, 63(1): 131-152 DOI:10.1146/annurev-arplant-042811-105522 |
LEHMANN S, FUNCK D, SZABADOS L, et al. Proline metabolism and transport in plant development. Amino Acids, 2010, 39(4): 949-962 DOI:10.1007/s00726-010-0525-3 |
LEWIS R J, GREEN M K, AFZAL M E. Effects of chelated iron on oogenesis and vegetative growth of kelp gametophytes (Phaeophyceae). Phycological Research, 2013, 61(1): 46-51 DOI:10.1111/j.1440-1835.2012.00667.x |
LI X S, YANG L, HE P M. Formation and growth of free-living conchosporangia of Porphyra yezoensis: Effects of photoperiod, temperature and light intensity. Aquaculture Research, 2011, 42(8): 1079-1086 DOI:10.1111/j.1365-2109.2010.02691.x |
LIN R L, STEKOLL M S. Responses of chlorophyll a content for conchocelis phase of Alaskan Porphyra (Bangiales, Rhodophyta) species to environmental factors. Advances in Bioscience and Bioengineering, 2013, 1(1): 28-39 DOI:10.11648/j.abb.20130101.14 |
LIN Z F, LIU N. Research progress in the control and regulation of plant growth and development by reactive oxygen species. Chinese Bulletin of Botany, 2012, 47(1): 74-86 [活性氧调控植物生长发育的研究进展. 植物学报, 2012, 47(1): 74-86] |
LIU J W, DONG S L, FENG L J. Physiological and ecological response of Gracilaria tenuistipitata var. liui to iron stress. Oceanologia et Limnologia Sinica, 2004, 35(2): 167-175 [细基江蓠繁枝变型(Gracilaria tenuistipitata var. liui)铁限制的生理生态学反应. 海洋与湖沼, 2004, 35(2): 167-175 DOI:10.3321/j.issn:0029-814X.2004.02.010] |
LÓPEZ-VIVAS J M, RIOSMENA-RODRÍGUEZ R, JIMÉNEZ-GONZÁLEZ DE LA LLAVE A A, et al. Growth and reproductive responses of the conchocelis phase of Pyropia hollenbergii (Bangiales, Rhodophyta) to light and temperature. Journal of Applied Phycology, 2015, 27: 1561-1570 DOI:10.1007/s10811-014-0434-z |
LU S, YARISH C. Interaction of photoperiod and temperature in the development of conchocelis of Porphyra purpurea (Rhodophyta: Bangiales). Journal of Applied Phycology, 2011, 23(1): 89-96 DOI:10.1007/s10811-010-9541-7 |
MANLEY S L. Iron uptake and translocation by Macrocystis pyrifera. Plant Physiology, 1981, 68(4): 914-918 DOI:10.1104/pp.68.4.914 |
MONOTILLA W D, NOTOYA M. Growth and development of Porphyra marcosii (Bangiales, Rhodophyta) under different temperatures and photoperiod. Philippine Journal of Science, 2010, 139(2): 197-206 |
MOTOMURA T, SAKAI Y. Regulation of gametogenesis of Saccharina and Desmarestia (Phaeophyta) by iron and boron. Journal of Phycology, 1984, 32(3): 209-215 |
PEREIRA R, SOUSA-PINTOⅠ, YARISH C. Field and culture studies of the life history of Porphyra dioica (Bangiales, Rhodophyta) from Portugal. Phycologia, 2004, 43(6): 756-767 DOI:10.2216/i0031-8884-43-6-756.1 |
RAVEN J A. The iron and molybdenum use efficiencies of plant growth with different energy, carbon and nitrogen sources. New Phytologist, 1988, 109(3): 279-287 DOI:10.1111/j.1469-8137.1988.tb04196.x |
SHEN S D, DAI J X. The influence of Fe2+ on growth and development of cells enzymatically isolated from Porphyra yezoensis blades. Chinese Journal of Oceanology and Limnology, 2005, 23(1): 48-53 DOI:10.1007/BF02845143 |
SHI Y C, YANG Y Y, XUE R L, et al. Research advance of biological function of ascorbic acid in plants. Plant Physiology Journal, 2015, 51(1): 1-8 [植物中抗坏血酸的生物学功能研究进展. 植物生理学报, 2015, 51(1): 1-8] |
SUZUKI Y, KUMA K, KUDO I, et al. Iron requirement of the brown macroalgae Laminaria japonica, Undaria pinnatifida (Phaeophyta) and the crustose coralline alga Lithophyllum yessoense (Rhodophyta), and their competition in the northern Japan Sea. Phycologia, 1995, 34(3): 201-205 DOI:10.2216/i0031-8884-34-3-201.1 |
SUZUKI Y, KUMA K, MATSUNAGA K. Effect of iron on oogonium formation, growth rate and pigment synthesis of Laminaria japonica (Phaeophyta). Fisheries Science, 1994, 60(4): 373-378 DOI:10.2331/fishsci.60.373 |
SZABADOS L, SAVOURÉ A. Proline: A multifunctional amino acid. Trends in Plant Science, 2010, 15(2): 89-97 DOI:10.1016/j.tplants.2009.11.009 |
TAKAHASHI M, MIKAMI K. Oxidative stress promotes asexual reproduction and apogamy in the red seaweed Pyropia yezoensis. Frontiers in Plant Science, 2017, 8: 26 |
TANG X R, FEI X G. Artificial culture from conchocelis to conchosporelings of Porphyra katadai var. hemiphylla. Oceanologia et Limnologia Sinica, 1999, 30(2): 180-185 [半叶紫菜华北变种的丝状体成苗研究. 海洋与湖沼, 1999, 30(2): 180-185 DOI:10.3321/j.issn:0029-814X.1999.02.011] |
TANG X R, FEI X G. Effects of light and temperature on the growth and development of Porphyra conchocelis. Marine Sciences, 1998(4): 44-46 [光温对紫菜丝状体生长发育的影响. 海洋科学, 1998(4): 44-46] |
TÓTH S Z, SCHANSKER G, GARAB G. The physiological roles and metabolism of ascorbate in chloroplasts. Physiologia Plantarum, 2013, 148(2): 161-175 DOI:10.1111/ppl.12006 |
TSENG C K. Common seaweeds of China. Beijing: Science Press, 1983
|
VARELA-ALVAREZ E, STENGEL D B, GUIRY M D. The use of image processing in assessing conchocelis growth and conchospore production in Porphyra linearis. Phycologia, 2004, 43(3): 282-287 DOI:10.2216/i0031-8884-43-3-282.1 |
WANG W J, SUN X T, LIU F L, et al. Effect of abiotic stress on the gameophyte of Pyropia katadae var. hemiphylla (Bangiales, Rhodophyta). Journal of Applied Phycology, 2016, 28(1): 469-479 DOI:10.1007/s10811-015-0579-4 |
WANG H, JIN J Y. Possible effects of iron, magnesium and zinc on the metabolism of reactive oxygen species in plants. Plant Nutrition and Fertilizer Science, 2006, 12(5): 738-744 [铁、镁、锌营养胁迫对植物体内活性氧代谢影响机制. 植物营养与肥料学报, 2006, 12(5): 738-744 DOI:10.3321/j.issn:1008-505X.2006.05.023] |
WANG S P, JIANG H R. Studies on the ecology of free-living conchocelis of Porphyra yezoensis. Marine Fisheries Research, 1983, 14(5): 77-94 [条斑紫菜Porphyra yezoensis游离丝状体生态的研究. 海洋水产研究, 1983, 14(5): 77-94] |
WANG X, LIU F L, LIANG Z R, et al. Effects of iron on the growth and development of gametophyte clones in Saccharina japonica. Journal of Fishery Sciences of China, 2020, 27(9): 1052-1061 [铁离子对海带配子体克隆系生长发育的影响. 中国水产科学, 2020, 27(9): 1052-1061] |
WANG Y X, WANG M M, XIA D M, et al. Photosynthetic characteristics during the formation of reproductive tissues of Porphyra katadai var. hemiphylla. Journal of Nanjing Normal University (Natural Science), 2011, 34(3): 95-102 [华北半叶紫菜繁殖组织形成期间的光合特性研究. 南京师大学报(自然科学版), 2011, 34(3): 95-102 DOI:10.3969/j.issn.1001-4616.2011.03.018] |
WEI J H, LI G L, WANG W J, et al. Effects of light intensity and temperature on photosynthetic adaptability of the different stages of Pyropia yezoensis free-living conchocelis. Progress in Fishery Sciences, 2020, 41(6): 115-124 [条斑紫菜丝状体不同发育时期对光照和温度的光合适应能力. 渔业科学进展, 2020, 41(6): 115-124] |
XIE H, YANG L, LI Z G. The roles of proline in the formation of plant tolerance to abiotic stress. Biotechnology Bulletin, 2011(2): 23–27,60 [脯氨酸在植物非生物胁迫耐性形成中的作用. 生物技术通报, 2011(2): 23–27,60] |
XUE X, ZHANG Q, WU J X. Research of reactive oxygen species in plants and its application on stress tolerance. Biotechnology Bulletin, 2013(10): 6-11 [植物体内活性氧的研究及其在植物抗逆方面的应用. 生物技术通报, 2013(10): 6-11] |
YAN C S, LI D Q, ZHANG J H. Plant leaf senescence and oxidative stress. Chinese Bulletin of Botany, 1999, 16(4): 398-404 [植物叶片衰老与氧化胁迫. 植物学通报, 1999, 16(4): 398-404] |
YIN Y Q, HU J B, DENG M J. Latest development of antioxidant system and responses to stress in plant leaves. Chinese Agricultural Science Bulletin, 2007, 23(1): 105-110 [植物叶片抗氧化系统及其对逆境胁迫的响应研究进展. 中国农学通报, 2007, 23(1): 105-110] |
ZHANG M R, LU Q Q, XU G P. The present situation of Porphyra industry and prospects on its healthy development. China Fisheries, 2012(11): 15-19 [条斑紫菜产业现状及对其健康发展的思考. 中国水产, 2012(11): 15-19] |
ZHANG S R. A discussion on chlorophyll fluorescence kinetics parameters and their significance. Chinese Bulletin of Botany, 1999, 16(4): 444-448 [叶绿素荧光动力学参数的意义及讨论. 植物学通报, 1999, 16(4): 444-448] |
ZHAO C N, WU Y L, CAI Z Q, et al. Experimental study on deep-water rollover type cultivation of Porphyra yezoensis. Journal of Anhui Agricultural Sciences, 2020, 48(11): 107-109 [紫菜深水翻台式养殖试验研究. 安徽农业科学, 2020, 48(11): 107-109] |
ZHAO L, CAO R, WANG L Z, et al. Nutritional analysis and umami assessment of Pyropia yezoensis from Jing Bay. Progress in Fishery Sciences, 2018, 39(6): 134-140 [靖海湾条斑紫菜的营养及鲜味评价. 渔业科学进展, 2018, 39(6): 134-140] |
ZHAO S F. Marine algae and algal culture science. Beijing: National Defence Industry Press, 2012 [赵素芬. 海藻与海藻栽培学. 北京: 国防工业出版社, 2012]
|
ZHOU C Y, WU G L, DUAN Z Q, et al. H2O2-NOX system: An important mechanism for developmental regulation and stress response in plants. Chinese Bulletin of Botany, 2010, 45(5): 615-631 [H2O2-NOX系统: 一种植物体内重要的发育调控与胁迫响应机制. 植物学报, 2010, 45(5): 615-631] |
ZHOU D C. Vegetative and reproductive growth of plants. Bulletin of Biology, 1984(6): 5-6 [植物的营养生长和生殖生长. 生物学通报, 1984(6): 5-6] |



