2. 中国水产科学研究院黄海水产研究所 农业农村部海水养殖病害防治重点实验室 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 山东 青岛 266071;
3. 浙江海洋大学海洋科学与技术学院 浙江 舟山 316022
2. Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture and Rural Affairs; Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Laboratory for Marine Fisheries and Food Production Processes, Pilot National Laboratory for Marine Sciences and Technology (Qingdao), Qingdao, Shandong 266071, China;
3. Marine Science and Technology College, Zhejiang Ocean University, Zhoushan, Zhejiang 316022, China
海水池塘养殖历来是我国沿海水产养殖的主要方式,主要以养殖虾、蟹等甲壳类为主。2019年全国海水池塘养殖面积为376 091 hm2,约占海水养殖总面积的18%左右,海水池塘养殖产量为250.35万t,约占总产量的12%以上(中国渔业统计年鉴, 2020)。传统池塘养殖易受气候条件、环境变化和病害等因素的影响。近年来,传统海水池塘养殖面临底质老化和水域环境恶化等突出问题,导致养殖容纳量下降,多种病害频繁暴发。与此同时,池塘养殖尾水排放对周边水域生态环境造成的压力日益凸显,严重威胁产业的稳定和可持续发展(王武, 2009)。随着国家对生态环境的重视程度越来越高,未来的水产养殖要着眼于可持续发展,在提高产量的同时要保证质量,又要注意环境保护,研究和开发“高效、生态、安全”的健康养殖技术和模式已成为国内外渔业生产的重要发展方向。
海水池塘生态养殖模式是一种新兴的养殖理念(马雪健等, 2016),通过基础食物网的建立,利用不同营养级生物的生活习性,使系统中投饵性养殖单元(如鱼、虾类)产生的残饵、粪便、营养盐等有机或无机物质成为其他类型养殖单元(如滤食性贝类)的食物或营养物质来源,将系统内多余的营养物质转化到养殖生物体内,达到系统内营养物质的高效循环利用,在减轻养殖对环境压力的同时,提高养殖种类的多样性和经济效益(Chopin et al, 2008; Troell et al, 2009; Chang et al, 2020)。该养殖模式已经在世界多个国家,如中国、加拿大、智利、南非、挪威、以色列等广泛实践,并取得了诸多积极效果。
浮游植物是养殖生态系统的重要组成部分,不仅可以通过光合作用利用环境中的氮、磷等营养物质,起到调控水质的作用(Harrison et al, 2005),还可以作为养殖生物的直接或间接饵料(Pulz et al, 2004)。研究发现,以绿藻和硅藻为优势种的养殖池水质相对稳定,养殖生物生长较好,而以蓝藻为优势种的养殖池中,养殖生物生长缓慢且易发生病害(苏永金等, 1994)。绿藻和硅藻不仅对养殖水体有重要的调节作用,而且含有丰富的蛋白质、碳水化合物、维生素等重要营养成分,可满足养殖生物的营养需求(张继红等, 2016);而蓝藻,如在养殖后期占优势的颤藻(Oscillatoria)、微囊藻(Microcystis),在富营养化水体中能迅速生长繁殖,释放大量羟胺、硫化物等物质,致使水体散发腥臭味,有些藻可分泌毒素,危害养殖生物健康生长(Paerl et al, 1995)。目前,针对原位监测水体中浮游植物的研究更多集中在利用传统镜检鉴定方法(Soares et al, 2011; 常孟阳等, 2019; 潘玉龙等, 2019)。镜检鉴定方法主要基于细胞形态对浮游植物进行鉴定分类,不仅费时耗力,且容易遗漏个体较小或丰度较低的物种(Manoylov, 2014),不能全面、准确地评价水生生态系统中浮游植物群落结构及多样性。近年来,随着分子生物学技术的发展,高通量测序技术被广泛应用于浮游植物群落结构和多样性研究(Penna et al, 2017; Oliveira et al, 2018)。与形态学方法相比,高通量测序技术省时节力、灵敏度高、检出限低(Reuter et al, 2015),可检测到丰度低、个体小的物种,甚至可能会发现新物种(de Vargas et al, 2015; Oliveira et al, 2018)。但高通量测序不能对浮游植物进行绝对定量,且可能会高估某些物种的相对丰度,因此,仅利用高通量测序评价浮游植物群落结构也是不准确的(Quince et al, 2009)。
本研究利用形态学鉴定方法结合高通量测序技术调查养殖末期虾–蟹–鱼混养池塘和贝养殖池中浮游植物群落组成和多样性,比较分析2种检测方法获得的结果,探讨基于形态学和高通量测序检获的浮游植物群落组成和多样性的异同,为更全面、准确研究浮游植物群落结构及多样性提供理论依据。
1 材料与方法 1.1 样品采集样品于2018年12月采自山东省日照开航水产有限公司。该海水池塘生态养殖系统由虾–蟹–鱼混养池塘和贝养殖池组成,混养池塘中混养品种分别为中国对虾(Fenneropenaeus chinensis)、三疣梭子蟹(Portunus trituberculatus)和罗非鱼(Oreochromis niloticus),贝养殖池中养殖品种为文蛤(Meretrix meretrix)。用YSI手持式多参数水质分析仪(YSI Incorporated,美国)现场测定水温、盐度、溶解氧和pH;取1 L水样,加入5 mL鲁格试剂固定后用于浮游植物形态学鉴定与计数;取100 mL水样经0.22 μm微孔滤膜过滤,滤膜用于高通量测序分析浮游植物群落组成,滤液用于氨氮(NH4+)、硝态氮(NO3–)、亚硝态氮(NO2–)、磷酸盐(DIP)、硅酸盐(DSi)、总溶解氮(DTN)和总溶解磷(DTP)浓度的测定。
1.2 水质参数测定养殖水体中NH4+、NO3–、NO2–、DIP和DSi浓度采用QuAAtro营养盐自动分析仪(Seal Analytical Ltd., 德国)测定;先用碱性过硫酸盐消化,用营养盐自动分析仪测定DTN和DTP浓度;溶解无机氮(DIN)浓度为NH4+、NO3–和NO2–浓度之和;溶解有机氮(DON)和溶解有机磷(DOP)浓度分别为DTN与DIN和DTP与DIP浓度之差。
1.3 浮游植物形态学分析采集1 L未过滤水样,加5 mL鲁格试剂固定,样品带回实验室后,浓缩至50 mL,然后用光学显微镜进行物种鉴定和计数。
1.4 浮游植物高通量测序和生物信息分析采用土壤DNA提取试剂盒(MP Biomedicals, 美国)提取样品总DNA。用23S rDNA引物p23SrV_f1 (5′-GGA CAG AAA GAC CCT ATG AA-3′)和p23SrV_r1 (5′-TCA GCC TGT TAT CCC TAG AG-3′) (Sherwood et al, 2007)对样品DNA进行PCR扩增,反应产物用2%琼脂糖凝胶电泳检测,然后用PCR产物纯化试剂盒(Axygen Biosciences, 美国)纯化上述所得的PCR产物,利用QuantiFluorTM-ST (Promega, 美国)进行定量检测,纯化后的PCR产物送美吉测序公司采用Illumina MiSeq平台进行PE300测序。本研究测序得到的23S rDNA基因核酸序列已上传至美国国立生物技术信息中心(NCBI)高通量测序数据库Sequence Read Archive (SRA),登录号为SRP185765。
下机后的数据用软件QIIME (V1.70)处理。使用Trimmomatic软件对原始数据进行质量控制,并用FLASH软件进行拼接,使用UPARSE软件(V7.1 http://drive5.com/uparse/)以99%的相似度对序列进行OTU聚类,并用UCHIME软件去除嵌合体,利用BLAST在NCBI数据库对每条序列进行物种分类注释。保留所有注释到真核浮游藻类和蓝藻的序列,用于后续浮游植物群落组成分析。
1.5 浮游植物群落分析浮游植物在门水平和属水平上的相对丰度以该类别的细胞密度或序列数占总细胞密度或总序列数的比例来表征;浮游植物群落结构多样性则是用香农–威纳多样性指数来衡量。本研究中,浮游植物按粒径大小分为微微型浮游植物(≤2 μm)、较小的微型浮游植物(>2 μm且≤10 μm)、较大的微型浮游植物(>10 μm且≤20 μm)和小型浮游植物(>20 μm且 < 200 μm)。
2 结果 2.1 水质分析海水池塘生态养殖系统的水质参数见表 1。该海水池塘生态养殖系统中的平均水温、盐度、pH分别为4.87℃、26.01 g/L和9.03;虾–蟹–鱼混养池塘中的溶解氧浓度高于贝养殖池,分别为10.29 mg/L和9.08 mg/L。混养池塘中的NH4+、NO3–和NO2–浓度均低于贝养殖池,而DON浓度则是混养池塘中的高;混养池塘和贝养殖池中的DIP浓度均为0.02 mg/L,DOP浓度分别为0.02 mg/L和0.03 mg/L;混养池塘中DSi浓度低于贝养殖池,分别为0.55 mg/L和0.95 mg/L。
|
|
表 1 海水池塘生态养殖系统中的水质参数 Tab.1 Quality parameters of water in the ecological aquaculture system in marine pond |
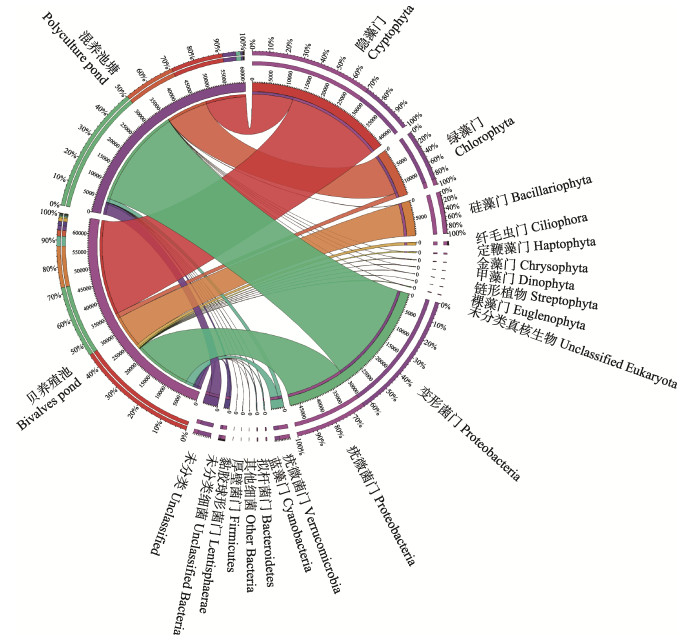
对虾–蟹–鱼混养池塘和贝养殖池中浮游生物的23S rDNA进行Illumina高通量测序,分别获得71 097和70 324条原始序列,通过质量控制分别得到64 298和60 599条高质量序列,平均序列长度为388 bp,在99%相似性水平上划分OTU,共得到283个OTU (表 2)。利用BLAST在NCBI数据库对每个OTU的代表序列进行物种分类注释,注释到真核生物和细菌的序列数分别占总序列数的54%和43%。在门水平上,变形菌门(Proteobacteria)和隐藻门(Cryptophyta)的相对丰度最高,分别为38.33%和33.33%,其次为绿藻门(Chlorophyta, 11.12%)、硅藻门(Bacillariophyta, 7.99%)和疣微菌门(Verrucomicrobia, 2.85%),其余门的相对丰度均低于1% (图 1)。保留所有注释到真核浮游藻类和蓝藻的序列,共得到72个OTU、66 300条序列,混养池塘和贝养殖池中OTU数分别为51和37,序列数分别为41 247和25 053,混养池塘高于贝养殖池(表 2)。
|
|
表 2 不同池塘样品中序列数和OTU数 Tab.2 Number of sequences and OTUs from different ponds |
|
图 1 海水池塘生态养殖系统中真核生物和细菌组成 Fig.1 Composition of eukaryotes and bacteria in the ecological aquaculture system in marine pond |
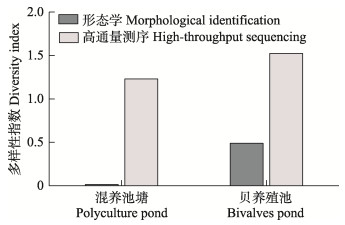
利用形态学方法和高通量测序技术分析虾–蟹–鱼混养池和贝养殖池中浮游植物多样性发现,混养池塘中浮游植物多样性指数低于贝养殖池,且形态学方法调查的浮游植物多样性指数低于高通量测序方法(图 2)。
|
图 2 海水池塘生态养殖系统中浮游植物多样性 Fig.2 Phytoplankton diversity in the ecological aquaculture system in marine pond |
门水平上,利用形态学鉴定方法共鉴定浮游植物6个门,分别为隐藻门、绿藻门、硅藻门、蓝藻门(Cyanophyta)、甲藻门(Dinophyta)和裸藻门(Euglenophyta),其中,绿藻门平均相对丰度最高,达90%以上。虾–蟹–鱼混养池和贝养殖池中绿藻门的细胞密度分别为1.03×107 cells/L和3.51×105 cells/L,分别占总细胞密度的99.85%和91.05%。利用高通量测序技术共鉴定浮游植物8个门,除形态学方法鉴定出的6个门,还包括定鞭藻门(Haptophyta)和金藻门(Chrysophyta),8个门中,隐藻门的平均相对丰度最高,为60.11%,其次为绿藻门(26.64%)和硅藻门(12.20%)。混养池中,隐藻门的相对丰度最高(70.57%),其次为硅藻门(24.10%)和绿藻门(3.59%);贝养殖池中,绿藻门和隐藻门的相对丰度较高,分别为49.68%和49.64%(图 3)。

|
图 3 海水池塘生态养殖系统中浮游植物在门水平和属水平上的相对丰度 Fig.3 Relative abundance of phytoplankton at the phylum and genus levels in the ecological aquaculture system in marine pond |
属水平上,利用形态学鉴定方法共鉴定浮游植物14个属,其中,塔胞藻属的平均相对丰度最高,虾–蟹–鱼混养池塘和贝养殖池中的相对丰度分别为99.85%和91.05%。利用高通量测序技术共鉴定浮游植物30个属,其中,全沟藻属(Teleaulax)的平均相对丰度最高(58.31%),其次为微球藻属(Ostreococcus) (17.62%)、辐环藻属(Actinocyclus) (7.87%)、微胞藻属(Micromonas) (7.25%)、海链藻属(Thalassiosira) (3.40%)、蛋白藻属(Proteomonas) (1.78%)和Pseudoscourfieldia (1.62%),其余属的相对密度均低于1%。混养池塘中全沟藻属的相对丰度最高(68.81%),其次为辐环藻属(15.69%)和海链藻属(6.79%);贝养殖池中,全沟藻属的相对丰度最高,为47.81%,其次为微球藻属(35.23%)和微胞藻属(14.35%) (图 3)。
种水平上,利用形态学鉴定方法共鉴定浮游植物16种(表 3),混养池塘中塔胞藻的细胞密度最高,为1.03×107 cells/L,其次是裸甲藻,达8.00×103 cells/L;贝养殖池中也是塔胞藻细胞密度最高,细胞密度为3.51×105 cells/L,其次是尖尾蓝隐藻和菱形藻,细胞密度分别为9.00×103 cells/L和8.00×103 cells/L。对比发现,混养池中浮游植物种数低于贝养池。
|
|
表 3 形态学鉴定方法揭示的浮游植物及其细胞密度 Tab.3 Phytoplankton cell density revealed by morphological analysis |
池塘养殖是我国传统的养殖模式,在我国水产养殖发展中占据举足轻重的地位。近年来,传统海水池塘养殖面临着底质老化和水域环境恶化等突出问题,导致养殖容纳量下降,多种病害频繁暴发,养殖尾水的排出还可能加剧周边区域的水体富营养化,严重制约着海水池塘养殖产业的可持续发展(王武, 2009)。随着国家对生态环境的重视程度越来越高,海水池塘生态养殖模式因环境友好、生态高效的特点得到了迅速发展(马雪健等, 2016)。浮游植物是养殖生态系统中的重要组成部分,一些浮游植物,如硅藻和绿藻,营养价值高且无毒害作用,对养殖是有益的(Roy et al, 2015; Brito et al, 2016);一些浮游植物,如蓝藻和甲藻,营养价值低且可能会产生毒素,不利于养殖生物的生长(Sinden et al, 2016; Pérez-Morales et al, 2017)。因此,了解浮游植物群落,对如何构建经济、安全、有效的生态养殖模式有重要的科学依据和现实意义。
本研究中,利用形态学鉴定方法结合高通量测序技术研究了海水池塘生态养殖系统中浮游植物群落结构,共鉴定浮游植物8个门,形态学鉴定结果中,绿藻门的平均相对丰度最高,达90%以上,而高通量测序结果中,绿藻门和隐藻门的相对丰度较高;8个门中有2个门(定鞭藻门和金藻门)仅在高通量测序结果中出现,镜检并未检测到(图 3)。属水平上,2种方法共鉴定浮游植物39个属,仅有5个属是2种方法鉴定结果中共有的,包括裸藻属(Eutreptiella)、颤藻属(Oscillatoria)、拟菱形藻属(Pseudonitzschia)、塔胞藻属(Pyramimonas)和全沟藻属(Teleaulax)(图 3)。此外,形态学方法调查的浮游植物多样性指数低于高通量测序方法(图 2)。
形态学鉴定结果和高通量测序结果产生差异的原因包括以下几个方面。首先,形态学鉴定方法主要基于细胞形态对浮游植物进行鉴定分类,对一些形态相似、细胞较小或丰度较低的类群,该方法难以识别和鉴定(Manoylov, 2014)。而高通量测序技术检测速度快、检出限低,可以极大地扩展对水生生态系统中浮游植物多样性的认识(Reuter et al, 2015)。本研究中,利用高通量测序检测到一些微微型和较小的微型浮游植物,但在显微镜鉴定结果中并未出现(表 4),其中,微微型浮游植物占总浮游植物序列丰度的25.24%,较小的微型浮游植物占总浮游植物序列丰度的60.42%。其次,高通量测序不能对物种进行绝对定量,利用物种的相对丰度对物种进行定量分析可能会高估其丰度,一方面,浮游植物基因组的rDNA序列包含大量重复序列(Schippers et al, 2006),基因拷贝数的变化可能会影响物种的相对丰度(Reeder et al, 2010);另一方面,通过高通量测序还可以检测到某些类群的休眠细胞、死亡细胞或分子碎片,从而高估其相对丰度。第三,23S rDNA的数据库不完整,分类信息并不能覆盖所有物种,通过核苷酸搜索发现,该数据库中缺少双眉藻属(Amphora)等的23S rDNA序列,因此,需要进一步完善23S rDNA参考数据库,提高其物种分类信息的覆盖率。综上所述,利用传统的形态学鉴定方法结合分子生物学技术更能全面地揭示养殖系统中浮游植物群落组成和多样性。
|
|
表 4 高通量测序技术揭示的微微型浮游植物和较小的微型浮游植物 Tab.4 List of described picophytoplankton and small nanophytoplankton species revealed by high-throughput sequencing |
利用形态学鉴定方法调查海水池塘生态养殖系统中浮游植物群落组成及多样性发现,塔胞藻为绝对优势种,其在虾–蟹–鱼混养池和贝养殖池中的细胞密度分别为1.03×107 cells/L和3.51×105 cells/L,分别占总细胞密度的99.85%和91.05% (图 3)。塔胞藻属于绿藻门,易培养,温度耐受性好,且细胞内含有丰富的蛋白质、多糖和不饱和脂肪酸等营养物质(张福绥等, 1983; 缪锦来等, 2005),被广泛应用于双壳类的养殖及养虾前期培样中(张福绥等, 1984; 王廷贵, 2011)。研究表明,塔胞藻对贻贝(Mytilus edulis)幼虫、虾夷扇贝(Patinopecten yessoensis)幼虫和栉孔扇贝(Azumapecten farreri)幼虫的饲养效果比常用的褐指藻、扁藻及小球藻等的效果要好(张福绥等, 1983)。本研究中,贝养殖池中塔胞藻的细胞密度比虾–蟹–鱼混养池中低了2个数量级,可能与文蛤对塔胞藻德摄食有关。此外,塔胞藻对海水中的苯、苯酚、二甲苯等有机物及敌敌畏、氧化乐果、辛硫磷等常见农药具有较强的吸附作用,对有机物和农药造成的污染有一定的净化作用,且藻细胞密度达到1.0×104 cells/mL时,净化效果最显著(张建民等, 2006、2007)。塔胞藻还含有抗植物病原菌成分,抑菌效果非常明显(江红霞等, 2008、2009)。
利用高通量测序技术调查海水池塘生态养殖系统中浮游植物群落组成及多样性发现,双尖全沟藻(Teleaulax amphioxeia)的平均相对丰度最高,为52.30% (表 4)。双尖全沟藻属于隐藻门,广泛分布于许多国家的沿海地区(Yoo et al, 2017)。研究发现,双尖全沟藻可以以完整细胞形式在红色中缢虫(Mesodinium rubrum)(赤潮种)体内进行内共生,红色中缢虫一方面帮助隐藻从环境中吸收营养物质供隐藻细胞增殖所用,另一方面又从隐藻的光合产物中获益,而鳍藻(Dinophysis)又通过摄食红色中缢虫而获得隐藻的叶绿体(Kim et al, 2015; Qiu et al, 2016)。因此,双尖全沟藻在海洋食物网中占有重要地位。微球藻属和微胞藻属是通过高通量测序检测到的2种微微型绿藻,分别占总浮游植物序列丰度的17.62%和7.25% (图 3)。研究发现,它们广泛分布在世界各地的沿海地区(Foulon et al, 2010; Rodríguez et al, 2010; Kilias et al, 2014; Rashid et al, 2018),微球藻属甚至会形成短暂的藻华(O'Kelly et al, 2003),但在以往对黄海海域的浮游植物调查中并未发现该藻(黄备等, 2018)。这可能是因为微球藻属和微胞藻属的细胞均 < 3 μm,利用光学显微镜难以辨别。因此,仅利用形态学鉴定方法并不能全面、准确地评价水生生态系统中浮游植物群落结构及多样性。
水产养殖的关键环境问题之一是营养物质的积累,这会导致水质恶化和有害藻的繁殖(Huang et al, 2016)。研究表明,海水池塘生态养殖模式不仅比传统的单种养殖具有更高的营养物质利用效率,而且可以提高水产养殖的产量(Li et al, 2019),但池塘养殖的经济效益和生态影响很大程度上取决于养殖品种的组成(Jena et al, 2002; Rahman et al, 2007)。本研究中,虾–蟹–鱼混养池塘中的混养品种为中国对虾、三疣梭子蟹和罗非鱼,贝养殖池中养殖品种为文蛤。罗非鱼是一种滤食杂食性鱼类,其选择性摄食对浮游植物的丰度及组成有很大影响(Menezes et al, 2010; Sun et al, 2011)。研究表明,罗非鱼的摄食选择性随体重的增加而略有变化(Abdel-Tawwab, 2011),罗非鱼在整个生长过程中均可摄食蓝藻和裸藻类,体重较大的鱼对绿藻和硅藻的选择性较弱,这个可能是混养池塘中绿藻和硅藻相对丰度较高的原因之一(图 3)。贝类的生长对温度和饵料的变化具有很强的适应性,是池塘生态养殖模式中的常见物种(Troell et al, 2009)。滤食性贝类具有很发达的滤水系统,可以通过生物过滤作用摄食水体中的微藻及颗粒有机物,从而对浮游植物丰度产生影响。本研究中,贝养殖池中浮游植物总密度为3.86×105 cells/L(表 3),比混养池低2个数量级,这可能与贝类摄食有关。研究表明,贝类对浮游植物的摄食也具有选择性,从而影响浮游植物群落结构(Newell, 2004)。本研究中,贝养殖池中微微型浮游植物如微球藻属和微胞藻属的序列丰度较高,占总浮游植物序列丰度的35.23%和14.25% (图 3)。研究发现,与个体较小的微微型浮游植物(< 2 μm)相比,微型浮游植物(2~20 μm)更容易被摄食(Newell, 2004),从而有利于微微型浮游植物的生长繁殖(Newell et al, 2009)。除了细胞大小,取食的选择性还取决于浮游植物的游动能力(Zhuang et al, 2004)。全沟藻有鞭毛,可以自由移动(Laza-Martínez et al, 2012),从而不易被摄食,这可能是其相对丰度较高的原因之一。
综上所述,利用形态学鉴定方法结合高通量测序技术研究海水池塘生态养殖系统中浮游植物群落组成及多样性,2种方法共鉴定浮游植物8个门,绿藻门和隐藻门为主要优势类群;共鉴定浮游植物39个属,仅有5个属是2种方法鉴定结果中共有的,包括裸藻属、颤藻属、拟菱形藻属、塔胞藻属和全沟藻属;一些微微型(≤2 μm)和较小的微型浮游植物(>2 μm且≤10 μm)仅在高通量测序结果中发现,其中,微微型浮游植物占总浮游植物序列丰度的25.24%,较小的微型浮游植物占总浮游植物序列丰度的60.42%;形态学方法调查的浮游植物多样性指数低于高通量测序方法。因此,利用形态学鉴定方法结合高通量测序技术,更能全面、准确地了解养殖生态系统中浮游植物群落结构及多样性。本研究仅对该养殖系统进行了一次取样调查,未对海水池塘生态养殖系统中浮游植物群落动态进行描述。因此,有必要进行连续监测调查,以探索海水池塘生态养殖系统中浮游植物群落的演替规律,并阐明该演替的主要驱动因素。本研究结果为后续利用形态学结合分子手段进行海水池塘生态养殖系统中浮游植物群落演替规律及其关键驱动因素的研究奠定了基础。
ABDEL-TAWWAB M. Natural food selectivity changes with weights of Nile tilapia, Oreochromis niloticus (Linnaeus), reared in fertilized earthen ponds. Journal of Applied Aquaculture, 2011, 23(1): 58-66 DOI:10.1080/10454438.2011.549785 |
AMSPOKER M C. Eunotogramma litorale sp. nov. a marine epipsammic diatom from Southern California, USA. Diatom Research, 2016, 31(4): 1-7 DOI:10.1080/0269249X.2016.1256350 |
BERGHOLTZ T, DAUGBJERG N, MOESTRUP Ø, et al. On the identity of Karlodinium veneficum and description of Karlodinium armiger sp. nov. (Dinophyceae), based on light and electron microscopy, nuclear-encoded LSU rDNA, and pigment composition. Journal of Phycology, 2010, 42(1): 170-193 DOI:10.1111/j.1529-8817.2006.00172.x |
BRITO LO, DOS SANTOS I G S, DE ABREU JL. Effect of the addition of Bacillariophyta (Navicula spp.) and rotifers (Brachionus plicatilis) on water quality and growth of the Litopenaeus vannamei postlarvae reared in a biofloc system. Aquaculture Research, 2016, 47(12): 3990-3997 DOI:10.1111/are.12849 |
CHANG M Y, LI C L, DONG J, et al. Dynamic changes of phytoplankton composition during cyanobacteria blooms in aquaculture ponds. Progress in Fishery Sciences, 2019, 40(1): 36-45 [常孟阳, 李晨露, 董静, 等. 蓝藻水华暴发期间养殖池塘浮游藻类动态变化. 渔业科学进展, 2019, 40(1): 36-45] |
CHANG Z Q, NEORI A, HE Y Y, et al. Development and current state of seawater shrimp farming, with an emphasis on integrated multi-trophic pond aquaculture farms, in China: A review. Reviews in Aquaculture, 2020, 12(4): 2544-2558 DOI:10.1111/raq.12457 |
CHOPIN T, ROBINSON S M C, TROELL M, et al. Multitrophic integration for sustainable marine aquaculture. Encyclopedia of Ecology, 2008, 2463-2475 DOI:10.1016/B978-008045405-4.00065-3 |
DE VARGAS C, AUDIC S, HENRY N, et al. Eukaryotic plankton diversity in the sunlit ocean. Science, 2015, 348(17): 1261605 DOI:10.1126/science.1261605 |
DROOP M R. Some new supra-littoral Protista. Journal of the Marine Biological Association of the United Kingdom, 1955, 34(2): 233-245 DOI:10.1017/S0025315400027612 |
Fishery Administration Bureau of Ministry of Agriculture and Rural Affairs, National Aquatic Technology Extension Station, China Society of Fisheries. China fishery statistical yearbook. Beijing: China Agriculture Publishing House, 2020 [农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 中国渔业统计年鉴. 北京: 中国农业出版社, 2020]
|
FOULON E, NOT F, JALABERT F, et al. Ecological niche partitioning in the picoplanktonic green alga Micromonas pusilla: Evidence from environmental surveys using phylogenetic probes. Environmental Microbiology, 2010, 10(9): 2433-2443 DOI:10.1111/j.1462-2920.2008.01673.x |
HARRISON W G, PERRY T, LI W K W. Ecosystem indicators of water quality Part Ⅰ. Plankton biomass, primary production and nutrient demand. In Anderson R (Ed. ), Environmental Effects of Marine Finfish Aquaculture. Berlin Heidelberg: Springer, 2005, 59-82
|
HEIMANN K, BENTING J, TIMMERMANN S, et al. The flagellar developmental cycle in algae: Two types of flagellar development in uniflagellate algae. Protoplasma, 1989, 153(1/2): 14-23 DOI:10.1007/BF01322460 |
HERDMAN M, CASTENHOLZ R W, WATERBURY J B, et al. Form-genus XIII. Synechococcus. In: Boone DR, Castenholz RW (Eds. ), Bergey's Manual of Systematic Bacteriology, Springer-Verlag, New York, 2001, 508-512
|
HUANG B, WEI N, TANG J L, et al. Changes of phytoplankton community structure and diversity in the south Yellow Sea during 2007-2017. Environmental Monitoring in China, 2018, 34(6): 137-148 [黄备, 魏娜, 唐静亮, 等. 南黄海2007-2017年浮游植物群落结构及多样性变化. 中国环境监测, 2018, 34(6): 137-148] |
HUANG S, WU M, ZANG C, et al. Dynamics of algae growth and nutrients in experimental enclosures culturing bighead carp and common carp: Phosphorus dynamics. International Journal of Sediment Research, 2016, 31(2): 173-180 DOI:10.1016/j.ijsrc.2016.01.003 |
JENA JK, AYYAPPAN S, ARAVINDAKSHAN P K, et al. Evaluation of production performance in carp polyculture with different stocking densities and species combinations. Journal of Applied Ichthyology, 2002, 18(3): 165-171 DOI:10.1046/j.1439-0426.2002.00302.x |
JIANG H X, LEI H J, XUAN W J. Studies on antimicrobial activities against three plant pathogen by using eleven microalgae extracts. Journal of Anhui Agricultural Sciences, 2008, 38(10): 4167-4169 [江红霞, 雷红娟, 轩文娟. 11种微藻提取物对3种植物病原菌抗菌活性的研究. 安徽农业科学, 2008, 38(10): 4167-4169 DOI:10.3969/j.issn.0517-6611.2008.10.102] |
JIANG H X, ZHOU X Y, LEI M Y, et al. Antimicrobial activities and chemical compositions of liposoluble compounds in Pyramidomonas delicatula. Journal of Henan Agricultural Sciences, 2009(8): 88-91 [江红霞, 周晓杨, 雷梦云, 等. 娇柔塔胞藻脂溶性化合物抗植物病原菌活性及成分分析. 河南农业科学, 2009(8): 88-91 DOI:10.3969/j.issn.1004-3268.2009.08.023] |
KILIAS E S, NÖTHIG E M, WOLF C, et al. Picoeukaryote plankton composition off West Spitsbergen at the entrance to the Arctic Ocean. Journal of Eukaryotic Microbiology, 2014, 61(6): 569-579 DOI:10.1111/jeu.12134 |
KIM J I, YOON H S, YI G, et al. The plastid genome of the cryptomonad Teleaulax amphioxeia. PLoS One, 2015, 10(6): e0129284 DOI:10.1371/journal.pone.0129284 |
LAZA-MARTíNEZ A, ARLUZEA J, MIGUEL I, et al. Morphological and molecular characterization of Teleaulax gracilis sp. nov. and T. minuta sp. nov. (Cryptophyceae). Phycologia, 2012, 36(1): 37-52 DOI:10.2216/11-044.1 |
LI Y, QIN J, ZHENG X, et al. Production performance of largemouth bass Micropterus salmoides and water quality variation in monoculture, polyculture and integrated culture. Aquaculture Research, 2019, 50(2): 423-430 DOI:10.1111/are.13901 |
MA X J, LIU D H, HU G B, et al. Development of integrated multi trophic aquaculture mode and its application on management. Ocean Development and Management, 2016, 33(4): 74-78 [马雪健, 刘大海, 胡国斌, 等. 多营养层次综合养殖模式的发展及其管理应用研究. 海洋开发与管理, 2016, 33(4): 74-78 DOI:10.3969/j.issn.1005-9857.2016.04.015] |
MANOYLOV K M. Taxonomic identification of algae (morphological and molecular): Species concepts, methodologies, and their implications for ecological bioassessment. Journal of Phycology, 2014, 50(3): 409-424 DOI:10.1111/jpy.12183 |
MEDLIN L K, ELWOOD H J, STICKEL S, et al. Morphological and genetic variation within the diatom Skeletonema costatum (Bacillariophyta): Evidence for a new species, Skeletonema pseudocostatum. Journal of Phycology, 2010, 27(4): 514-524 |
MENEZES R F, ATTAYDE J L, VASCONCELOS F R. Effects of omnivorous filter-feeding fish and nutrient enrichment on the plankton community and water transparency of a tropical reservoir. Freshwater Biology, 2010, 55(4): 767-779 DOI:10.1111/j.1365-2427.2009.02319.x |
MIAO J L, WANG B, KAN G F, et al. The influence of environment factors on lipid content and fatty acid composition in two species of Antarctic green microalga. Marine Sciences, 2005, 29(1): 4-11 [缪锦来, 王波, 阚光锋, 等. 环境因子对2种南极绿藻脂肪含量和脂肪酸组成的影响. 海洋科学, 2005, 29(1): 4-11 DOI:10.3969/j.issn.1000-3096.2005.01.002] |
MOESTRUP Ø, ETTL H. A light and electron microscopical study of Nephroselmis olivacea (Prasinophyceae). Opera Botanica, 1979, 49: 1-40 |
MOESTRUP Ø, THRONDSEN J. Light and electron microscopical studies on Pseudoscourfieldia marina, a primitive scaly green flagellate (Prasinophyceae) with posterior flagella. Canadian Journal of Botany, 1988, 66(7): 1415-1434 DOI:10.1139/b88-197 |
NEWELL R I E, TETTELBACH S T, GOBLER C J, et al. Relationships between reproduction in suspension-feeding hard clams Mercenaria mercenaria and phytoplankton community structure. Marine Ecology Progress, 2009, 387(12): 179-196 DOI:10.3354/meps08083 |
NEWELL R I E. Ecosystem influences of natural and cultivated populations of suspension-feeding bivalve molluscs: A review. Journal of Shellfish Research, 2004, 23(1): 51-62 |
O'KELLY C J, SIERACKI M E, THIER E C, et al. A transient bloom of Ostreococcus (Chlorophyta, Prasinophyceae) in west Neck Bay, Long Island, New York. Journal of Phycology, 2003, 39(5): 850-854 DOI:10.1046/j.1529-8817.2003.02201.x |
OLIVEIRA M C, REPETTI S I, IHA C, et al. High-throughput sequencing for algal systematics. European Journal of Phycology, 2018, 53(3): 1-17 |
PAERL H W, TUCKER C S. Ecology of blue-chlorophyta in aquaculture ponds. Journal of the World Aquaculture Society, 1995, 26(2): 109-131 DOI:10.1111/j.1749-7345.1995.tb00235.x |
PAN Y L, LIU X, SHA J J, et al. Influence of environmental factors on phytoplankton community structure and its relationship with coastal aquaculture in the waters adjacent to Rongcheng. Progress in Fishery Sciences, 2019, 40(5): 26-33 [潘玉龙, 刘潇, 沙婧婧, 等. 荣成近岸养殖海域浮游植物群落结构及与环境因子的关系. 渔业科学进展, 2019, 40(5): 26-33] |
PENNA A, CASABIANCA S, GUERRA A F, et al. Analysis of phytoplankton assemblage structure in the Mediterranean Sea based on high-throughput sequencing of partial 18S rRNA sequences. Marine Genomics, 2017, 36: 49-55 DOI:10.1016/j.margen.2017.06.001 |
PéREZ-MORALES A, BAND-SCHMIDT C J, MARTíNEZ-DíAZ S F. Mortality on zoea stage of the Pacific white shrimp Litopenaeus vannamei caused by Cochlodinium polykrikoides (Dinophyceae) and Chattonella spp. (Raphidophyceae). Marine Biology, 2017, 164(3): 57 DOI:10.1007/s00227-017-3083-3 |
PULZ O, GROSS W. Valuable products from biotechnology of microalgae. Applied Microbiology and Biotechnology, 2004, 65(6): 635-648 DOI:10.1007/s00253-004-1647-x |
QIAO H, WANG G, ZHANG X. Isolation and characterization of Chlorella sorokiniana GXNN01 (Chlorophyta) with the properties of heterotrophic and microaerobic growth. Journal of Phycology, 2009, 45(5): 1153-1162 DOI:10.1111/j.1529-8817.2009.00736.x |
QIU D, HUANG L, LIN S. Cryptophyte farming by symbiotic ciliate host detected in situ. Proceedings of the National Academy of Sciences of the USA, 2016, 113(43): 12208-12213 DOI:10.1073/pnas.1612483113 |
QUINCE C, LANZéN A, CURTIS T P, et al. Accurate determination of microbial diversity from 454 pyrosequencing data. Nature Methods, 2009, 6(9): 639-641 DOI:10.1038/nmeth.1361 |
RAHMAN M M, VERDEGEM M C. Multi-species fishpond and nutrients balance. In: van der Zijpp A J, Verreth J A J, Tri L Q, et al. (eds. ) Fishponds in farming systems. Wageningen Academic Publishers, Netherlands, 2007, 79-88
|
RASHID J, KOBIYAMA A, REZA M S, et al. Seasonal changes in the communities of photosynthetic picoeukaryotes in Ofunato Bay as revealed by shotgun metagenomic sequencing. Gene, 2018, 665: 127-132 DOI:10.1016/j.gene.2018.04.071 |
REEDER J, KNIGHT R. Rapidly denoising pyrosequencing amplicon reads by exploiting rank-abundance distributions. Nature Methods, 2010, 7(9): 668-669 DOI:10.1038/nmeth0910-668b |
REUTER J, SPACEK D V, SNYDER M. High-throughput sequencing technologies. Molecular Cell, 2015, 58(4): 586-597 DOI:10.1016/j.molcel.2015.05.004 |
RIPPKA R, CASTENHOLZ R W, HERDMAN M. Form-Cyanobium. Bergey's manual of systematics of archaea and bacteria. John Wiley & Sons, Ltd, 2015 |
RODRíGUEZ F, DERELLE E, GUILLOU L, et al. Ecotype diversity in the marine picoeukaryote Ostreococcus (Chlorophyta, Prasinophyceae). Environmental Microbiology, 2010, 7(6): 853-859 DOI:10.1111/j.1462-2920.2005.00758.x |
ROY S S, PAL R. Microalgae in aquaculture: A review with special references to nutritional value and fish dietetics. Proceedings of the Zoological Society, 2015, 68(1): 1-8 DOI:10.1007/s12595-013-0089-9 |
SCHIPPERS A, NERETIN L N. Quantification of microbial communities in near-surface and deeply buried marine sediments on the Peru continental margin using real-time PCR. Environmental Microbiology, 2006, 8(7): 1251-1260 DOI:10.1111/j.1462-2920.2006.01019.x |
SHERWOOD AR, PRESTING G G. Universal primers amplify a 23S rDNA plastid marker in eukaryotic algae and cyanobacteria. Journal of Phycology, 2010, 43(3): 605-608 |
SINDEN A, SINANG S C. Cyanobacteria in aquaculture systems: Linking the occurrence, abundance and toxicity with rising temperatures. International Journal of Environmental Science and Technology, 2016, 13(12): 1-8 DOI:10.1007/s13762-016-1112-2 |
SLANKIS T, GIBBS S P. The fine structure of mitosis and cell division in the Chrysophycean alga Ochromonas danica. Journal of Phycology, 2008, 8(3): 243-256 DOI:10.1111/j.1529-8817.1972.tb04035.x |
SOARES M C S, LúCIA M L, VIDAL L O, et al. Light microscopy in aquatic ecology: Methods for plankton communities studies. Methods in Molecular Biology, 2011, 689: 215-227 DOI:10.1007/978-1-60761-950-5_13 |
SU Y J, CAI X Y, WANG J, et al. A preliminary study on water quality affected by algae in shrimp ponds. Journal of Fisheries Research, 1994(4): 36-39 [苏永金, 蔡心一, 王军, 等. 藻类影响虾池若干水质因子初探. 渔业研究, 1994(4): 36-39] |
SUBIRANA L, PéQUIN B, MICHELY S, et al. Morphology, genome plasticity, and phylogeny in the genus Ostreococcus reveal a cryptic species, O. mediterraneus sp. nov. (Mamiellales, Mamiellophyceae). Protist, 2013, 164(5): 643-659 DOI:10.1016/j.protis.2013.06.002 |
SUN W, DONG S, JIE Z, et al. The impact of net-isolated polyculture of tilapia (Oreochromis niloticus) on plankton community in saline-alkaline pond of shrimp (Penaeus vannamei). Aquaculture International, 2011, 19(4): 779-788 DOI:10.1007/s10499-010-9394-8 |
SYM S D, PIENAAR R N. Taxonomy of Pyramimonas obovata and other observations on the subgenus Vestigifera of Pyramimonas (Prasinophyceae, Chlorophyta). Phycological Research, 1995, 43(1): 17-32 DOI:10.1111/j.1440-1835.1995.tb00002.x |
TOMAS C R. Identifying marine phytoplankton. New York: Academic Press, 1997
|
TROELL M, JOYCE A, CHOPIN T, et al. Ecological engineering in aquaculture-potential for integrated multi-trophic aquaculture (IMTA) in marine offshore systems. Aquaculture, 2009, 297(1): 1-9 |
VAULOT D, EIKREM W, VIPREY M, et al. The diversity of small eukaryotic phytoplankton (≤3 μm) in marine ecosystems. FEMS Microbiology Reviews, 2008, 32(5): 795-820 DOI:10.1111/j.1574-6976.2008.00121.x |
WANG T G. Overwintering cultivation technique of bay scallop. Hebei Fisheries, 2011(12): 42-43 [王廷贵. 海湾扇贝种贝越冬培育技术. 河北渔业, 2011(12): 42-43 DOI:10.3969/j.issn.1004-6755.2011.12.011] |
WANG W. Current situation and development trend of aquaculture industry in China. Fishery Guide to be Rich, 2009, 271(7): 12-18 [王武. 我国水产养殖业的现状与发展趋势. 渔业致富指南, 2009, 271(7): 12-18] |
WEI Y X. Chrysochromulina parva lackey (Prymnesiophyceae): New record in China and its seasonal fluctuation in Lake Donghu, Wuhan. Acta Hydrobiologica Sinica, 1996, 20(4): 317-321 [魏印心. 中国新记录: 小金色藻在武汉东湖的季节消长. 水生生物学报, 1996, 20(4): 317-321] |
YOO Y, SEONG K A, JEONG H J, et al. Mixotrophy in the marine red-tide cryptophyte Teleaulax amphioxeia and ingestion and grazing impact of cryptophytes on natural populations of bacteria in Korean coastal waters. Harmful Algae, 2017, 68: 105-117 DOI:10.1016/j.hal.2017.07.012 |
ZHANG F S, HE Y C, MA J H, et al. The introduction of the Japanese scallop, Patinopecten yessoensis (Jay), into China, its spat-rearing and experimental cultivation. Marine Sciences, 1984, 8(5): 38-45 [张福绥, 何义朝, 马江虎, 等. 虾夷扇贝的引种、育苗及试养. 海洋科学, 1984, 8(5): 38-45] |
ZHANG F S, LI S Y. Discovery of Pyramimonas sp. in China seas and its application in feeding bivalve larvae. Marine Sciences, 1983, 7(6): 49-50 [张福绥, 李淑英. 塔胞藻在中国海的发现与应用. 海洋科学, 1983, 7(6): 49-50] |
ZHANG J M, HAN X D, JIA H F. The study of decontamination of microalgae to organic compound in the ocean. Journal of Linyi Teachersx College, 2006, 28(3): 79-82 [张建民, 韩晓弟, 贾宏福. 海洋微藻对海水中有机物的净化作用研究. 临沂师范学院学报, 2006, 28(3): 79-82 DOI:10.3969/j.issn.1009-6051.2006.03.022] |
ZHANG J M, HAN X D, WANG X W, et al. The study of decontamination of microalgae to pesticide in the ocean. Journal of Yunnan Agricultural University, 2007, 22(3): 462-465 [张建民, 韩晓弟, 王相伟, 等. 塔胞藻对海水中农药的响应及净化作用初步研究. 云南农业大学学报, 2007, 22(3): 462-465 DOI:10.3969/j.issn.1004-390X.2007.03.035] |
ZHANG J H, REN D D, JIANG Y S, et al. Microalgae in aquaculture: A review to nutritional value and rotifers enrichment. Science and Technology of Food Industry, 2016, 37(20): 371-376 [张继红, 任丹丹, 姜玉声, 等. 微藻营养价值及其在水产生物营养强化中的应用. 食品工业科技, 2016, 37(20): 371-376] |
ZHUANG S H, WANG Z Q. Influence of size, habitat and food concentration on the feeding ecology of the bivalve, Meretrix meretrix Linnaeus. Aquaculture, 2004, 241(1/2/3/4): 689-699 |



