2. 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 山东 青岛 266071;
3. 中国水产科学研究院黄海水产研究所 农业农村部海洋渔业可持续发展重点实验室 山东 青岛 266071
2. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao, Shandong 266071, China;
3. Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture and Rural Affairs; Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao, Shandong 266071, China
日本对虾(Marsupenaeus japonicus)食性杂、生长快、离水不易死亡,适于活虾上市和长途运输,是我国海水养殖的重要虾类之一(赵先银等, 2006)。
日本对虾适宜生长温度为23℃~32℃,最适温度为25℃~30℃,在8℃~10℃出现倒伏现象并停止摄食,5℃以下死亡(李凤晨等, 2006; 宋晓红等, 2014)。北方地区冬季温度过低,严重影响日本对虾养殖周期。有研究表明,低温胁迫诱导斑节对虾(Penaeus monodon)活性氧的产生,导致体内氧化代谢紊乱(Jiang et al, 2019)。细胞凋亡是受基因调控、主动的生理性细胞自杀行为,当机体受到外来刺激时,通过细胞凋亡来清除体内受损伤、衰老和多余的细胞,以保持机体内环境平衡和维持正常生理活动(董自梅等, 2020)。Caspase (cysteinyl aspartate specific proteinase)又称天冬氨酸特异性半胱氨酸蛋白酶,是执行动物细胞凋亡的主要蛋白酶家族,通常情况下以无活性的酶原形式存在于活细胞中,当受到凋亡刺激时,被激活成具有活性的Caspase,在不同的凋亡阶段发挥重要作用(Wang et al, 2020)。其中以Caspase-3最为重要,Caspase-3是细胞凋亡的执行者之一,它的激活标志着细胞凋亡进入不可逆转的阶段(Scatena et al, 2007)。TUNEL (原位末端切口标记法)为一种新型的细胞凋亡检测方法,其原理是在脱氧核糖核苷酸末端转移酶作用下将脱氧核糖核苷酸和荧光素、过氧化物酶、碱性磷酸酶或生物素形成的衍生物标记到凋亡细胞中断裂DNA形成的3-OH末端游离羟基上,进行原位凋亡细胞的检测,而正常细胞几乎无断裂DNA (李进军等, 2017)。有关低温对日本对虾抗氧化及凋亡影响的研究尚未见报道,本研究通过TUNEL检测直观地呈现出低温胁迫下对日本对虾细胞凋亡率,并通过检测低温胁迫对日本对虾抗氧化系统及凋亡通路的影响,从体内抗氧化酶活力、凋亡通路酶活力、脂质过氧化产物以及基因表达水平探讨了日本对虾对低温胁迫的生理应答反应,以期为耐低温新品种的培育提供参考。
1 材料与方法 1.1 实验材料实验所用日本对虾均取自中国水产科学研究院黄海水产研究所实验基地山东省昌邑市海丰水产养殖有限责任公司,湿体重为(14.24±1.12) g的健康虾。对虾于200 L的PVC桶中暂养3 d,暂养期间,持续充氧,每天早晚投喂蛤蜊肉并更换30%的水,以保持水质良好,保持水温为(28±2)℃、盐度为30、pH=8.2。
1.2 实验方法 1.2.1 实验设计本实验使用冷水机(GRTE- HXB10N,格瑞特节能设备有限公司)对日本对虾所生存的水域进行降温。设置10℃ (不摄食温度)、16℃、22℃和28℃(对照组) 4个温度梯度,采用调节冷水机自动降温,使4个温度组均在12 h时由28℃同时降至所设置的温度,每组3个平行,每个平行20尾虾。开始降温时的样品为0 h样品(对照组),在降至所设置28℃、22℃、16℃和10℃后,分别于3、24、72 h取部分虾的鳃和肝胰腺,分别放入4%甲醛固定液中保存,最后进行TUNEL检测。剩余鳃和肝胰腺放入液氮中速冻,测定其酶活和基因表达。
1.2.2 样品处理将鳃和肝胰腺加液氮研磨成粉末,取50 mg样品迅速转至已加入1 mL TRIzol的1.5 mL离心管中,于−80℃保存,用于总RNA提取;剩余样品,称取1 g组织(鳃和肝胰腺),加入9 mL (pH 7.2)预冷的PBS缓冲液,用匀浆器将标本匀浆充分。离心(4℃, 2000 g, 20 min),收集上清液。分装1份用于组织抗氧化酶活测定,其余置于−80℃冰箱备用。
1.2.3 酶活性的测定总抗氧化能力(T-AOC)、超氧化物歧化酶(SOD)、Caspase-3活性、还原型谷胱甘肽(GSH)和丙二醛(MDA)含量测定均根据试剂盒说明书进行(上海酶联生物科技有限公司)。
1.2.4 SOD和Caspase-3基因的表达分析 1.2.4.1 引物设计根据日本对虾SOD和Caspase-3基因cDNA序列,通过Primer Premier 5.0设计Real-time PCR扩增特异性引物,引物合成和cDNA序列测定委托上海生工生物工程有限公司完成,序列详见表1。
|
|
表 1 本研究所用引物 Tab.1 Primers used in this study |
按照TRIzol法提取总RNA,使用核酸定量仪(Thermo Scientific)检测RNA含量和纯度,1%非变性琼脂糖凝胶电泳检测其完整性。使用M-MLV(AG)试剂盒进行反转录合成cDNA第一链,−20℃保存备用。
1.2.4.3 实时定量PCR扩增采用Real-time PCR (SYBR Green)相对定量法,按照SYBR Green Pro Taq HSⅡ(AG)试剂盒说明书,在ABI 7500 Fast荧光定量PCR仪中进行扩增。反应体系为10 μL:5.0 μL SYBR Green Pro Taq HS premix (2×),3.0 μL RNA-free水,0.2 μL Rox参比染料,上、下游引物各0.4 μL (10 μmol/L),模板cDNA 1.0 μL。每个样品设3个重复,加完样品瞬时离心将液体集中在管底。反应程序:扩增曲线,95℃ 30 s;95℃ 5 s,60℃ 34 s,40个循环;熔解曲线,95℃ 15 s,60℃ 1 min,95℃ 15 s。采用2−ΔΔCt法分析SOD和Caspase-3基因的相对表达量,使用Origin Pro 2016软件绘制柱状图。
1.2.5 TUNEL检测将固定在4%甲醛固定液中的鳃和肝胰腺分别进行石蜡包埋,然后按照4~5 μm厚度进行连续切片。
将石蜡切片脱蜡至水,稍甩干后用蛋白酶K工作液覆盖组织,37℃孵育25 min,PBS洗涤3次,每次5 min。切片稍甩干后用破膜工作液覆盖组织,室温孵育20 min,PBS洗涤3次,每次5 min。采用TUNEL试剂盒(罗氏公司)内适量试剂1 (TdT)和试剂2 (dUTP)按1∶9混合覆盖组织,切片平放于湿盒内,37℃恒温箱孵育2 h,盒内加少量水保持湿度。孵育后的切片PBS洗涤3次,每次5 min。甩干后滴加DAPI染液,避光室温孵育10 min。PBS洗涤3次,每次5 min。甩干后用抗荧光淬灭封片剂封片。切片于荧光显微镜下观察并采集图像。
1.2.6 数据统计所得实验数据均用平均值±标准差(Mean±SD)表示。采用SPSS 22.0软件进行单因素方差分析(one-way ANOVA)和邓肯(Duncan′s)多重比较,P < 0.05为差异显著。
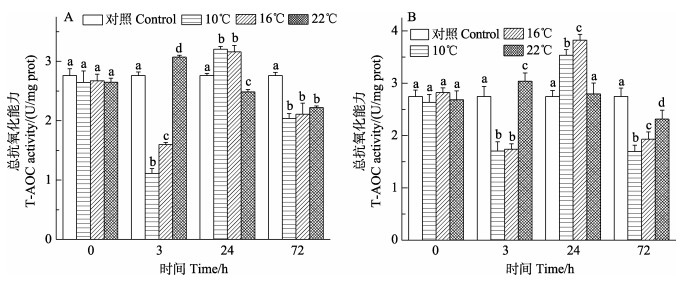
2 结果与分析 2.1 低温胁迫对日本对虾鳃和肝胰腺抗氧化系统影响 2.1.1 低温胁迫对日本对虾T-AOC的影响如图 1所示,低温组(10℃和16℃)日本对虾鳃和肝胰腺T-AOC整体呈先降低后升高再降低的变化趋势,在3 h时达到最低点(P < 0.05),然后逐渐升高,在24 h时达到最高点(P < 0.05),在72 h时低于对照组(P < 0.05);22℃组鳃组织和肝胰腺T-AOC呈先升高再降低的变化趋势,分别在3 h和72 h达到最高点和最低点(P < 0.05)。
|
图 1 日本对虾鳃(A)和肝胰腺(B) T-AOC随低温胁迫时间的变化 Fig.1 Changes of T-AOC in the gill (A) and hepatopancreas (B) of M. japonicus under low temperature stress 不同字母表示差异显著(P < 0.05)。下同 Different superscript indicated significant difference (P < 0.05). The same as below |
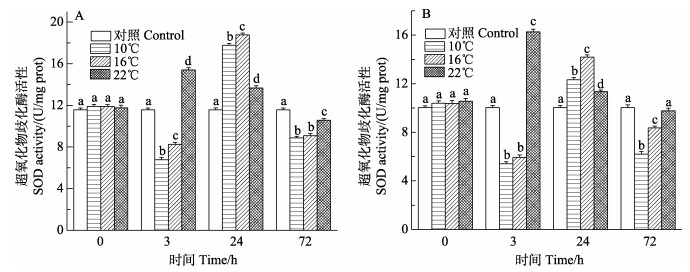
如图 2所示,低温(10℃和16℃)组日本对虾鳃和肝胰腺SOD活性整体呈先降低后升高再降低的变化趋势,在3 h时达到最低点(P < 0.05),然后逐渐升高,在24 h时达到最高点(P < 0.05),在72 h时低于对照组(P < 0.05);22℃组鳃组织和肝胰腺SOD活性呈先升高再降低的变化趋势,分别在3 h和72 h达到最高点和最低点(P < 0.05),72 h肝胰腺22℃组SOD活性与对照组相比差异不显著。
|
图 2 日本对虾鳃(A)和肝胰腺(B) SOD随低温胁迫时间的变化 Fig.2 Changes of SOD activity in the gill (A) and hepatopancreas (B) of M. japonicus under low temperature stress |
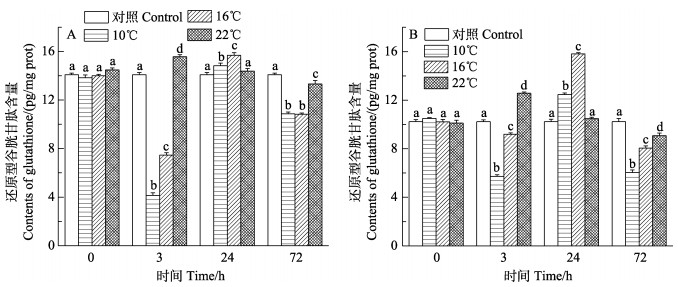
如图 3所示,低温(10℃和16℃)组日本对虾鳃和肝胰腺GSH含量整体呈先降低后升高再降低的变化趋势,在3 h时达到最低点(P < 0.05),然后逐渐升高,在24 h时达到最高点(P < 0.05),在72 h时低于对照组(P < 0.05);22℃组鳃组织和肝胰腺GSH含量呈先升高再降低的变化趋势,在3 h和72 h达到最高点和最低点(P < 0.05)。
|
图 3 日本对虾鳃(A)和肝胰腺(B) GSH随低温胁迫时间的变化 Fig.3 Changes of GSH activity in the gill (A) and hepatopancreas (B) of M. japonicus under low temperature stress |
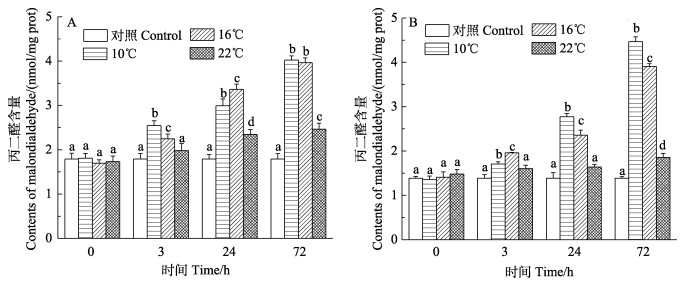
如图 4所示,3个实验组MDA含量都呈上升趋势,在72 h达到最大值(P < 0.05)。低温组(10℃和16℃)日本对虾鳃和肝胰腺MDA含量在各时间点变化趋势明显,且显著高于对照组(P < 0.05);22℃组各组织在0和3 h MDA含量与对照组相比差异均不显著。
|
图 4 日本对虾鳃(A)和肝胰腺(B) MDA含量随低温胁迫时间的变化 Fig.4 Changes of MDA content in the gill (A) and hepatopancreas (B) of M. japonicus under low temperature stress |
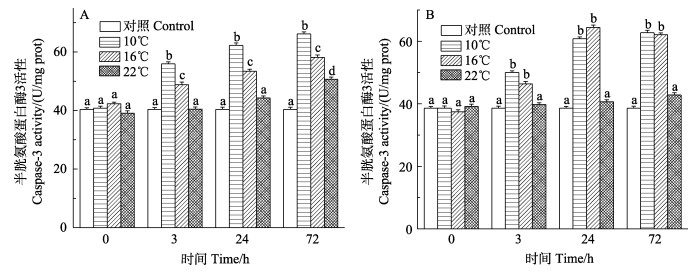
如图 5所示,低温组(10℃和16℃)日本对虾鳃和肝胰腺Caspase-3活性变化呈上升趋势,72 h达到峰值,在各时间点变化趋势明显,且显著高于对照组(P < 0.05);22℃鳃和肝胰腺Caspase-3活性变化呈上升趋势,在72 h达到峰值,与对照组相比差异不显著。
|
图 5 日本对虾鳃(A)和肝胰腺(B) Caspase-3活力随低温胁迫时间的变化 Fig.5 Changes of Caspase-3 activity in the gill (A) and hepatopancreas (B) of M. japonicus under low temperature stress |
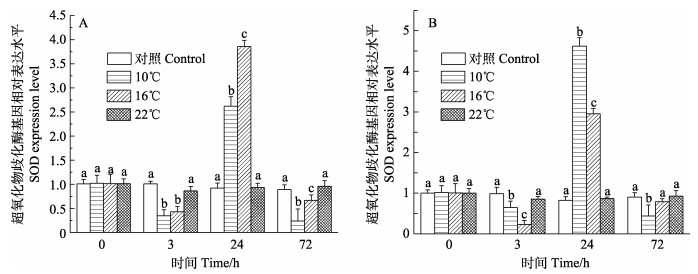
10℃和16℃低温胁迫组日本对虾鳃和肝胰腺SOD基因相对表达量呈先降低后上升再降低的变化趋势(图 6),均在24 h达到峰值,且显著高于对照组(P < 0.05);22℃实验组SOD基因相对表达量在各个时间点与对照组相比无显著差异。
|
图 6 日本对虾鳃(A)和肝胰腺(B) SOD基因相对表达水平随低温胁迫时间的变化 Fig.6 Relative expression of SOD gene in gill (A) and hepatopancreas (B) of M. japonicus under low temperature stress |
如图 7所示,10℃和16℃低温胁迫组日本对虾鳃和肝胰腺Caspase-3基因相对表达量呈上升趋势,72 h达到峰值,在各时间点均显著高于对照组(P < 0.05);22℃实验组Caspase-3基因相对表达量在各时间点均与对照组相比无显著差异。

|
图 7 日本对虾鳃(A)和肝胰腺(B) Caspase-3基因相对表达水平随低温胁迫时间的变化 Fig.7 Relative expression of Caspase-3 gene in gill (A) and hepatopancreas (B) of M. japonicus under low temperature stress |
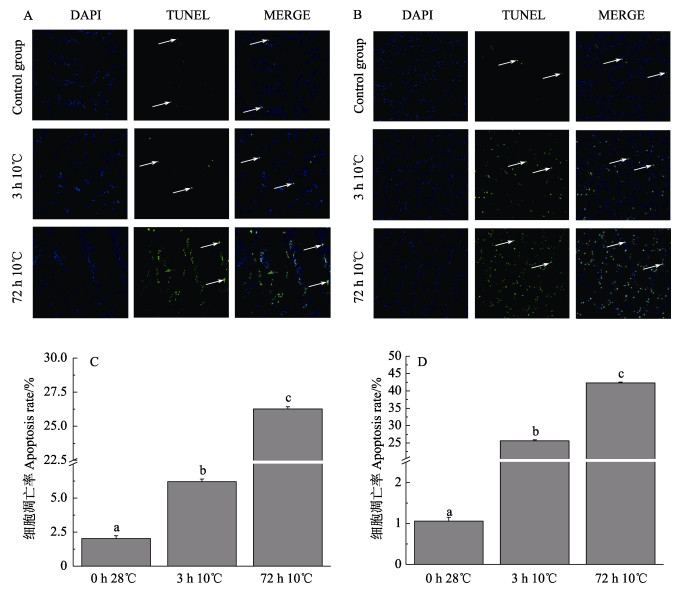
为了更直观地表现低温对日本对虾机体的影响,取10℃低温胁迫3 h和72 h的日本对虾鳃和肝胰腺进行TUNEL检测,将室温28℃水温中的日本对虾作为对照。分析发现,对照组中只有少量凋亡细胞,而随10℃低温胁迫时间的增加,凋亡细胞数量不断增加(图 8A、B)。图 8C、D分别为鳃和肝胰腺细胞凋亡率统计结果,其中,鳃对照组、3 h 10℃组和72 h 10℃组的细胞凋亡率分别为2.03%、6.20%和26.27%,肝胰腺细胞凋亡率分别为1.06%、25.65%和42.33%。
|
图 8 细胞凋亡检测结果 Fig.8 Cell apoptosis detection result A:鳃检测结果;B:肝胰腺检测结果;C:鳃统计结果;D:肝胰腺统计结果 A: Gill detection result; B: Hepatopancreas detection result; C: Gill statistical results; D: Hepatopancreas statistical results |
温度是甲壳动物常见的非生物应激源,几乎影响甲壳类所有生理生化过程(Huang et al, 2017)。例如,对冷应激反应的热休克蛋白(Meng et al, 2019)、蜕皮和存活率都受到水温变化的影响(Hewitt et al, 2001)。环境因子(如低温、盐度和pH等)变化引发的生理效应可能经由氧化还原途径实现(Assefa et al, 2005; Richier et al, 2006; Ryter et al, 2007),即环境胁迫因子造成活性氧自由基大量积累(Lushchak et al, 2006),从而影响抗氧化系统的功能。低温胁迫导致凡纳滨对虾(Litopenaeus vannamei)肝胰腺总抗氧化能力下降(吴萌, 2017)。冷应激可以抑制红螯螯虾(Cherax quadricarinatus)的新陈代谢,引起氧化损伤和免疫缺陷(Wu et al, 2019)。低温胁迫导致点篮子鱼(Siganus guttatus)幼鱼肝脏抗氧化酶活性下降(宋志明等, 2015)。岩扇贝(Crassadoma gigantea)在低温胁迫下,T-AOC显著下降(王潇等, 2018)。过量的活性氧也会影响ATP的产生,破坏线粒体膜电位以及细胞电子传递链,从而影响机体呼吸作用,最终导致细胞凋亡(Dandapat et al, 2003; Ott et al, 2007)。
3.1 低温胁迫对日本对虾抗氧化系统的影响抗氧化系统由酶促体系及非酶类组成,其中,酶促体系包括过氧化物还原酶、过氧化氢酶、超氧化物歧化酶等,由抗氧化系统清除体内过量的活性氧,保护机体不受氧化损伤(Mathew et al, 2007; 陈梓聪等, 2020)。SOD活性可以反映机体清除氧自由基的能力(李彦等, 2008)。GSH能将脂质过氧化物还原成醇,减少脂类被氧化的机率及MDA对细胞的损伤(李勇等, 2008)。本研究中,低温胁迫3 h后,日本对虾鳃和肝胰腺T-AOC、SOD活力和GSH含量下降,可能是组织中抗氧化酶活性储备减弱。随着胁迫时间的延长,各指标基本在24 h达到峰值,说明低温胁迫导致机体中的活性氧自由基大量增加,进而启动日本对虾抗氧化系统,生成大量SOD,以清除体内多余的活性氧。这与Stebbing (1982)提出的“毒物兴奋效应”相似。胁迫后期,日本对虾T-AOC、SOD活性、GSH含量下降,可能是长时间低温胁迫打破了体内平衡,导致肝胰腺受到损伤而不能及时恢复,这与张德康等(2020)的研究结果相似。而22℃组实验结果与低温组相反,在3 h达到峰值,随后逐渐下降,接近对照组,28℃为日本对虾最适生长温度,22℃虽然不属于其最适生长温度,但也处于日本对虾可生长温度范围内,当水温由28℃降至22℃时,日本对虾可以通过提高SOD活性来应对低温应激反应对虾体的影响;但当水温降至10℃和16℃时,虾体抗氧化酶活性受到显著抑制,使得低温组SOD活性显著低于22℃组,而随着时间的延长,抗氧化能力最终不如对照组,各项指标逐渐下降,这与管敏等(2018)的研究结果相似。
MDA是一种脂质过氧化产物,可以反映机体脂质过氧化速率和强度,也能间接反映组织过氧化损伤程度(刘晓华等, 2007)。低温组日本对虾鳃和肝胰腺中MDA含量随胁迫时间的延长大幅增加,且显著高于对照组,这与孙学亮等(2010)的研究结果基本一致。MDA主要在肝胰腺中分解,随着胁迫时间的延长,肝胰腺中MDA含量不断增加(王奇等, 2010),这也表明低温胁迫下,MDA的增加可能是低温对日本对虾机体产生危害的主要原因之一。TUNEL检测也证明低温胁迫确实对鳃和肝胰腺产生损伤,造成细胞凋亡。
3.2 低温胁迫对日本对虾细胞凋亡的影响Caspase家族在介导细胞凋亡的过程中起着非常重要的作用,而Caspase-3作为关键的执行分子,它在凋亡信号传导途径中发挥主导功能,因此,细胞或组织中Caspase-3基因的表达量是检测细胞是否发生凋亡的重要方法(Zvereva et al, 2003)。本研究中,低温胁迫后,鳃和肝胰腺中Caspase-3基因的相对表达量随胁迫时间的增加而不断上升,显著高于对照组,并且Caspase-3活性随胁迫时间的延长显著升高,说明低温胁迫激活细胞凋亡的执行因子—Caspase-3,进而引发细胞凋亡。这与贾旭颖等(2014)报道的温度突变后凡纳滨对虾Caspase-3活性显著升高的结果相似。生物体受到逆境胁迫时,体内活性氧代谢的平衡被打破,如不及时消除就会造成生物体活性氧伤害(West, 2000),同时,会导致细胞组分变成异物或者机体生物合成机制被破坏,进而诱发细胞凋亡的发生。推测是低温胁迫过程细胞不断受到氧化损伤,进而诱导细胞凋亡。
组织动力学研究表明,如果只能观察到少量的凋亡细胞,就意味着有大量的凋亡细胞已经被清除。一旦这种识别机制受损,凋亡细胞不能被吞噬细胞及时清除,就会导致凋亡细胞大量积累,最终引起组织结构和功能的损害(彭黎明, 1999)。本研究中,低温胁迫后,日本对虾鳃和肝胰腺中的凋亡细胞数量随低温胁迫时间的延续而大幅度增加,可能是低温胁迫导致上述组织动力学研究中的识别机制受损,进而导致凋亡细胞不能及时清除,在组织内不断积累。
4 结论低温(10℃和16℃)胁迫能影响日本对虾抗氧化酶、细胞凋亡酶活力及其基因表达水平,导致脂质过氧化产物MDA含量的增加,最终诱导细胞凋亡,并表现出一定的时间量效关系。低温胁迫前期能诱导机体抗氧化酶活力增加,进而促进机体清除过多的活性氧自由基,短期内表现出积极的作用,但随胁迫时间的延长,低温抑制了抗氧化系统,导致脂质过氧化加剧,细胞凋亡率大幅增加,最终造成各组织器官受损。因此,在实际养殖过程中,要尽量避免日本对虾长期处于16℃以下低温环境中。
ASSEFA Z, AN V L, GARMYN M, et al. Ultraviolet radiation-induced apoptosis in keratinocytes: On the role of cytosolic factors. Biochimica et Biophysica Acta,, 2005, 1755(2): 90-106 |
CHEN Z C, CHEN P M, YUAN H R, et al. Effect of recovery time on antioxidant capacity of juvenile Penaeus monodon after exhaustive exercise. Progress in Fishery Sciences, 2020, 41(6): 58-65 [陈梓聪, 陈丕茂, 袁华荣, 等. 恢复时间对力竭训练后的斑节对虾幼虾的抗氧化功能的影响. 渔业科学进展, 2020, 41(6): 58-65] |
DANDAPAT J, CHAINY G B N, RAO K J. Lipid peroxidation and antioxidant defence status during larval development and metamorphosis of giant prawn, Macrobrachium rosenbergii. Comparative Biochemistry and Physiology, Part C: Toxicology and Pharmacology, 2003, 135(3): 221-233 DOI:10.1016/S1532-0456(03)00080-2 |
DONG Z M, WANG J, GAO S, et al. Apoptosis in the regeneration of animal. Journal of Henan Normal University (Natural Science), 2020, 48(2): 87-93 [董自梅, 王静, 高帅, 等. 细胞凋亡与动物再生. 河南师范大学学报(自然科学版), 2020, 48(2): 87-93] |
GUAN M, ZHANG H B, WANG L, et al. The effects of acute low temperature stress on antioxidative and immune indices of juvenile Amur sturgeon (Acipenser schrenckii). Freshwater Fisheries, 2018, 48(6): 17-22 [管敏, 张厚本, 王龙, 等. 急性低温胁迫对史氏鲟幼鱼抗氧化和免疫指标的影响. 淡水渔业, 2018, 48(6): 17-22 DOI:10.3969/j.issn.1000-6907.2018.06.003] |
HEWITT D R, DUNCAN P F. Effect of high water temperature on the survival, moulting and food consumption of Penaeus (Marsupenaeus) japonicus (Bate, 1888). Aquaculture Research, 2001, 32(4): 305-313 DOI:10.1046/j.1365-2109.2001.00560.x |
HUANG W, REN C, LI H, et al. Transcriptomic analyses on muscle tissues of Litopenaeus vannamei provide the first profile insight into the response to low temperature stress. PLoS One, 2017, 12(6): e0178604 DOI:10.1371/journal.pone.0178604 |
JIA X Y, ZHANG D, LU Y L, et al. Effects of abrupt change in temperature and non-ionic ammonia on the cyt-C and caspase-3 of Litopenaeus vannamei in freshwater. Journal of Fishery Sciences of China, 2014, 21(4): 700-710 [贾旭颖, 张丹, 路允良, 等. 温度突变和非离子氨胁迫对淡水养殖凡纳滨对虾cyt-C和caspase-3的影响. 中国水产科学, 2014, 21(4): 700-710] |
JIANG S, ZHOU F L, YANG Q B, et al. Impact of temperature stress on oxygen and energy metabolism in the hepatopancreas of the black tiger shrimp, Penaeus monodon (Crustacea: Decapoda: Penaeidae). Pakistan Journal of Zoology, 2019, 51(1): 141-148 |
LI F C, GONG C G, SU L. Low temperature resistance test of Marsupenaeus japonicus. Reservoir Fisheries, 2006, 26(4): 35-48 [李凤晨, 宫春光, 苏利. 日本对虾耐低温试验. 水利渔业, 2006, 26(4): 35-48 DOI:10.3969/j.issn.1003-1278.2006.04.016] |
LI J J, DU Y, PANG P, et al. Lymphocyte apoptosis in PCV2- infected piglets was detected by TUNEL assay. Shanghai Journal of Animal Husbandry and Veterinary Medicine, 2017(5): 7-9 [李进军, 杜耀, 庞培, 等. TUNEL法检测PCV2感染仔猪的淋巴细胞凋亡. 上海畜牧兽医通讯, 2017(5): 7-9] |
LI Y, KONG L Q, GAO H, et al. Progress on free radical and diseases. Progress in veterinary Medicine, 2008, 29(4): 85-88 [李勇, 孔令青, 高洪, 等. 自由基与疾病研究进展. 动物医学进展, 2008, 29(4): 85-88 DOI:10.3969/j.issn.1007-5038.2008.04.021] |
LI Y, YANG Z B, YANG W R, et al. Effects of different supplemental levels of vitamin A and vitamin E in diets on antioxidation and immune performance in broilers. Chinese Journal of Animal Nutrition, 2008, 20(4): 417-422 [李彦, 杨在宾, 杨维仁, 等. 日粮维生素A和维生素E水平对肉鸡抗氧化和免疫性能的影响. 动物营养学报, 2008, 20(4): 417-422 DOI:10.3969/j.issn.1006-267X.2008.04.007] |
LIU X H, CAO J M, YANG D W, et al. Distribution of antioxidant enzymes and lipid peroxidation products in the tissues of Litopenaeus vannamei before and after ammonia nitrogen stress. Reservoir Fisheries, 2007, 27(6): 24-26 [刘晓华, 曹俊明, 杨大伟, 等. 氨氮胁迫前后凡纳滨对虾组织中抗氧化酶和脂质过氧化产物的分布. 水利渔业, 2007, 27(6): 24-26 DOI:10.3969/j.issn.1003-1278.2007.06.009] |
LUSHCHAK V I, BAGNYUKOVA T V. Temperature increase results in oxidative stress in goldfish tissues. Ⅰ. Indices of oxidative stress. Comparative Biochemistry and Physiology, Part C: Toxicology and Pharmacology, 2006, 143(1): 30-35 DOI:10.1016/j.cbpc.2005.11.017 |
MATHEW S, KUMAR K A, ANANDAN R, et al. Changes in tissue defence system in white spot syndrome virus (WSSV) infected Penaeus monodon. Comparative Biochemistry and Physiology, Part C: Toxicology and Pharmacology, 2007, 145(3): 315-320 DOI:10.1016/j.cbpc.2007.01.001 |
MENG X H, DONG L J, SHI X L, et al. Screening of the candidate genes related to low-temperature tolerance of Fenneropenaeus chinensis based on high-throughput transcriptome sequencing. PLoS One, 2019, 14(4): e0211182 DOI:10.1371/journal.pone.0211182 |
OTT M, GOGVADZE V, ORRENIUS S, et al. Mitochondria, oxidative stress and cell death. Apoptosis: An International Journal on Programmed Cell Death, 2007, 12(5): 913-922 DOI:10.1007/s10495-007-0756-2 |
PENG L M. Recognition and phagocytosis of apoptotic cells by phagocytes. Chinese Journal of Pathology, 1999, 28(4): 304-306 [彭黎明. 吞噬细胞对凋亡细胞的识别与吞噬. 中华病理学杂志, 1999, 28(4): 304-306 DOI:10.3760/j.issn:0529-5807.1999.04.020] |
RICHIER S, SABOURAULT C, COURTIADE J, et al. Oxidative stress and apoptotic events during thermal stress in the symbiotic sea anemone, Anemonia viridis. FEBS Journal, 2010, 273(18): 4186-4198 |
RYTER S W, KIM H P, HOETZEL A, et al. Mechanisms of cell death in oxidative stress. Antioxidants and Redox Signaling, 2007, 9(1): 49-89 DOI:10.1089/ars.2007.9.49 |
SCATENA R, BOTTONI P, BOTTA G, et al. The role of mitochondria in pharmacotoxicology: A reevaluation of an old, newly emerging topic. American Journal of Physiology, Cell Physiology, 2007, 293(1): 12-21 DOI:10.1152/ajpcell.00314.2006 |
SONG X H, MAO Y, DONG H B, et al. The thermotolerance of the two morphologically similar varieties of juvenile kuruma shrimp (Marsupenaeus japonicus). Journal of Fisheries of China, 2014, 38(1): 84-90 [宋晓红, 毛勇, 董宏标, 等. 两种形态变异类型日本囊对虾稚虾高温耐受性的比较. 水产学报, 2014, 38(1): 84-90] |
SONG Z M, LIU J Y, ZHUANG P. Influence of low- temperature stress on the antioxidant enzymes activities and malondialdehyde contents in liver of juvenile Siganus guttatas. Marine Fisheries, 2015, 37(2): 142-150 [宋志明, 刘鉴毅, 庄平. 低温胁迫对点篮子鱼幼鱼肝脏抗氧化酶活性及丙二醛含量的影响. 海洋渔业, 2015, 37(2): 142-150 DOI:10.3969/j.issn.1004-2490.2015.02.007] |
STEBBING A R D. Hormesis: The stimulation of growth by low levels of inhibitors. Science of the Total Environment, 1982, 22(3): 213-234 DOI:10.1016/0048-9697(82)90066-3 |
SUN X L, XING K Z, CHEN C X, et al. The effects of acute temperature stress on blood parameters in half-smooth tongue-sole (Cynoglossus semilaevis). Fisheries Science, 2010, 29(7): 387-392 [孙学亮, 邢克智, 陈成勋, 等. 急性温度胁迫对半滑舌鳎血液指标的影响. 水产科学, 2010, 29(7): 387-392 DOI:10.3969/j.issn.1003-1111.2010.07.002] |
WANG Q, FAN C P, CHEN K C, et al. Effects of three kinds of sulfa drugs on the glutathione transferase (GST) and malondialdehyde (MDA) in the liver tissues of tilapia. Ecological and Environmental Sciences, 2010, 19(5): 1014-1019 [王奇, 范灿鹏, 陈锟慈, 等. 三种磺胺类药物对罗非鱼肝脏组织中谷胱甘肽转移酶(GST)和丙二醛(MDA)的影响. 生态环境学报, 2010, 19(5): 1014-1019 DOI:10.3969/j.issn.1674-5906.2010.05.002] |
WANG X, CAO S M, LIU G, et al. Effects of temperature on keeping-alive without water and antioxidant enzyme of the rock scallop Crassadoma gigantea. Marine Science Bulletin, 2018, 20(1): 1-20 [王潇, 曹善茂, 刘钢, 等. 温度对岩扇贝无水保活及抗氧化酶活力的影响. 海洋通报(英文版), 2018, 20(1): 1-20] |
WANG Y N, HU S M, TUERDI M, et al. Initiator and executioner caspases in salivary gland apoptosis of Rhipicephalus haemaphysaloides. Parasites and Vectors, 2020, 13(1): 288 DOI:10.1186/s13071-020-04164-5 |
WEST I C. Radicals and oxidative stress in diabetes. Diabet Medicine, 2000, 17(3): 171-180 DOI:10.1046/j.1464-5491.2000.00259.x |
WU D L, HUANG Y H, CHEN Q, et al. Effects and transcriptional responses in the hepatopancreas of red claw crayfish Cherax quadricarinatus under cold stress. Journal of Thermal Biology, 2019, 85(1): 102404 |
WU M. Effect of low temperature stress on respiratory performance and antioxidant capacity of Litopenaeus vannamei. Master´s Thesis of Huazhong Agricultural University, 2017 [吴萌. 低温胁迫对凡纳滨对虾呼吸性能及抗氧化能力的影响. 华中农业大学硕士研究生学位论文, 2017]
|
ZHANG D K, GAO J C, WANG Y Y, et al. Influences of low temperature stress on antioxidant status and expression of stress-related genes of American shad, Alosa sapidissima. Transactions of Oceanology and Limnology, 2020, 173(2): 146-153 [张德康, 高建操, 王裕玉, 等. 低温胁迫对美洲鲥抗氧化状态及应激相关基因表达的影响. 海洋湖沼通报, 2020, 173(2): 146-153] |
ZHAO X Y, LI J, LI J T, et al. Effects of pH stress on non-specific immune factors and RNA/DNA ratio of Marsupenaeus japonicus. Progress in Fishery Sciences, 2011, 32(1): 60-66 [赵先银, 李健, 李吉涛, 等. pH胁迫对日本对虾非特异性免疫因子及RNA/DNA比值的影响. 渔业科学进展, 2011, 32(1): 60-66] |
ZVEREVA E, SEREBROV V, GLUPOV V, et al. Activity and heavy metal resistance of non-specific esterases in leaf beetle Chrysomela lapponica from polluted and unpolluted habitats. Comparative Biochemistry and Physiology, Part C Toxicology and Pharmacology, 2003, 135(4): 383-391 DOI:10.1016/S1532-0456(03)00115-7 |




