2. 中国水产科学研究院黄海水产研究所 农业农村部海洋渔业可持续发展重点实验室 山东 青岛 266071;
3. 水产科学国家级实验教学示范中心 上海海洋大学 上海 201306;
4. 河北省水产良种与渔业环境监测保护总站 河北 石家庄 050011
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture and Rural Affairs, Qingdao, Shandong 266071, China;
3. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China;
4. Hebei Provincial General Station of Aquatic Products and Fishery Environmental Monitoring and Protection, Shijiazhuang, Hebei 050011, China
我国盐碱水的面积高达4.6×107 hm2 (陈学洲等, 2020),高pH和高碱度是盐碱水最明显的2个特征。调查显示,山东东营盐碱水pH为8.5~9.5,碳酸盐碱度为1.4~8.0;河北沧州盐碱水pH为8.3~9.2,碳酸盐碱度为3.5~13.0 (Ge et al, 2019)。资源丰富的盐碱水既不能用于人畜饮用,也不能用于农田灌溉。因此,盐碱水养殖是盐碱水开发利用的有效途径。pH值是养殖水体的重要指标,水体pH发生变化会引起刺参(Oplopanax elatus Nakai)、海湾扇贝(Argopecten irradians)的应激反应,严重影响其生长发育,甚至导致水生动物死亡(韩莎等, 2018; Liu et al, 2020)。盐碱水的pH值远高于正常养殖水体(pH为7.5~8.5) (韩旭等, 2021),在养殖过程中产生的残饵和废料也会使水体富营养化,从而导致养殖水体pH值升高(Lucia et al, 2013; 李瑞萍等, 2015)。过高的pH会腐蚀虾的鳃组织,使其呼吸困难,严重时可导致窒息死亡,同时会使免疫功能下降,直接或间接影响其生长、繁殖和抗氧化等能力(胡硕等, 2019; 赵先银等, 2011; 王芸等, 2013)。水体碱度一般是指水体中能与强酸发生中和反应的物质总量,主要由HCO3-、CO32-组成,称为碳酸盐碱度(柳飞等, 2016)。房文红等(2000)研究表明,水体碱度与pH影响中国对虾(Fenneropenaeus chinensis)幼虾的存活率,高碳酸盐碱度会影响中国对虾的生长、发育和繁殖。脊尾白虾(Exopalaemon carinicauda)的抱卵率、孵化率和幼体成活率等会随着碱度的升高而降低(么宗利等, 2010、2012; 柳飞等, 2016)。上述研究表明,盐碱水的高pH和高碱度特性是影响水生生物生长存活的主要原因。近年来,凡纳滨对虾(Litopenaeus vannamei)、脊尾白虾、罗非鱼(Oreochromis mossambicus)等经过多年盐碱水养殖模式和技术的探索,已基本实现盐碱水养殖,大大提高了盐碱水的利用率,创造了较大的经济价值(孙家强, 2018; 冯伟业等, 2020)。因此,研究中国对虾的耐盐碱机制,为提升其对环境的适应性及抗逆性提供理论依据,对早日实现中国对虾盐碱水养殖具有重要意义。
自噬(autophagy)是细胞维持正常生理活动及内部稳态的一种代谢活动,其作用机理是通过溶酶体降解来清除自身异常组分或细胞通过降解自身组分来解决外界营养匮乏的问题(Matsushita et al, 2007)。目前,在酵母中已经发现了40个自噬相关基因(autophagy- related gene, ATG)(卫亚平, 2016),众多自噬相关基因中,ATG5被证明是微自噬和巨自噬的重要标志(Mizushima et al, 1999; 王懿峥等, 2018),与ATG12共轭结合形成异源二倍体,后又与ATG16共价结合,形成类泛素结合系统,共同转运到自噬体膜上(Matsushita et al, 2007; 陈立德等, 2017),参与自噬体膜的延伸和扩张以及最终包裹内容物形成自噬体的过程(Klionsky et al, 2003),被广泛作为研究自噬行为的对象(Simonsen et al, 2008; Egan et al, 2011; Wei et al, 2016)。已有研究表明,ATG5在动植物应对逆境胁迫时表达量会明显上调,与野生型相比,过表达番茄(Solanum lycopersicum)的耐高温、耐旱和耐高盐等性能均有所提高(陈立德等, 2017; 贾昕, 2018)。在哺乳动物中,ATG5-ATG12共轭物参与小鼠(Mus musculus)先天抗病毒免疫,促进小鼠的杀菌作用; ATG5参与牦牛(Bos grunniens)生殖过程中卵母细胞的发育、成熟和早期胚胎的发育(Jounai et al, 2007; 王靖雷等, 2019)。在鱼类中,ATG5被证明在神经保护和先天免疫中发挥作用,且过表达会促进自噬活动(Hu et al, 2017; Chu et al, 2019); 斑节对虾(Penaeus monodon)在哈维氏弧菌(Vibrio harveyi)攻毒下,不论是干扰ATG5、ATG12单个基因或者2个基因同时干扰,其自噬水平均有所下降(刘伟, 2018)。
本课题组在中国对虾转录组中发现,非生物胁迫下自噬相关基因差异表达(未发表),鉴于自噬基因在其他物种中的研究进展,本研究对非生物胁迫下自噬相关基因所发挥的作用进行验证。本研究通过克隆中国对虾ATG5全长基因,分析其在各组织中的表达特征及其在pH胁迫、碳酸盐碱度胁迫下的差异表达情况并验证其功能,为中国对虾在细胞自噬方面的研究提供参考,旨在为提高中国对虾抗逆性和良种选育提供理论依据。
1 材料与方法 1.1 实验材料实验用虾取自山东日照开航水产养殖公司,选择健康无病、规格整齐、活力旺盛的中国对虾进行pH、碳酸盐碱度胁迫及siRNA干扰实验,所用对虾体长为(11.59±0.96) cm,体重为(21.29±2.47) g。实验用水为过滤后的地下海水,温度为20℃~22℃,盐度为26~28,pH 8.14~8.20。实验前将虾置于养殖池中暂养3~5 d。暂养期间,池中水深为30~40 cm,每天换水1/3,投喂饵料为中国对虾体重的5%,待其适应环境后开展实验。
1.2 组织采集选取9尾未经处理的健康中国对虾,取其鳃、肝胰腺、眼柄、肌肉、胃、心脏、肠和血淋巴细胞,每3尾为1组,放入冻存管中,迅速放入液氮保存,用于后续总RNA的提取以及组织表达分析。
1.3 实验方法 1.3.1 pH、碳酸盐碱度胁迫实验根据预实验结果,pH胁迫实验共分为2组,pH 8.2 (自然海水)为对照组,pH 9.0为胁迫组,每组设置3个平行,每个平行放入30尾中国对虾,参照李政道(2018)和哈承旭等(2009)的实验设计,使用NaOH、HCl和NaHCO3调节水体pH值。胁迫实验在60 L的整理箱中进行。实验开始前48 h调好水体pH值,当水体稳定后,将虾放入整理箱中开始胁迫实验。pH胁迫实验开始后第0、3、6、12、24、48、72、96 h分别从每个实验组随机挑选9尾虾,取其鳃组织,迅速放入液氮中保存,用于后续实验中总RNA的提取。实验开始后,每3 h测一次水体pH值并校正。
根据预实验结果,将碳酸盐碱度胁迫实验分为2组,碱度3.2 (自然海水)为对照组,碱度11为胁迫组,每组设置3个平行,每个平行放入30尾中国对虾。参照柳飞(2016)和房文红等(2000)的实验设计,碳酸盐碱度胁迫实验使用Na2CO3和NaHCO3调节实验水体碱度,用0.1 mol/L的NaOH和0.1 mol/L的HCl进行微调,实验在60 L的整理箱中进行。实验开始前48 h调好水体碱度,当水体碱度稳定后将虾放入整理箱中开始胁迫实验。碳酸盐胁迫实验开始后第0、3、6、12、24、48、72、96小时分别从每个实验组随机取出9尾虾,取其鳃组织,迅速放入液氮中保存,用于后续实验中总RNA的提取。实验开始后,每3 h测1次水体碱度并校正,采用双指示剂滴定法(酚酞和甲基橙作为指示剂)测定碱度。
1.3.2 总RNA的提取及cDNA第一链的合成先将收集的样品进行预处理,体积较大的,如肌肉、肝胰腺,采用液氮研磨法处理,其他体积较小的样品用低温匀浆机处理。将处理好的样品分装至无RNA酶的离心管中,每管装样品80~100 mg,加入1 mL TransZol Up,每个组织取1管分装好的样品使用总RNA提取试剂盒(全式金,北京)提取总RNA,将提取的总RNA放入-80℃保存备用。使用超微量紫外分光光度计(Thermo, 美国)测定RNA质量和浓度,并通过琼脂糖凝胶电泳检测其完整性。使用SMARTer® RACE 5′/3′ (宝生物,大连)试剂盒合成中国对虾3′、5′RACE模板,用于基因克隆,-80℃保存。
1.3.3 中国对虾ATG5基因克隆从中国对虾转录组中筛选自噬相关基因ATG5的EST序列。使用Primer Premier 5.0软件设计特异性引物(表 1),通过PCR扩增得到FcATG5中间片段,并使用DNAMAN软件对其验证。以验证后的序列为模板,设计RACE引物,进行RACE扩增。将RACE扩增产物连接到T1载体(全式金,北京)后转化到DH5α化学感受态细胞(全式金,北京)中,挑取单克隆菌株进行阳性克隆鉴定,通过菌液PCR产物的凝胶电泳结果,选出阳性菌液进行测序。使用软件Contig Express拼接菌液测序结果,得到5′和3′端扩增序列; 使用在线软件ORF Finder (https://www.ncbi.nlm.nih.gov/orffinder/)查找FcATG5的开放阅读框。
|
|
表 1 本研究所用引物 Tab.1 The primers used in this research |
利用NCBI中的Blast (https://blast.ncbi.nlm.nih.gov/Blast.cgi)区域,对FcATG5核苷酸序列进行序列比对,使用Protein Blast比对FcATG5与其他物种自噬相关基因ATG5的同源性。使用DNAMAN软件进行多生物氨基酸序列对比。使用MEGA 7软件构建N-J进化树。使用SMART软件预测蛋白质结构域,使用TMHMM Server v. 2.0软件预测蛋白质有无跨膜结构,使用ExPASy中ProtParam tool预测蛋白质特性,使用ExPASy中ProtScale推测蛋白质亲水性,使用SignalP 4.1 Server预测信号肽。
1.3.5 FcATG5基因siRNA干扰实验根据FcATG5基因cDNA序列,设计3个干扰靶点,分别编号为ATG5-1、ATG5-2和ATG5-3 (表 2),进行预实验。以注射无意义双链siRNA-NC为阴性对照组,以分别注射ATG5-1、ATG5-2和ATG5-3作为干扰组,每组设置3个平行,每个平行放入10尾虾,注射siRNA前称量虾的重量,根据虾体重来调整注射量(1 μg/g),注射部位为第2腹节肌肉,注射完成后放入装有正常海水的60 L整理箱中。注射后24 h,每组中随机选取3尾虾,检测干扰后FcATG5基因在鳃中的表达变化,选出干扰效果最好的靶点进行正式实验。siRNA干扰正式实验设置4个实验组:在pH 9.0、碳酸盐碱度11.0胁迫下,注射无意义双链siRNA-NC作为2个对照组,以注射效果最佳的靶点作为2个干扰组。实验开始后统计胁迫48 h死亡率。
|
|
表 2 本研究所用siRNA序列与NC序列 Tab.2 The sequences of siRNA and NC used in this research |
利用Primer Premier 5.0软件设计实时荧光定量引物FcATG5-F1和FcATG5-R1(表 1)。使用反转录试剂盒HiScript® II Q RT SuperMix for qPCR (+gDNA wiper) (诺唯赞,南京)将待测样品RNA反转录得到cDNA。使用ChamQTM SYBR® Color qPCR master mix试剂盒(诺唯赞,南京)和7500 Real Time PCR System仪器(ABI,美国)检测中国对虾FcATG5各组织表达分布及其在pH胁迫、碳酸盐碱度胁迫下的表达。实时荧光定量结果使用2-ΔΔCt方法计算得出FcATG5相对表达量,使用SPSS进行单因素方差分析(one-way ANOVA),运用Duncan多重比较进行显著性检验,使用OriginPro 2018软件作图。
2 结果与分析 2.1 FcATG5基因序列分析通过RACE技术得到中国对虾ATG5基因序列,全长为2224 bp,将其命名为FcATG5 (GenBank登录号:MW426527),开放阅读框为810 bp,5′端非编码区107 bp,3′端非编码区307 bp,编码269个氨基酸(图 1)。信号肽预测结果显示,FcATG5不包含信号肽。预测其编码的蛋白分子量为31.103 kDa,理论等电点为5.59,亲水性平均值为-0.407,不稳定性指数为43.43,表明该基因编码的蛋白为疏水性不稳定蛋白,SMART软件预测结果显示,其具有1个APG5自噬相关蛋白结构域,不含跨膜结构。

|
图 1 FcATG5基因cDNA序列和预测的氨基酸序列 Fig.1 cDNA sequence and predicted amino acid sequence of FcATG5 gene 预测的开放阅读框内核苷酸序列用大写字母表示,位于氨基酸序列下方; 起始密码子(ATG)为下方划红线区域,终止密码子(TGA)上方标有星号(*) Nucleotide sequences in the predicted open reading frame are represented in capital letters below the amino acid sequence. The start codon (ATG) is the red line below, and the stop codon (TGA) is marked with an asterisk (*) above it |
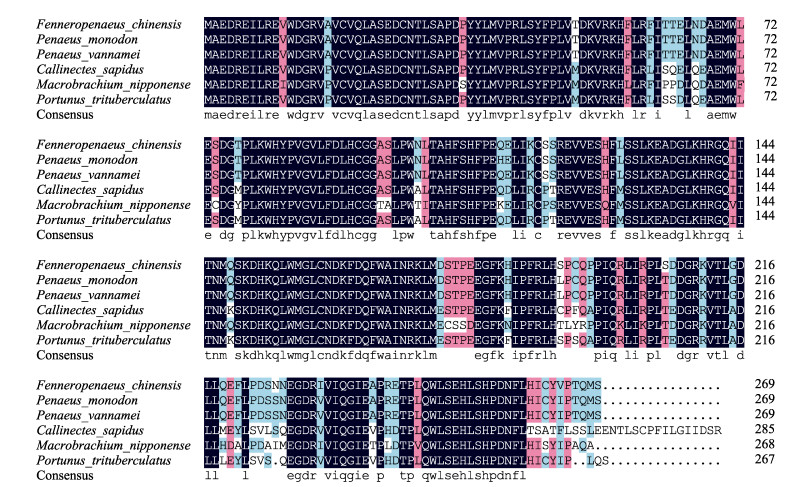
使用DNAMAN软件将FcATG5氨基酸序列与其他物种进行同源比对。结果显示,中国对虾FcATG5与凡纳滨对虾的同源性最高,为98.14%,与斑节对虾的同源性为97.77%,与三疣梭子蟹(Portunus trituberculatus)、日本沼虾(Macrobrachium nipponense)、蓝蟹(Callinectes sapidus)的同源性分别为85.50%、81.04%、78.32%(图 2)。
|
图 2 FcATG5基因与多种生物氨基酸序列比对 Fig.2 Aligning of multi-biological amino acid sequence of FcATG5 gene |
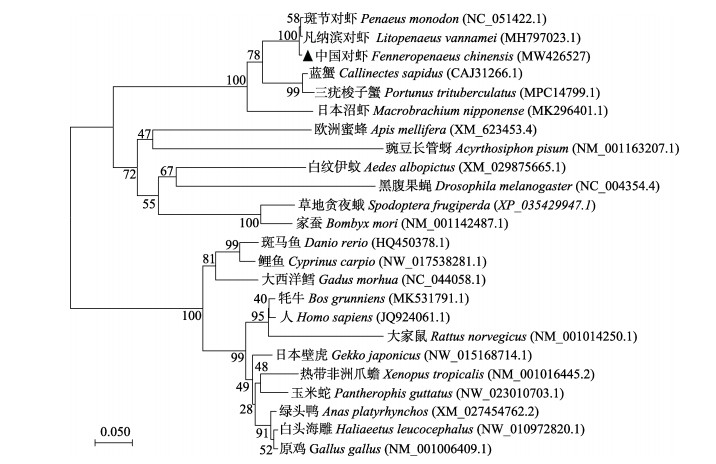
使用软件MEGA 7.0构建Neighbor-Joining进化树(图 3)。从图 3可以看出,进化树分为两大支,第一支为节肢动物门(Arthropoda),第二支为脊索动物门(Chordata)。其中,中国对虾隶属节肢动物门、甲壳纲(Crustacea),属于第一支,与斑节对虾、凡纳滨对虾首先聚为一支,其次为三疣梭子蟹、蓝蟹。
|
图 3 基于中国对虾FcATG5氨基酸序列构建的Neighbor-Joining进化树 Fig.3 Neighbor-Joining tree constructed from amino acid sequence of FcATG5 of F. chinensis |
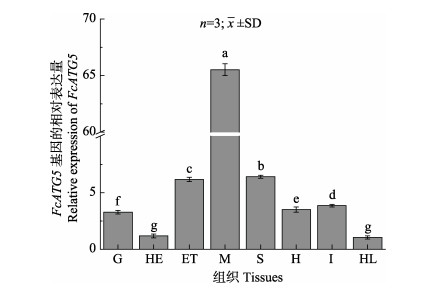
利用实时荧光定量的方法检测FcATG5在中国对虾不同组织中的表达情况。结果显示,FcATG5基因在中国对虾各个组织中均有表达,但其在不同组织中的表达量不同,在肌肉中的表达量最高,其次在胃、眼柄中表达较高,在血淋巴细胞中表达量最低(图 4)。
|
图 4 FcATG5在中国对虾各组织中的表达 Fig.4 Expression of FCATG5 in the tissues of F. chinensis G:鳃; HE:肝胰腺; ET:眼柄; M:肌肉; S:胃; H:心脏; I:肠; HL:血淋巴细胞; 柱上不同字母代表表达差异显著(P < 0.05)。下同 G: Gill; HE: Hepatopancreas; ET: Eye stalk; M: Muscle; S: Stomach; H: Heart; I: Intestines; HL: Hemolymph cells. Different letters on the column represent significant differences (P < 0.05). The same as below |
鳃作为水生动物的呼吸器官,与养殖水体直接接触,受水体pH、碱度等水体主要指标变化影响较大,也是水生动物调节体内渗透压和维持内部稳态的重要调节器官。因此,本研究以中国对虾鳃组织为主要研究对象。
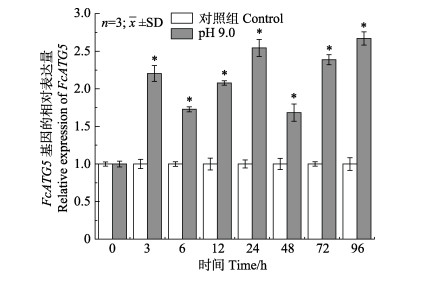
pH胁迫3 h,FcATG5基因在中国对虾鳃组织中的表达量显著高于对照组(P < 0.05);在胁迫后96 h内,FcATG5的表达呈现多峰式变化。胁迫后96 h,FcATG5最高,为对照组的2.67倍; 在48 h表达量相对最低,为对照组的1.68倍(图 5)。
|
图 5 pH胁迫下FcATG5基因在鳃中的相对表达 Fig.5 Relative expression of FCATG5 gene in gills under high pH stress *:与对照相比,表达差异显著(P < 0.05)。下同 *: Significant difference compared with control (P < 0.05). The same as below |
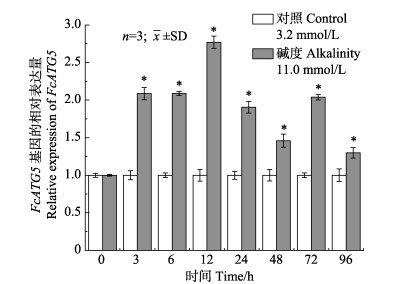
与对照组相比,碳酸盐碱度胁迫下FcATG5在鳃组织中的表达变化呈显著升高趋势(P < 0.05),。胁迫后96 h内,FcATG5的表达基本呈先上调再下调的变化趋势,在胁迫后12 h达到最高,为对照组的2.77倍; 在96 h表达量最低,为对照组的1.30倍(图 6)。
|
图 6 碳酸盐碱度胁迫下FcATG5基因在鳃中的表达 Fig.6 Expression of FCATG5 gene in gills under carbonate alkalinity stress |
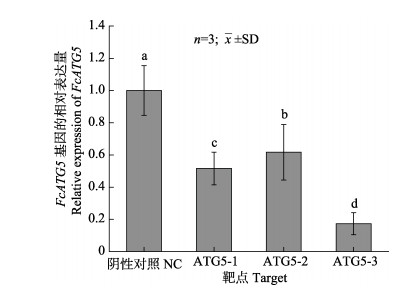
siRNA干扰后,FcATG5基因在中国对虾鳃中的相对表达量如图 7所示。与对照组相比,注射不同干扰试剂24 h时,FcATG5基因在鳃中的表达量呈显著降低的趋势(P < 0.05)。注射ATG5-1 24 h时,基因表达量为对照组的0.516倍; 注射ATG5-2 24 h时,基因表达量为对照组的0.617倍; 注射ATG5-3 24 h时,基因表达量为对照组的0.174倍。经比较,ATG5-3干扰效果最好,干扰效果达到82.6%,选择干扰靶点ATG5-3进行后续实验。
|
图 7 注射ATG5-1、ATG5-2和ATG5-3 24 h时FcATG5基因在鳃中的表达 Fig.7 Expression of FcATG5 gene in gill after ATG5-1, ATG5-2 and ATG5-3 injection in 24 h |
向中国对虾注射FcATG5基因siRNA干扰试剂ATG5-3,并对其进行pH胁迫,统计其0~48 h内的死亡率,结果如图 8所示。干扰组在0~48 h的累计死亡率(50%)显著高于对照组(33.33%) (P < 0.05)。其中,0~12 h干扰组死亡率为8.33%,对照组为0;12~24 h干扰组死亡率为25%,对照组为8.33%。

|
图 8 pH 9.0胁迫注射干扰的中国对虾累计死亡率 Fig.8 Cumulative mortality of F. chinensis after pH stress (pH 9.0) and siRNA interference |
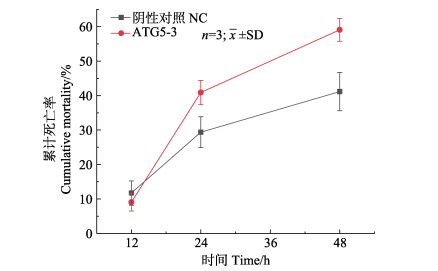
向中国对虾注射FcATG5基因siRNA干扰试剂ATG5-3,并对其进行高碱度胁迫,统计其0~48 h内的死亡率,结果如图 9所示。干扰组在0~48 h的累计死亡率(59.09%)显著高于对照组(41.18%) (P < 0.05)。其中,0~12 h干扰组死亡率为9.09%,对照组为11.76%;12~24 h干扰组死亡率为31.82%,对照组为17.65%。
|
图 9 碳酸盐碱度11胁迫注射干扰的中国对虾累计死亡率 Fig.9 Cumulative mortality of F. chinensis after carbonate alkalinity (11.0 mmol/L) stress and siRNA interference |
本研究运用RACE技术首次克隆得到中国对虾FcATG5基因cDNA全长,并对其进行分析。结果显示,FcATG5基因与其他物种,如太平洋鳕(Gadus macrocephalus)(孙航等, 2015)、斑节对虾(刘伟, 2018)的ATG5基因的预测结果相同或相似。FcATG5开放阅读框编码的氨基酸序列与凡纳滨对虾等物种具有较高的同源性,且包含1个自噬相关蛋白结构域APG5,这表明FcATG5基因所编码的蛋白具有高度保守性。
中国对虾FcATG5基因的组织特异性表达分析结果显示,FcATG5基因在各组织中均有表达,无组织特异性,但在各组织中表达量差异性显著,其中,在肌肉中表达量最高,在血淋巴细胞中表达最低,这与刘伟(2018)的研究结果一致。鳃是水生动物的呼吸器官,与养殖水体直接接触,受水体pH、碱度等水体主要指标变化影响较大,也是水生动物调节体内渗透压和维持内部稳态的重要调节器官。在pH和碳酸盐碱度胁迫下,鳃作为主要的响应器官,在维持机体生理功能中发挥积极调控作用,而细胞自噬是免疫调控的重要部分,在水生动物应对胁迫时发挥重要作用(张小明, 2018; Li, 2018; 何丽等, 2019; 洋雯, 2019)。因此,推测FcATG5在中国对虾应对pH、碳酸盐胁迫时发挥重要作用。研究自噬基因FcATG5在中国对虾应对盐碱胁迫的机理,对于丰富中国对虾应对盐碱胁迫基础性研究尤为重要。
研究表明,ATG5基因不仅能促进细胞自噬的形成,而且可以刺激细胞凋亡,在动物的先天免疫、神经保护、生殖发育等过程中发挥重要作用(Jounai et al, 2007; 王靖雷等, 2019)。ATG5作为细胞自噬的重要标志(Mizushima et al, 1999; 王懿峥等, 2018),根据其表达量的变化可推测细胞自噬水平的变化。本研究结果显示,pH、碳酸盐碱度胁迫下,中国对虾鳃中FcATG5表达量均有所升高,pH胁迫后96 h达到最高,碳酸盐碱度胁迫后12 h达到最高,这与哈维氏弧菌刺激下,斑节对虾中ATG5表达量上调,在72 h达到最高的研究结果相似(刘伟, 2018)。由此推测,鳃作为调节渗透压、维持体内稳态的主要器官,在响应pH、碳酸盐碱度胁迫时,其细胞自噬活动增强,且分别在胁迫后96 h和12 h达到最高水平。
RNA干扰技术是由dsRNA介导的基因沉默现象,研究人员通常利用RNA干扰技术进行基因功能的探索。已有研究表明,干扰ATG5会导致细胞自噬水平下降,而对ATG5进行过表达处理则会促进细胞自噬,这揭示了ATG5对细胞自噬的调控作用(刘伟, 2018; Chu et al, 2019)。研究表明,沉默癌细胞中ATG5基因可以提高化疗药物对癌症的治疗效果(Egan et al, 2011; Simonsen et al, 2008; Wei et al, 2016); 对斑马鱼(Danio rerio)进行ATG5过表达处理,可以减轻或者逆转帕金森氏病的病理特征(Hu et al, 2017); 沉默斑节对虾中ATG5会使斑节对虾细胞自噬水平下降(刘伟, 2018)。RNA干扰结果显示,沉默FcATG5会使中国对虾死亡率升高,表明在pH、碳酸盐碱度胁迫下,FcATG5表达量越低,中国对虾对非生物胁迫的耐受力越差,其存活率就越低。推测原因为沉默FcATG5后,其表达量下降,进而抑制了细胞自噬水平,降低了中国对虾的免疫力及抗逆性。这一结果与上述沉默动物或癌细胞中ATG5的相关研究结果相似。
非生物胁迫下,中国对虾体内积累大量活性氧中介物(ROS),使得机体受到氧化损伤,导致线粒体核糖体蛋白等受到损伤,产生功能性障碍(Li et al, 2021)。自噬相关基因通过调控细胞自噬过程来清除体内受损伤的细胞器和老化、错误折叠蛋白等,也可通过降解自身组分来解决外界营养匮乏的问题,维持机体内部相对稳态(高婷等, 2018),由此推测,FcATG5通过调控细胞自噬水平来清除由于非生物胁迫而受损伤的线粒体及蛋白质等。此外,自噬通过对葡萄糖的摄取、糖酵解关键酶和线粒体的调控来参与糖代谢过程(杨照国等, 2015)。中国对虾在应对非生物胁迫时机体耗能增加,糖代谢活动增强(He et al, 2019),由此推测,自噬基因可能通过此路径为机体在应对非生物胁迫时供能,从而降低中国对虾应对胁迫时的死亡率。本研究对FcATG5在非生物胁迫中的作用进行了初步验证,但其对细胞自噬过程的调控机制以及其所在自噬通路的调控网络有待进一步研究。
CHEN L D, LI A, LIU Z J, et al. Effects of different environmental stresses on the number of autophagosomes and expression of autophagy-related genes in 'Ningyu' strawberry leaves. Acta Horticulturae Sinica, 2017, 44(10): 1894-1904 [陈立德, 李傲, 刘众杰, 等. 逆境胁迫对'宁玉'草莓叶片自噬小体数量及其相关基因表达的影响. 园艺学报, 2017, 44(10): 1894-1904] |
CHEN X Z, LAI Q F, YAO Z L, et al. Technical model of green aquaculture in saline-alkali water. China Fisheries, 2020(9): 61-63 [陈学洲, 来琦芳, 么宗利, 等. 盐碱水绿色养殖技术模式. 中国水产, 2020(9): 61-63] |
CHU P F, HE L, YANG C, et al. Grass carp ATG5 and ATG12 promote autophagy but down-regulate the transcriptional expression levels of IFN-I signaling pathway. Fish and Shellfish Immunology, 2019, 92: 600-611 DOI:10.1016/j.fsi.2019.06.014 |
EGAN D, KIM J, SHAW R J, et al. The autophagy initiating kinase ULK1 is regulated via opposing phosphorylation by AMPK and mTOR. Autophagy, 2011, 7(6): 643-644 DOI:10.4161/auto.7.6.15123 |
FANG W H, WANG H, LAI Q F. Toxicity of carbonate- alkalinity and pH to larval Penaeus chinensis. Journal of Fishery Sciences of China, 2000, 7(4): 78-81 [房文红, 王慧, 来琦芳. 碳酸盐碱度、pH对中国对虾幼虾的致毒效应. 中国水产科学, 2000, 7(4): 78-81 DOI:10.3321/j.issn:1005-8737.2000.04.018] |
FENG W Y, YAO J, ZHAO Y, et al. Experiment on the cultivation of Litopenaeus vannamei in saline-alkali water. Modern Agriculture, 2020(4): 13-14 [冯伟业, 姚静, 赵悦, 等. 利用盐碱水养殖南美白对虾试验. 现代农业, 2020(4): 13-14 DOI:10.3969/j.issn.1008-0708.2020.04.004] |
GAO T, WANG Z X, CHEN Z M, et al. Oxidative stress and autophagy mediated by reactive oxygen species. China Animal Husbandry and Veterinary Medicine, 2018, 45(3): 656-662 [高婷, 王子旭, 陈祝茗, 等. ROS介导的氧化应激与自噬. 中国畜牧兽医, 2018, 45(3): 656-662] |
GE Q Q, LI J, WANG J J, et al. Characterization, functional analysis, and expression levels of three carbonic anhydrases in response to pH and saline-alkaline stresses in the ridgetail white prawn Exopalaemon carinicauda. Cell Stress and Chaperones, 2019, 24(3): 503-515 DOI:10.1007/s12192-019-00987-z |
HA C X, LIU P, HE Y Y, et al. Effects of high pH on immune enzymes of "Huanghai No.1" population of shrimp Fenneropenaeus chinensis. Journal of Fishery Sciences of China, 2009, 16(2): 303-306 [哈承旭, 刘萍, 何玉英, 等. 高pH胁迫对"黄海1号"中国对虾免疫相关酶的影响. 中国水产科学, 2009, 16(2): 303-306 DOI:10.3321/j.issn:1005-8737.2009.02.020] |
HAN S, HU W, LI C L, et al. Effects of pH stress on survival rate, growth and antioxidant enzyme activities of the sea cucumber, Apostichopus japonicus selenka. Progress in Fishery Sciences, 2018, 39(5): 91-98 [韩莎, 胡炜, 李成林, 等. pH胁迫对刺参存活、生长及抗氧化酶活性的影响. 渔业科学进展, 2018, 39(5): 91-98] |
HAN X, HE Y Y, LI J, et al. Correlation between the SNP of NAGase gene and susceptibility to high pH stress in Fenneropenaeus chinensis. Progress in Fishery Sciences, 2021, 42(1): 124-133 [韩旭, 何玉英, 李健, 等. 中国对虾NAGase基因SNP标记的筛选及与耐高pH性状的关联分析. 渔业科学进展, 2021, 42(1): 124-133] |
HE L, RUAN J M, LIU Y, et al. Cloning of Beclin1, an autophagy gene, and its expression under Microcystin-LR stress in grass carp. Acta Hydrobiologica Sinica, 2019, 43(3): 479-485 [何丽, 阮记明, 刘毅, 等. 草鱼自噬相关基因Beclin1的克隆及其在MC-LR胁迫下的表达特征. 水生生物学报, 2019, 43(3): 479-485] |
HE Y Y, LI Z X, ZHANG H E, et al. Genome-wide identification of Chinese shrimp (Fenneropenaeus chinensis) microRNA responsive to low pH stress by deep sequencing. Cell Stress and Chaperones, 2019, 24(4): 689-695 DOI:10.1007/s12192-019-00989-x |
HU S, HE Y Y, LI J, et al. Expression analysis of the V-ATPase subunit c under the condition of high pH stress in Fenneropenaeus chinensis. Journal of Fishery Sciences of China, 2019, 26(6): 1064-1074 [胡硕, 何玉英, 李健, 等. 中国对虾V-ATPase亚基基因的克隆及其在高pH胁迫下的表达分析. 中国水产科学, 2019, 26(6): 1064-1074] |
HU Z Y, CHEN B, ZHANG J P, et al. Up-regulation of autophagy- related gene 5 (ATG5) protects dopaminergic neurons in a zebrafish model of Parkinson᾽s disease. Journal of Biological Chemistry, 2017, 292(44): 18062-18074 DOI:10.1074/jbc.M116.764795 |
JIA X. Functional analysis of apple autophagy-related gens MdATG5-1 and MdATG5-2 in response to drought and high temperature stresses. Masterxs Thesis of Northwest A & F University, 2018 [贾昕. 苹果自噬相关基因MdATG5-1和MdATG5-2在干旱、高温逆境中的功能分析. 西北农林科技大学硕士研究生学位论文, 2018]
|
JOUNAI N, TAKESHITA F, KOBIYAMA K, et al. The Atg5-Atg12 conjugate associates with innate antiviral immune responses. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(35): 14050-14055 DOI:10.1073/pnas.0704014104 |
KLIONSKY D J, CREGG J M, DUNN W A Jr, et al. A unified nomenclature for yeast autophagy-related genes. Developmental Cell, 2003, 5(4): 539-545 DOI:10.1016/S1534-5807(03)00296-X |
LI R P, ZHANG X X, LIU Z, et al. Distribution characteristics and relationships of pH, nutrients, chlorophyll-a and three sulfonamides in pond aquaculture water. Chinese Journal of Environmental Engineering, 2015, 9(6): 2582-2588 [李瑞萍, 张欣欣, 刘卓, 等. 池塘养殖水体pH、营养盐、叶绿素a及3种磺胺类抗生素分布特征及其相关性分析. 环境工程学报, 2015, 9(6): 2582-2588] |
LI X P, CHI H, ZHANG J. Beclin-1 is involved in tongue sole Cynoglossus semilaevis immune defense against bacterial infection. Fish and Shellfish Immunology, 2018, 77: 8-12 DOI:10.1016/j.fsi.2018.03.023 |
LI Z D. The role of Na+/H+ exchanger and carbonic anhydrase in Fenneropenaeus chinensis in response to pH stress. Masterxs Thesis of Shanghai Ocean University, 2018 [李政道. 钠氢交换体和碳酸酐酶在中国对虾响应pH胁迫中的功能研究. 上海海洋大学硕士研究生学位论文, 2018]
|
LI Z X, TANG X Q, LI J, et al. Comparative proteomic and transcriptomic analysis reveals high pH-induced expression signatures of Chinese shrimp Fenneropenaeus chinensis. Functional and Integrative Genomics, 2021, 21(2): 299-311 DOI:10.1007/s10142-021-00779-8 |
LIU F, LI J, LI J T, et al. Effects of carbonate alkalinity stress on the survival, growth, reproduction, and immune enzyme activities of Exopalaemon carinicauda. Journal of Fishery Sciences of China, 2016, 23(5): 1137-1147 [柳飞, 李健, 李吉涛, 等. 碳酸盐碱度对脊尾白虾生存、生长、繁殖及免疫酶活性的影响. 中国水产科学, 2016, 23(5): 1137-1147] |
LIU F. Effects of carbonate alkalinity stresses on the growth and reproduction of Exopalaemon carinicauda. Masterxs Thesis of Shanghai Ocean University, 2016 [柳飞. 碳酸盐碱度对脊尾白虾生长和繁殖的影响. 上海海洋大学硕士研究生学位论文, 2016]
|
LIU W. Mechanism of miR-7562 mediated ATG5-ATG12 conjugation system in response to Vibrio harveyi stress in Penaeus monodon. Masterxs Thesis of Shanghai Ocean University, 2018 [刘伟. 斑节对虾miR-7562介导下ATG5-ATG12共轭系统应答哈维弧菌胁迫的作用机制研究. 上海海洋大学硕士研究生学位论文, 2018]
|
LIU Y, YU R H, ZHANG Z, et al. Effects of different pH on embryonic development and larval growth and development of bay scallop. Progress in Fishery Sciences, 2020, 41(6): 108-114 |
LUCIA S H, DANIELA U, WU Y, et al. Effluent, nutrient and organic matter export from shrimp and fish ponds causing eutrophication in coastal and back-reef waters of NE Hainan, tropical China. Continental Shelf Research, 2013, 57: 92-104 DOI:10.1016/j.csr.2012.05.006 |
MATSUSHITA M, SUZUKI N N, OBARA K, et al. Structure of Atg5-Atg16, a complex essential for autophagy. Journal of Biological Chemistry, 2007, 282(9): 6763-6772 DOI:10.1074/jbc.M609876200 |
MININA E A, MOSCHOU P N, VETUKURI R R, et al. Transcriptional stimulation of rate-limiting components of the autophagic pathway improves plant fitness. Journal of Experimental Botany, 2018, 69(6): 1415-1432 DOI:10.1093/jxb/ery010 |
MIZUSHIMA N, NODA T, OHSUMI Y. Apg16p is required for the function of the Apg12p-Apg5p conjugate in the yeast autophagy pathway. EMBO Journal, 1999, 18(14): 3888-3896 DOI:10.1093/emboj/18.14.3888 |
SIMONSEN A, CUMMING R C, BRECH A, et al. Promoting basal levels of autophagy in the nervous system enhances longevity and oxidant resistance in adult Drosophila. Autophagy, 2008, 4(2): 176-184 DOI:10.4161/auto.5269 |
SUN H, MAO M G, JIANG J L, et al. Cloning and expression of ATG5 gene in Pacific cod Gadus macrocephalus. Journal of Dalian Ocean University, 2015, 30(5): 478-483 [孙航, 毛明光, 蒋洁兰, 等. 太平洋鳕ATG5基因的克隆及表达分析. 大连海洋大学学报, 2015, 30(5): 478-483] |
SUN J Q. Technique of tilapia sheath and tail white shrimp in saline water pond. Chinese Fisheries, 2018(12): 103-105 [孙家强. 盐碱水池塘罗非鱼套养脊尾白虾技术. 中国水产, 2018(12): 103-105] |
WANG J L, PANG Y Y, MA R, et al. Cloning of yak's (Bos grunniens) Atg5 and its expression in the main reproductive organs. Acta Theriologica Sinica, 2019, 39(5): 546-555 [王靖雷, 潘阳阳, 马睿, 等. 牦牛Atg5基因克隆及其在输卵管、卵巢和子宫中的表达定位. 兽类学报, 2019, 39(5): 546-555] |
WANG Y Z, CHEN Y, YU L. The discovery and research of autophagy. Chinese Journal of Biochemistry and Molecular Biology, 2018, 34(3): 229-239 [王懿峥, 陈扬, 俞立. 自噬的前世今生. 中国生物化学与分子生物学报, 2018, 34(3): 229-239] |
WANG Y, LI J, ZHANG Z, et al. Effects of pH stress on antioxidant system enzyme activities and gene expression of Fenneropenaeus chinensis. Progress in Fishery Sciences, 2013, 34(5): 43-50 [王芸, 李健, 张喆, 等. pH、氨氮胁迫对中国对虾HSP90基因表达的影响. 渔业科学进展, 2013, 34(5): 43-50 DOI:10.3969/j.issn.1000-7075.2013.05.007] |
WEI J, LONG L Y, YANG K, et al. Autophagy enforces functional integrity of regulatory T cells by coupling environmental cues and metabolic homeostasis. Nature Immunology, 2016, 17(3): 277-285 DOI:10.1038/ni.3365 |
WEI Y P. Systematic study of ATG genes in the regulation of yeast autophagy. Masterxs Thesis of Huazhong University of Science and Technology, 2016 [卫亚平. ATG基因调控酵母自噬的系统研究. 华中科技大学硕士研究生学位论文, 2016]
|
YANG W. Functional study on the involvement of Beclin-1, AMPKβ and Akirin in antibacterial immunity in Chinese mitten crab Eriocheir sinensis. Masterxs Thesis of Dalian Ocean University, 2019 [洋雯. Beclin-1、AMPKβ和Akirin参与中华绒螯蟹抗细菌免疫的功能研究. 大连海洋大学硕士研究生学位论文, 2019]
|
YANG Z G, ZHANG X D, TANG S L, et al. Research progress of autophagy on regulation of energy metabolism in tumor cells. Chinese Journal of Bases and Clinics in General Surgery, 2015, 22(12): 1525-1529 [杨照国, 张小东, 唐世磊, 等. 自噬对肿瘤细胞能量代谢调控的研究进展. 中国普外基础与临床杂志, 2015, 22(12): 1525-1529 DOI:10.7507/1007-9424.20150397] |
YAO Z L, WANG H, ZHOU K, et al. Effects of water carbonate alkalinity and pH on survival rate of post-larval Litopenaeus vannamei. Chinese Journal of Ecology, 2010(5): 945-950 [么宗利, 王慧, 周凯, 等. 碳酸盐碱度和pH值对凡纳滨对虾仔虾存活率的影响. 生态学杂志, 2010(5): 945-950] |
YAO Z L, YING C Q, ZHOU K, et al. Gene expression profiles of Litopenaeus vannamei in response to carbonate alkalinity stress. Journal of Fishery Sciences of China, 2012, 19(1): 1-12 [么宗利, 应成琦, 周凯, 等. 碳酸盐碱度胁迫下凡纳滨对虾基因的差异表达. 中国水产科学, 2012, 19(1): 1-12] |
ZHANG X M. Preliminary study on the cause and mechanism of white spot syndrome virus (WSSV) pathogenicity to Chinese mitten crab (Eriocheir sinensis). Masterxs Thesis of Shanghai Ocean University, 2018 [张小明. 白斑综合征病毒(WSSV)对中华绒螯蟹(Eriocheir sinensis)致病的原因及机制初步研究. 上海海洋大学硕士研究生学位论文, 2018]
|
ZHAO X Y, LI J, LI J T, et al. Effects of pH stress on non-specific immune factors and RNA/DNA ratio of Marsupenaeus japonicus. Progress in Fishery Sciences, 2011, 32(1): 60-66 [赵先银, 李健, 李吉涛, 等. pH胁迫对日本对虾非特异性免疫因子及RNA/DNA比值的影响. 渔业科学进展, 2011, 32(1): 60-66 DOI:10.3969/j.issn.1000-7075.2011.01.009] |



