2. 中国水产科学研究院珠江水产研究所农业农村部热带亚热带水产资源利用与养殖重点实验室 广东 广州 510380
2. Pearl River Fishery Research Institute, Chinese Academy of Fishery Sciences, Key Laboratory of Tropical & Subtropical Fishery Resource Application and Cultivation, Ministry of Agriculture and Rural Affairs, Guangzhou, Guangdong 510380, China
草鱼(Ctenopharyngodon idellus)为中国“四大家鱼”之一,广泛分布于我国淡水水域,具有生长快、饲料成本低、蛋白利用率高等优点(马贵华等, 2008)。草鱼是我国养殖产量最大的淡水鱼类,据《2020中国渔业统计年鉴》统计,2019年,我国草鱼总产量为553.30万t,占养殖淡水鱼总产量的21% (于秀娟等, 2020)。随着养殖产业化和集约化的快速发展,养殖草鱼因饲料的不均衡等因素的影响导致鱼体免疫力下降,在应激状态下易爆发一系列的疾病,包括草鱼出血病、肠炎、烂鳃和赤皮病等,对养殖生产造成严重的影响(陈继楚等, 2020)。鉴于国家对抗生素等药物滥用的控制,通过绿色饲料学途径提高草鱼机体抗病力是未来养殖产业发展的重要方向。
在自然环境中,草鱼生长到特定规格(5.5 cm左右)后就以各种草类作为食物的主要来源(He et al, 2015)。从进化的角度来看,青草类饲料应该是最符合草鱼营养需求且有益于草鱼机体健康的食物来源。然而,当前商用草鱼配合饲料中几乎不添加青草类饲料原料(叶元土等, 2013)。有研究表明,传统养殖模式中采用青饲料与配合饲料搭配投喂草鱼,显示出促草鱼生长、提高草鱼成活率、增加养殖经济效益等特点(张耀武等, 2007; 段小明等, 2008; 朱庆红等, 2009; 李建光等, 2012)。在其他鱼类中,如饲料中添加大蒜(Allium sativum L.)茎粉和牛至(Origanum vulgare L.)草粉能提高镜鲤(Cyprinus carpio)血清溶菌酶活性、C3和C4活性等非特异免疫性能(徐奇友等, 2010),基础饲料中添加7.5%杜仲(Eucommia ulmoides Oliver)叶粉能显著促进青鱼鱼种的生长性能,并提高免疫球蛋白M、补体C3等非特异免疫基因的表达(许友卿等, 2015)。这些结果提示,饲料中添加青草类饲料不仅有益于草食性鱼类,且对杂食性和肉食性鱼类免疫力的提升都有正面效果。推测与人摄食有益于健康的膳食纤维类似(刘劼等, 2020)。由此,在鱼饲料制作的过程中,应考虑青草类饲料的添加。另一方面,随着养殖产业的发展以及饲料用粮食的贸易风险,发展含青草类的草鱼饲料也是当前饲料产业的一个重要选择。然而,鉴于青草分为很多种类,产量、营养成分及饲料制作工艺也存在差异,很难判断哪种青草类饲料有益于鱼体健康并适用于鱼饲料中,因此,大量相关的评估工作亟待展开。
皇竹草(Pennisetum sinese Roxb)为多年生禾本科植物,由象草(Pennisetum purpereum)和美洲狼尾草(Pennisetum americanum×P. purpure)杂交选育而成,属四碳植物(夏先玖, 1999),具有产量高、竞争力强、易栽易管、生长快、抗逆性强和营养丰富等特点,广泛分布于热带与亚热带,在广东、广西、海南等地区产量较高(古辉辉等, 2019)。由于皇竹草叶质柔软,茎叶脆嫩多汁,适口性好,可用作多种动物(猪、牛、鸡、鹅、鱼等)的饲料,表现出较高的饲料利用率(于凌云等, 2013),是一种新型高效经济作物,被誉为“牧草之王”(唐式校等, 2006)。研究表明,皇竹草含19种氨基酸,其中,赖氨酸、矿物质和维生素等的含量较高,可以满足鱼类生长发育的需要(丁翠华, 2008; 吴斌等, 2018)。杨明富(2003)指出,不论是鲜草,还是青贮或风干加工成草粉,皇竹草都是饲养各种草食性鱼类的好饲料。本团队前期发现,单纯投喂皇竹草的草鱼具有出肉率高、体型好等优点(毛东东等, 2018)。在广东,已经有企业将皇竹草制成草粉在鱼饲料中添加,然而,皇竹草粉对草鱼的健康影响如何,目前还不明确。为此,本研究以草鱼幼鱼为研究对象,在半精制饲料的基础上评估皇竹草粉对草鱼的生长及健康的影响,重点关注抗氧化与肠道健康相关指标,为皇竹草粉作为水产类饲料原料的应用提供理论依据和基础数据。
1 材料与方法 1.1 实验饲料实验用皇竹草粉购自广东省江门市鹤山广佛饲料厂。参考Lovell (1989)中的饲料配方,以酪蛋白和明胶为蛋白源,鱼油和大豆油为脂肪源,设置3组蛋白质水平为33%、脂肪水平为9%的等氮等能半精制饲料。对照组(C)不做处理,处理组分别添加10%和20%皇竹草粉(P1和P2),每组添加0.1%二丁基羟基甲苯作为抗氧化剂(表 1)。饲料制备前先将饲料原料粉碎,过60目筛。按比例准确称取饲料原料,按照含量从小到大的原则逐级混合,然后再将脂肪源和水分别混入,搓匀。将混合均匀的原料用饲料制粒机挤压成2.0 mm粒径的颗粒饲料,在阴凉处风干后放在–20℃储存备用。
|
|
表 1 实验饲料组成及成分 Tab.1 Formulation and chemical composition of the experimental diets |
实验用鱼购自广东佛山市南海通威水产科技有限公司,养殖实验在中国水产科学研究院珠江水产研究所养殖基地进行。实验鱼先放于4.5 m×4.5 m×1.1 m的水泥池中暂养14 d,以对照组饲料对草鱼进行驯食。暂养结束后,挑选规格均一、体格健壮的草鱼198尾[(28.51±0.04) g]分配到9个养殖缸(1.2 m×0.6 m× 0.5 m)中,每个养殖鱼缸22尾。每组饲料随机投喂3个养殖缸,实验周期为56 d,每天08:30和16:30各投喂1次。养殖期间,饲喂采用饱食投喂,每天记录进食量、水温、天气和死亡情况,期间水体pH为6.5~7.8,溶氧量(DO)为5.7~7.6 mg/L,氨氮浓度≤0.20 mg/L,水温为28.0℃~33.0℃。
1.3 采样与处理养殖结束后停食24 h,对所有鱼进行采样。采样前先用MS222麻醉,进而测量体重和体长。从每个鱼缸中随机选取6尾草鱼,在工作台上,用1 mL无菌注射器从尾静脉取血,装于1.5 mL无菌离心管中,4℃静置过夜后3500 r/min离心10 min,吸取上清液,分装于1.5 mL无菌离心管中,并保存在–80℃冰箱,用于血清指标测定。另随机取9尾草鱼进行解剖。其中,中肠和肝脏迅速置于液氮中冻存,进而转移到–80℃超低温冰箱冷冻保存,用于肝脏生化指标测定和RNA提取。随机挑选3尾鱼采集长度约1 cm的中肠,固定于4%多聚甲醛溶液中,用于组织切片。实验鱼的增重率(weight gain rate, WGR, %)、成活率(survival rate, SR, %)、饲料系数(feed conversion ratio, FCR)、摄食率(feeding ratio, FR, %/d)计算公式如下:
| $ {\rm{WGR}}=100×(W_{t}–W_{0})/W_{0};$ |
| $ {\rm{SR}}=100×N_{t}/N_{0};$ |
| $ {\rm{FCR}}=F/(W_{t}–W_{0});$ |
| $ {\rm{FR}}=100×F/(W_{0}/2+W_{t/}2)/t;$ |
式中,W0为初始体重(g);Wt为终末体重(g);Nt为终末尾数;N0为初始尾数;F为摄入饲料总量(g);t为饲养天数(d)。
1.4 血清与肝脏生化指标和酶活性的测定血清中谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)、丙二醛(malondialdehyde, MAD)、补体3(complement 3, C3)、补体4(complement 4, C4)等指标测定使用试剂盒检测(南京建成生物科技有限公司),操作步骤均按照试剂盒说明书进行。
肝脏的鱼3–羟酰辅酶A脱氢酶(fish 3-hydroxyacyl- CoA dehydrogenase, HOAD)和鱼细胞色素C氧化酶(fish cytochrome c oxidase, COX)的测定使用试剂盒进行,并参照说明书进行具体操作。HOAD和COX试剂盒购于上海酶联生物有限公司。
1.5 组织切片将固定的肠道组织样品在自来水中洗涤12 h,然后在一系列梯度乙醇中进行脱水(30%、50%、70%、80%、90%、95%和100%两次)。根据先前描述的标准组织学技术,将样品在二甲苯中平衡并包埋在石蜡中(Yu et al, 2017)。用旋转切片机(莱卡RM2235,德国)切割为5 μm的切片。中肠肠道组织采用苏木精–伊红(hematoxylin- eosin staining, H & E)染色。使用立式显微镜(Leica biosystems, Wetzlar, 德国)观察组织学样品并拍照。
1.6 肠道组织免疫相关基因表达量测定 1.6.1 总RNA的提取中肠肠道组织总RNA采用TRIZOL试剂盒(TaKaRa, 日本)提取,并用1%琼脂糖变性胶来检测总RNA的提取质量和完整性。除去总RNA中的DNA后,利用PrimeScriptTM反转录试剂盒(TaKaRa, 日本),以1 μg总RNA为模板,37℃ 15 min,85℃反应5 s,4℃结束,反转录合成cDNA。cDNA保存在–20℃用于基因检测。
1.6.2 实时定量PCR实时荧光定量PCR(qRT-PCR)是通过LightCycler®96—TimePCR Detection System (Roche, 瑞士)来完成的,所用的qRT-PCR试剂是Power SYBR™Green PCR Master Mix (Thermo Scientific, 美国)。qRT-PCR反应的总体积为20 μL,包括:上下游引物各0.6 μL,1.0 μL稀释的第一链cDNA产物,10 μL 2×Power SYBR™Green PCR Master Mix和7.8 μL灭菌双蒸馏水。循环参数如下:50℃ 2 min,95℃ 2 min,然后95℃ 15 s,60℃ 1 min,40个循环。PCR反应后,熔解曲线为72℃~95℃的范围内进行分析(以1℃/20 s的步长)以确认单个产物。qRT-PCR中检测的基因的引物是通过已经发表的草鱼β-肌动蛋白(β-actin)、肿瘤坏死因子α (tnfα)和白细胞介素1β (il-1β)序列基础上设计的,由生工生物工程(上海)有限公司合成(表 2)。相关基因的相对表达水平是以β-actin基因的表达为参照,运用比较CT方法(2–ΔΔCt)计算基因表达值(Livaka et al, 2001)。所有的RNA样品都设置3个重复进行检测。
|
|
表 2 实时荧光定量PCR中基因的引物 Tab.2 Primers used in quantitative real-time PCR |
所有的数据以平均值±标准差(Mean±SD)表示,实验所获得各项数据采用SPSS 22.0软件进行单因素方差(one-way ANOVA)分析,差异显著时,采用Duncan’s进行多重比较,P < 0.05表示差异显著。
2 结果 2.1 饲料添加皇竹草粉对草鱼幼鱼生长性能及饲料利用的影响经56 d的养殖实验,饲料中添加皇竹草粉对草鱼生长性能的影响见表 3。结果显示,与对照组(C组)比较,10%皇竹草粉组(P1组)与20%皇竹草粉组(P2组)的增重率分别提高了10.85%和17.18% (P < 0.05),成活率提高了19.50%和23.69% (P < 0.05),饲料系数分别降低10.69%和12.07%,摄食率提高6.25%和4.86%,但均无显著性差异(P > 0.05)。
|
|
表 3 饲料中皇竹草粉对草鱼幼鱼生长和饲料利用的影响 Tab.3 Effects of diets supplemented with P. sinese Roxb meal on growth performance and feed utilization of juvenile grass carp (n=3) |
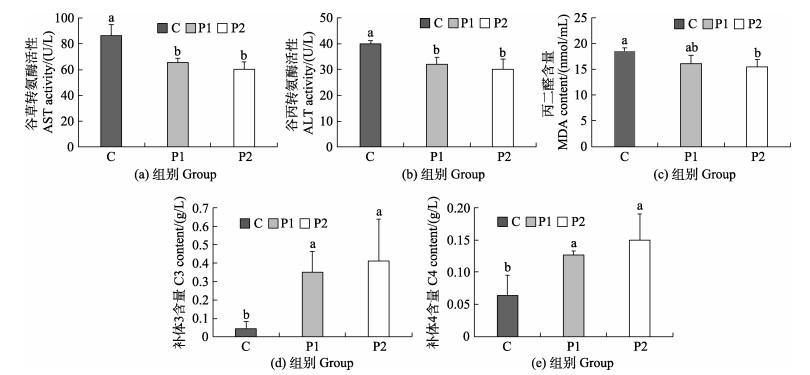
由图 1a、图 1b可知,饲料中添加皇竹草粉显著降低草鱼血清中AST和ALT的活性(P < 0.05)。P2组的MDA含量显著低于C组(P < 0.05)(图 1c)。P1组和P2组的补体C3和C4含量显著高于C组(P < 0.05) (图 1d、图 1e)。
|
图 1 饲料中添加皇竹草粉对草鱼幼鱼血清生理生化指标的影响(n=3) Fig.1 Effects of the diets supplemented with P. sinese Roxb meal on serum physiological and biochemical indexes of juvenile grass carp (n=3) 不同小写字母表示数据间有显著的统计学差异(P < 0.05);C:对照组;P1:10%皇竹草粉组;P2:20%皇竹草粉组,下同 Different lowercase letters indicate statistically significant differences between the data (P < 0.05); C: Control group; P1: 10% grass meal group; P2: 20% grass meal group, the same as below |
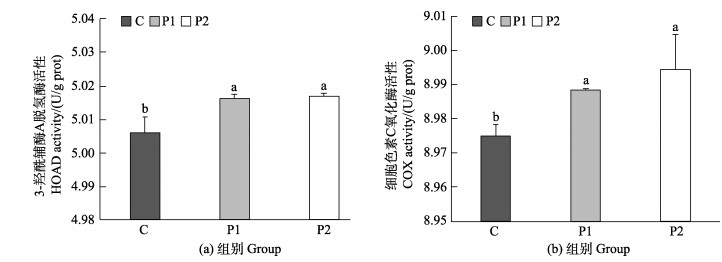
如图 2a、图 2b所示,与C组相比,P1和P2组显著增加了草鱼肝脏HOAD和COX的活性(P < 0.05)。
|
图 2 饲料中皇竹草粉对草鱼幼鱼肝脏生理生化指标的影响(n=3) Fig.2 Effects of the diets supplemented with P. sinese Roxb meal on liver physiological and biochemical indexes of juvenile grass carp (n=3) |
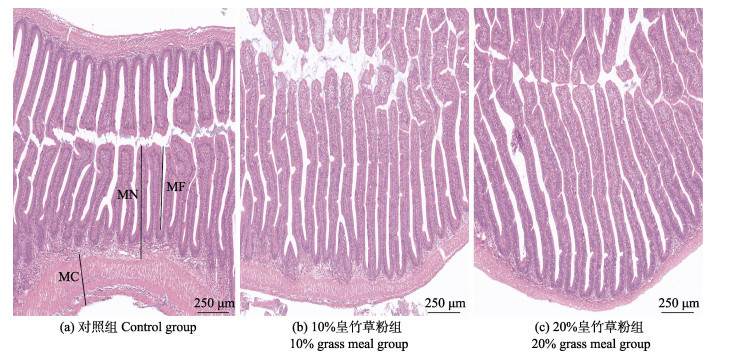
从肠道显微结构(图 3)中可以看出,相比对照组,饲料中添加皇竹草粉后促进了中肠肠道绒毛的发育,绒毛高度与皱褶深度有所增加,但肌层厚度有所下降。表 4显示,饲料中添加皇竹草粉显著提高草鱼幼鱼中肠肠道绒毛高度和皱褶深度,降低了肠道肌层厚度(P < 0.05)。
|
图 3 饲料中添加皇竹草粉后草鱼幼鱼肠道组织的显微结构(×100) Fig.3 Microstructure of the intestinal tissue of grass carp juveniles after adding P. sinese Roxb meal to the diets(×100) MN:绒毛高度;MF:皱褶深度;MC:肌层厚度 MN: Villus height; MF: Folds depth; MC: Muscle thickness |
|
|
表 4 饲料中皇竹草粉对草鱼幼鱼肠道形态学影响(n=3) Tab.4 Effects of diets supplemented with P. sinese Roxb meal on intestinal morphology of juvenile grass carp (n=3) |
饲料中添加皇竹草粉对草鱼中肠炎症相关基因表达的影响见图 4。与C组相比,P1组和P2组的促炎因子tnfα和il-1β的基因的相对表达水平显著降低(P < 0.05)。

|
图 4 饲料添加皇竹草粉对草鱼肠道组织免疫基因相对表达的影响(n=3) Fig.4 Effects of diets supplemented with P. sinese Roxb meal on the relative mRNA expression of the intestine in grass carp (n=3) |
本研究中饲料添加皇竹草粉提高了草鱼的生长性能,可能草鱼对植物性饲料原料有天然的需求。研究发现,饲喂植物性饵料浮萍(Lemna minor L.)的草鱼生长发育速度明显快于饲喂动物性饵料摇蚊幼虫(Chironomid)的草鱼(张杏波等, 2012)。黄飞等(2008)研究指出,草粉可促进肠道发育,降低肠道pH值,促进有益菌群的繁殖,这些有益菌能产生一系列有益于生长和健康的挥发性脂肪酸,如乙酸、丙酸和丁酸等。He等(2015)研究发现,草鱼在食性转变后(从肉食性转为植食性),肠道中丝氨酸蛋白、酸性葡聚糖、兴奋性氨基酸转运蛋白3等参与消化代谢的基因也显著增加。研究表明,青草类饲料对草鱼体内环境的改善间接提高了鱼体对饲料的利用率。在本研究中,草鱼在摄食添加皇竹草粉的饲料后对生长表现出了正向的效果,尽管本研究中也发现草鱼在摄食半精制饲料的过程中生长较为缓慢,针对皇竹草粉对草鱼生长的影响还需后期长时间饲喂实验或者在实用饲料中进行评估。
3.2 饲料添加皇竹草粉对草鱼幼鱼血清和肝脏生理生化指标的影响鱼类血液指标被广泛运用于评价鱼体健康状况、营养状况及对环境的适应状况等,是一种良好的生理、病理和毒理学指标(周玉等, 2001)。AST和ALT在血液中的活性通常被用来指示肝脏的健康程度(郭小泽, 2013)。本研究中,摄食添加皇竹草粉饲料的草鱼血清中的AST和ALT都显著低于对照组,说明皇竹草粉减少了草鱼肝细胞的损伤。类似的,草鱼在摄食苦草(Vallisneria natans)粉饲料后,血清中的AST活力也显著降低(黄仲园等, 2020),表明青草类饲料可能具有护肝的功效。这可能与肝脏脂肪含量有关,一般认为肝脏的脂肪含量和血清AST和ALT呈现正相关的关系(Tian et al, 2020)。本研究中,另外也检测了肝脏的脂肪含量,发现摄食皇竹草粉后草鱼肝脏的脂肪含量显著降低,一些与肥胖相关的肠道菌群明显下降(未发表资料),推测皇竹草粉改善了肠道微环境,降低了草鱼肝脏内脂肪的沉积,进而减少了肝细胞的损伤。与之对应的是,饲喂皇竹草粉后草鱼肝脏的HOAD和COX活性显著升高,这2种酶反映了细胞代谢的活力(Beenakkers et al, 1984; 曹玲芳等, 2013),侧面支持了皇竹草粉提高草鱼肝脏健康的作用。
本研究中,饲喂皇竹草粉提高了草鱼幼鱼的成活率,间接表明皇竹草粉可能提高了鱼体的抗病力。血液是机体免疫发生的主要内环境,作为补体激活经典途径的C4及补体激活替代途径的C3主要成分在血液免疫功能上发挥着重要作用(唐宏刚, 2008)。本研究中,皇竹草粉组草鱼C3和C4含量显著增高,显示饲料添加皇竹草粉一定程度增加草鱼的抗病菌的能力。与徐奇友等(2010)在鲤鱼(Cyprinus carpio)上的研究结果一致。一般认为,草粉饲料里富含多糖类物质,Chen等(2019)研究表明,饲料中添加多糖类饲料原料可以提高草鱼稚鱼血清中补体C3和C4含量,减少了细菌和病毒的感染。另一方面,抗氧化能力也是机体非特异免疫屏障中重要的一环,脂质,尤其是多不饱和脂肪酸易受氧自由基攻击,引起膜脂质的氧化损伤,进而损害细胞的生物膜。MDA是脂质过氧化损伤的最终代谢产物,间接反映了细胞损伤的程度(Zhou et al, 2003)。本研究中,与C组相比较,P1组和P2组血清中MDA的含量都降低,表明饲料中添加皇竹草粉可能降低了鱼体内部的氧化应激反应。在黄河鲤(Cyprinus carpio-haematopterus)中的研究发现,苜蓿草(Medicago sativa L.)粉也能够降低MDA含量(王成章等, 2008)。草粉类物质中富含胡萝卜素、硒和多种维生素(包括维生素C和维生素E)等,这些物质在提高机体抗氧化能力、消除自由基等方面均有积极的效果(史莹华等, 2011)。氧化应激是很多应激损伤的本质所在,也是众多病害发生的病理生理基础(Lushchak, 2011)。本研究中,添加皇竹草粉后减缓的氧化应激可能是草鱼生长增加和免疫性能提升的原因之一(Fast et al, 2008)。
3.3 饲料添加皇竹草粉对草鱼幼鱼肠道结构和基因表达的影响肠道绒毛高度、皱褶深度、肌层厚度是衡量肠道消化、吸收和肠道健康的重要指标(张敏等, 2009)。本研究发现,饲料中添加皇竹草粉提高了草鱼幼鱼肠道的绒毛高度和皱褶深度,但降低了肌层厚度。目前,较少的研究指出草粉在鱼类肠道组织学的影响,但在肉鸡(Gallus gallus domesticus)中发现,饲喂苜蓿草粉增加了肠绒毛的高度和肌层厚度(徐珊珊, 2013)。较长的绒毛能够在肠腔中充分延伸,保证绒毛与食糜间的充分接触,是提高消化吸收效率的结构保障(刘敏, 2009)。肌层厚度上升会造成鱼类肠内膜面积变小,降低鱼类对营养物质的消化吸收能力(姚浪群等, 2003)。推测肠绒毛高度的增加以及肌层厚度的降低是肠道对于更多营养物质吸收的适应性结果。另外,有益肠道菌群产生的短链脂肪酸也在促进肠道发育过程中起到重要作用(余荣等, 2012)。本研究是采用等氮等能的饲料配方,在此机制下草鱼在饲喂皇竹草粉后肠道对营养物质的吸收总量可能有所增强,有利于提高饲料的消化率,与本研究中饲料系数的变化趋势相符。
除了消化和吸收营养素,肠道还扮演阻断肠道内共生微生物屏障的作用(Patankar et al, 2020)。当肠道损伤、肠道微生物失衡或者病原菌入侵,均会造成肠道炎症,造成机体的不健康状态,增加死亡率。肿瘤坏死因子(tnf-α)是机体在病原体入侵时,由激活的巨噬细胞、淋巴细胞以及其他免疫细胞产生的促炎细胞因子,在抵抗细菌、病毒和寄生虫感染的过程中发挥重要介质的作用(Horiuchi et al, 2010)。白细胞介素1β (il-1β)是一种由单核细胞、巨噬细胞、朗氏细胞等多种细胞产生的一种重要的促炎细胞因子,在炎症过程中起着重要的作用(Bird et al, 2002)。鱼类肠道中这2个细胞因子的表达量与肠炎密切相关(Liu et al, 2018; 胡鹏莉等, 2019)。本研究结果显示,饲料中添加皇竹草粉下调了促炎细胞因子mRNA的相对表达水平,可能一定程度缓解肠道炎症反应对组织的损害。在哺乳动物中,增加膳食纤维能够缓解肠道炎症,Singh等(2019)研究表明,纤维类食物主要通过改变肠道菌群的组成以及它们的代谢产物丁酸来调控肠道炎症。此外,Zhou等(2020)研究指出,气单胞菌属(Aeromonas)是一类条件致病菌,往往造成草鱼的肠道炎症。同时,Blumberg等(2012)研究指出,厚壁菌门(Firmicutes)细菌减少是肠道炎症的主要表现之一。本研究还对摄食皇竹草粉饲料肠道菌群分析,发现厚壁菌门和气单胞菌属的丰度在皇竹草粉组显著降低,拟杆菌门(Bacteroidetes)的丰度显著上调(未发表资料),暗示皇竹草粉可能通过调节肠道菌群的组成,进而影响了肠道炎症的状态。
综上所述,本研究探讨了饲料添加皇竹草粉对草鱼生长、免疫、抗氧化和肠道健康的影响。研究发现,饲料中添加10%和20%的皇竹草粉能够显著促进草鱼的生长、提高鱼体非特异免疫力、降低氧化应激以及改善肠道炎症状况等。研究结果可为生产实践中皇竹草作为一种新型的饲料原料的应用提供理论依据和基础数据。
BEENAKKERS A M, VAN DER HORST D J, VAN MARREWIJK W J A. Insect flight muscle metabolism. Insect Biochemistry, 1984, 14(3): 243-260 DOI:10.1016/0020-1790(84)90057-X |
BIRD S, ZOU J, WANG T H, et al. Evolution of interleukin-1β. Cytokine and Growth Factor Reviews, 2002, 13(6): 483-502 DOI:10.1016/S1359-6101(02)00028-X |
BLUMBERG R, POWRIE F. Microbiota, disease, and back to health: A metastable journey. Science Translational Medicine, 2012, 4(137): 137 |
CAO L F, LI Y F, HE R R, et al. Regulation function of cytochrome C oxidase on aging: Research advances. Journal of International Pharmaceutical Research, 2013, 40(6): 751-756 [曹玲芳, 李怡芳, 何蓉蓉, 等. 细胞色素c氧化酶对衰老调控作用的研究进展. 国际药学研究杂志, 2013, 40(6): 751-756] |
CHEN J C, CHEN C X, WANG X M, et al. Research progress of grass carp immune genes. Jiangsu Agricultural Sciences, 2020, 48(2): 46-51 [陈继楚, 陈成勋, 王晓梅, 等. 草鱼免疫基因研究进展. 江苏农业科学, 2020, 48(2): 46-51] |
CHEN L, ZHANG Y P. The growth performance and nonspecific immunity of juvenile grass carp (Ctenopharyngodon idella) affected by dietary Porphyra yezoensis polysaccharide supplementation. Fish and Shellfish Immunology, 2019, 87: 615-619 DOI:10.1016/j.fsi.2019.02.013 |
DING C H. Characteristics and comprehensive utilization of Pennisetum hydridum. Modernizing Agriculture, 2008(12): 33-34 [丁翠华. 皇竹草特性及综合开发利用. 现代化农业, 2008(12): 33-34 DOI:10.3969/j.issn.1001-0254.2008.12.003] |
DUAN X M, CHEN S Q, PENG S Z. Comparative experiment on the benefits of green fodder and pelleted fodder for breeding grass carp. Current Fisheries, 2008, 33(1): 21-22 [段小明, 陈世琪, 彭双智. 青饲料和颗粒饲料养殖草鱼效益对比试验. 内陆水产, 2008, 33(1): 21-22 DOI:10.3969/j.issn.1674-9049.2008.01.017] |
FAST M D, HOSOYA S, JOHNSON S C, et al. Cortisol response and immune-related effects of Atlantic salmon (Salmo salar Linnaeus) subjected to short- and long-term stress. Fish and Shellfish Immunology, 2008, 24(2): 194-204 DOI:10.1016/j.fsi.2007.10.009 |
GU H H, XU H P, ZHENG J Y, et al. Effects of different additives on the fermentation quality of Pennisetum sinese Roxb silage. Guangdong Feed, 2019, 29(3): 22-23 [古辉辉, 许萍好, 郑洁怡, 等. 不同添加剂对皇竹草青贮发酵品质的影响. 广东饲料, 2019, 29(3): 22-23] |
GUO X Z. Effect of dietary non-protein energy sources on fat deposition and lipid metabolism of grass carp (Ctenopharyngodon idellus). Master's Thesis of Huazhong Agricultural University, 2013 [郭小泽. 饲料中非蛋白能量源对草鱼脂肪蓄积及脂肪代谢的影响研究. 华中农业大学硕士研究生学位论文, 2013]
|
HE S, LIANG X F, LI L, et al. Transcriptome analysis of food habit transition from carnivory to herbivory in a typical vertebrate herbivore, grass carp Ctenopharyngodon idella. BMC Genomics, 2015, 16(1): 1-14 DOI:10.1186/1471-2164-16-1 |
HORIUCHI T, MITOMA H, HARASHIMA S, et al. Transmembrane TNF-alpha: Structure, function and interaction with anti-TNF agents. Rheumatology, 2010, 49(7): 1215-1228 DOI:10.1093/rheumatology/keq031 |
HU P L, WU R, LU K L, et al. Effects of replacing fish meal with composite protein on growth, diet digestibility, and gut health in Japanese seabass (Lateolabrax maculatus). Progress in Fishery Sciences, 2019, 40(6): 56-65 [胡鹏莉, 吴瑞, 鲁康乐, 等. 复合蛋白替代鱼粉对花鲈生长、消化能力和肠道健康的影响. 渔业科学进展, 2019, 40(6): 56-65] |
HUANG F, ZHOU Z Y. The effect of alfalfa meal on the performance of growing pigs and immune function. Journal of Shaoguan University, 2008, 29(6): 88-90 [黄飞, 周志远. 苜蓿草粉对生长猪生产性能和免疫功能的影响. 韶关学院学报, 2008, 29(6): 88-90 DOI:10.3969/j.issn.1007-5348.2008.06.022] |
HUANG Z Y, HE W H, PENG Z R, et al. Effects of adding Vallisneria natans meal to diet on growth performance, physiological and biochemical properties of juvenile grass carps (Ctenopharyngodon idellus). Progress in Fishery Sciences, 2020, 41(1): 169-177 [黄仲园, 何文辉, 彭自然, 等. 苦草粉对草鱼幼鱼生长性能与生理生化性能的影响. 渔业科学进展, 2020, 41(1): 169-177] |
LI J G, LIU H Z, YANG X, et al. Cultivation of grass carp species with fine green material in pond. Guizhou Animal Science and Veterinary Medicine, 2012, 36(1): 66 [李建光, 刘化铸, 杨兴, 等. 池塘精青料混合培育草鱼种. 贵州畜牧兽医, 2012, 36(1): 66 DOI:10.3969/j.issn.1007-1474.2012.01.034] |
LIU H X, ZHOU X Q, JIANG W D, et al. Optimal α-lipoic acid strengthen immunity of young grass carp (Ctenopharyngodon idella) by enhancing immune function of head kidney, spleen and skin. Fish and Shellfish Immunology, 2018, 80: 600-617 DOI:10.1016/j.fsi.2018.06.057 |
LIU J, YAN D Q, LIU J. Dietary fiber—The guardian of human health. Modern Food, 2020(1): 113-115 [刘劼, 严冬青, 刘健. 膳食纤维—人类的健康卫士. 现代食品, 2020(1): 113-115] |
LIU M. Study on the histology and histochemistry of digestive tract in Brachymystax lenok larvae. Master's Thesis of Northeast Agricultural University, 2009 [刘敏. 细鳞鱼稚鱼消化道组织学与组织化学研究. 东北农业大学硕士研究生学位论文, 2009]
|
LIVAKA K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2−ΔΔCT method. Methods, 2001, 25(4): 402-408 DOI:10.1006/meth.2001.1262 |
LOVELL T. Nutrition and feeding of fish. New York: Van Nostrand Reinhold, 1999
|
LUSHCHAK V I. Environmentally induced oxidative stress in aquatic animals. Aquatic Toxicology, 2011, 101(1): 13-30 DOI:10.1016/j.aquatox.2010.10.006 |
MA G H, CHEN D Y, LIU L Y, et al. The study situation of the immunology of grass carp's toxic bleeding disease. Fishery Modernization, 2008, 35(1): 45-49 [马贵华, 陈道印, 刘六英, 等. 草鱼出血病的免疫学研究进展. 渔业现代化, 2008, 35(1): 45-49] |
MAO D D, ZHANG K, OU H X, et al. Effects of hybrid giant napier Pennisetum sinese Roxb and formulated feed on growth and nutrient compositions in muscle of grass carp Ctenopharyngodon idellus. Journal of Dalian Fisheries University, 2018, 33(1): 7-13 [毛东东, 张凯, 欧红霞, 等. 投喂皇竹草和配合饲料对草鱼生长及肌肉营养成分的影响. 大连海洋大学学报, 2018, 33(1): 7-13] |
PATANKAR J V, BECKER C. Cell death in the gut epithelium and implications for chronic inflammation. Nature Reviews Gastroenterology and Hepatology, 2020, 17(9): 543-556 DOI:10.1038/s41575-020-0326-4 |
SHI Y H, WANG C Z, CHEN M L, et al. Effects of alfalfa hay meal on growth performance, antioxidant and immune values of Sichuan white geese. Pratacultural Science, 2011, 28(5): 841-847 [史莹华, 王成章, 陈明亮, 等. 苜蓿草粉对四川白鹅生长性能及抗氧化和免疫指标的影响. 草业科学, 2011, 28(5): 841-847 DOI:10.3969/j.issn.1001-0629.2011.05.025] |
SINGH V, YEOH B S, WALKER R E, et al. Microbiota fermentation-NLRP3 axis shapes the impact of dietary fibres on intestinal inflammation. Gut, 2019, 68(10): 1801-1812 DOI:10.1136/gutjnl-2018-316250 |
TANG H G. Effects of fish protein hydrolysate on growth and metabolism, muscle quality, immunity and antioxidant properties of Larimichthys crocea. Master's Thesis of Zhejiang University, 2008 [唐宏刚. 鱼蛋白水解物对大黄鱼生长代谢、肌肉品质、免疫及抗氧化性能的影响. 浙江大学硕士研究生学位论文, 2008]
|
TANG S X, LU Y C, WANG Y L, et al. The feeding characteristics of "King of Pasture" Pennisetum sinese Roxb. Animal Husbandry and Veterinary Medicine, 2006(10): 61 [唐式校, 陆玉春, 王寅雷, 等. "牧草之王"皇竹草的饲用特点. 畜牧与兽医, 2006(10): 61] |
TIAN J J, FU B, YU E M, et al. Feeding faba beans (Vicia faba L.) reduces myocyte metabolic activity in grass carp (Ctenopharyngodon idellus). Frontiers in Physiology, 2020, 11: 391 DOI:10.3389/fphys.2020.00391 |
WANG C Z, HE Y, SHI Y H, et al. Effect of adding alfalfa meal in diet on antioxidant function and lipid metabolism of Cyprinus carpio-haematopterus. Acta Prataculturae Sinica, 2008, 17(4): 141-148 [王成章, 何云, 史莹华, 等. 饲粮中添加苜蓿草粉对黄河鲤鱼抗氧化性能及脂质代谢的影响. 草业学报, 2008, 17(4): 141-148] |
WU B, HE G, WANG Q P, et al. The key technologies and typical cases of the "Pennisetum sinese Roxb+grass carp+ micro-flowing water" model. Fishery Guide to Be Rich, 2018(11): 31-34 [吴斌, 贺刚, 王庆萍, 等. "皇竹草+草鱼+ 微流水"模式的关键技术及典型案例. 渔业致富指南, 2018(11): 31-34] |
XIA X J. Summary of high-quality and high-yielding forage grass. Sichuan Grassland, 1999(3): 15-17 [夏先玖. 优质高产牧草皇竹草综述. 四川草原, 1999(3): 15-17] |
XU J Y, TANG L, WANG C A, et al. Effects of garlic stem powder and oregano leaf powder on antioxidant capacity, non-specific immune performance and meat quality of the carp (Cyprinus specularis). Acta Agriculturae Boreali-Sinica, 2010, 25(z2): 133-139 [徐奇友, 唐玲, 王常安, 等. 大蒜茎粉和牛至草粉对镜鲤抗氧化, 非特异免疫以及肌肉品质的影响. 华北农学报, 2010, 25(z2): 133-139] |
XU S S. Effect of alfalfa meal on production performance and intestional development of broilers. Master's Thesis of Jilin Agricultural University, 2013 [徐珊珊. 饲喂苜蓿草粉对肉鸡生产性能及肠道发育的影响. 吉林农业大学硕士研究生学位论文, 2013]
|
XU Y Q, ZHANG Q H, LI Y H, et al. Effects of dietary Eucommia ulmoides Oliver leaf powder on the growth performance and expression of immunity related genes in Mylopharyngodon piceus. Research of Agricultural Modernization, 2015, 36(6): 1074-1079 [许友卿, 张青红, 李颖慧, 等. 饲料中添加杜仲叶粉对青鱼生长和组织免疫相关基因表达的影响研究. 农业现代化研究, 2015, 36(6): 1074-1079] |
YANG M F. High quality hybrid pasture—Pennisetum sinese Roxb—a brief introduction to the development prospects and key cultivation techniques of Pennisetum sinese Roxb. Applicable Technologies for Rural Areas, 2003(1): 20-21 [杨明富. 优质杂交牧草—皇竹草—皇竹草的开发前景及栽培技术要点简介. 农村实用技术, 2003(1): 20-21] |
YAO L Q, SA R N, TONG J M, et al. Effect of apramycin on intestinal flora and intestinal morphology of piglets. Acta Veterinaria et Zootechnica Sinica, 2003, 34(3): 250-257 [姚浪群, 萨仁娜, 佟建明, 等. 安普霉素对仔猪肠道微生物及肠壁组织结构的影响. 畜牧兽医学报, 2003, 34(3): 250-257] |
YE Y T, CAI C F, ZHANG B T, et al. Fish nutrition and feed preparation. Beijing: Chemical Industry Press, 2013 [叶元土, 蔡春芳, 张宝彤, 等. 鱼类营养与饲料配制. 北京: 化学工业出版社, 2013]
|
YU E M, ZHANG H F, LI Z F, et al. Proteomic signature of muscle fibre hyperplasia in response to faba bean intake in grass carp. Scientific Reports, 2017, 7: 45950 |
YU L Y, BAI J J, LIU B H, et al. Analysis of nutrition composition of hybrid giant napier and artificial feed and evaluation of the effect of weight gain in two-month-old grass carp. Journal of Anhui Agricultural Sciences, 2013, 41(28): 11388-11389 [于凌云, 白俊杰, 刘邦辉, 等. 皇竹草和人工配合饲料营养成分分析及其对2月龄草鱼的增重效果. 安徽农业科学, 2013, 41(28): 11388-11389] |
YU R, XU X F, WANG W X. Research progress on the effects of butyric acid on animal intestines. Chinese Journal of Animal Science, 2012, 48(16): 64-68 [余荣, 徐小芳, 王雯熙. 丁酸对动物肠道影响的研究进展. 中国畜牧杂志, 2012, 48(16): 64-68] |
YU X J, XU L J, WU F X. China fishery statistical yearbook. Beijing: China Agriculture Press, 2020 [于秀娟, 徐乐俊, 吴反修. 中国渔业统计年鉴. 北京: 中国农业出版社, 2020]
|
ZHANG M, ZOU X T, SUN Y L. Supplement of glutamine on growth performance and intestinal mucosae development in avian broilers. Chinese Journal of Animal Science, 2009, 45(9): 32-36 [张敏, 邹晓庭, 孙雅丽. 外源性谷氨酰胺对艾维茵肉仔鸡生长性能和小肠发育的影响. 中国畜牧杂志, 2009, 45(9): 32-36] |
ZHANG X B, LIANG X F, ZHU T, et al. The digestive tube development and the activity distribution of three kinds of digestive enzymesof Ctenopharyngodon idellus fed on different diets. Acta Hydrobiologica Sinica, 2012, 36(3): 569-572 [张杏波, 梁旭方, 朱滔, 等. 食性对草鱼消化道发育及三种消化酶活性的影响. 水生生物学报, 2012, 36(3): 569-572] |
ZHANG Y W, CHEN W G. Effects of different feeds on the main grass carp pond. Scientific Fish Farming, 2007(2): 65-66 [张耀武, 陈万光. 不同饲料对主养草鱼池塘的效果试验. 科学养鱼, 2007(2): 65-66] |
ZHOU J F, CAI D, TONG G Z. Oxidative stress and potential free radical damage associated with photocopying. A role for ozone?. Free Radical Research, 2003, 37(2): 137-143 |
ZHOU L, WEI J F, LIN K T, et al. Intestinal microbial profiling of grass carp (Ctenopharyngodon idellus) challenged with Aeromonas hydrophila. Aquaculture, 2020, 524: 735292 |
ZHOU Y, GUO W C, YANG Z G, et al. Advances in the study of haemotological indices of fish. Journal of Shanghai Fisheries University, 2001, 10(2): 163-165 [周玉, 郭文场, 杨振国, 等. 鱼类血液学指标研究的进展. 上海水产大学学报, 2001, 10(2): 163-165] |
ZHU Q H, LI L. High-yield experiment of cultivating grass carp species with compound feed and duckweed. Journal of Anhui Agricultural Sciences, 2009, 37(16): 7493-7494, 7511 [朱庆红, 李莉. 配合饲料搭配浮萍培育草鱼种高产试验. 安徽农业科学, 2009, 37(16): 7493-7494, 7511] |



