翘嘴鳜(Siniperca chuatsi)隶属鲈形目(Perciformes)、
嗜水气单胞菌广泛分布于各种淡水水域,宿主范围十分广泛,是淡水鱼类最为常见的重要病原菌(秦莉等, 2014),也是一种典型的人–兽–鱼共染的病原菌(王艺等, 2019),可引起人胃肠道感染、胃肠道外感染及败血症等(张曼等, 2020; 李小艳等, 2020)。该菌对鳜鱼的危害颇为严重,感染后可引起肝、脾、肾等组织产生免疫反应,以抵御细菌感染。头肾作为鱼类重要的造血器官和免疫器官,其中的巨噬细胞与B淋巴细胞共同介导和参与免疫反应,维护鱼类的机体健康(田敬云等, 2005)。高通量测序技术(RNA-seq)能获得特定条件下生物体细胞或组织的所有转录本信息(曹梅等, 2021),被广泛应用于分析病菌感染宿主后的免疫应答。嗜水气单胞菌是危害鳜鱼养殖生产的主要病原,该菌感染鳜鱼引起的免疫反应却少有报道。因此,本研究利用RNA-seq技术对嗜水气单胞菌感染翘嘴鳜后进行转录组分析,筛选翘嘴鳜免疫相关的差异表达基因,开展GO (gene ontology)分子功能注释和KEGG通路富集分析,并利用实时荧光定量PCR (qRT-PCR)技术对随机选取的IL-6等7个与免疫相关的差异表达基因(DEGs)进行相对定量分析,以期获得可能参与免疫反应的候选基因和调控通路,从而为解析翘嘴鳜免疫应答提供理论参考。
1 材料与方法 1.1 实验鳜鱼与菌株健康翘嘴鳜由江苏扬州市董氏特种水产有限公司提供,体重为(130±5) g。实验前,于水温为(26±2)℃的淡水循环养殖系统中暂养1周,以适应实验环境。
实验用嗜水气单胞菌G3菌株分离于发病翘嘴鳜,由本实验室保存(张悦等, 2017)。实验挑取纯培养菌株接种于LB培养液培养16 h,5000 r/min离心10 min,弃上清液,用pH 7.2的无菌PBS缓冲液重悬菌体,并将菌悬液浓度调至2.3×106 CFU/mL。
1.2 人工感染实验将健康的翘嘴鳜分为感染组与对照组。感染组每尾腹腔注射100 μL嗜水气单胞菌悬浮液,对照组按同样方式和剂量注射无菌PBS缓冲液。注射24 h后,每组随机挑选3尾,取出头肾组织,于液氮中备用。
1.3 RNA提取、cDNA文库构建和转录组测序采用Trizol法提取感染组与对照组翘嘴鳜头肾组织总RNA,设置3个重复,RNA样品使用DNaseⅠ去除基因组DNA。用1%琼脂糖凝胶初步评价RNA质量,并分别使用NanoPhotometer®分光光度计、Agilent 2100生物分析仪进行RNA的纯度、浓度及完整性检测。使用poly-Toligo-attached磁珠纯化mRNA,并利用随机引物和反转录酶合成第1条cDNA;第2条cDNA由DNA聚合酶Ⅰ、RNase H、dNTPs合成;cDNA片段通过AMPure XP系统进行纯化,PCR扩增获得cDNA文库;最后,在Illumina Hiseq 2000平台上测序。
1.4 转录组denovo组装和基因注释将Illumina Hiseq高通量测序平台测得的原始数据去除接头(adapter)、包含ploy-N和低质量reads质控后,用软件Trinity (http://trinityrnaseq.sourceforge.net/)进行序列拼接得到unigene,使用BLAST算法(E-value < 10–5)对组装的Unigene序列进行遗传相似性比较,以进行蛋白质功能注释,包括GO、COG (clusters of orthologous groups)、KOG (eukaryotic orthologous groups)、KEGG (kyoto encyclopedia of genes and genomes)、Nr (non-redundant)、Swiss-Prot、Pfam和EggNOG (evolutionary genealogy of genes: non- supervised orthologous groups)数据库。
1.5 基因差异表达分析通过DESeq软件对测序数据进行比对分析,并将错误发现率(false discovery rate,FDR)作为筛选差异表达基因(DEGs)的指标,筛选的标准是Fold Change≥2且FDR < 0.01,将筛选出的DEG通过GO数据库进行Pathway注释并筛选富集GO条目和Pathway显著性筛选。
1.6 荧光定量PCR验证利用qRT-PCR检测7个选择的免疫相关基因,以进一步验证转录组测序的准确性。采用Primer Premier 5设计特异性引物并合成,引物序列见表 1。qRT-PCR反应体系共20 μL,其中,正反向引物(10 μmol/L) 各0.4 μL、2×SuperMix 10 μL、ddH2O 8.2 μL、稀释的cDNA模板1 μL。反应程序:94℃,5 min;94℃,10 s;60℃,30 s;72℃,15 s,共40个循环。以β-actin为内参基因,用2–∆∆Ct法计算基因的相对表达量。
|
|
表 1 qRT-PCR所用引物 Tab.1 Primers for qRT-PCR |
利用Illumina HiSeq 2000对翘嘴鳜头肾组织进行测序,拼接共获得53 040个的unigene,平均长度为1236 bp,N50为2319 bp,长度为300~500 bp的unigenes有21 667个,约为全部unigenes的40.85%。GC含量区间为48.23%~50.59%,Q30≥93.87% (表 2)。测序数据与拼接结果比对显示,6个样本中能定位到组装转录本上的clean reads所占的百分比在71.86%~ 77.44%之间。
|
|
表 2 样品测序数据与组装结果统计 Tab.2 Summary of sequencing and transcriptome assembly |
将unigene与GO、COG、KOG、KEGG、Nr、Swiss-Prot、Pfam和EggNOG共8个数据库进行比对并注释,共有21 693条unigene被注释(表 3)。
|
|
表 3 Unigene注释统计 Tab.3 Summary of unigenes annotation |
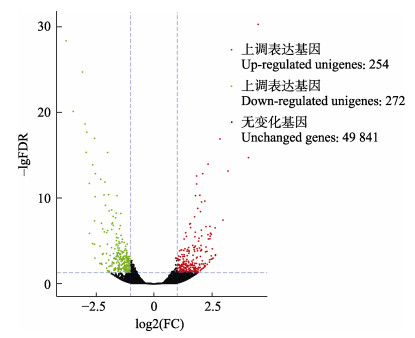
翘嘴鳜感染嗜水气单胞菌24 h后的头肾组织的转录组文库与对照组比较分析。结果显示,翘嘴鳜头肾组织差异表达基因(DEGs)有526个,其中,差异表达上调基因有254个,差异表达下调基因有272个(图 1)。此外,翘嘴鳜感染嗜水气单胞菌后免疫相关的主要差异表达基因显示,上调表达的基因主要有炎症和免疫原性细胞因子白介素(IL-8、IL-6、IL-17)、补体系统(CR1)、MHCⅠ型抗原提呈(MHCⅠ)、抗菌肽溶菌酶(Lys)、丝氨酸蛋白酶抑制因子(Serpin)、泛素蛋白连接酶(E3)等(表 4),说明这些免疫相关基因参与到抵抗嗜水气单胞菌入侵的途径中,对翘嘴鳜起到免疫保护作用。
|
图 1 对照组和实验组差异表达基因火山图 Fig.1 Volcano plot of differentially expressed genes comparing control and infection groups x轴表示fold change,y轴表示差异表达的显著性。 The x-axis represents fold change, the y-axis indicates significance of differential expression. |
|
|
表 4 感染嗜水气单胞菌后差异表达的上调的主要免疫相关基因 Tab.4 Up-regulated immune-related DEGs after A. hydrophila infection |
为进一步探究病原嗜水气单胞菌感染翘嘴鳜后差异表达基因的功能,对差异表达基因进行GO功能注释(图 2)。显著富集GO条目主要涉及生物学过程(biological process, BP)、细胞组分(cellular component, CC)和分子功能(molecular function, MF),分别为22、17和23个。细胞组分富集最显著的为细胞、细胞组分、生物膜和生物膜组分;分子功能类富集最显著的为结合和催化活性;生物学过程类富集最显著的为细胞过程和单个有机体过程。此外,大量差异表达基因富集至与免疫相关的条目,如免疫系统过程、对刺激的反应、抗氧化活性等。

|
图 2 嗜水气单胞菌感染翘嘴鳜实验组与对照组表达差异基因GO分析 Fig.2 GO enrichment analysis of the differential expression genes between the infection and control groups |
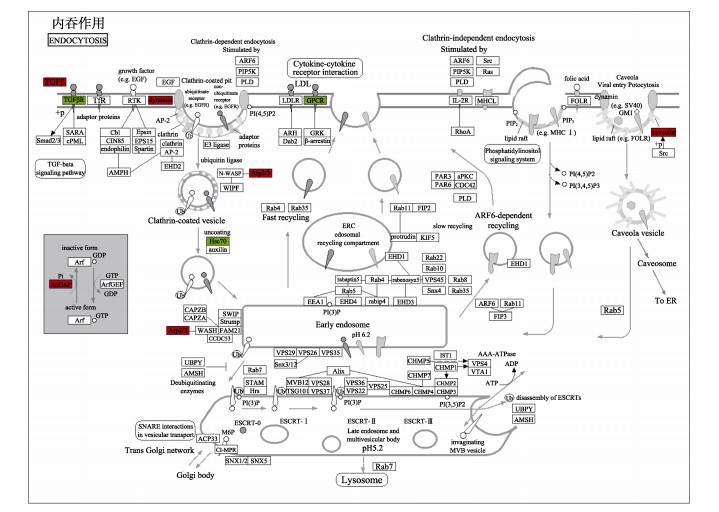
共富集到89个代谢通路,选取前20位显著富集通路进行KEGG富集分析,发现与免疫相关的代谢通路主要有内吞作用(endocytosis)、吞噬体(phagosome)、TGF-beta信号通路(TGF-beta signaling pathway)、NOD样受体信号通路(NOD-like receptor signaling pathway)等(图 3)。内吞作用代谢通路如图 4所示,表明嗜水气单胞菌感染翘嘴鳜后引起TGFβ、dynamin、ArfGAP、Arp2/3和caveolin等参与内吞作用的相关基因显著上调,而TGFβR、GPCR和Hsc70等参与内吞作用的相关基因显著下调;吞噬体代谢通路(图 5)表明,嗜水气单胞菌感染翘嘴鳜后引起avβ3、MR和TUBB等参与吞噬作用的相关基因显著上调,而IG和CALR等参与吞噬作用的相关基因显著下调。

|
图 3 嗜水气单胞菌感染翘嘴鳜实验组与对照组表达差异基因KEGG通路富集分析 Fig.3 KEGG pathway enrichment analysis of the differential expression genes between the infection and control groups 图中每个圆表示1个KEGG通路。 Circle in the figure represents a KEGG pathway. |
|
图 4 内吞作用的信号通路 Fig.4 Pathway map of the endocytosis pathway in KEGG 基因表达上调和下调分别用红色和绿色方框表示,下同。 The red boxes represent genes up-regulating, the green boxes represent genes down-regulating. The same as below. |

|
图 5 吞噬体的信号通路 Fig.5 Pathway map of the phagosome pathway in KEGG |
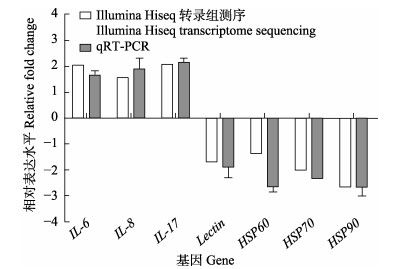
为了进一步验证RNA-seq数据的准确性,选择免疫相关基因IL-6、IL-8、IL-17、Lectin、HSP60、HSP70和HSP90进行qRT-PCR分析。结果显示,翘嘴鳜感染嗜水气单胞菌24 h后,免疫相关基因的荧光定量表达结果与转录组测序结果一致(图 6),此结果验证了转录组测序数据的可靠性。
|
图 6 嗜水气单胞菌感染翘嘴鳜后差异表达基因qRT-PCR分析 Fig.6 Comparative analysis of qRT-PCR of differentially expressed genes of S. chuatsi infected with A. hydrophila |
翘嘴鳜在养殖过程中遭受多种病原的感染,其中,嗜水气单胞菌感染会造成翘嘴鳜出血性败血症,严重损伤肾脏、肝脏及脾脏等组织,造成坏死和解体等病理变化(Chen et al, 2018)。本研究通过对嗜水气单胞菌感染翘嘴鳜头肾组织的转录本进行分析,挖掘免疫应答基因,为揭示翘嘴鳜抗嗜水气单胞菌感染的分子机制提供理论依据。目前,高通量测序技术在嗜水气单胞菌感染水产养殖动物后的宿主免疫反应研究中得到了广泛应用。Xu等(2021)利用高通量测序技术比较了嗜水气单胞菌感染和未感染的黄鳝(Monopterus albus)脾脏组织中基因表达差异,其中,上调表达基因有928个,下调表达基因有573个。Yuan等(2021)利用高通量测序技术比较了嗜水气单胞菌感染和未感染的大口黑鲈(Micropterus salmoides)脾脏组织中基因表达差异,其中,上调表达基因有1748个,下调表达基因有2120个。Luo等(2018)利用转录组测序技术检测嗜水气单胞菌感染的长江鲟(Acipenser dabryanus Dumeril),结果显示,在感染的头肾组织中共检测到1728个DEGs,其中,980个上调表达基因和748个下调表达基因。本研究中,高通量测序结果显示,嗜水气单胞菌感染后,翘嘴鳜头肾组织存在526个差异表达基因,其中,差异表达上调基因有254个,差异表达下调基因有272个,大量基因都与炎症、免疫、防御反应相关,这可能与嗜水气单胞菌在翘嘴鳜体内大量复制和宿主抵抗细菌感染有关,表明嗜水气单胞菌进入翘嘴鳜体内后,可诱导机体的非特异性免疫应答反应。
病原生物感染水生动物后获得大量差异表达基因,为分析宿主免疫应答方式和免疫防御提供了数据支持(刘文静等, 2013)。本研究发现,嗜水气单胞菌感染翘嘴鳜后,白介素IL-8、IL-6、IL-17、补体系统受体C1R、抗原提呈MHCⅠ、溶酶体Lys、丝氨酸蛋白酶抑制因子Serpin和泛素蛋白连接酶E3等免疫相关基因表达显著上调,说明这些基因在感染中参与应答反应。其中,白介素IL是参与炎症反应,免疫调节,刺激T细胞、B细胞增殖等免疫应答的关键因子(McBeath et al, 2007)。类似的研究发现,大西洋鲑(Salmo salar)在接种杀鲑气单胞菌(Aeromonas salmonicida)疫苗后,IL-8在其肝脏和肾脏中的表达显著升高(Fast et al, 2007)。斑马鱼(Danio rerio)在接种迟缓爱德华氏菌减毒疫苗后,IL-8基因出现明显的上调表达(Yang et al, 2013)。MHC分子属于免疫蛋白超家族,包括MHCⅠ类分子和MHCⅡ类分子,MHCⅠ类主要组织相容性复合抗原的功能是呈递细胞内病原产生的肽给CD8+ T细胞,诱导T细胞活化并杀死靶细胞。费超(2013)研究发现,用减毒鳗弧菌(Vibrio anguillarum)注射斑马鱼能有效激发MHCⅠ和MHCⅡ免疫应答。溶菌酶基因在先天性免疫系统中充当着重要角色,负责抵抗病原微生物的入侵。Zhang等(2018)研究发现,加州鲈(Microptenus salmoides)感染嗜水气单胞菌后,lysozyme表达量显著提高。
为更好地了解病原宿主之间的免疫应答及由细菌感染引起的一系列免疫反应的分子机制,本研究对嗜水气单胞菌感染翘嘴鳜后头肾组织差异表达基因进行GO富集和KEGG富集分析。GO富集分析显示,显著富集与免疫相关的GO条目有免疫系统过程、对刺激的反应、抗氧化活性等,说明嗜水气单胞菌感染翘嘴鳜,导致宿主产生强烈的免疫应答反应。KEGG富集分析显示,显著富集的免疫相关通路有内吞作用和吞噬体。内吞作用是细胞外物质通过质膜的变形运动进入胞内的过程,也是病原感染细胞的常见感染途径,在病原感染宿主细胞的早期发挥作用(Mayor et al, 2007);从内吞作用通路可以看出(图 4),显著上调基因(TGFβ、dynamin、ArfGAP、Arp2/3和caveolin)参与了网格蛋白(clathrin)介导的内吞途径,而发动蛋白(dynamin)是该内吞途径重要的蛋白,在网格蛋白介导的内吞过程中发挥“剪刀”的作用,将网格蛋白包被小窝与质膜分离(彭镜等, 2011);显著下调基因(TGFβR、GPCR和Hsc70)也参与了网格蛋白介导的内吞途径,并且G蛋白偶联受体(GPCR)信号通路受到了以β抑制蛋白(β-arrestion)为主的一系列辅助蛋白的负调节(殷琳等, 2019)。此外,吞噬作用在鱼类抵御病原细菌感染过程中发挥重要作用,对入侵的外源物质进行吞入和破坏(Zhao et al, 2016; 王超等, 2020)。吞噬过程主要分3个步骤:首先,病原细菌黏附到吞噬细胞表面;其次,抗原受体复合物通过内吞途径形成吞噬体;最后,病原在吞噬体内被消除(Gotthardt et al, 2002; 邰光富等, 2013; Keller et al, 2017)。从吞噬体通路可以看出(图 5),上调表达基因(avβ3、MR和TUBB)在病原识别到加工、运输、呈递中发挥重要作用,吞噬细胞表面的受体(avβ3和MR)首先识别病原,之后形成吞噬体,再通过微管蛋白(TUBB)等细胞骨架成分转运至溶酶体,微管蛋白在吞噬作用中起着重要作用(Gunning et al, 2015)。
综上所述,本研究利用RNA-seq技术分析了翘嘴鳜感染嗜水气单胞菌后的应答反应,获得多个显著差异表达基因,这些差异表达基因参与了重要的信号通路,尤其是免疫信号通路。研究结果为揭示翘嘴鳜感染嗜水气单胞菌的应答机制提供参考,为嗜水气单胞菌引起翘嘴鳜细菌性败血症的防治提供理论基础。
AN W, XIAO Y, GAO X H, et al. Isolation and identification of pathogenic Pseudomonas fluorescens from Siniperca chuatsi. Chinese Journal of Zoology, 2014, 49(5): 760-765 [安伟, 肖雨, 高晓华, 等. 鳜源致病性荧光假单胞菌的分离与鉴定. 动物学杂志, 2014, 49(5): 760-765] |
CAO M, WANG X Q, QING C X, et al. Transcriptome analysis of Palaemon carincauda subjected to hypoxic stress. Progress in Fishery Sciences, 2021, 42(2): 112-123 [曹梅, 王兴强, 秦传新, 等. 脊尾白虾对低氧响应的转录组学分析. 渔业科学进展, 2021, 42(2): 112-123] |
CHEN C F, SHI W Z, LI J, et al. A preliminary study on the immune response against Cytophaga columnaris of mandarin fish (Siniperca chuatsi B.). Journal of Huazhong Agricultural University, 1995, 14(4): 377-380 [陈昌福, 史维舟, 李静, 等. 翘嘴鳜对柱状嗜纤维菌免疫反应的初步研究. 华中农业大学学报, 1995, 14(4): 377-380] |
CHEN K, ZHANG Z, LI J, et al. Different regulation of branched-chain amino acid on food intake by TOR signaling in Chinese perch (Siniperca chuatsi). Aquaculture, 2021, 530: 735792 DOI:10.1016/j.aquaculture.2020.735792 |
CHEN N, JIANG J J, GAO X J, et al. Histopathological analysis and the immune related gene expression profiles of mandarin fish (Siniperca chuatsi) infected with Aeromonas hydrophila. Fish and Shellfish Immunology, 2018, 83: 410-415 DOI:10.1016/j.fsi.2018.09.023 |
FAST M D, JOHNSON S C, JONES S R M. Differential expression of the pro-inflammatory cytokines IL-1β-1, TNFα-1 and IL-8 in vaccinated pink (Oncorhynchus gorbuscha) and chum (Oncorhynchus keta) salmon juveniles. Fish and Shellfish Immunology, 2007, 22: 403-407 DOI:10.1016/j.fsi.2006.06.012 |
FEI C. Zebrafish model-based transcription profiles of immune-related genes in responsing to infection with wild type and attenuated strains of Vibrio anguillarum and Edwardsiella tarda. Masterxs Thesis of East China University of Science and Technology, 2013, 46–48 [费超. 斑马鱼为动物模型对鳗弧菌、迟钝爱德华氏菌野生株和减毒株感染应答的转录分析. 华东理工大学硕士研究生学位论文, 2013, 46–48]
|
GAO J W, LIANG L G, WANG Y B, et al. Identification and susceptibility test of pathogenic Aeromonas veronii isolated from Siniperca chuatsi. Microbiology China, 2016, 43(12): 2686-2692 [高金伟, 梁利国, 王亚冰, 等. 鳜源致病性维氏气单胞菌的鉴定及药敏试验. 微生物学通报, 2016, 43(12): 2686-2692] |
GOTTHARDT D, WARNATZ H J, HENSCHEL O, et al. High-resolution dissection of phagosome maturation reveals distinct membrane trafficking phases. Molecular Biology of the Cell, 2002, 13(10): 3508-3520 DOI:10.1091/mbc.e02-04-0206 |
GU T Z, LU C P, CHEN H Q. Invasion of an Acinetobacter baumannii train isolated from mandarin fish. Chinese Journal of Veterinary Science, 2000, 20(5): 468-470 [顾天钊, 陆承平, 陈怀青. 鲍氏不动杆菌鳜鱼分离株的侵袭特性. 中国兽医学报, 2000, 20(5): 468-470 DOI:10.3969/j.issn.1005-4545.2000.05.020] |
GUNNING P W, GHOSHDASTIDER U, WHITAKER S, et al. The evolution of compositionally and functionally distinct actin filaments. Journal of Cell Science, 2015, 128(11): 2009-2019 DOI:10.1242/jcs.165563 |
HUANG W F, LI H Y, ZHANG J Y. The pathogen of bacterial gill disease in mandarin fish Siniperca chuatisi. Microbiology China, 1999, 26(4): 246-250 [黄文芳, 李海燕, 张剑英. 翘嘴鳜烂鳃病病原的研究. 微生物学通报, 1999, 26(4): 246-250] |
KELLER S, BERGHOFF K, KRESS H. Phagosomal transport depends strongly on phagosome size. Scientific Reports, 2017, 7(1): 17068 DOI:10.1038/s41598-017-17183-7 |
LI X Y, LI Z Q, WANG Y Q, et al. Construction of Aeromonas hydrophila acrA deficient strain and determination of its physiological function. Biotechnology Bulletin, 2020, 36(11): 63-69 [李小艳, 李泽琦, 汪玉倩, 等. 嗜水气单胞菌acrA缺失菌株的构建及其生理功能的测定. 生物技术通报, 2020, 36(11): 63-69] |
LIU W J, YANG L S, LI X L, et al. Cloning and mRNA expression analysis of Relish gene in Penaeus monodon following immune stimulation. Journal of Fishery Sciences of China, 2013, 20(1): 50-60 [刘文静, 杨丽诗, 李晓兰, 等. 斑节对虾Relish基因的克隆及免疫刺激对其mRNA表达水平的影响. 中国水产科学, 2013, 20(1): 50-60] |
LUO K, DI J, HAN P P, et al. Transcriptome analysis of the critically endangered Dabry's sturgeon (Acipenser dabryanus) head kidney response to Aeromonas hydrophila. Fish and Shellfish Immunology, 2018, 83: 249-261 DOI:10.1016/j.fsi.2018.09.044 |
MAYOR S, PAGANO R E. Pathways of clathrin-independent endocytosis. Nature Reviews Molecular Cell Biology, 2007, 8: 603-612 DOI:10.1038/nrm2216 |
MCBEATH A J A, SNOW M, SECOMBES C J, et al. Expression kinetics of interferon and interferon-induced genes in Atlantic salmon (Salmo salar) following infection with infectious pancreatic necrosis virus and infectious salmon anaemia virus. Fish and Shellfish Immunology, 2007, 22(3): 230-241 DOI:10.1016/j.fsi.2006.05.004 |
PENG J, WU L, ZHANG C L, et al. The functional domain of Dynamin-Ⅰ and its role in the endocytosis of synaptic vesicles. Progress in Physiological Sciences, 2011, 42(2): 121-124 [彭镜, 吴蕾, 张慈柳, 等. Dynamin-Ⅰ的功能结构域及其在突触囊泡内吞过程中的作用. 生理科学进展, 2011, 42(2): 121-124] |
QING L, YIN J G, ZHANG W, et al. Isolation and identification of pathogenic Aeromonas hydrophila from Esox lucius around Urumqi in Xinjiang. Progress in Fishery Sciences, 2014, 35(5): 40-45 [秦莉, 殷建国, 张薇, 等. 白斑狗鱼(Esox lucius)致病性嗜水气单胞菌的分离与鉴定. 渔业科学进展, 2014, 35(5): 40-45] |
TAI G F, YAN Q P, XU X J, et al. Establishment of quantitative model on eel peripheral blood leukocytes phagocytosing Aeromonas hydrophila in vitro. Progress in Fishery Sciences, 2013, 34(6): 68-74 [邰光富, 鄢庆枇, 徐晓津, 等. 鳗鲡外周血白细胞体外吞噬嗜水气单胞菌数量模型的建立. 渔业科学进展, 2013, 34(6): 68-74 DOI:10.3969/j.issn.1000-7075.2013.06.010] |
TIAN J Y, XIE H X, YAO W J, et al. Ontogenetic development of the pronephros and the distribution of B-lymphocytes in adult pronephros of the mandarin fish Siniperca chuatsi. Acta Zoologica Sinica, 2005, 51(3): 440-446 [田敬云, 谢海侠, 姚卫建, 等. 鳜鱼头肾的组织发生及成鱼头肾B淋巴细胞的分布. 动物学报, 2005, 51(3): 440-446] |
WANG C, ZHANG L G, WU M M, et al. Important role of phagocytosis in the defense of Nile tilapia (Oreochromis niloticus) against Aeromonas hydrophila infection. Journal of Fishery Sciences of China, 2020, 27(3): 346-354 [王超, 张龙岗, 吴蒙蒙, 等. 吞噬作用在尼罗罗非鱼抵抗嗜水气单胞菌感染过程中的重要作用. 中国水产科学, 2020, 27(3): 346-354] |
WANG Y, LIU W Z, FU S Z, et al. Etiology and genomic characteristics of an Aeromonas hydrophila strain isolated from Ctenopharyngodon idella. Journal of Fisheries of China, 2019, 43(4): 1181-1191 [王艺, 刘文珍, 傅松哲, 等. 一株从草鱼中分离的嗜水气单胞菌的病原学及基因组特征. 水产学报, 2019, 43(4): 1181-1191] |
WU Y L, MIAO P F, YU H, et al. Isolation, identification and drug susceptibility test of pathogenic Edwardsiella tarda in Siniperca chuatsi. Journal of Southern Agriculture, 2018, 49(4): 794-799 [吴勇亮, 苗鹏飞, 于辉, 等. 鳜鱼致病性迟缓爱德华氏菌的分离鉴定及药敏试验. 南方农业学报, 2018, 49(4): 794-799 DOI:10.3969/j.issn.2095-1191.2018.04.27] |
XU D D, HAN P P, XIA L H, et al. A comparative transcriptome analysis focusing on immune responses of Asian swamp eel following infection with Aeromonas hydrophila. Aquaculture, 2021, 539: 736655 DOI:10.1016/j.aquaculture.2021.736655 |
YANG D H, LIU Q, NI C S, et al. Gene expression profiling in live attenuated Edwardsiella tarda vaccine immunized and challenged zebrafish: Insights into the basic mechanisms of protection seen in immunized fish. Developmental and Comparative Immunology, 2013, 40(2): 132-141 DOI:10.1016/j.dci.2013.01.014 |
YIN L, CHEN X, YANG X Y, et al. Mechanisms of β-arrestin-biased GPCR signal transduction and advances in drug research. Acta Pharmaceutica Sinica, 2019, 54(1): 66-72 [殷琳, 陈熙, 杨秀颖, 等. 偏向β-抑制蛋白的GPCR信号传导机制及药物研究进展. 药学学报, 2019, 54(1): 66-72] |
YUAN X Y, ZHANG X T, XIA Y T, et al. Transcriptome and 16S rRNA analyses revealed differences in the responses of largemouth bass (Micropterus salmoides) to early Aeromonas hydrophila infection and immunization. Aquaculture, 2021, 541: 736759 |
ZHANG C N, ZHANG J L, LIU M, et al. Molecular cloning, expression and antibacterial activity of goose-type lysozyme gene in Microptenus salmoides. Fish and Shellfish Immunology, 2018, 82: 9-16 |
ZHANG M, WANG Z G, GAO F, et al. Isolation, identification and pathogenicity analysis of Aeromonas hydrophila from Pseudocrossocheilus bamaensis. Journal of Southern Agriculture, 2020, 51(9): 2051-2060 [张曼, 王振光, 高峰, 等. 巴马拟缨鱼源嗜水气单胞菌分离鉴定及其致病力分析. 南方农业学报, 2020, 51(9): 2051-2060] |
ZHANG Y, GAO X J, YE J M, et al. Molecular characterization and establishment of LAMP detection method of pathogenic Aeromonas hydrophila isolated from Siniperca chuatsi. Acta Hydrobiologica Sinica, 2017, 41(6): 1225-1231 [张悦, 高晓建, 叶金明, 等. 翘嘴鳜病原嗜水气单胞菌分子特征及LAMP检测方法的建立. 水生生物学报, 2017, 41(6): 1225-1231] |
ZHAO L J, TU J G, ZHANG Y L, et al. Transcriptomic analysis of the head kidney of topmouth culter (Culter alburnus) infected with Flavobacterium columnare with an emphasis on phagosome pathway. Fish and Shellfish Immunology, 2016, 57: 413-418 |



