国家二级保护动物塔里木裂腹鱼(Schizothorax biddulphi)属鲤形目(Cypriniformes)、鲤科(Cyprinidae)、裂腹鱼亚科(Schizothpracinae)、裂腹鱼属(Schizothorax),俗称“尖嘴鱼”,是我国的特有物种(王德忠, 1998)。有关塔里木裂腹鱼的报道主要集中在其地理分布(张人铭等, 2007)、形态特征(杨天燕等, 2018)、繁殖特性(魏杰等, 2011)、线粒体基因组DNA结构分析(杨天燕等, 2011)、遗传标记开发(Luo et al, 2012)及遗传多样性(海萨等, 2016)等方面。
鱼类组织细胞培养起步于20世纪60年代。最早的研究开始于海水鱼类组织细胞培养,并建立蓝仿石鲈(Haemulon sciurus)尾鳍细胞系(CF-1)(Clew et al, 1961);但公认的第1个鱼类永久性细胞系是虹鳟(Oncorhynchus mykiss)生殖腺细胞系(RTG-2)(Wolf et al, 1962)。之后建立了胖头 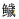
盐碱度水平是影响硬骨鱼类生存、繁殖、发育、生长和生理功能的最重要环境因素之一,会由于自然因素或人为因素而发生变化,从而对养殖鱼类造成渗透调节胁迫,影响其正常生长(Resley et al, 2006)。水体中盐碱度水平对鱼类的存活有显著影响,盐碱度过高或过低都会使鱼类的存活率显著的降低(Yao et al, 2010)。鱼类细胞系是进行病毒学、环境毒理学、分子遗传学、基因功能分析、细胞遗传学与种质保存等研究的材料和模型(周广舟等, 2011)。草鱼鳍细胞系可用于研究草鱼源维氏气单胞菌(Aeromonas veronii)对宿主细胞的毒性及致死机制(刘明珠等, 2019);异育银鲫(Carassius auratus gibelio)尾鳍细胞(GiCF)可用于辛硫磷对GiCF毒性研究(赵燕楠等, 2020);泥鳅(Misgurnus anguillicaudatus)鳍细胞系用于研究铜、锌对泥鳅鳍细胞DNA损伤及金属硫蛋白表达的影响(姜姗等, 2020)。
本研究建立了塔里木裂腹鱼尾鳍组织细胞系,测定了盐度(NaCl)和碱度(NaHCO3)对其增殖的影响。本研究旨在为合理开发和利用塔里木裂腹鱼遗传资源以及建立和保护其种质资源提供一定的科学依据。
1 材料与方法 1.1 实验材料实验用塔里木裂腹鱼于2019年9月取自新疆克孜勒河,饲养在新疆建设兵团塔里木畜牧科技重点实验室。取其中1条健康雌塔里木裂腹鱼,体重为21.37 g,全长为15.46 cm。
DME/F12、L-15、MEM、RPMI-1640、M199培养基购自Hyclone公司;胎牛血清(FBS)购自Gibco公司;磷酸缓冲液(PBS)、青霉素–链霉素双抗、二甲基亚砜(DMSO)购自Solarbio公司;台盼蓝和0.25%胰酶购自Biotopped公司;MS-222购自渔夫宝公司;基因组DNA提取试剂盒购自天根生化科技有限公司;其他化学试剂均为分析纯。
1.2 实验方法 1.2.1 原代培养与传代培养取健康塔里木裂腹鱼,加入0.1 μL/g的MS-222麻醉剂麻醉后,剪取上尾鳍。用75%的酒精对尾鳍进行消毒,置于超净台中。取4个培养皿,其中,1个加入75%的酒精,3个加入添加含500 IU/mL青霉素、500 μg/mL链霉素、12.5 μg/mL两性霉素B的PBS。尾鳍放入酒精中30 s,然后依次在另外3个培养皿中浸泡,之后将其放入2 mL无菌离心管中,并用无菌眼科剪将其剪成大约1~2 mm3的组织碎块,向其中加入500 μL的DME/F12培养液,将组织碎块移到25 mm2培养瓶中,正相放入25℃、5%的CO2培养箱中,观察细胞贴壁情况。4 h后反相放置,培养2 h后,向其中加入1 mL DME/F12培养液(含20% FBS、500 IU/mL青霉素、500 μg/mL链霉素、12.5 μg/mL两性霉素B),正相放入25℃、5%的CO2培养箱中继续培养,12 h后加入9 mL培养液,继续正相放置培养。每天用倒置荧光显微镜(AMG EVOS F1)观察组织块迁移情况。
原代培养过程中,更换培养液的时间为2~4 d。当组织碎块周围迁出细胞,细胞浓度达106 cells/mL时,按1∶2的比例进行传代。直到第5代后,青霉素、链霉素的浓度降低到200 IU/mL和200 μg/mL,FBS浓度也降低到15%。到第8代后,使用含10% FBS和1% P/S的DME/F12培养液。
1.2.2 细胞生长曲线将一定浓度的细胞接种到24孔细胞培养板,分成8组,每组6孔,连续7 d常规培养,用血球计数板进行计数,每天记1组,分析数据并绘制细胞生长曲线。细胞生长曲线的纵坐标为每天计数的细胞平均个数,时间为横坐标。根据下面公式计算细胞的群体倍增时间:
| $ T=t \times \lg / \lg \left(N_{t} / N_{0}\right) $ |
式中,Nt为时间t后的细胞数,N0接种细胞数(Nicholas, 1991)。
1.2.3 最佳培养基检测DME/F12、M199、L-15、MEM、RPMI-1640共5种不同培养基维持细胞生长的能力。每种培养基中均补充10% FBS和1% P/S。分别将一定浓度的细胞接种在不同的培养基中,在25℃、5%的CO2条件下培养96 h,在5个时间点,即0、24、48、72及96 h利用血球计数板进行细胞计数,绘制细胞的生长曲线。
1.2.4 最适培养温度检测20℃、25℃、30℃和37℃不同温度对细胞生长的影响。所用培养液为含10% FBS和1% P/S的DME/F12培养液。在25℃、5%的CO2条件下培养96 h,在5个时间点即0、24、48、72及96 h利用血球计数板进行细胞计数,绘制细胞的生长曲线。
1.2.5 最适血清浓度确定最适合的培养液及温度后,其他条件一致,设置不同FBS浓度(0、5%、10%和20%),在25℃、5%的CO2条件下培养,在5个时间点,即0、24、48、72及96 h利用血球计数板进行细胞计数,绘制细胞生长曲线。
1.2.6 细胞冻存与复苏配制10% DMSO、20% FBS、70% DME/F-12的细胞冻存液,细胞浓度为2×106 cells/mL,倒入冷冻管,液氮冻存。按细胞∶培养液=1∶5比例加入培养液使细胞悬浮,复苏培养。
1.2.7 细胞污染鉴定选用观察法与PCR法检测细胞是否被细菌、真菌、支原体污染。所用引物见表 1。
|
|
表 1 通用引物序列 Tab.1 Universal primer sequence |
利用动物组织基因组DNA提取试剂盒(DP304)提取塔里木裂腹鱼尾鳍细胞的基因组DNA。通过PCR扩增提取DNA。根据塔里木裂腹鱼16S rRNA设计引物,扩增引物为16SF和16SR (表 1)。配制50 μL反应体系:25 μL 2×Taq PCR MasterMix,引物各2.5 μL,5 μL模板DNA,15 μL的灭菌超纯水。PCR反应条件:95℃预变性3 min;94℃变性30 s,56.8℃退火30 s,72℃延伸40 s,循环35次;72℃延伸10 min。扩增反应结束后,取1 μL PCR产物在核酸蛋白检测仪上检测DNA的浓度;取8 μL PCR产物在1%琼脂糖凝胶中进行电泳检测。PCR产物测序,比较获得序列与已发表序列的一致率。
1.2.9 盐碱度对塔里木裂腹鱼细胞系增殖数量的影响NaCl盐度设置1、2、4、6、8、10共6个梯度。称取NaCl加入DME/F12培养液溶解,溶解后再用0.22 μm过滤筛过滤。
NaHCO3碱度设置2、3、4、5、6、7、8、10 g/L共8个梯度。称取NaHCO3加入DME/F12培养液溶解,溶解后再用0.22 μm过滤筛过滤。
细胞铺板:将第10代对数生长期BICF1用含10%胎牛血清DME/F12培养液调整密度为1×104 cells/mL的细胞悬液,铺置于96孔细胞培养板上,每种材料铺6孔。每孔加入100 μL细胞悬液,25℃、5% CO2培养箱培养12 h后,按分组分别加入不同浓度盐和碱,各孔20 μL,继续培养24、48、72 h。之后将每个液体孔加入20 μL MTT后继续培养4 h,小心吸出各孔内液体,然后,每孔加入150 μL DMSO。摇床培养20 min,酶联免疫检测仪490 nm波长下测定各孔的OD值。通过计算,得出细胞相对增殖率:
相对增殖率=OD实验组/OD空白对照组×100%。
使用SPSS 20软件包对数据进行统计学分析,数据以平均值±标准差(Mean±SD)表示,P < 0.05为差异具有显著性。多组间比较用方差分析,两组间比较采用T检验。α=0.05为检验水准。
2 结果 2.1 塔里木裂腹鱼尾鳍细胞原代培养与传代培养观察塔里木裂腹鱼尾鳍细胞生长状态。3 d后,细胞贴壁且组织块周围逐渐有细胞迁出;7 d后,细胞正常迁出;13 d后,细胞铺满细胞瓶70%;18 d后,细胞出现悬浮现象(图 1);19 d后,进行原瓶传代。细胞浓度到106 cells/mL时,进行1∶2传代,此后每隔2~4 d传代1次。细胞悬浮生长,成功传至45代。

|
图 1 塔里木裂腹鱼尾鳍细胞原代培养的不同阶段 Fig.1 Different stages of primary culture of tail fin cells of S. biddulphi |
塔里木裂腹鱼尾鳍细胞系第10代细胞的生长曲线呈“S”型,0~1 d为潜伏期,1~4 d为指数生长期,4~5 d为平台期,5 d之后为衰退期(图 2)。第10代塔里木裂腹鱼尾鳍细胞的群体倍增时间为28.11 h,细胞分裂旺盛。
|
图 2 塔里木裂腹鱼尾鳍细胞生长曲线 Fig.2 The growth curve of tail fin cells of S. biddulphi 标有不同字母者表示组间差异显著(P < 0.05)。下同。 Means with different letters are significantly different (P < 0.05). The same as below. |
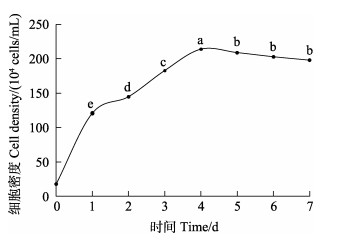
塔里木裂腹鱼尾鳍细胞在DME/F12、M199、L-15、MEM、RPMI-1640不同培养基中维持细胞生长的能力如图 3所示,在这些培养基中均能生长,但在DME/F12培养基中细胞生长最好。因此,DME/F12为最佳培养基(P < 0.05)。
|
图 3 塔里木裂腹鱼尾鳍细胞最佳培养基 Fig.3 Optimum medium of tail fin cells of S. biddulphi 小写字母表示同一时间下BICF1多重比较。下同。 Indicated with lowercase letters for BICF1 multiple comparisons at the same time. The same as below. |
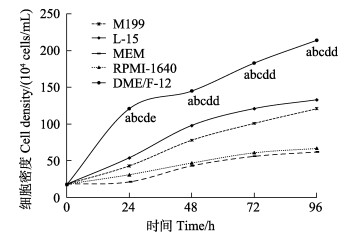
塔里木裂腹鱼尾鳍细胞在30℃生长最慢,25℃生长最快,20℃生长较快,在20℃~25℃范围内,皆能良性生长(图 4),生长的最适温度为25℃(P < 0.05)。
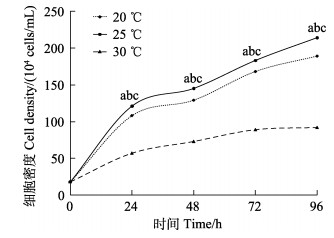
|
图 4 塔里木裂腹鱼尾鳍细胞最适培养温度 Fig.4 Optimum culture temperature of tail fin tissue cell of S. biddulphi |
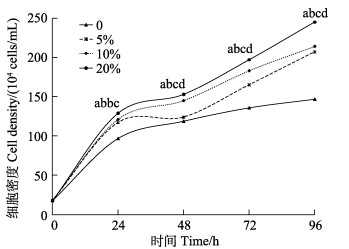
塔里木裂腹鱼尾鳍细胞在未加血清的培养基中生长明显低于添加血清的细胞生长,随着血清浓度5%、10%、20%依次增大,细胞生长依次加快,当FBS浓度为20%时,塔里木裂腹鱼尾鳍细胞生长明显最快(P < 0.05)(图 5)。
|
图 5 塔里木裂腹鱼尾鳍细胞最适血清浓度 Fig.5 Optimum serum concentration of tail fin tissue cells of S. biddulphi |
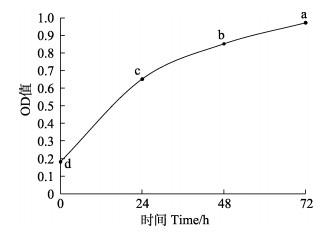
对塔里木裂腹鱼第6代尾鳍细胞系进行液氮冷冻,保存40、90及180 d后复苏,经台盼蓝染色并计数统计,40 d存活率为(91.49±0.69)%,90 d存活率为(88.41±0.80)%,180 d存活率为(87.85±0.66)%,90和180 d存活率差异不显著(P > 0.05)(表 2)。细胞具有活性,且复苏后增殖速度快(图 6),可正常传代(图 7)。
|
|
表 2 冻存后复苏存活率 Tab.2 Survival rate of recovery after freezing |
|
图 6 MTT法测定复苏细胞增殖 Fig.6 Determination of the resuscitated cells by MTT method |

|
图 7 塔里木裂腹鱼尾鳍细胞复苏培养 Fig.7 The resuscitation culture of tail fin of S. biddulphi |
塔里木裂腹鱼尾鳍细胞中提取细菌、真菌和支原体,经过PCR法鉴定细菌、真菌、支原体污染,样品均无与阳性对照组一致的条带,样品中无细菌、真菌、支原体,塔里木裂腹鱼尾鳍细胞未被污染。
2.8 塔里木裂腹鱼尾鳍细胞来源鉴定用基因组DNA试剂盒提取塔里木裂腹鱼尾鳍细胞DNA,经PCR扩增,在琼脂糖凝胶中电泳检测,PCR产物目的条带大小符合16S rRNA的大小。经测序后的序列片段与数据库中的GenBank进行Blast比对。塔里木裂腹鱼尾鳍细胞同源性与GenBank中发布的来源于塔里木裂腹鱼线粒体基因(JQ844133.1)的序列达到100%;证明尾鳍细胞来自于塔里木裂腹鱼。
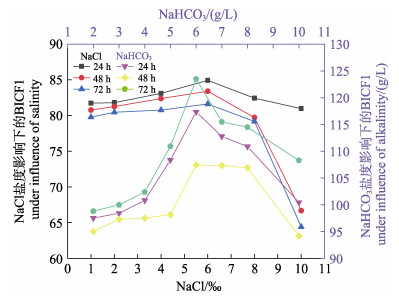
2.9 MTT法检测各组盐碱度的细胞增殖数量 2.9.1 盐度对塔里木裂腹鱼尾鳍细胞增殖数量的影响在盐度一定的情况下,BICF1的增殖数量随时间延长而下降,盐度对BICF1的相对增殖数量的抑制可随时间延长而增强。BICF1增殖数量在盐度为1、2、4、6时呈上升趋势,在盐度为6、8、10呈下降趋势,盐度为6时,BICF1增殖数量最高。BICF1增殖数量随盐度增加呈先升高后下降的趋势(表 3和图 8)。
|
|
表 3 盐度对BICF1增殖的影响(Mean±SD) Tab.3 Effects of salinity on BICF1 cell proliferation |
|
图 8 不同浓度NaCl/NaHCO3对BICFI细胞增殖数量的影响 Fig.8 Effects of different concentrations of NaCl/NaHCO3 on the number of proliferation of BICFI cells |
在碱度一定时,BICF1的增殖数量随时间(24、48、72 h)延长而下降,碱度对BICF1的相对增殖数量的抑制随时间延长而增强。在同一时间点上,BICF1增殖数量在碱度2、3、4、5、6 g/L时呈上升趋势,在碱度为6、7、8、10 g/L时呈下降趋势,碱度为6 g/L时,BICF1增殖数量最高。BICF1增殖数量随NaHCO3碱度增加呈先升高后下降的趋势(表 4和图 8)。
|
|
表 4 NaHCO3碱度对BICF1增殖的影响 Tab.4 Effect of NaHCO3 alkalinity on BICF1 cell proliferation (Mean±SD) |
本研究以塔里木裂腹鱼尾鳍组织为材料,采用组织块移植法成功进行了塔里木裂腹鱼尾鳍组织细胞原代培养,命名为BICFI。BICFI在10% FBS的DME/F12培养液中生长良好。细胞培养常用的培养液有L-15、MEM和M199,但不同的鱼类对环境要求不尽相同,因此,不同鱼类的最适培养基亦不同。青鱼(Mylopharyngodon piceus)尾鳍细胞系(BC-Fin)的最佳培养液为L-15(张雪萍等, 2016);麦穗鱼(Pseudorasbora parva)鳍细胞系的最佳培养液为MEM(杨坤等, 2013);匙吻鲟(Polyodon spathula)鳍细胞系(PF-Fin)的最佳培养液为M199(肖艺等, 2010);红鳍东方鲀(Takifugu rubripes)鳍细胞系的最佳培养液为DMEM/F12(王缙云等, 2018),本研究中筛选了DME/F12、L-15、MEM、RPMI-1640和M199培养基,得出DME/F12为最佳培养液。鱼类组织细胞生长温度范围和哺乳类组织细胞比较,范围比较广。BICFI在20℃~25℃均能正常生长。研究表明,牙鲆(Paralichthys olivaceus)与鲈(Perca fluviatilis)鳍细胞系为广温性(童裳亮等, 1997),本研究与已报道的鱼类细胞的温度适应范围是一致的(Wang et al, 2010),这与鱼类是变温动物有很大关系。在0、5%、10%、20%的FBS中生长时,未加FBS的生长速度明显低于添加FBS的生长速度,在FBS为20%时生长最快,FBS浓度对细胞生长有明显的影响,与已报道的研究相似(王缙云等, 2018)。本研究测定的第10代BICF1生长曲线呈“S”型生长曲线,1 d为指数生长期。红鳍东方鲀鳍细胞系在2~4 d为指数生长期,4~5 d为平稳期(王缙云等, 2018),5 d之后为衰退期。与红鳍东方鲀鳍细胞相比,BICF1进入指数生长期更快。
本研究塔里木裂腹鱼BICF1呈悬浮生长。贴壁培养型的细胞,细胞膜表面含有大量黏附因子。这些黏附因子可激活不同的信号通路调节贴壁细胞的活性和增殖,如整合素(integrins)活化黏着斑激酶(focal adhesion kinase)激活信号通路抑制细胞内源性的凋亡(Zhong et al, 2012; Hofmann et al, 2007)。悬浮培养的细胞一般为淋巴细胞等血液系统来源的细胞,细胞体积小,缺乏粘附分子的表达(姬广超等, 2020; 徐伟等, 2020)。在塔里木裂腹鱼BICF1染色体的制备中发现,用0.075 mol/L的KCl低渗时间达90 min。有研究报道,棕点石斑鱼(Epinephelus fuscoguttatus♀)×鞍带石斑鱼(Epinephelus lanceolatus♂) F1染色体制备中低渗时间为25 min (刘莉等, 2016);鲤(Procypris rabaudi)染色体标本的制备中低渗的时间控制在35 min (耿波等, 2003);黄颡鱼(Pelteobagrus fulvidraco)染色体标本的制备中低渗的时间控制在40 min (宋立民等, 2010);灰海马(Hippocampus erectus)染色体标本的制备中低渗的时间为50 min (刘鑫等, 2020);报道的研究中低渗的时间在25~50 min。因此,推测塔里木裂腹鱼BICF1细胞膜不易破裂,与BICF1细胞膜的坚韧程度有关。用物理方法进行贴壁型细胞的悬浮驯化时,使细胞发生失巢凋亡(anoikis)(王朋朋等, 2021),无血清与生物反应器驯化使贴壁细胞产生失巢凋亡的拮抗。目前,MDCK(吴培培等, 2016)、BHK-21(赵彩红等, 2019)、Hi5-SF(马伟等, 2017)、PK15(刘天伦等, 2019)等被驯化。塔里木裂腹鱼BICF1培养中可能产生类似于失巢凋亡的调节。塔里木裂腹鱼肾细胞呈悬浮生长的状态,可能与其体积和细胞膜表面粘附分子的表达及细胞膜坚韧程度有关,可能与类似于失巢凋亡的调节有关,具体原因有待于进一步研究。
细胞来源的鉴定通常采用16S rRNA、12S rRNA和Cytb等基因片段,本研究选择16S rRNA进行鉴定,BICF1序列分析结果与塔里木裂腹鱼基因序列一致性为100%,证明细胞系来自于塔里木裂腹鱼。
塔里木裂腹鱼曾是新疆博斯腾湖主要经济鱼类,由于开荒造田,农田盐碱水大量排入湖水,盐碱度逐年升高(刘立彭, 1983)。水体中盐碱度水平对鱼类存活有显著影响,盐碱度过高或过低都会显著降低鱼类的存活率(张雅芝等, 2009; 秦志清等, 2010)。在尼罗罗非鱼(Oreochromis niloticus)盐碱度的耐受性研究中发现,盐度为20时,仅少数个体能存活96 h;NaHCO3碱度为12 g/L时,96 h全部死亡(赵丽慧等, 2014);对缢蛏(Sinonovacula constricta)急性低盐胁迫,并检测当盐度由2到0时,其存活率随盐度的下降而降低(李智等, 2020);当碳酸盐碱度为0~44.58 mmol/L、pH为9.0~10.0时,随着碳酸盐碱度浓度的上升,缢蛏的存活率明显下降(叶博等, 2019)。本研究中,盐度为1~6时,BICF1增殖数量上升;盐度为6~10时,BICF1增殖数量下降;盐度为6时,BICF1增殖数量最高。NaHCO3碱度为2~6 g/L时,BICF1增殖数量上升;碱度为6~10 g/L时,BICF1增殖数量下降;碱度为6 g/L时,BICF1增殖最高。本研究中,盐碱度过高或过低都会使塔里木裂腹鱼尾鳍细胞的存活率降低。红鲫(Carassius auratus red)鳍细胞系被建立被用于抗药性和抗病性的研究,细胞系可用于毒性筛选和病毒分离的材料(Xiao et al, 2018)。草鱼鳍细胞系用于研究草鱼源维氏气单胞菌对宿主细胞的毒性致死机制(刘明珠等, 2019);异育银鲫(Carassius auratus gibelio)尾鳍细胞(GiCF)用于辛硫磷对GiCF毒性研究,表明GiCF可作为农药的细胞毒性研究材料(赵燕楠等, 2020)。本研究中,塔里木裂腹鱼尾鳍细胞系可作为研究盐碱度对塔里木裂腹鱼的影响的材料,可为其选择育种和功能基因研究提供良好的载体。
BABU V, NAMBI K, CHANDRA V, et al. Establishment and characterization of a fin cell line from Indian walking catfish, Clarias batrachus (L.). Journal of Fish Diseases, 2011, 34(5): 355-364 DOI:10.1111/j.1365-2761.2011.01247.x |
BEJAR J, BORREGO J J, ALVAREZ M C. A continuous cell line from the cultured marine fish gilt-head seabream (Sparus aurata L.). Aquaculture, 1997, 150(1/2): 143-153 |
CLEW L W, MOEWUS L, SIGEL M M. Studies with cells from marine fish in tissue culture. Proceedings of the Society for Experimental Biology and Medicine, 1961, 108(3): 762-766 DOI:10.3181/00379727-108-27059 |
GENG B, LIANG L Q, SUN X W. The search for the blood lymphocytic cell cultivation of the common carp and the preparation of chromosomes. Chinese Journal of Fisheries, 2003(2): 32-34 [耿波, 梁利群, 孙效文. 鲤鱼血淋巴细胞培养及染色体制备条件探索. 水产学杂志, 2003(2): 32-34 DOI:10.3969/j.issn.1005-3832.2003.02.006] |
GONG Q L, ZHENG L, ZHANG H L, et al. Testing lab animal dermatophytes using PCR method. Chinese Journal of Comparative Medicine, 2007, 17(3): 132-135 [龚巧玲, 郑龙, 张换铃, 等. PCR方法检测实验动物皮肤病原真菌. 中国比较医学杂志, 2007, 17(3): 132-135] |
GRAVELL M, MALSBERGER R. A permanent cell line from the fathead minnow (Pimephales promelas). Annals of the New York Academy of Sciences, 1965, 126(1): 555-565 |
HAYSA A, GUO Y, MENG W, et al. Genetic diversity and population differentiation of Schizothorax biddulphi based on mtDNA control region sequences. Journal of Fishery Sciences of China, 2016, 23(4): 944-954 [海萨•艾也力汗, 郭焱, 孟玮, 等. 基于线粒体控制区序列的塔里木裂腹鱼遗传多样性及种群分化分析. 中国水产科学, 2016, 23(4): 944-954] |
HOFMANN C, OBERMEIER F, ARTINGER M, et al. Cell-cell contacts prevent anoikis in primary human colonic epithelial cells. Gastroenterology, 2007, 132(2): 587-600 DOI:10.1053/j.gastro.2006.11.017 |
JI G C, WANG X M, SU M M, et al. Analysis of lymphocyte subsets to predict their killing activity. Chinese Journal of Clinical Rational Drug Use, 2020, 13(27): 172-173 [姬广超, 王晓明, 苏苗苗, 等. 淋巴细胞的亚群分析预测其杀伤活性研究. 临床合理用药杂志, 2020, 13(27): 172-173] |
JIANG S, LI X, LI Z Z, et al. Toxicity of copper sulfatde and zine chloride on DNA damage and metallothionein gene expression in loach cell lines. Fisheries Science, 2020, 39(3): 381-387 [姜姗, 李霞, 李状状, 等. 铜、锌对泥鳅细胞DNA损伤及金属硫蛋白表达的影响. 水产科学, 2020, 39(3): 381-387] |
JIN M, HUANG A H, CHEN Z L, et al. Detection of common fungal pathogens by general primer PCR. Journal of Environment and Health, 2009, 26(11): 969-971 [金敏, 黄爱华, 陈照立, 等. 常见致病真菌通用引物PCR检测技术研究. 环境与健康杂志, 2009, 26(11): 969-971] |
KELLY R K, LOH P C. Some properties of an established fish cell line from Xiphophorus helleri (red swordtail). In Vitro, 1973, 9(2): 73-80 DOI:10.1007/BF02616003 |
LI Z, PENG M X, YE B, et al. Effects of acute low salinity on Sinonovacula constricta survival rate, Na+/K+-ATPase activity and phagocytosis of hemocytes. Journal of Shanghai Ocean University, 2020, 29(4): 489-495 [李智, 彭茂潇, 叶博, 等. 急性低盐度对缢蛏存活率、Na+/K+-ATPase活性以及血淋巴细胞吞噬能力的影响. 上海海洋大学学报, 2020, 29(4): 489-495] |
LIU L, ZHANG Y, CHEN C. Preparation of chromosomes and analysis of karyotypes of hybrid F1 (Epinephelus fuscoguttatus♀×Epinephelus lanceolatus♂) groupers. Progress in Fishery Sciences, 2016, 37(2): 33-40 [刘莉, 张岩, 陈超, 等. 棕点石斑鱼(Epinephelus fuscoguttatus♀)×鞍带石斑鱼(Epinephelus lanceolatus♂) F1染色体制备方法及核型分析. 渔业科学进展, 2016, 37(2): 33-40] |
LIU L P. Comments on the Bosten Lake fishery and its resource multiplication. Freshwater Fisheries, 1983(3): 12-14 [刘立彭. 博斯腾湖渔业及其资源增殖的意见. 淡水渔业, 1983(3): 12-14] |
LIU M Z, YU Q, XIAO H H, et al. Study on cytotoxicity and apoptosis of Aeromonas veronii to grass carp pectoral fin cell. Journal of Guangxi Academy of Sciences, 2019, 35(3): 213-218 [刘明珠, 余庆, 肖贺贺, 等. 维氏气单胞菌对草鱼背鳍细胞的毒性及凋亡研究. 广西科学院学报, 2019, 35(3): 213-218] |
LIU T L, LANG H B, KONG S. Domestication of a PK15 cell line to suspension culture by serum-free medium. Chinese Journal of Veterinary Drug, 2019, 53(9): 12-18 [刘天伦, 郎洪彬, 孔飒. PK15细胞的无血清全悬浮驯化研究. 中国兽药杂志, 2019, 53(9): 12-18] |
LIU X, ZHANG D, LIN T T, et al. Chromosome preparation and karyotype of the lined seahorse (Hippocampus erectus). Journal of Fisheries of China, 2020, 44(6): 907-914 [刘鑫, 张东, 林听听, 等. 灰海马染色体制备及核型分析. 水产学报, 2020, 44(6): 907-914] |
LUO W, NIE Z L, ZHAN F B, et al. Rapid development of microsatellite markers for the endangered fish Schizothorax biddulphi (Günther) using next generation sequencing and cross-species amplification. International Journal of Molecular Sciences, 2012, 13(11): 14946-14955 |
MA W, WANG J M, MA G L, et al. Establishment and identification of Hi5-SF suspension cell line. Acta Agriculturae Boreali-Occidentalis Sinica, 2017, 26(2): 173-178 [马伟, 王家敏, 马桂兰, 等. Hi5-SF悬浮细胞系的建立及鉴定. 西北农业学报, 2017, 26(2): 173-178] |
NICHOLAS H A, TERRY R, ALLEN W, et al. Evaluation of flow cytometric methods for determining population potential doubling times using cultured cells. Cytometry Part A, 1991, 12(3): 234-241 DOI:10.1002/cyto.990120305 |
NICHOLSON B L, BYRNE C. An established cell line from the Atlantic salmon (Salmo salar). Canadian Journal of Fisheries and Aquatic Sciences, 1973, 30(70): 913-916 |
QIN Z Q, ZHANG Y Z, LIN Y J, et al. Effects of salinity on growth and survival of young Paralichthys lethostigma. Chinese Journal of Fisheries, 2010, 23(2): 1-5 [秦志清, 张雅芝, 林越赳, 等. 盐度对漠斑牙鲆幼鱼生长与存活的影响. 水产学杂志, 2010, 23(2): 1-5 DOI:10.3969/j.issn.1005-3832.2010.02.001] |
RESLEY M J, WEBB Jr.K A, HOLT G J. Growth and survival of juvenile cobia, Rachycentron canadum, at different salinities in a recirculating aquaculture system. Aquaculture, 2006, 253(1/2/3/4): 398-407 |
SONG L M, WANG W M, WANG Y F. The tissue cultivation of fins and preparation of chromosomes in yellow catfish Pelteobagrus fulvidraco. Journal of Dalian Ocean University, 2010, 25(6): 502-505 [宋立民, 王卫民, 王玉芬. 黄颡鱼鳍组织培养及染色体制备条件的研究. 大连海洋大学学报, 2010, 25(6): 502-505 DOI:10.3969/j.issn.1000-9957.2010.06.005] |
SWAMINATHAN T R, LAKRA W S, GOPALAKRISHNAN A, et al. Development and characterization of a new epithelial cell line PSF from tail fin of green chromide, Etroplus suratensis (Bloch, 1790). In Vitro Cellular and Developmental Biology-Animal, 2010, 46(8): 647-656 DOI:10.1007/s11626-010-9326-y |
TONG S L, LI H, MIAO H Z. Four continuous cell lines of three marine fish species were established. Progress in Biomedical Engineering, 1997, 17(3): 3-4 [童裳亮, 李宏, 苗宏志. 牙鲆、鲈鱼和真鲷的四个永生性细胞系建立. 生物工程进展, 1997, 17(3): 3-4] |
WAN Y J, ZHANG J L, AN J. Rapid detection of bacterial or microbial contamination in cell cultures. Journal of Regional Anatomy and Operative Surgery, 2005, 14(2): 88-90 [万颖杰, 张俊磊, 安静. 细胞培养中细菌类微生物污染的快速检测. 同解手术学杂志, 2005, 14(2): 88-90] |
WANG D Z. The Schiz. Othoracinae fish in Xinjing. Arid Zone Research, 1998, 15(4): 26-32 [王德忠. 新疆的裂腹鱼亚科鱼类研究. 干旱区研究, 1998, 15(4): 26-32] |
WANG J Y, LI X, QIN Y J, et al. Establishment and characterization of fin cell lines from redfin puffer Takifugu rubripes. Journal of Dalian Ocean University, 2018, 33(6): 703-708 [王缙云, 李霞, 秦艳杰, 等. 红鳍东方鲀鳍细胞系的建立及生长特性研究. 大连海洋大学学报, 2018, 33(6): 703-708] |
WANG P P, HUANG S L, ZHANG Y K, et al. Research progress on serum free suspension culture of mammalian cells. China Animal Husbandry and Veterinary Medicine, 2021, 48(3): 839-845 [王朋朋, 黄书林, 张云科, 等. 哺乳动物细胞无血清全悬浮培养技术研究进展. 中国畜牧兽医, 2021, 48(3): 839-845] |
WANG X L, CHEN S L, SHA Z X, et al. Establishment and characterization of a new cell line from the kidney of spotted halibut Verasper variegates. Periodical of Ocean University of China, 2010, 9(2): 162-168 DOI:10.1007/s11802-010-0162-1 |
WEI J, NIE Z L, LI J, et al. Morphological and histological observation of gonadal development of Tarim schizotharacin Schizothorax biddulphi. Journal of Dalian Ocean University, 2011, 26(3): 227-231 [魏杰, 聂竹兰, 李杰, 等. 塔里木裂腹鱼性腺形态学与组织学的研究. 大连海洋大学学报, 2011, 26(3): 227-231 DOI:10.3969/j.issn.1000-9957.2011.03.007] |
WEI L, NIE Z L, ZHAN F B, et al. Rapid development of microsatellite markers for the endangered fish Schizothorax biddulphi (Günther) using next generation sequencing and cross-species amplification. International Journal of Molecular Sciences, 2012, 13: 14946-14955 DOI:10.3390/ijms131114946 |
WEI Y Z, LU R H, BAI G D. Establishment of grass carp (Ctenopharyngodon idellus) caudal fin diploid cell line GCCF-2 and analysis of some of its biological characteristics. Journal of Fisheries of China, 1987, 11(4): 269-275 [魏彦章, 陆仁后, 白国栋. 草鱼尾鳍组织二倍体细胞系GCCF-2的建立及其部分生物学特性分析. 水产学报, 1987, 11(4): 269-275] |
WOLF K, QUIMBY M. Established eurythermic line of fish cells in vitro. Science, 1962, 135(3508): 1065-1066 DOI:10.1126/science.135.3508.1065 |
WU P P, TANG Y H, CHU X, et al. Domestication of MDCK suspension cell lines for the H9 subtype of avian influenza virus proliferation and its biological characteristics evaluation. Jiangsu Journal of Agricultural Sciences, 2016, 32(6): 1377-1383 [吴培培, 唐应华, 褚轩, 等. 适应H9亚型禽流感病毒增殖的MDCK悬浮细胞株的驯化及其生物学特性. 江苏农业学报, 2016, 32(6): 1377-1383 DOI:10.3969/j.issn.1000-4440.2016.06.028] |
XIAO J, FU W M, ZHOU W, et al. Establishment of fin cell lines and their use to study the immune gene expression in cyprinid fishes with different ploidy in rhabdovirus infection. Developmental and Comparative Immunology, 2018, 88: 55-64 DOI:10.1016/j.dci.2018.07.007 |
XIAO Y, ZENG L B, LI X L, et al. Establishment and characterization of a cell line derived from fin of paddlefish, Polyodon spathula walbaum. Chinese Journal of Cell Biology, 2010, 32(4): 533-540 [肖艺, 曾令兵, 李晓莉, 等. 匙吻鲟鳍条组织细胞系的建立及其生物学特性. 中国细胞生物学学报, 2010, 32(4): 533-540] |
XU W, FANG S J, GUAN R, et al. Immunomodulatory effect of Atractylodis macrocephalae Koidz polysaccharides on mouse lymphocytes. Chinese Journal of Immunology, 2020, 36(13): 1573-1577 [徐伟, 方思佳, 关然, 等. 白术多糖对小鼠淋巴细胞的免疫调节作用. 中国免疫学杂志, 2020, 36(13): 1573-1577 DOI:10.3969/j.issn.1000-484X.2020.13.007] |
YAN W, NIE P, LU Y. Establishment, characterization and viral susceptibility of a new cell line derived from goldfish, Carassius auratus (L.) tail fin. Journal of Fish Diseases, 2011, 34(10): 757-768 DOI:10.1111/j.1365-2761.2011.01292.x |
YANG K, ZHU D M, WANG W M. Studies on fin tissue cultivation, Ag-NORS and C-banding patterns of Pseudorasbora parva. South China Fisheries Science, 2013, 9(3): 20-25 [杨坤, 祝东梅, 王卫民. 麦穗鱼鳍条组织培养及染色体Ag-NORs和C-带研究. 南方水产科学, 2013, 9(3): 20-25 DOI:10.3969/j.issn.2095-0780.2013.03.004] |
YANG T Y, MENG W, GUO Y, et al. The multivariate morphometric analysis of Schizothorax biddulphi and Schizothorax irregularis. Journal of Zhejiang Ocean University (Natural Science), 2018, 37(3): 221-227 [杨天燕, 孟玮, 郭焱, 等. 塔里木裂腹鱼和厚唇裂腹鱼多变量形态学分析. 浙江海洋大学学报(自然科学版), 2018, 37(3): 221-227 DOI:10.3969/j.issn.1008-830X.2018.03.006] |
YANG T Y, ZHANG R M, GUO Y, et al. Comparative study on partial mitochondrial COI gene of Aspiorhynchus laticeps and Schizothorax biddulphi. Journal of Hydroecology, 2011, 32(1): 45-50 [杨天燕, 张人铭, 郭焱, 等. 扁吻鱼和塔里木裂腹鱼线粒体COI基因片段的比较研究. 水生态学杂志, 2011, 32(1): 45-50] |
YAO Z L, LAI Q F, ZHOU K, et al. Developmental biology of medaka fish (Oryzias latipes) exposed to alkalinity stress. Journal of Applied Ichthyology, 2010, 26(3): 397-402 DOI:10.1111/j.1439-0426.2009.01360.x |
YE B, CHENG Z Y, PENG M X, et al. Effects of pH and carbonate alkalinity on survival rate, Na+/K+-ATPase activity and phagocytic ability of the razor clam (Sinonovacula constricta). Journal of Fisheries of China, 2019, 43(8): 1723-1732 [叶博, 程之扬, 彭茂潇, 等. 急性pH和碳酸盐碱度对缢蛏存活率、Na+/K+-ATPase活性及血淋巴吞噬能力的影响. 水产学报, 2019, 43(8): 1723-1732] |
ZHANG N C, YANG G Z. The establishment of strain ZC-7901 and substrain ZC-7901S1, from the snout tissue cells of grass carp. Journal of Fisheries of China, 1981, 5(2): 111-118 [张念慈, 杨广智. 草鱼吻端组织细胞株ZC-7901及其亚株ZC-7901S1的建立和特性观察. 水产学报, 1981, 5(2): 111-118] |
ZHANG R M, GUO Y, MA Y W, et al. A Survey on the resource and distribution of Schizothorax biddulphi gunther. Freshwater Fisheries, 2007, 37(6): 76-78 [张人铭, 郭焱, 马燕武, 等. 塔里木裂腹鱼资源与分布的调查研究. 淡水渔业, 2007, 37(6): 76-78] |
ZHANG X P, ZENG L B, CHEN Q, et al. Establishment and characterization of a cell line derived from fin of Mylopharyngodon piceus. Freshwater Fisheries, 2016, 46(2): 3-9 [张雪萍, 曾令兵, 陈倩, 等. 青鱼鳍条组织细胞系的建立及其生物学特性. 淡水渔业, 2016, 46(2): 3-9] |
ZHANG Y Z, LIU D E, FANG Q S, et al. Effects of temperature and salinity on growth and survival rate of young Epinephelus coioides. Journal of Jimei University (Natural Science), 2009, 14(1): 8-13 [张雅芝, 刘冬娥, 方琼珊, 等. 温度和盐度对斜带石斑鱼幼鱼生长与存活的影响. 集美大学学报(自然科学版), 2009, 14(1): 8-13] |
ZHAO C H, WANG M H, ZANG R X, et al. Growth characteristics and tumorigenic of suspension cultured BHK-21 cells. Journal of Northwest Minzu University (Natural Science), 2019, 40(4): 53-59 [赵彩红, 王美皓, 臧荣鑫, 等. 悬浮培养型BHK-21细胞生长特性及成瘤性研究. 西北民族大学学报(自然科学版), 2019, 40(4): 53-59] |
ZHAO L H, JIA J H, ZHANG Y H, et al. The tolerance and growth of three strains of Oreochromis niloticus in salinity-alkalinity water. Progress in Fishery Sciences, 2014, 35(5): 26-32 [赵丽慧, 筴金华, 张艳红, 等. 3种品系尼罗罗非鱼(Oreochromis niloticus)盐碱耐受性和生长比较. 渔业科学进展, 2014, 35(5): 26-32] |
ZHAO Y N, ZHOU H Z, LI W J, et al. Transcriptome analysis of the caudal fin cell line of silver crucian carp (Carassius auratus gibelio)(GiCF) affected by the pesticide phoxim. Genomics and Applied Biology, 2020, 39(11): 4953-4963 [赵燕楠, 周宏正, 李婉娟, 等. 辛硫磷胁迫对异育银鲫细胞基因表达的影响. 基因组学与应用生物学, 2020, 39(11): 4953-4963] |
ZHONG X, RESCORLA F J. Cell surface adhesion molecules and adhesion-initiated signaling: Under-standing of anoikis resistance mechanisms and therapeutic opportunities. Cellular Signalling, 2012, 24(2): 393-401 |
ZHOU G, GUI L, LI Z, et al. Establishment of a Chinese sturgeon Acipenser sinensis tail-fin cell line and its susceptibility to frog iridovirus. Journal of Fish Biology, 2008, 73(8): 2058-2067 |
ZHOU G Z, JING H J. Application development of fish cell lines on virology research. Letters in Biotechnology, 2011, 3: 21-26 [周广舟, 景红娟. 鱼类细胞系在病毒学研究中的应用进展. 生物技术通讯, 2011, 3: 21-26] |
ZUO W G, QIAN H X, XU Y F, et al. Establishment of kidney cell lines CIK from grass carp. Freshwater Fisheries, 1984, 14(2): 38-39 [左文功, 钱华鑫, 许映芳, 等. 草鱼肾脏组织细胞系CIK的建立. 淡水渔业, 1984, 14(2): 38-39] |



