2. 上海海洋大学 水产科学国家级实验教学示范中心 上海 201306;
3. 大连海洋大学水产与生命学院 辽宁 大连 116023
2. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China;
3. College of Fisheries and Life Science, Dalian Ocean University, Dalian, Liaoning 116023, China
白斑综合征是由白斑综合征病毒(white spot syndrome virus, WSSV)引起的水生动物重大传染病,是我国一类动物疫病。该病自20世纪90年代初暴发后,给我国蓬勃发展的中国明对虾(Fenneropenaeus chinensis)养殖造成了毁灭性打击,并迅速扩散至亚洲、美洲和地中海周边等主要的对虾养殖国家和地区,成为全球性的养殖对虾流行病。WSSV的宿主范围极广,可感染几乎所有的水生十足目(Decapoda)甲壳类(OIE, 2016)。1997年起,世界动物卫生组织(OIE)将白斑综合征列入疫病名录,在国际贸易中需进行重点检疫和防控。
近年来,免疫增强剂、中草药、益生菌和水产疫苗等一系列环境友好型的制剂或药物被应用于防治白斑综合征(周进等, 2003; Citarasu, 2009; 孙博超等, 2019)。卵黄抗体(immunoglobulin of yolk, IgY)是鸟类主要的免疫球蛋白,经抗原刺激的母鸡会产生特异性的IgY,并在卵黄中大量累积。IgY能与抗原特异性结合,通过中和作用保护机体(Warr et al, 1995; Xu et al, 2011)。IgY化学性质稳定,生产成本低、收集和纯化过程操作方便,且符合动物福利,作为传统疫苗的替代品已被越来越多地应用于水产养殖疾病防控中。袁雪梅等(2020)研究发现,特异性卵黄抗体对大口黑鲈(Micropterus salmoides)弹状病毒具有明显的中和作用。Qin等(2018)研究发现,特异性卵黄抗体可促进团头鲂(Megalobrama amblycephala)抗嗜水气单胞菌(Aeromonas hydrophila)的感染。Gao等(2016)研究发现,特异性卵黄抗体可提高凡纳滨对虾(Litopenaeus vannamei)抗哈氏弧菌(Vibrio harveyi)和副溶血弧菌(V. parahaemolyticus)感染的能力。在使用特异性卵黄抗体防控白斑综合征方面,Lu等(2009)研究发现,其制备的WSSV卵黄抗体投喂克氏原螯虾(Procambius clarkiaii),可显著降低WSSV攻毒后虾的死亡率。Fu等(2010)研制了WSSV卵黄抗体,分析了其生理生化特性,投喂中国明对虾后可显著提高WSSV攻毒对虾的存活率。韦嵩等(2009)研究发现,口服特异性卵黄抗体可提高凡纳滨对虾免疫酶活力,并增强对虾抗WSSV感染的能力。但目前的研究多以特异性卵黄抗体的制备、生理生化特性分析和应用效果评价为主,较少涉及卵黄抗体对对虾非特异性免疫功能的影响,尚未见有口服卵黄抗体对WSSV感染后对虾免疫酶活力及免疫基因表达水平影响的研究。
本研究将不同剂量的WSSV卵黄抗体添加到饲料中投喂凡纳滨对虾幼虾,28 d后用WSSV人工感染免疫对虾,测定对虾肝胰腺的免疫酶活力及免疫基因表达水平,以及感染后14 d内对虾的存活率,探讨特异性卵黄抗体对WSSV感染对虾的免疫力和免疫保护效果,以期为生产上使用特异性卵黄抗体防控WSSV提供依据,也为卵黄抗体抗对虾病毒机制的研究提供参考。
1 材料与方法 1.1 实验材料实验用凡纳滨对虾购自山东日照某水产养殖公司,体色光亮,活力旺盛,食欲良好,无明显病症,平均体重为(1.26±0.10) g。实验对虾养殖在含150 L过滤海水的圆柱形塑料桶中,盐度为30。实验前,参照Durand等(2002)的方法,使用实时荧光定量PCR (qPCR)检测WSSV,确认为阴性。
实验期间投喂自制饲料。基础饲料配方:鱼粉35%、豆粕28%、面粉26.1%、谷朊粉2%、鱼油2%、虾粉2%、磷脂1.5%、Ca(H2PO4)2 1.5%、胆碱1%、维生素混合物0.3%、矿物质混合物0.5%、维生素C 0.1%。维生素混合物和矿物质混合物的组成见张婷婷等(2017)。在基础饲料配方中分别添加0.2%和0.5% WSSV卵黄抗体制剂,配制成0.2%和0.5%免疫组饲料。基础饲料和2种免疫组饲料均用小型饲料机制成直径为3~4 mm、长度为3~5 mm的颗粒饲料,置于55℃鼓风干燥箱中6 h,烘干后分装,4℃保存。WSSV卵黄抗体制剂由韩国AD BIOTECH有限公司惠赠。
WSSV人工感染实验所用毒种为患白斑综合征的病虾,由依托于中国水产科学研究院黄海水产研究所的世界动物卫生组织(OIE)白斑综合征参考实验室提供,经PCR检测呈WSSV强阳性。取病虾头胸部去除肝胰腺后,剪碎、混合作为感染实验用对虾病料,分成小份,–80℃保存备用。
1.2 实验方法 1.2.1 WSSV卵黄抗体免疫实验免疫实验开始前,将实验对虾暂养1周。待对虾稳定后,选取480尾大小均一、活力良好的对虾,随机分为3个组(2个免疫组,1个对照组),每组160尾虾。免疫组分别投喂0.2%和0.5%免疫组饲料,对照组投喂基础饲料,持续投喂28 d。实验期间,连续充气,水温控制在(28±2)℃。每天投喂3次,日投喂量约为对虾体重的5%。24 h换水1次,换水量为养殖水体的1/3。
1.2.2 WSSV人工感染实验免疫实验28 d后,对0.2%免疫组、0.5%免疫组和对照组的对虾进行WSSV人工感染实验。每组各取120尾对虾,分别随机分入4个桶中,每桶30尾对虾。通过WSSV人工感染预实验确定本批对虾病料有效感染剂量为0.07 g/尾。人工感染前12 h停食,次日上午投喂–80℃保存的对虾病料。每天记录对虾的死亡情况,及时捞出死虾,使用qPCR方法检测濒死对虾体内的WSSV (Durand et al, 2002)。14 d后结束人工感染实验,统计各组对虾的存活率,计算WSSV卵黄抗体对凡纳滨对虾的相对免疫保护率(relative percentage of survival, RPS)。感染实验期间,养殖管理同1.2.1,各实验组继续投喂相应的免疫饲料或基础饲料。
1.2.3 肝胰腺样品的采集人工感染3 d后,每个实验组各取3尾对虾,取肝胰腺组织分成2份,置于液氮中速冻,然后,转移至–80℃冰箱中保存,分别用于测定免疫酶活力和免疫基因表达水平。
1.2.4 肝胰腺免疫酶活力测定准确称取各实验组肝胰腺组织,加入等质量的预冷0.85% NaCl溶液,混合后用组织研磨器6000~8000 r/min匀浆。然后加入9倍质量的预冷0.85% NaCl溶液,混匀后,4℃ 2700 r/min离心5 min,取上清液进行检测。
采用南京建成生物工程研究所的试剂盒,分别测定样品的酸性磷酸酶(ACP)、碱性磷酸酶(AKP)、超氧化物歧化酶(SOD)活力及总蛋白浓度,具体操作按试剂盒说明书进行。酚氧化酶(PO)活力测定参考雷质文等(2001)的方法进行,操作步骤:在酶标板中加入200 µL的0.1 mol/L pH 6.0的磷酸钾盐缓冲液、10 µL的0.01 mol/L的L-多巴(L-dopa)及10 µL肝胰腺上清液,于室温下混匀,在490 nm波长下每间隔2 min读取吸光值。在本实验条件下,每分钟每克蛋白吸光值增加0.001定义为1个活力单位(U/g prot)。
1.2.5 肝胰腺免疫基因表达水平测定使用逆转录实时荧光定量PCR (RT-qPCR)方法测定肝胰腺免疫基因表达水平。凡纳滨对虾免疫基因的检测引物信息见表 1。用QIAGEN RNeasy Mini Kit提取对虾肝胰腺样品总RNA,用Nanodrop 2000c (Thermo, 美国)测定RNA的质量及浓度。采用一步法反转录试剂盒(全式金),按试剂盒说明书合成cDNA,保存于–20℃备用。
|
|
表 1 凡纳滨对虾免疫基因表达水平检测用引物 Tab.1 Primers for detection of immune gene expression level in L. vannamei |
使用TaKaRa公司的TB Green Premix Ex Taq Ⅱ荧光定量试剂盒,以内参基因(β-actin)为参比,测定样品的热休克蛋白70基因(Hsp70)、凝集素基因(lectin)和β-1, 3-葡聚糖结合蛋白-脂蛋白基因(β-GBP-HDL)的表达水平,具体操作方法参照试剂盒说明书。
PCR反应总体积为25 µL,包括2×TB Green Premix Ex Taq Ⅱ 12.5 µL,cDNA模板1 µL,上下游引物各1 µL (10 µmol/L),DEPC处理水9.5 µL。PCR反应程序:95℃,30 s;95℃ 5 s,60℃ 1 min,40个循环。
1.2.6 数据处理与分析对肝胰腺免疫基因表达水平的RT-qPCR实验结果,采用2‒ΔΔCt法进行相对定量分析。采用SPSS 25.0软件对实验数据进行单因素方差分析(one-way ANOVA),以Duncan´s多重比较进行不同处理间的显著性分析,P < 0.05为差异显著。
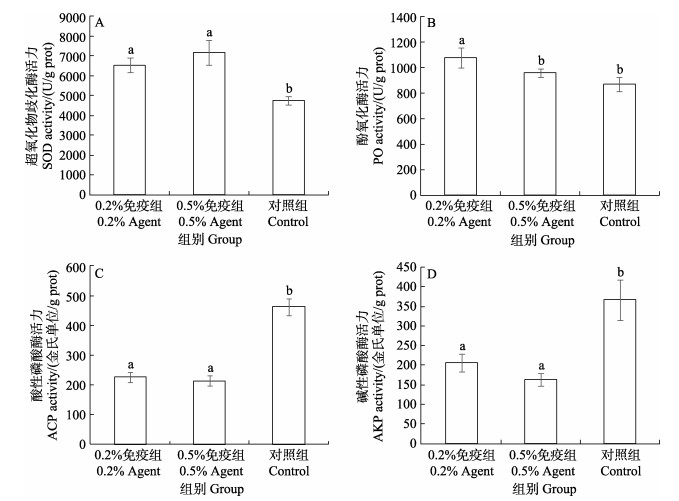
2 结果 2.1 WSSV感染凡纳滨对虾的肝胰腺免疫酶活力用WSSV卵黄抗体免疫28 d后,采用投喂的方式,使用含WSSV的对虾病料对各实验组凡纳滨对虾进行人工感染。感染3 d后,各组凡纳滨对虾肝胰腺免疫酶活力测定结果显示,0.2%和0.5%免疫组SOD活力均显著高于对照组(P < 0.05),0.2%和0.5%免疫组差异不显著(图 1A)。0.2%免疫组PO活力显著高于0.5%免疫组和对照组(P < 0.05),0.5%免疫组与对照组差异不显著(图 1B)。0.2%免疫组和0.5%免疫组ACP和AKP活力均显著低于对照组(P < 0.05),0.2%免疫组和0.5%免疫组差异不显著(图 1C、图 1D)。
|
图 1 WSSV卵黄抗体制剂对人工感染后凡纳滨对虾肝胰腺免疫酶活力的影响 Fig.1 Effects of WSSV IgY agent on the activity of immune enzymes in the hepatopancreas of L. vannamei after WSSV infection 同一免疫酶不同字母代表差异显著(P < 0.05)。 Different letters in the same immune enzyme mean significant difference (P < 0.05). |
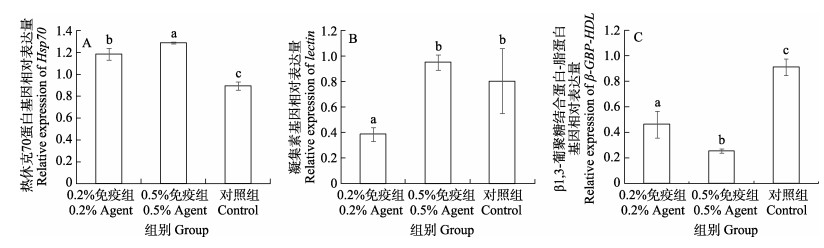
经WSSV卵黄抗体免疫28 d,再用含WSSV的对虾病料人工感染3 d后,各组凡纳滨对虾肝胰腺免疫基因表达水平测定结果显示,0.2%和0.5%免疫组Hsp70表达水平均显著高于对照组(P < 0.05),且0.5% 免疫组显著高于0.2%免疫组(P < 0.05)(图 2A)。0.5%免疫组和对照组lectin表达水平均显著高于0.2%免疫组(P < 0.05)(图 2B)。0.2%和0.5%免疫组β-GBP-HDL表达水平均显著低于对照组(P < 0.05),且0.5%免疫组显著低于0.2%免疫组(图 2C)(P < 0.05)。
|
图 2 WSSV卵黄抗体制剂对人工感染后凡纳滨对虾肝胰腺免疫基因表达水平的影响 Fig.2 Effects of WSSV IgY agent on the expression of immune genes in the hepatopancreas of L. vannamei after WSSV infection 同一基因不同字母代表差异显著(P < 0.05)。 Different letters in the same immune gene mean significant difference (P < 0.05). |
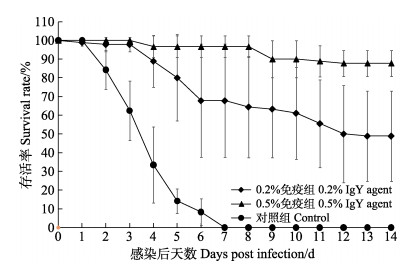
用含WSSV卵黄抗体制剂的饲料投喂28 d后,使用含WSSV的对虾病料对各实验组凡纳滨对虾进行人工感染。感染后第2天,对照组对虾即开始大量死亡,死亡率为15.73%;而0.2%免疫组对虾仅有极少量死亡,死亡率为2.22%,0.5%免疫组对虾无死亡。感染后的第7天,对照组对虾全部死亡,此时,0.2%和0.5%免疫组对虾的累积死亡率分别为32.22%和3.33%,均显著低于对照组(P < 0.05)。感染后的前10 d,0.2%和0.5%免疫组对虾的存活率差异不显著,但均显著高于对照组(P < 0.05)。感染后第11—14天,0.2%免疫组对虾仍持续死亡,而0.5%免疫组对虾几乎不再死亡,此时,0.5%免疫组存活率显著高于0.2%免疫组(P < 0.05)(图 3)。
|
图 3 WSSV投喂感染后各组凡纳滨对虾的存活率 Fig.3 Survival rate of L. vannamei after WSSV infection WSSV投喂感染前及感染期间,0.2%和0.5%免疫组分别投喂添加有0.2%和0.5% WSSV卵黄抗体制剂的饲料,对照组投喂基础饲料。 Before and during WSSV infection, the 0.2% and 0.5% IgY agent groups were fed diet containing 0.2% and 0.5% WSSV IgY agent, respectively. The control group was fed basic diet. |
人工感染实验结束时(攻毒后第14天),0.2%和0.5%免疫组对虾的存活率分别为48.89%和87.78%,均显著高于对照组(存活率为0)(P < 0.05),且0.5%免疫组显著高于0.2%免疫组(P < 0.05)。添加0.2%和0.5% WSSV卵黄抗体制剂对凡纳滨对虾的相对免疫保护率分别为48.89%和87.78%。死亡对虾的WSSV qPCR检测结果均呈强阳性。显然,WSSV卵黄抗体制剂能够在一定程度上改变疾病的历程,延迟对虾的发病和死亡时间,提高同期存活率,显著提高凡纳滨对虾抗WSSV感染的能力。
3 讨论 3.1 特异性卵黄抗体对感染WSSV对虾的肝胰腺免疫酶活力的影响对虾的免疫系统以非特异性为主,主要包括细胞免疫和体液免疫。细胞免疫包括血细胞的吞噬、包囊化及结节的形成,而体液免疫则包括酚氧化酶原激活系统、凝集素的凝集作用、溶血素的产生和一系列抗菌肽和抗病毒多肽的形成(Bachere et al, 2004; Vazquez et al, 2009)。ACP、AKP、SOD、PO是对虾体内重要体液免疫因子,其在抵抗WSSV的过程中具有重要作用(韦嵩等, 2009; Kumaran et al, 2018)。陈辉辉等(2017)先用复方中草药投喂凡纳滨对虾,再用WSSV攻毒,0—96 h内对虾的AKP和ACP活力呈先上升后下降的趋势。本研究结果显示,使用WSSV攻毒3 d后,0.2%和0.5%免疫组对虾的ACP和AKP活力均显著低于对照组,与上述研究结果相一致。推测该现象可能与WSSV感染后对虾为抵御病毒入侵而进行免疫调节有关。韦嵩等(2009)研究口服WSSV卵黄抗体后、使用WSSV攻毒前凡纳滨对虾血清的免疫酶活力,结果表明,WSSV卵黄抗体可提高凡纳滨对虾血清的PO和SOD活力,增强对虾抗WSSV的能力。但上述研究缺少WSSV攻毒后凡纳滨对虾免疫酶活力的数据,也未测定对虾免疫相关基因表达水平的变化。本研究测定了WSSV攻毒后免疫凡纳滨对虾的免疫力数据,为深入分析特异性卵黄抗体对凡纳滨对虾抗WSSV感染的免疫保护机制提供了参考。Rajesh Kumar等(2008)使用DNA疫苗免疫斑节对虾(Penaeus monodon),免疫组对虾的PO和SOD活力显著升高,攻毒后,免疫组对虾存活率显著高于对照组,推测这些免疫因子可能参与抵抗WSSV。本研究也发现,0.2%和0.5%免疫组的SOD活力均显著高于对照组,0.2%免疫组PO活力显著高于0.5%免疫组和对照组。这表明WSSV卵黄抗体有效激活了凡纳滨对虾的抗氧化防御系统,提高了机体吞噬和清除病原体的能力,从而增强了对虾的抗病毒能力。
3.2 特异性卵黄抗体对感染WSSV对虾的肝胰腺免疫基因表达水平的影响热休克蛋白70在甲壳类动物天然免疫和应对病原体感染中发挥着重要作用(Pockley et al, 2008),Hsp70表达水平与应激耐受能力呈正相关(张红波等, 2009)。王春迪等(2016)研究表明,在水体中添加蜡样芽孢杆菌(Bacillus cereus) PC46可提高凡纳滨对虾抗WSSV感染能力,益生菌处理组的Hsp70表达量在WSSV感染后呈显著上调趋势。与上述研究类似,本研究中,0.2%和0.5%免疫组Hsp70表达水平均显著高于对照组,表明WSSV卵黄抗体能提高对虾抗WSSV的能力。凝集素在对虾抵御细菌和病毒感染方面发挥着重要作用,可作为对虾抗病毒和细菌感染的潜在生物标志物(Liu et al, 2007)。Ma等(2007)研究发现,凡纳滨幼虾感染WSSV后,肝胰腺中的lectin表达水平相比于对照组在最初的2 h下降,4 h后升到更高的水平。本研究中,0.5%免疫组lectin表达水平高于对照组,但差异不显著;0.2%免疫组lectin表达水平显著低于对照组。推测WSSV卵黄抗体可以调节lectin的表达水平,其具体调节机制还需进一步研究。β-1, 3-葡聚糖结合蛋白-脂蛋白在激活酚氧化酶原系统和凝结过程中起着重要作用,是甲壳动物对抗病毒感染的一个重要免疫因子。本研究结果显示,WSSV攻毒后,0.2%和0.5%免疫组β-GBP-HDL基因的相对表达水平均显著低于对照组,与ACP和AKP活力具有相似的变化趋势。推测虾体感染病毒后,这些免疫因子在抗原识别和免疫系统激活阶段发挥作用,因过度消耗而下降,但仍需进一步研究口服WSSV卵黄抗体后对虾免疫因子的动态变化予以证实。
3.3 特异性卵黄抗体对凡纳滨对虾抗WSSV感染的保护效果研究表明,口服0.05%~1% WSSV卵黄抗体均可显著提高虾类抗WSSV感染的能力(Lu et al, 2009; Fu et al, 2010; 韦嵩等, 2009)。本研究结果显示,添加0.2%和0.5% WSSV卵黄抗体制剂对凡纳滨对虾均有显著的保护作用,其相对免疫保护率分别为48.89%和87.78%,0.5%添加量的保护效果更好。此外,本研究发现,使用WSSV卵黄抗体免疫凡纳滨对虾,还能在一定程度上改变白斑综合征的发病进程,延迟免疫对虾的发病和死亡时间,提高同期存活率,这与韦嵩等(2009)的研究结果相类似。推测卵黄抗体具有双重抗病机制,一方面可以与病原特异性结合,起到中和特定病原的作用(Gadde et al, 2015);另一方面可以刺激非特异性免疫系统,增强机体的抗病能力(Zhen et al, 2008)。由此可见,特异性卵黄抗体可有效地用于动物的被动免疫,在疾病控制方面具有极大的潜力。
综上所述,本研究报道了口服特异性卵黄抗体对WSSV感染后的对虾肝胰腺中的4种免疫酶活力和3种免疫基因表达水平的影响,表明在饲料中添加WSSV卵黄抗体制剂,可增强凡纳滨对虾的非特异性免疫机能和抗WSSV感染的能力,显著提高感染对虾的存活率。研究结果为卵黄抗体抗WSSV感染机制的研究提供了参考,也为在生产上使用卵黄抗体防控WSSV感染提供了科学依据。特异性卵黄抗体作为一种环境友好的新型免疫制剂能激活和调节凡纳滨对虾免疫系统,在防控对虾白斑综合征方面具有极大的潜在价值。
致谢: 本研究使用的自制对虾饲料由中国水产科学研究院黄海水产研究所梁萌青老师协助制作,人工感染用对虾病料由中国水产科学研究院黄海水产研究所杨冰老师提供,在此一并致谢。
BACHERE E, GUEGUEN Y, GONZALEZ M, et al. Insights into the anti-microbial defense of marine invertebrates: The penaeid shrimps and the oyster Crassostrea gigas. Immunological Reviews, 2004, 198(1): 149-168 DOI:10.1111/j.0105-2896.2004.00115.x |
CHEN H H, TU C L, TANG Y, et al. Effects of compound Chinese herbs on immune activities of Litopenaeus vannamei after infected with white spot syndrome virus. Journal of Xiamen University (Natural Science), 2017, 56(5): 686-692 [陈辉辉, 涂晨凌, 唐杨, 等. 复方中草药对白斑综合征病毒感染下凡纳滨对虾免疫活性的影响. 厦门大学学报(自然科学版), 2017, 56(5): 686-692] |
CITARASU T. Herbal biomedicines: A new opportunity for aquaculture industry. Aquaculture International, 2009, 18(3): 403-414 |
DURAND S V, LIGHTNER D V. Quantitative real time PCR for the measurement of white spot syndrome virus in shrimp. Journal of Fish Diseases, 2002, 25(7): 381-389 DOI:10.1046/j.1365-2761.2002.00367.x |
FU L L, WANG Y B, LI J R, et al. Protection of Fenneropenaeus chinensis (Osbeck, 1765) against the white spot syndrome virus using specific chicken egg yolk immunoglobulins by oral delivery. Aquaculture Research, 2010, 41(12): 1806-1816 DOI:10.1111/j.1365-2109.2010.02558.x |
GADDE U, RATHINAM T, LILLEHOJ H S. Passive immunization with hyperimmune egg-yolk IgY as prophylaxis and therapy for poultry diseases - A review. Animal Health Research Reviews, 2015, 16(2): 163-176 DOI:10.1017/S1466252315000195 |
GAO X J, ZHANG X J, LIN L, et al. Passive immune-protection of Litopenaeus vannamei against Vibrio harveyi and Vibrio parahaemolyticus infections with anti-Vibrio egg yolk (IgY)- encapsulated feed. International Journal of Molecular Sciences, 2016, 17(5): 723 DOI:10.3390/ijms17050723 |
KUMARAN T, THIRUMALAIKUMAR E, LELIN C, et al. Physicochemical properties of anti Vibrio harveyi egg yolk antibody (IgY) and its immunological influence in Indian white shrimp Fenneropenaeus indicus. Fish and Shellfish Immunology, 2018, 74: 349-362 DOI:10.1016/j.fsi.2017.12.062 |
LEI Z W, HUANG J, YANG B, et al. Immune factors in haemolymph supernatant of Penaeus chinensis infected by WSSV. Journal of Fishery Sciences of China, 2001, 8(4): 46-51 [雷质文, 黄倢, 杨冰, 等. 感染白斑综合症病毒(WSSV)对虾相关免疫因子的研究. 中国水产科学, 2001, 8(4): 46-51 DOI:10.3321/j.issn:1005-8737.2001.04.011] |
LIU Y C, LI F H, DONG B, et al. Molecular cloning, characterization and expression analysis of a putative C-type lectin (Fclectin) gene in Chinese shrimp Fenneropenaeus chinensis. Molecular Immunology, 2007, 44(4): 598-607 DOI:10.1016/j.molimm.2006.01.015 |
LU Y, LIU J, JIN L, et al. Passive immunization of crayfish (Procambius clarkiaii) with chicken egg yolk immunoglobulin (IgY) against white spot syndrome virus (WSSV). Applied Biochemistry and Biotechnology, 2009, 159(3): 750 DOI:10.1007/s12010-009-8555-6 |
MA T H T, TIU S H K, HE J G, et al. Molecular cloning of a C-type lectin (LvLT) from the shrimp Litopenaeus vannamei: Early gene down-regulation after WSSV infection. Fish and Shellfish Immunology, 2007, 23(2): 430-437 DOI:10.1016/j.fsi.2006.12.005 |
OIE. Manual of diagnostic tests for aquatic animals. 7th Edition. Paris: OIE, 2016: 186-199
|
QIN Z D, BABU V S, LI N Q, et al. Protective effects of chicken egg yolk immunoglobulins (IgY) against experimental Aeromonas hydrophila infection in blunt snout bream (Megalobrama amblycephala). Fish and Shellfish Immunology, 2018, 78: 26-34 DOI:10.1016/j.fsi.2018.04.001 |
POCKLEY A G, MUTHANA M, CALDERWOOD S K. The dual immunoregulatory roles of stress proteins. Trends in Biochemical Sciences, 2008, 33(2): 71-79 DOI:10.1016/j.tibs.2007.10.005 |
RAJESH KUMAR S, ISHAQ AHAMED V P, SARATHI M, et al. Immunological responses of Penaeus monodon to DNA vaccine and its efficacy to protect shrimp against white spot syndrome virus (WSSV). Fish and Shellfish Immunology, 2008, 24(4): 467-478 DOI:10.1016/j.fsi.2008.01.004 |
SUN B C, YANG Y K, LI Y H, et al. Effects of single or mixed Bacillus on WSSV infection and immune-related gene expression in Litopenaeus vannamei. Progress in Fishery Sciences, 2019, 40(3): 113-121 [孙博超, 杨运楷, 李玉宏, 等. 饲料中添加复合芽孢杆菌对凡纳滨对虾抗病毒感染能力及抗病基因表达的影响. 渔业科学进展, 2019, 40(3): 113-121] |
VAZQUEZ L, ALPUCHE J, MALDONADO G, et al. Immunity mechanisms in crustaceans. Innate Immunity, 2009, 15(3): 179-188 DOI:10.1177/1753425909102876 |
WANG C D, SONG X L, ZHANG X J, et al. Effects of adding Bacillus cereus PC465 to rearing water on disease resistance of Litopenaeus vannamei. Journal of Fishery Sciences of China, 2016, 23(1): 146-155 [王春迪, 宋晓玲, 张晓静, 等. 养殖水体中添加蜡样芽孢杆菌PC465对凡纳滨对虾抗病力的影响. 中国水产科学, 2016, 23(1): 146-155] |
WARR G W, MAGOR K E, HIGGINS D A. IgY: Clues to the origins of modern antibodies. Immunology Today, 1995, 16(8): 392-398 DOI:10.1016/0167-5699(95)80008-5 |
WEI S, SONG X L, LI H B, et al. Effects of Ig-guard (shrimp) on immunity-related enzyme activities and WSSV resistance of Litopenaeus vannamei. Journal of Fisheries of China, 2009, 33(1): 112-118 [韦嵩, 宋晓玲, 李海兵, 等. 白斑综合征病毒卵黄抗体对凡纳滨对虾免疫相关酶活力和抗病毒能力的影响. 水产学报, 2009, 33(1): 112-118] |
XU Y P, LI X Y, JIN L J, et al. Application of chicken egg yolk immunoglobulins in the control of terrestrial and aquatic animal diseases: A review. Biotechnology Advances, 2011, 29(6): 860-868 DOI:10.1016/j.biotechadv.2011.07.003 |
YUAN X M, LÜ S J, SHI W D, et al. Isolation and egg-yolk antibody preparation of Micropterus salmonides rhabdovirus. Progress in Fishery Sciences, 2020, 41(3): 151-157 [袁雪梅, 吕孙建, 施伟达, 等. 大口黑鲈弹状病毒的分离培养及其卵黄抗体的制备. 渔业科学进展, 2020, 41(3): 151-157] |
ZHANG H B, WAN Y T, WANG L Z, et al. The protection and regulation of Hsp70 in cellular stress response. China Practical Medicine, 2009, 14(4): 228-229 [张红波, 万亚涛, 王莲哲, 等. 在细胞应激反应中HSP70的保护与调节作用. 中国实用医药, 2009, 14(4): 228-229 DOI:10.3969/j.issn.1673-7555.2009.04.190] |
ZHANG T T, CHEN X R, LIANG M Q, et al. Effects of different protein hydrolysates on growth performance and non-specific immunity of Japanese seabass (Lateolabrax japonicus). Progress in Fishery Sciences, 2017, 38(3): 96-105 [张婷婷, 陈效儒, 梁萌青, 等. 不同蛋白水解物对花鲈(Lateolabrax japonicus)生长性能及非特异性免疫的影响. 渔业科学进展, 2017, 38(3): 96-105] |
ZHEN Y H, JIN L J, GUO J, et al. Characterization of specific egg yolk immunoglobulin (IgY) against mastitis-causing Escherichia coli. Veterinary Microbiology, 2008, 130(1/2): 126-133 |
ZHOU J, HUANG J, SONG X L. Applications of immunostimulants in aquaculture. Marine Fisheries Research, 2003, 24(4): 70-79 [周进, 黄倢, 宋晓玲. 免疫增强剂在水产养殖中的应用. 海洋水产研究, 2003, 24(4): 70-79] |



