2. 中国水产科学研究院黄海水产研究所 农业农村部海洋渔业可持续发展重点实验室 山东 青岛 266071
2. Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture and Rural Affairs, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao, Shandong 266071, China
微孢子虫感染对虾肝胰腺最早发现于马来西亚养殖斑节对虾(Penaeus monodon)中(Anderson et al, 1989)。Hudson等(2001)报道,日本对虾(Penaeus japonicus)中也存在微孢子虫感染。Chayaburakul等(2004)发现,泰国养殖斑节对虾生长缓慢可能与包括微孢子虫在内的多种病原有关。Tourtip等(2009)将感染对虾肝胰腺的一类微孢子虫正式命名虾肝肠胞虫(Enterocytozoon hepatopenaei, EHP)。此后,越南、印度尼西亚、印度、中国、委内瑞拉等国家养殖对虾中都相继检出EHP (Jaroenlak et al, 2018)。近年来,EHP在我国养殖对虾中流行率居高不下,已成为危害我国养殖对虾的重要病原之一(农业农村部渔业渔政管理局等, 2020)。
EHP在分类上属微孢子纲(Microsporea)、肠胞虫科(Enterocytozoonidae)、肠胞虫属(Enterocytozoon) (Sprague et al, 1992; Tourtip et al, 2009)。对虾感染EHP后生长缓慢,但通常不会发生死亡(Biju et al, 2016; 黄倢等, 2016; 姜宏波等, 2020);EHP感染对虾早期可正常摄食、无明显病症(Remany et al, 2017),感染2~3个月后才出现摄食减少、生长缓慢甚至停止生长等现象(胡吉卉等, 2020; Aranguren et al, 2017),给对虾养殖产业造成极大的经济损失(宋增磊等, 2019)。目前,尚无商品化药物可有效杀灭对虾体内的EHP,对虾养殖过程中开展EHP早期检测或监测,阻断其进入养殖系统极为重要。EHP直径仅为1 μm,用光镜直接观察和确认较为困难(Tourtip et al, 2009),而EHP的组织学检测法流程繁琐、耗时长,且极易漏诊。分子生物学方法更适用于EHP检测,目前最常用的方法为套式PCR和荧光定量PCR法,但这2种方法需要基因扩增仪等精密仪器,限制了其在基层养殖现场的应用。
作者前期利用环介导等温扩增(loop-mediated isothermal amplification, LAMP)技术建立了EHP的现场快速检测法,开发制备了其现场检测试剂盒。为系统测试该检测试剂盒的检测性能参数,本研究参照世界动物卫生组织(OIE)《水生动物诊断手册》、农业农村部公告第683号和质检行业标准等规范性文件要求,对试剂盒的分析特异性(analytical specificity, ASp)、分析灵敏度(analytical sensitivity, ASe)、诊断特异性(diagnostic sensitivity, DSe)、诊断灵敏度(diagnostic specificity, DSp)、重复性和稳定性等性能开展了系统测试和评价。
1 材料与方法 1.1 病原阳性样品及实验动物虾肝肠胞虫(EHP)、偷死野田村病毒(CMNV)、白斑综合征病毒(WSSV)、致急性肝胰腺坏死病副溶血弧菌(VpAHPND)、传染性皮下及造血组织坏死病毒(IHHNV)和虾血细胞虹彩病毒(SHIV)等病原阳性核酸由作者实验室制备保存。
2019年10月从山东省海阳市某养殖场购入健康凡纳滨对虾活虾250尾,经TaqMan探针荧光定量PCR (TaqMan-qPCR)方法检测显示为EHP阴性。从山东省潍坊某养殖场采集典型生长缓慢症状凡纳滨对虾(Litopenaeus vannamei)样品,其中48份样品经TaqMan-qPCR法(Liu et al, 2018)检测为EHP阳性,将其作为EHP阳性病料样品。
1.2 主要仪器与试剂主要仪器:ABI VERITI 96-Wel梯度PCR仪(美国, 加利福尼亚),BIO-Rad CFX实时荧光定量PCR仪(美国, 加利福尼亚);Eppendorf离心机(德国, Saxony),博日恒温金属浴(中国, 杭州),佳能70D照相机(日本, 大分县)。
主要试剂:FIP/BIP/F3/B3/LF/LB引物[生工生物工程(上海)股份有限公司],Ex Taq酶,10×Isothermal Amplification Buffer,MgSO4,Betaine(Sigma, 美国),dNTPs (索莱宝, 中国, 北京)以及Bst 2.0 WarmStart® DNA Polymerase (NEB, 美国),TIANGEN (中国, 北京)海洋动物组织基因组DNA提取试剂盒,TaKaRa (中国, 大连)质粒小提取试剂盒。
1.3 组织样品DNA提取对1.1中的298份样品进行编号,每尾对虾用医用刀片切取鳃与肝胰腺组织60 mg,将样品均分为两等份:一份为检测样品,按海洋动物组织基因组DNA提取试剂盒制备组织DNA,溶解于60 μL洗脱缓冲液(TE)中,Thermo NanoDrop 2000c测定核酸浓度,并保存于–40℃冰箱中;另一份样品同上编号,用冻存管保存,用于EHP诊断灵敏度和诊断特异性测试。
1.4 EHP靶基因重组质粒标准品制备为比较检测试剂盒和TaqMan-qPCR检测的灵敏度,用试剂盒的2条外引物(表 1 F3和B3)对EHP阳性核酸进行PCR扩增,获得包含有EHP靶基因的目标片段,按照李小平(2018)的方法构建含EHP片段的重组质粒。TaKaRa质粒提取试剂盒提取重组质粒DNA,NanoDrop 2000c测定重组质粒DNA浓度,质粒置于–40℃保存备用。按下列公式计算质粒拷贝数:
|
|
表 1 EHP-LAMP引物序列 Tab.1 EHP-LAMP primer sequences |
拷贝数=6.02×l023拷贝数/摩尔×(质粒浓度)/(含插入片段的质粒长度×660)。
适量1×TE缓冲液对已知拷贝数的EHP阳性质粒DNA进行10倍浓度梯度稀释,制备浓度为5.05×100~ 5.05×107 copies/μL EHP阳性质粒标准品,–80℃保存,用于分析灵敏度测定。
扩增EHP靶基因片段的PCR反应体系:2× Reaction buffer 12.5 μL;EHP-F1 (10 mmol/L) 0.5 μL;EHP-R1 (10 mmol/L) 0.5 μL;无菌双蒸水10 μL;PCR反应程序:94℃变性5 min;30个循环:94℃ 30 s,59℃ 30 s,72℃ 30 s;72℃延伸5 min。
1.5 EHP检测试剂盒检测流程EHP现场快速检测试剂盒按以下步骤开展样品检测:
(1) 样品采集:将待测对虾样品置于无菌培养皿中,用医用刀片切取黄豆粒大小的肝胰腺组织,放入试剂盒的样品采集管中,快速将组织样品研磨成浆状,将采样用膜片放入浆状样品中充分浸润,随后把膜片转移到采样用膜片小管中。
(2) 膜片处理:向采样用膜片小管内加入30 μL试剂盒提供的A液,轻轻搅动膜片10 s后,将采样用膜片转移至装有漂洗液的管内震荡漂洗1 min,然后将漂洗完的采样用膜片和试剂盒提供的阴性对照膜片、阳性对照膜片转移至核酸变性管内,95℃保温3 min,取出置于室温冷却2 min。
(3) 扩增反应:将上述变性冷却后的膜片转移到对应编号的核酸检测管内,在63℃条件下保温60 min进行扩增反应。
(4) 检测管显色:将检测管置于95℃的金属浴中保温3 min,然后取出检测管,将其迅速上下用力甩动10 s,使检测管内盖上预置的核酸染料融化并与检测管内的反应液充分混匀。
(5) 结果判定:待检测管温度降至室温后,将其放置于黑色背景下观察颜色;加入阴性膜片的检测管为橙红色,加入阳性膜片的反应管为荧光绿色,根据试剂盒自带的比色卡判断样品的检测结果。
1.6 EHP检测试剂盒性能参数评价 1.6.1 分析特异性(ASp)测试随机选取4套同一批制成的EHP现场快速高灵敏检测试剂盒,分别检测EHP、CMNV、WSSV、VpAHPND、SHIV和IHHNV的阳性核酸样品,每份样品做3个重复。具体检测方法:各取1 μL上述阳性核酸样品直接加入检测管内,63℃金属浴中保温60 min后显色,评估试剂盒的ASp。

|
图 1 EHP现场快速检测试剂盒 Fig.1 High sensitive kit for rapid detection of EHP in field |
为了测试EHP现场快速高灵敏检测试剂盒检测EHP标准质粒样品的分析灵敏度,以5.05×100~5.05×107 copies/μL的EHP阳性质粒标准品为模板,分别采用试剂盒(同一批制作的试剂盒随机选取20套)及套式PCR方法进行ASe测试。试剂盒检测的具体流程为:将5.05×100~ 5.05×107 copies/μL的EHP阳性质粒标准品在95℃预变性5 min,然后取1 μL加入试剂盒检测管,将检测管放入63℃金属浴中保温60 min进行显色反应。5.05×107~5.05×103 copies/μL及5.05×100 copies/μL的EHP阳性质粒标准品设置3个重复,5.05×102~5.05× 101 copies/μL EHP阳性质粒标准品设置10个重复。ASe的检测结果根据50%平行样品检出阳性结果的最低EHP阳性质粒标准品浓度来决定。
1.6.3 诊断特异性(DSp)和诊断灵敏度(DSe)测试根据OIE《水生动物诊断手册》1.2章“感染性疫病诊断分析验证的原理和方法”中关于若拟使DSp和DSe测试的可靠性在“95%以上置信区间、允许误差2%范围”内,需要利用试剂盒和参比方法对279份或以上临床样品进行逐个检测并对比的要求。本研究利用EHP现场快速高灵敏检测试剂盒和已报道的EHP TaqMan-qPCR法对298份临床样品进行对比测试,然后根据试剂盒检测与TaqMan-qPCR检测的结果,利用根据计算公式:DSp=试剂盒阴性数/(试剂盒阴性数+试剂盒假阳性数)×100%,DSe=试剂盒阳性数/(试剂盒阳性数+试剂盒假阴性数)×100%,对EHP检测试剂盒的DSp和DSe进行评估。
1.6.4 重复性实验用EHP TaqMan-PCR法检测患病对虾临床组织样品DNA,根据检测结果确定“在30个循环内起峰的临床组织样品作为EHP强阳性样品”、“在30~35个循环内起峰的临床组织样品作为EHP弱阳性样品”“在39个循环内未起峰的临床组织样品作为EHP阴性样品”(Liu et al, 2018),并利用上述3类临床组织样品对EHP的现场快速高灵敏检测试剂盒进行重复性测试。利用上述3类临床组织样品对同一批次生产的EHP检测试剂盒进行批内重复性测试,利用上述3类临床组织样品对3个批次生产的EHP检测试剂盒进行批次间重复性测试。将EHP检测试剂盒的采样用膜片分别浸润于待测的3类临床组织样品匀浆液中,然后按照试剂盒说明书要求进行膜片漂洗和变性处理,最后,将每类临床组织样品浸润的膜片(EHP强阳性、弱阳性、阴性)置于8个EHP检测管中进行扩增,扩增结束后观察检测管显色情况,并根据试剂盒提供的比色卡统计记录检测结果情况:检测管中荧光绿色信号强度为比色卡中3个以上“+”,判为强阳性;检测管中荧光绿色信号强度为比色卡中1~2个“+”,判为弱阳性;检测管中荧光绿色信号强度为比色卡中“–”,判为阴性。
1.6.5 稳定性测试抽取3个批次生产的试剂盒,每个批次的试剂盒均分为2组分别进行稳定性测试。2组稳定性测试实验为:第1组试剂盒全程在–40℃储存,前12个月每4个月抽检1次;第2组试剂盒全程在–20℃储存,每月抽检1次,每次抽检同一批试剂盒中的3个检测管。为了保证测试的可靠性和可比性,采用5.05×105 copies/μL的EHP阳性质粒标准品作为模板用于EHP检测试剂盒的稳定性测试。测试过程中,根据反应后EHP检测管显色与试剂盒内标准比色卡的比对结果判断EHP试剂盒内扩增体系是否有效。
2 结果 2.1 分析特异性(ASp)测试结果当利用WSSV、VpAHPND、CMNV、IHHNV和SHIV等5种病原的阳性核酸样品进行测试时,本研究EHP检测试剂盒的检测管均显示为橙红色,判断为EHP阴性;3份EHP阳性核酸样品经检测,其检测管均显示为绿色,判断为EHP阳性。上述结果表明,本研究的EHP检测试剂盒与上述5种对虾病原核酸均无交叉反应(图 2)。
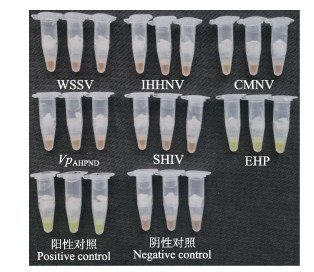
|
图 2 EHP检测试剂盒的ASp测试结果 Fig.2 The result of analytical specificity of the EHP detection kit |
利用EHP检测试剂盒与TaqMan-qPCR方法对EHP阳性质粒标准品的10倍梯度稀释液(5.05×100~ 5.05×107 copies/μL)分别进行检测,依据检测结果判定EHP的检测试剂盒相比于TaqMan-qPCR方法的分析灵敏度(ASe)。测试结果显示,当检测管中加入103~107拷贝的EHP阳性质粒标准品时,检测管显色后均为亮绿色,颜色亮度均在比色卡“+++”阳性显色亮度以上;当检测管中加入102拷贝的EHP阳性质粒标准品时,检测管显示的绿色亮度在比色卡“++”水平;当检测管中加入101拷贝的EHP阳性质粒标准品时,检测管显示的绿色亮度处于比色卡“++”~“+”水平,但EHP检测试剂盒对101拷贝EHP阳性质粒标准品的检出率为50%;另外,试剂盒检测100拷贝EHP阳性质粒标准品时,其显色为橙色,检测结果判定为阴性。综合上述结果,EHP检测试剂盒的ASe为101 copies/反应(图 3)。
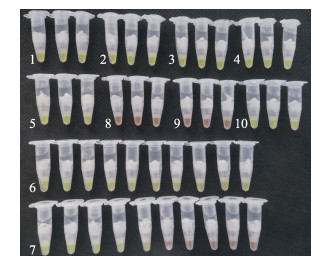
|
图 3 EHP的检测试剂盒相比于TaqMan-qPCR检测方法ASe测试结果 Fig.3 Comparison of analytical sensitivity of EHP TaqMan-qPCR and the EHP detection kit 1~8: 5.05×107, 5.05×106, 5.05×105, 5.05×104, 5.05×103, 5.05×102, 5.05×101, 5.05×100 copies/μL; 9: Negative control; 10: Positive control. |
利用EHP TaqMan-qPCR方法对298份临床样品进行检测分析,检测结果显示,其中48份样品为EHP阳性、250份样品为EHP阴性。利用EHP检测试剂盒对上述临床样品进行检测的结果显示,48份TaqMan-qPCR方法检测为阳性的临床样品中44份为EHP检测试剂盒测试的阳性、4份为阴性,250份TaqMan-qPCR方法检测为阴性的临床样品中2份为EHP检测试剂盒测试的阳性、248份为阴性。计算得出,该EHP检测试剂盒相比于EHP TaqMan-qPCR方法的DSp为99.2%,DSe为91.7% (表 2)。
|
|
表 2 试剂盒对不同状态样品检测结果 Tab.2 The detecting results of different samples |
利用3个批次生产的EHP检测试剂盒分别测试经TaqMan-qPCR方法鉴定为阴性、弱阳性和强阳性的3组匀浆的对虾组织样品,每组测试8个检测管。测试结果显示,对于阴性样品和强阳样品,EHP检测试剂盒的批内及批间检测管重复性均为100%;对于弱阳性样品,3个批次检测试剂盒的批内重复性依次为100%、87.5%和100%,3个批间检测试剂盒的重复性为95.8% (表 3)。
|
|
表 3 EHP检测试剂盒的重复性测试结果 Tab.3 The repeatability test result of the EHP detection kit |
对保存于不同温度条件下的EHP检测试剂盒的测试结果显示(图 4、图 5),EHP检测试剂盒在–20℃条件下保存7个月时均能够检测出含105 copies/μL的EHP阳性质粒标准品,显色亮度相当于试剂盒比色卡上“+++”阳性绿色荧光强度;EHP检测试剂盒在–40℃条件下保存12个月时均能够检测出含105 copies/μL的EHP阳性质粒标准品,显色亮度相当于试剂盒比色卡上“+++”阳性绿色荧光强度。因此,EHP试剂盒在–20℃条件下的保存期至少为7个月,在–40℃的条件下保存期至少为12个月。
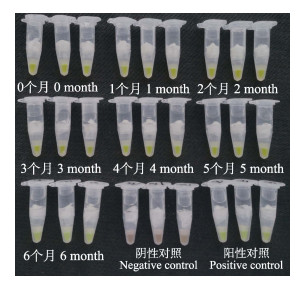
|
图 4 –20℃储存条件下试剂盒的稳定性测试结果 Fig.4 The stability test result of EHP detection kit stored at –20℃ |

|
图 5 –40℃储存条件下试剂盒的稳定性测试结果 Fig.5 The stability test result of EHP detection kit stored at –40℃ |
本研究对作者实验室前期研发的EHP现场快速高灵敏检测试剂盒的6个性能参数进行了测试和评估。特异性测试结果表明,该试剂盒能特异性地扩增EHP,具有很高的特异性;ASe测试结果表明,该试剂盒的检测管最低可检测101 copies/反应的目标核酸,具有较高的灵敏度。本研究中,EHP检测试剂盒的ASe比马芳等(2016)评估的基于等温扩增技术的WSSV现场快速高灵敏度检测试剂盒ASe (102 copies/反应)略高。在开展EHP现场快速高灵敏检测试剂盒ASp和ASe测试过程中,为提高测试结果的可靠性与可信度,本研究根据OIE《水生动物诊断手册》要求,利用EHP检测试剂盒对298份临床样品进行了测试分析,与EHP TaqMan RT-qPCR方法相比,该试剂盒的DSp为99.2%、DSe为91.7%,表现出了优异的诊断性能。从总体上看,本研究EHP检测试剂盒诊断性能与参比的EHP TaqMan RT-qPCR基本相当,能较好地满足现场快速和高灵敏检测EHP的需要。
检测试剂盒生产过程中相同批次/不同批次产品间诊断性能的稳定性,即不同试剂盒检测同类样本的可重复性,对于保障用户使用过程中检测结果的可靠性非常重要。本研究对EHP检测试剂盒可重复的测试结果表明,对于阴性样品和强阳样品,试剂盒的批内及批间检测管的重复性均为100%,表现稳定;对于弱阳性样品,3个生产批次试剂盒批内的重复性依次为100%、87.5%和100%,推测这是由于该试剂盒检测灵敏度略低于用于样品分类(强阳性、弱阳性和阴性)的TaqMan RT-qPCR方法所导致的,上述研究中该试剂盒DSe为91.7% (与DSp相比未超过99%)也从侧面佐证了这一点。对不同批次EHP检测试剂盒的重复性测试发现,3个检测试剂盒批次间,EHP检测管检测结果的可重复性为95.8%,性能表现稳定。分析上述结果可以得出,EHP检测试剂盒具有良好的可重复性。
水产病原检测试剂盒从生产到现场使用一般需要经历生产存储、运输、分销商存储以及用户存储等多个环节。因此,具备良好的存储稳定性也是一款病原检测试剂盒必须满足的条件之一。本研究开展的EHP检测试剂盒的稳定性测试结果显示,在–20℃条件下存储7个月,在–40℃条件下存储12个月,试剂盒的检测性能仍能够保持有良好的稳定性。这说明,该试剂盒在–20℃和–40℃的条件下储藏均能够满足实际生产、分销等过程对较长仓储期限的需要。
综上所述,本研究开发的EHP现场快速高灵敏度检测试剂盒不仅具有操作简便、无需复杂设备即可使用的优点,同时其特异性、灵敏度、重复性和稳定性等性能参数均表现优良,可为对虾EHP的现场诊断提供快速、灵敏、简捷的检测技术,有助于提高对虾养殖企业或对虾疫病检测基层单位对EHP的检测能力,具有较高的实际应用价值。
ANDERSON I G, SHARIFF M, NASH G. A hepatopancreatic microsporidian in pond-reared tiger shrimp, Penaeus monodon, from Malaysia. Journal of Invertebrate Pathology, 1989, 53(2): 278-280 DOI:10.1016/0022-2011(89)90020-7 |
ARANGUREN L F, HAN J E, TANG K F J. Enterocytozoon hepatopenaei (EHP) is a risk factor for acute hepatopancreatic necrosis disease (AHPND) and septic hepatopancreatic necrosis (SHPN) in the Pacific white shrimp Penaeus vannamei. Aquaculture, 2017, 471: 37-42 DOI:10.1016/j.aquaculture.2016.12.038 |
BIJU N, SATHIYARAJ G, RAJ M, et al. High prevalence of Enterocytozoon hepatopenaei in shrimps Penaeus monodon and Litopenaeus vannamei sampled from slow growth ponds in India. Diseases of Aquatic Organisms, 2016, 120(3): 225-230 DOI:10.3354/dao03036 |
Bureau of Fisheries, Ministry of Agriculture and Rural Affairs, National Fisheries Technology Extension Center, China Society of Fisheries. China fishery statistical yearbook 2020. Beijing: China Agriculture Press, 2020 [农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 2020中国渔业统计年鉴. 北京: 中国农业出版社, 2020]
|
CHAYABURAKUL K, NASH G, PRATANPIPAT P, et al. Multiple pathogens found in growth-retarded black tiger shrimp Penaeus monodon cultivated in Thailand. Diseases of Aquatic Organisms, 2004, 60(2): 89-96 |
HU J H, LI Z M, DUAN J C, et al. Advances in epidemiological studies of Enterocytozoon hepatopenaei cysts in shrimp. Journal of Aquaculture, 2020, 41(11): 1–4, 10 [胡吉卉, 李正民, 段健诚, 等. 虾类肝肠胞虫流行病学研究进展. 水产养殖, 2020, 41(11): 1–4, 10] |
HUANG J, ZENG L B, DONG X, et al. Trend analysis and policy recommendation on aqutic biosecurity in China. Engineering Science, 2016, 18(3): 15-21 [黄倢, 曾令兵, 董宣, 等. 水产生物安保发展趋势与政策建议. 中国工程科学, 2016, 18(3): 15-21] |
HUDSON D A, HUDSON N B, PYECROFT S B. Mortalities of Penaeus japonicus prawns associated with microsporidean infection. Australian Veterinary Journal, 2001, 79(7): 504-505 DOI:10.1111/j.1751-0813.2001.tb13027.x |
JAROENLAK P, BOAKYE D W, VANICHVIRIYAKIT R, et al. Identification, characterization and heparin binding capacity of a spore-wall, virulence protein from the shrimp microsporidian, Enterocytozoon hepatopenaei (EHP). Parasites and Vectors, 2018, 11(1): 177 DOI:10.1186/s13071-018-2758-z |
JIANG H B, CHEN Y W, CHEN Q J. Research progress of Enterocytozoon hepatopenaei (EHP). Journal of Shenyang Agricultural University, 2020, 51(3): 370-376 [姜宏波, 陈裕文, 陈启军. 虾肝肠胞虫病的研究进展. 沈阳农业大学学报, 2020, 51(3): 370-376] |
LI X P. Establishment and application of nucleic acid detection techniques for two emerging shrimp viruses. Masterxs Thesis of Shanghai Ocean University, 2018 [李小平. 两种对虾新发病毒核酸检测技术的建立及应用. 上海海洋大学硕士研究生学位论文, 2018]
|
LIU Y M, QIU L, SHENG A Z, et al. Quantitative detection method of Enterocytozoon hepatopenaei using TaqMan probe real-time PCR. Journal of Invertebrate Pathology, 2018, 151: 191-196 DOI:10.1016/j.jip.2017.12.006 |
MA F, ZHANG Q L, WANG X Y, et al. Validation of the LAMP-based high sensitive detection kit for rapid use on field for white spot syndrome virus. Chinese Journal of Preventive Veterinary Medicine, 2016, 38(4): 316-321 [马芳, 张庆利, 万晓媛, 等. 基于LAMP技术的对虾白斑综合征病毒现场快速高灵敏度检测试剂盒的评价. 中国预防兽医学报, 2016, 38(4): 316-321] |
REMANY M C, CYRIAC D, RAJU P K K V, et al. Haematological parameters as predictive indicators of stress induced mortality in Pacific white shrimp Penaeus vannamei (Boone, 1931) broodstock during transboundary shipment. Indian Journal of Geo Marine Sciences, 2017, 46(7): 1440-1446 |
SONG Z L, DONG X, ZHAO R H, et al. Evaluation on the detection of Enterocytozoon hepatopenaei in pooled DNA samples of Litopenaeus vannamei based on TaqMan qPCR. Progress in Fishery Sciences, 2019, 40(3): 122-132 [宋增磊, 董宣, 赵若恒, 等. 基于TaqMan qPCR检测凡纳滨对虾样品中虾肝肠胞虫并样检测方法的评价. 渔业科学进展, 2019, 40(3): 122-132] |
SPRAGUE V, BECNEL J J, HAZARD E I. Taxonomy of phylum microspora. Critical Reviews in Microbiology, 1992, 18(5/6): 285-395 |
TOURTIP S, WONGTRIPOP S, STENTIFORD G D, et al. Enterocytozoon hepatopenaei sp. nov. (Microsporida: Enterocytozoonidae), a parasite of the black tiger shrimp Penaeus monodon (Decapoda: Penaeidae): Fine structure and phylogenetic relationships. Journal of Invertebrate Pathology, 2009, 102(1): 21-29 |



