2. 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 山东 青岛 266071
2. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao, Shandong 266071, China
脊尾白虾(Exopalaemon carinicauda)又称小白虾、迎春虾,主要分布于黄渤海浅海低盐水域,是我国重要的中小型经济虾类。脊尾白虾为广温、广盐、广布种,具有生长速度快、繁殖周期短、适应能力强等优点,现已成为我国沿海地区的特色养殖品种。我国有低洼盐碱水域4600万hm2,具有养殖潜力的盐碱水面积可达667万hm2,盐碱水由于具有高pH、高碳酸盐碱度及离子组成复杂等特点,阻碍了盐碱水资源的充分开发利用。脊尾白虾作为一种对盐碱环境适应能力强的经济虾类,是开展甲壳类盐碱适应分子机制研究的理想材料。
水通道蛋白(aquaporin, AQP)是一种细胞膜上特异性转运水分子及其他中性代谢分子的膜蛋白家族(冯学超等, 2005; 王渝等, 2014)。目前,共有13种哺乳动物水通道蛋白被鉴定,根据其功能可分为三类:AQP0、AQP1、AQP2、AQP4和AQP5仅对水分子有通透性,为水选择性水通道蛋白;AQP3、AQP7、AQP9和AQP10对水、甘油、尿素等均有通透性,为水甘油通道蛋白;AQP11与AQP12的功能还未确定且基因同源性低,为超级水通道蛋白。水通道蛋白对生物的细胞内外渗透压稳定具有重要的调节作用,其对水产动物的生存意义重大。现阶段对水通道蛋白的研究主要集中于植物与哺乳动物,研究表明,植物水通道蛋白可以通过调节根部的导水率来增加水分的吸收以响应盐胁迫与干旱胁迫;在哺乳动物中,水通道蛋白在肾脏的表达量最高,在水运输的主要组织中发挥重要作用(Li et al, 2019; 段梦莎, 2020; 郝建峰, 2020; 李娟等, 2021; 李青云, 2020; 张亚楠等, 2019)。目前,关于水产动物水通道蛋白的研究尚少,主要集中于三疣梭子蟹(Portunus trituberculatus) (王渝等, 2014)、中华绒螯蟹(Eriocheir sinensis) (杨志刚等, 2021)、萨罗罗非鱼(Sarotherodon melanotheron) (甘远迪, 2014)等水产动物中,研究表明,水通道蛋白基因在水产动物的肠道、胃与鳃组织中相对表达量较高,且盐度胁迫可显著改变其表达模式,推测水通道蛋白在水产动物渗透压调节过程中起重要作用。本研究根据前期碱度胁迫下脊尾白虾的转录组测序结果,克隆碱度胁迫下的差异表达基因EcAQP4和EcAQP11,并分析其序列特征;利用RNA干扰技术特异性地沉默EcAQP4和EcAQP11基因的表达,然后对脊尾白虾进行碱度胁迫,验证EcAQP4和EcAQP11基因在碱度胁迫过程中的作用。结果可为解析脊尾白虾响应碱度胁迫机制提供基础信息。
1 材料与方法 1.1 实验材料及处理实验用脊尾白虾平均体长为(2.1±0.4) cm,均取自山东日照海辰水产有限公司。实验前将脊尾白虾在100 L的桶中暂养7 d,按时投喂饲料,连续充氧。
取6尾体长、体重相近且活力旺盛的脊尾白虾,取其鳃、肝胰腺、肌肉、肠、血细胞和胃组织于液氮中储存,用于合成RACE模板。
1.2 AQP4与AQP11基因的cDNA全长克隆使用TransZol Up Plus RNA试剂盒(TRAN, 中国)提取脊尾白虾RNA。配制1.0%的琼脂糖凝胶进行电泳,检测RNA的条带完整性;使用Thermo NanoDrop 2000分光光度计检测RNA的纯度及浓度。RACE模板第一链使用SMARTer® RACE 5′/3′试剂盒合成。根据脊尾白虾转录组中EcAQP4与EcAQP11的测序结果,利用Primer Premier 5.0软件设计3′与5′引物,引物序列见表 1。使用Advantage 2 Polymerase Mix高保真聚合酶依据说明书进行目的基因RACE 5′和3′末端巢式PCR扩增,将获得的PCR产物进行切胶回收、连接转化,然后挑取阳性单克隆,经M13通用引物进行菌落PCR鉴定,并将所筛选的菌液进行测序。
|
|
表 1 水通道蛋白基因克隆所用引物序列 Tab.1 The sequence of primers used for AQP gene cloning |
使用Contig Express软件进行拼接,得到EcAQP4基因与EcAQP11基因cDNA全长,将cDNA序列用ORFFinder在线软件(https://www.ncbi.nlm.nih.gov/orffinder/)预测开放阅读框,得到基因的氨基酸序列后,使用在线软件SignalP-5.0 Server (http://www.cbs.dtu.dk/services/SignalP/)、SMART(http://smart.embl-heidelberg.de/)、TMHMM Server v.2.0 (http://www.cbs.dtu.dk/services/TMHMM/)和ProtParam tool(http://web.expasy.org/protparam/)预测其蛋白质信号肽、蛋白质结构域、蛋白跨膜情况、蛋白质特性和亲水性。
利用在线软件NCBI BLAST (https://blast.ncbi.nlm.nih.gov/Blast.cgi)分析基因与其他物种的同源性和一致性;使用DNAMAN软件对多个物种氨基酸序列进行比对;使用MEGA 7.0软件构建Neighbor-joining进化树。
1.4 RNA干扰实验 1.4.1 dsRNA的合成使用T7 RNAi Transcription Kit-BOX1 (Vazyme, 中国)合成dsRNA。合成干扰的引物需添加T7启动子,使用在线设计软件https://www.flyrnai.org/cgi-bin/RNAi_find_primers.pl设计引物,引物由生工生物工程(上海)有限公司合成。
本次干扰实验以绿色荧光蛋白(green fluorescent protein (GFP)为对照,具体的合成步骤:将GFP质粒溶解,取2 μL质粒溶液加入100 μL大肠杆菌(Escherichia coli) DH5α感受态细胞,冰浴30 min,42℃热激90 s,再冰浴2 min,加入900 μL未加卡那霉素(KAN)的LB液体培养基,200 r/min震荡培养45 min。将菌液6000 r/min离心5 min,取沉淀涂至已加KAN的LB固体培养基上,过夜培养12 h以上。挑取单克隆菌落至已加KAN的LB液体培养基中,震荡培养12 h。以培养后的菌液为模板,使用T7 RNAi Transcription Kit-BOX1按照dsRNA合成步骤合成GFP,其引物GFP-T7F:GATCACTAATACGACTCACT ATAGGGATGGTGAGCAAGGGGGAGGA;GFP-T7R:GATCACTAATACGACTCACTATAGGGTTACTTGTACAGCTCGTCCA。
1.4.2 dsRNA的注射准备9个10 L整理箱,每个箱子加入8 L海水,调节其碳酸盐碱度至8.26 mmol/L,稳定24 h,每天调节2次海水碱度。设置GFP组、EcAQP4组和EcAQP11组,每组3个平行。挑选体长、体重相近的脊尾白虾进行胁迫实验,每个箱子放入10尾虾,依据组别在脊尾白虾的第4腹足基部注射干扰,注射量为1 μg/g,观察记录脊尾白虾在24、48和72 h的死亡率。
另设置空白组、GFP组、EcAQP4组和EcAQP11组,调节其碳酸盐碱度至8.26 mmol/L,每个箱子放入30尾脊尾白虾,依据组别在脊尾白虾的第4腹足基部注射干扰,注射量为1 μg/g,空白组不进行胁迫与干扰,在24、48和72 h 3个时间点,取其血液测量渗透压,并取鳃组织检测其中EcAQP基因表达量。
1.4.3 干扰后血淋巴渗透压的变化每个时间点取6尾虾的血淋巴混合测量其渗透压。将混合后的血淋巴样品放入4℃冰箱中24 h后,3000 r/min离心15 min,取60 μL上清液,使用渗透压测定仪测量渗透压,每个样品测量3次。
1.4.4 干扰后AQP基因表达量的检测在干扰后24、48和72 h 3个时间点取GFP组、EcAQP4组与EcAQP11组的鳃组织,液氮研磨,使用TransZol Up Plus RNA kit (TRAN,中国)提取RNA。
通过荧光定量PCR (qRT-PCR)分析EcAQP4与EcAQP11在不同组织中的表达,以18S基因作为内参基因,针对EcAQP4、EcAQP11与18S设计特异性引物(表 2),按照ChamQTM SYBR® Color qPCR master mix说明书,利用荧光定量PCR仪器进行定量分析,通过2–ΔΔCt法计算分析注射干扰后EcAQP4与EcAQP11基因mRNA的相对表达量,利用SPSS 17.0软件进行单因素方差分析(one-way ANOVA),运用多重比较进行显著性检验。
|
|
表 2 qRT-PCR所用引物 Tab.2 Primers used for qRT-PCR |
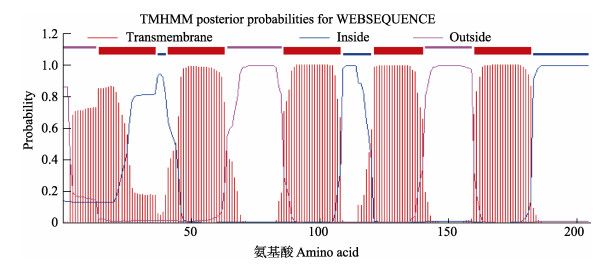
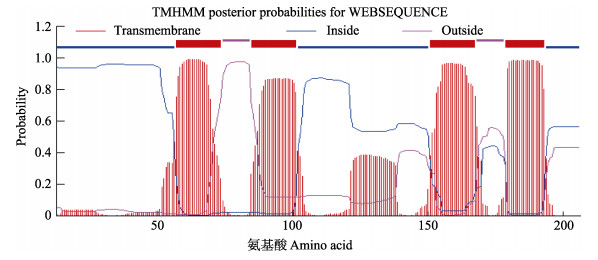
本研究利用RACE技术成功克隆了脊尾白虾EcAQP4与EcAQP11的cDNA全长,序列分析结果显示,EcAQP4基因开放阅读框(ORF)长度为621 bp,共编码206个氨基酸,预测蛋白分子量为21.673 kDa,理论等电点为8.30,为疏水性蛋白(图 1);跨膜分析结果显示,该基因跨膜5次;SMART分析显示,该基因具有5个跨膜结构域(图 2)。EcAQP11基因ORF长度为783 bp,共编码261个氨基酸,预测其蛋白分子量为28.490 kDa,理论等电点为5.40,为疏水性蛋白(图 3);跨膜分析结果显示,该基因跨膜4次;SMART分析显示,该基因具有4个跨膜结构域(图 4)。

|
图 1 EcAQP4基因cDNA全长及推导的氨基酸序列 Fig.1 Nucleotide sequence and deduced amino acid sequence of EcAQP4 ATG:起始密码子;TAA:终止密码子。图 3同。 ATG: Initiation codon; TAA: Termination codon. The same as in Fig.3. |
|
图 2 EcAQP4的跨膜结构域 Fig.2 The transmembrane domain of EcAQP4 |

|
图 3 EcAQP11基因ORF及其推导的氨基酸序列 Fig.3 Open reading frame and deduced amino acid sequence of EcAQP11 |
|
图 4 EcAQP11的跨膜结构域 Fig.4 The transmembrane domain of EcAQP11 |
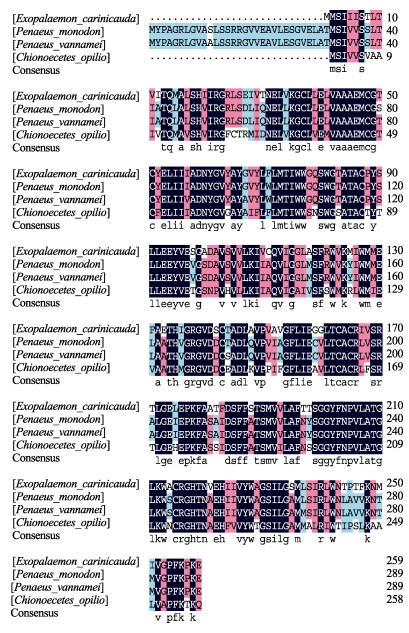
将EcAQP4与ECAQP11的氨基酸序列在NCBI上比对发现,与EcAQP4氨基酸序列同源性较高的物种有罗氏沼虾(Macrobrachium rosenbergii)、斑节对虾(Penaeus monodon)、凡纳滨对虾(Litopenaeus vannamei)、三疣梭子蟹(图 5);与EcAQP11氨基酸序列同源性较高的物种有斑节对虾、灰眼雪蟹(Chionoecetes opilio)、凡纳滨对虾(图 6)。同源性分析显示,EcAQP4具有多个保守区域,其中与罗氏沼虾同源性最高,为94.63%,与三疣梭子蟹同源性最低,为68.14%,所比对的物种均含有HINPAVT和PLAIGL这2个保守域;EcAQP11比EcAQP4保守性较差,与斑节对虾同源性最高,达到81.47%,与灰眼雪蟹同源性最低,为67.18%。

|
图 5 EcAQP4基因氨基酸序列与其他已知物种同源序列比对 Fig.5 Amino acid sequences alignment of EcAQP4 with other species´ AQP NPA结构单元以方框表示;2个保守序列HINPAVT和PLAIGL以下划线表示。 The NPA structural motifs are marked in the box. Two conserved sequences (HINPAVT and PLAIGL) are underlined. |
|
图 6 EcAQP11基因氨基酸序列与其他已知物种同源序列比对 Fig.6 Amino acid sequences alignment of EcAQP11 with other species´ AQP |
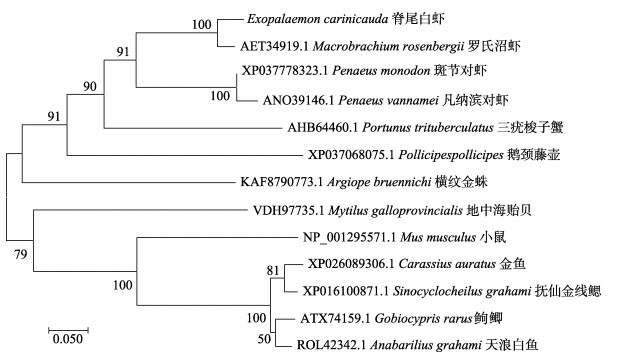
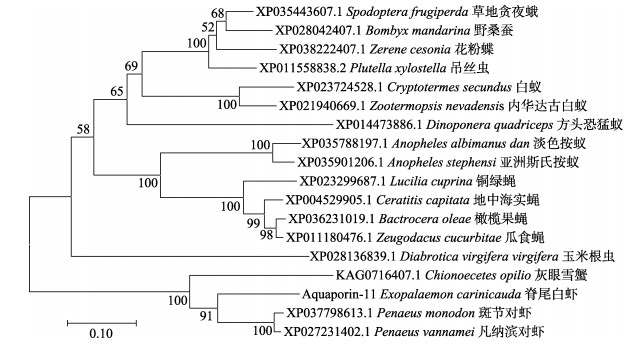
利用MEGA 7.0软件对脊尾白虾EcAQP4与EcAQP11基因的氨基酸序列进行系统进化分析(图 7,图 8),结果显示,EcAQP4基因的进化树分为两支,第一支为节肢动物门,第二支为脊索动物门,脊尾白虾与罗氏沼虾聚为一支,亲缘关系最为相近,与其他甲壳纲动物亲缘关系也较近;脊索动物门中的硬骨鱼类为一支,与脊尾白虾亲缘关系较远。EcAQP11基因的进化树分为两支,第一支为昆虫纲,第二支为甲壳纲,脊尾白虾与斑节对虾与凡纳滨对虾聚为一支,亲缘关系较近。
|
图 7 基于EcAQP4基因氨基酸序列构建的Neighbor-joining进化树 Fig.7 Neighbor-joining phylogenetic tree based on EcAQP4 amino acid sequences |
|
图 8 基于EcAQP11基因氨基酸序列构建的Neighbor-joining进化树 Fig.8 Neighbor-joining phylogenetic tree based on EcAQP11 amino acid sequences |
|
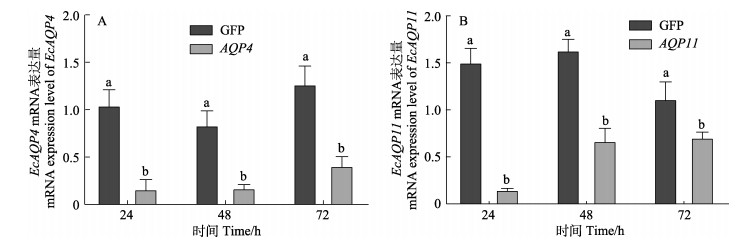
图 9 脊尾白虾注射干扰后EcAQP4 (A)与EcAQP11 (B)基因的表达情况
Fig.9 The expression of EcAQP4 (A) and EcAQP11 (B) after interference
|
取干扰后脊尾白虾的鳃组织,提取RNA,进行反转录,通过qRT-PCR检测2个基因在各个时间点的表达量。结果显示,注射dsRNA对脊尾白虾EcAQP4与EcAQP11基因干扰效果明显。与GFP对照组相比,EcAQP4基因在注射干扰24 h与48 h后的表达量下降80%左右,72 h干扰效果逐渐减弱;EcAQP11基因在注射干扰24 h时表达量下降87%,干扰效果显著,48 h时基因表达量下降60%,72 h时基因表达量下降35%。
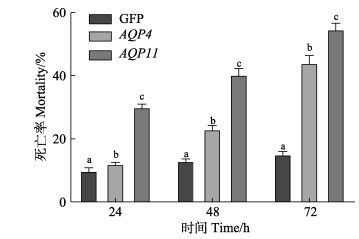
2.5 RNA干扰对脊尾白虾死亡率的影响统计每个时间点各组别的死亡率,如图 10所示。与GFP组相比,注射干扰后,EcAQP4与EcAQP11组死亡率显著升高(P < 0.05),说明RNA干扰这2个基因表达后,脊尾白虾耐碱度能力降低,最终导致死亡。同时,发现24 h与48 h 2个时间点AQP11组死亡率显著高于AQP4组(P < 0.05),在72 h时2组死亡率接近,相比EcAQP4基因,EcAQP11基因能够更加快速地影响脊尾白虾渗透压调节能力,在脊尾白虾耐碱机制中起到更为重要的作用。综上所述,EcAQP4与EcAQP11基因对脊尾白虾耐碱能力有重要的作用。
|
图 10
Fig.10 The mortality of E. carinicauda after RNA interference
|
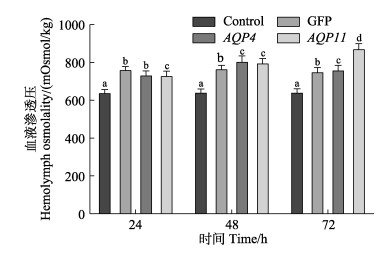
使用渗透压测量仪测量各组在不同时间点脊尾白虾的血液渗透压,结果如图 11所示。与空白组相比,碱度胁迫后,脊尾白虾血液渗透压显著升高(P < 0.05),这是由于水体碱度升高,其中的离子浓度也随之升高,脊尾白虾体内累积的离子升高所导致,但总体来看,GFP组脊尾白虾血液渗透压相对稳定,呈现先上升后下降的趋势;AQP4干扰组的渗透压变化趋势与GFP组相同,在48与72 h时2个时间点其渗透压高于GFP组;AQP11干扰组渗透压则是一直升高的,72 h时显著升高(P < 0.05),升高的幅度较大。推测干扰EcAQP4与EcAQP11基因表达后,水分子的转运受到影响,脊尾白虾渗透压调节能力降低,造成AQP4组上升与下降趋势大于对照组;AQP11干扰组脊尾白虾渗透压上升明显,说明EcAQP11在脊尾白虾渗透压调节过程中发挥重要作用,是脊尾白虾耐碱机制中的重要基因。
|
图 11 RNA干扰后脊尾白虾的血液渗透压变化 Fig.11 The hemolymph osmolality of E. carinicauda after RNA interference |
本研究通过对转录组中差异表达基因的分析,发现在碱度胁迫后,与渗透压调节相关的基因大量表达,为了进一步了解脊尾白虾的耐碱机制,我们从差异表达基因中挑选了水通道蛋白这一渗透压调节的关键基因(Deane et al, 2006; Holm et al, 2005; MacIver et al, 2009; Preston et al, 1992; Robinson et al, 1996; 隋海心等, 2004),通过RACE技术克隆cDNA全长并对其进行序列分析,利用RNA干扰技术验证其在碱度胁迫过程中的响应机制。
3.1 AQP4与AQP11基因的氨基酸序列及同源性分析本研究利用RACE技术首次克隆获得脊尾白虾EcAQP4与EcAQP11基因的cDNA全长,并运用生物信息学软件对其序列进行分析。通过比对发现,脊尾白虾EcAQP4基因保守性较好,具有HINPAVT和PLAIGL两个保守域,与高沿等(2017)研究结果相同。
3.2 EcAQP4与EcAQP11基因的功能验证水通道蛋白是生物细胞膜转运水分子的重要结构,在维持细胞内外渗透压平衡中起重要作用,现阶段关于水通道蛋白的研究有很多,最初人们在脑星形胶质细胞、胃壁细胞和肾集合小管等部位发现AQP4蛋白,它是一种水特异性通道蛋白,仅对水分子具有渗透性,其在人体中主要作用为维持脑内水平衡及脑水肿发生发展(张士保等, 2013)。现阶段对AQP4的研究主要集中于其在脑水肿、视神经脊髓炎(Yang et al, 2013)、癫痫(Hsu et al, 2011)等中枢神经系统疾病中所起的作用,其调节机制主要是维持细胞间隙K+缓冲与渗透压平衡,但其在水产动物中的研究还未见报道。EcAQP11基因在各个物种之间的氨基酸同源性低,功能尚不确定,但有研究表明,EcAQP11具有水转运活性,作为水通道发挥作用(Yakata et al, 2007),对体内水的稳态平衡有重要作用(He et al, 2017),其发挥作用的主要方式为维持上皮细胞水和离子的吸收转运,保持细胞渗透压平衡。
为验证EcAQP4与EcAQP11两基因在脊尾白虾适应碱度胁迫中所起的作用,本研究设计合成了相应的dsRNA,对脊尾白虾进行注射干扰后,通过qRT-PCR技术检测了碱度胁迫后上述2个基因的表达变化,结果显示,与对照组相比,各个时间点基因的表达均发生了显著下降,说明所设计的dsRNA具有良好的干扰效果。对脊尾白虾注射干扰后进行碱度胁迫,发现其死亡率明显升高,碱度胁迫72 h时,EcAQP4组死亡率达到45%,EcAQP11组达到55%,说明基因的沉默对脊尾白虾的耐碱度能力产生明显影响。渗透压测定结果显示,与空白组相比,GFP对照组血液渗透压升高,各时间点总体变化不大,从侧面反映了脊尾白虾的耐碱能力较强。渗透压的变化趋势总体来说呈现先上升后下降的趋势,与盐碱胁迫对尼罗罗非鱼(Oreochromis niloticus)血清渗透压变化趋势相同(赵丽慧等, 2014)。在碱度胁迫条件下,脊尾白虾体内的离子逐渐累积增强,导致血液渗透压增高,但脊尾白虾通过体内的渗透压调节机制将渗透压维持稳定。与GFP对照组相比,EcAQP4干扰组脊尾白虾的血液渗透压上升下降的幅度变大,说明EcAQP4基因的沉默表达影响了脊尾白虾的渗透压调节能力,从而导致脊尾白虾耐碱度能力减弱,死亡率升高。相比对照组和EcAQP干扰组,EcAQP11干扰组的渗透压升高更明显,且呈现一直升高的趋势,这可能是EcAQP11基因在脊尾白虾耐碱机制中起到了更重要的作用,其对脊尾白虾的渗透压调节影响较大。前文提到,EcAQP11基因现阶段的功能与调控机制尚未完全解析,但本研究结果表明,EcAQP11基因在脊尾白虾渗透压调节中发挥了重要作用。
本研究成功克隆了脊尾白虾EcAQP4与EcAQP11基因,设计干扰dsRNA并对脊尾白虾进行注射沉默上述2个基因的表达,结果发现,与对照组相比,注射干扰后的脊尾白虾在碱度胁迫下死亡率明显升高;EcAQP4干扰组脊尾白虾血液渗透压变化幅度增大,EcAQP11干扰组血液渗透压升高明显,干扰EcAQP4与EcAQ11表达后的脊尾白虾耐碱度胁迫能力减弱,表明上述2个基因在脊尾白虾适应碱度胁迫过程中发挥着重要作用。
DEANE E E, WOO N Y S. Tissue distribution, effects of salinity acclimation, and ontogeny of aquaporin 3 in the marine teleost, silver sea bream (Sparus sarba). Marine Biotechnology, 2006, 8(6): 663 DOI:10.1007/s10126-006-6001-0 |
DUAN M S. Identification of aquaporin gene in tea tree and study of CsPIP1;5 functional. Masterxs Thesis of Northwest A & F University, 2020 [段梦莎. 茶树水通道蛋白基因的鉴定与CsPIP1;5的功能研究. 西北农林科技大学硕士研究生学位论文, 2020]
|
FENG X C, MA T H. Physiological importance of aquaporin water channels accessed by phenotype studies of aquaporin knockout mice. Progress in Biochemistry and Biophysics, 2005, 32(4): 291 [冯学超, 麻彤辉. 水通道蛋白的生理功能——水通道基因敲除小鼠表型研究进展. 生物化学与生物物理进展, 2005, 32(4): 291 DOI:10.3321/j.issn:1000-3282.2005.04.001] |
GAN Y D. cDNA cloning of aquaporin 3 in Sarotherodon melanothern, Oreochromis niloticus and tissue expression patterns under salinity stresses. Masterxs Thesis of Shanghai Ocean University, 2014 [甘远迪. 萨罗罗非鱼、尼罗罗非鱼AQP3cDNA序列克隆及盐度胁迫下组织表达特征. 上海海洋大学硕士研究生学位论文, 2014]
|
GAO Y, HU C Q, REN C H, et al. Molecular cloning of aquaporin-4 (AQP4) gene in the Pacific white shrimp (Litopenaeus vannamei) and the effect of salinity stress on its expression in hepatopancreas. Marine Sciences, 2017, 41(2): 61 [高沿, 胡超群, 任春华, 等. 凡纳滨对虾水孔蛋白-4的cDNA克隆及盐度胁迫对其肝胰腺mRNA表达水平的影响. 海洋科学, 2017, 41(2): 61] |
HAO J F. Genome-wide identification of aquaporin gene family in cotton and functional characterization in response to osmotic stresses. Masterxs Thesis of Zhengzhou University, 2020 [郝建峰. 棉花水通道蛋白家族基因鉴定及其渗透胁迫应答功能研究. 郑州大学硕士研究生学位论文, 2020]
|
HE L Q, HUANG N, LI H, et al. AMPK/α-ketoglutarate axis regulates intestinal water and ion homeostasis in young pigs. Journal of Agricultural and Food Chemistry, 2017, 65(11): 2287 DOI:10.1021/acs.jafc.7b00324 |
HOLM L M, JAHN T P, MØLLER A L B, et al. NH3 and NH4+ permeability in aquaporin-expressing Xenopus oocytes. Pflügers Archiv-European Journal of Physiology, 2005, 450(6): 415 DOI:10.1007/s00424-005-1399-1 |
HSU M S, SELDIN M, LEE D J, et al. Laminar-specific and developmental expression of aquaporin-4 in the mouse hippocampus. Neuroscience, 2011, 178: 21 DOI:10.1016/j.neuroscience.2011.01.020 |
LI J, WANG L, LUO X L, et al. Cloning of AQP1 and AQP3 genes and their locations and expressions in different tissues of yak (Bos grunniens). Acta Theriologica Sinica, 2021, 41(1): 51 [李娟, 王利, 罗晓林, 等. 牦牛水通道蛋白AQP1和AQP3基因克隆及在不同组织中表达和定位. 兽类学报, 2021, 41(1): 51] |
LI Q Y. Genome-wide identification and transcriptome analysis of aquaporin gene family in Nicotiana tabacum. Masterxs Thesis of Shandong Agricultural University, 2020 [李青云. 普通烟草中水通道蛋白基因家族的鉴定和转录组分析. 山东农业大学硕士研究生学位论文, 2020]
|
LI W X, ZHANG D Y, ZHU G Z, et al. Combining genome-wide and transcriptome-wide analyses reveal the evolutionary conservation and functional diversity of aquaporins in cotton. BMC Genomics, 2019, 20(1): 538 DOI:10.1186/s12864-019-5928-2 |
MACIVER B, CUTLER C P, YIN J, et al. Expression and functional characterization of four aquaporin water channels from the European eel (Anguilla anguilla). Journal of Experimental Biology, 2009, 212(17): 2856 DOI:10.1242/jeb.025882 |
PRESTON G M, CARROLL T P, GUGGINO W B, et al. Appearance of water channels in Xenopus oocytes expressing red cell CHIP28 protein. Science, 1992, 256(5055): 385 DOI:10.1126/science.256.5055.385 |
ROBINSON D G, SIEBER H, KAMMERLOHER W, et al. PIP1 aquaporins are concentrated in plasmalemmasomes of arabidopsis thaliana mesophyll. Plant Physiology, 1996, 111(2): 645 DOI:10.1104/pp.111.2.645 |
SUI H X, REN G. Structure and mechanism of water channels. Progress in Chemistry, 2004, 16: 145 [隋海心, 任罡. 水分子通道蛋白的结构与功能. 化学进展, 2004, 16(2): 145 DOI:10.3321/j.issn:1005-281X.2004.02.001] |
WANG Y, LÜ J J, LIU P, et al. Cloning and characterization of aquaporins 1 and its expression analysis under salinity stress in Portunus trituberculatu. Journal of Fishery Sciences of China, 2014, 21(5): 893 [王渝, 吕建建, 刘萍, 等. 三疣梭子蟹水通道蛋白1 cDNA及其盐度胁迫下的表达分析. 中国水产科学, 2014, 21(5): 893] |
YAKATA K, HIROAKI Y, ISHIBASHI K, et al. Aquaporin-11 containing a divergent NPA motif has normal water channel activity. Biochimica et Biophysica Acta, 2007, 1768 |
YANG Y, HUANG D H, WU W P, et al. The role of aquaporin-4 antibodies in Chinese patients with neuromyelitis optica. Journal of Clinical Neuroscience, 2013, 20(1): 94 DOI:10.1016/j.jocn.2012.06.006 |
YANG Z G, ZHANG L, CHEN C Y, et al. Study on cloning, expression and RNA interference of aquaporin 1 gene of Eriocheir sinensisi. Journal of Fudan University (Natural Science), 2021, 60(1): 93 [杨志刚, 张龙, 陈春宇, 等. 中华绒螯蟹水通道蛋白1基因的克隆、表达及RNA干扰研究. 复旦学报(自然科学版), 2021, 60(1): 93] |
ZHAO L H, ZHAO L, JEERAWAT T, et al. Effects of salinity-alkalinity on serum osmolality, ion concentration and mRNA expression of ion transport enzymes of Oreochromis niloticus. Journal of Fisheries of China, 2014, 38(10): 1696 [赵丽慧, 赵金良, Jeerawat T, 等. 盐碱胁迫对尼罗罗非鱼血清渗透压、离子浓度及离子转运酶基因表达的影响. 水产学报, 2014, 38(10): 1696] |
ZHANG S B, DAI D W, DAI Y M. Advances of aquaporin-4 research. Chinese Journal of Clinical Neurosciences, 2013, 21(4): 451 [张士保, 代大伟, 代亚美. 水通道蛋白-4的研究进展. 中国临床神经科学, 2013, 21(4): 451 DOI:10.3969/j.issn.1008-0678.2013.04.016] |
ZHANG Y N, WANG Y, ZHU J J, et al. Analysis of cloning and expression of AQP7 gene in Tibetan goat. Southwest China Journal of Agricultural Sciences, 2019, 32(8): 1956 [张亚楠, 王永, 朱江江, 等. 藏山羊AQP7基因克隆和不同组织器官差异表达分析. 西南农业学报, 2019, 32(8): 1956] |



