2. 中国水产科学研究院黄海水产研究所 农业农村部海洋渔业可持续发展重点实验室 山东 青岛 266071;
3. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室 山东 青岛 266071;
4. 通标标准技术服务(青岛)有限公司 山东 青岛 266101
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture and Rural Affairs, Qingdao, Shandong 266071, China;
3. Laboratory of Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao, Shandong 266237, China;
4. SGS-CSTC Standards Technical Services Co., Ltd. Qingdao Branch, Qingdao, Shandong 266101, China
海洋具有地球上最大的碳汇功能,在调节全球气候变化中发挥着重要作用。开展近海养殖,从而增加海洋碳汇是应对全球气候变化的一条新的科学途径(张永雨等, 2017)。近海养殖区沉积物中总有机碳(TOC)的储存是其从生物圈向地圈迁移的主要途径,有助于调节全球碳循环(Walsh et al, 1981)。贝类通过生物沉积作用加速近海养殖区水体中的颗粒物质向沉积环境的输送,桑沟湾养殖的栉孔扇贝(Chlamys farreri)通过生物沉积作用,每年碳的沉积量达8.71×104 t (张明亮等, 2011)。碳沉积是养殖碳汇的重要组成部分,也是以往研究中易被遗漏的部分。所以,解析海水养殖区沉积物中有机质的来源,对于阐明海水养殖对近海碳循环的影响具有重要意义(Bauer et al, 2013)。碳稳定同位素(δ13C)是一种可靠的地球化学指标,可以用来指示有机质的来源,有机碳氮摩尔比(C/N)和氮稳定同位素(δ15N)受成岩作用的影响,也可以作为辅助指标(Zhang et al, 2009)。因此,通常将C/N和δ13C进行联合用来分析有机质的来源。
我国是世界上养殖规模最大的国家,其中,贝藻养殖占主要部分,2019年贝、藻养殖产量为1 712.33万t,占全国水产养殖产量的33.71%,贝藻养殖面积为 1 345 990 hm2,占全国海水养殖面积的67.56% (农业农村部渔业渔政管理局, 2020)。养殖藻类通过光合作用直接吸收海水中的CO2,促进并加速了大气CO2向海水中扩散,从而减少大气中的CO2含量。而养殖贝类在生长过程中,直接吸收海水中的碳酸氢根转化形成CaCO3的外壳。所以,海水贝藻养殖具有高效的“固碳”作用(唐启升等, 2016)。
桑沟湾位于山东省荣成市东岸,是我国北方海域典型的贝、藻养殖基地。已有研究表明,桑沟湾海藻的光合作用可以去除海水中的无机碳,降低溶解无机碳和二氧化碳分压(pCO2)水平,提高pHT值;相反,双壳贝类的呼吸作用会释放CO2到海水中,增加溶解无机碳和pCO2水平,同时,降低pHT水平。所以,海藻和贝类养殖对海水碳酸盐系统产生了影响(Li et al, 2020),但关于贝、藻生物沉积对近海碳循环的影响研究还很少(Xia et al, 2018)。本研究以桑沟湾为研究区域,分析了该海湾不同区域沉积物的粒度、TOC、总氮(TN)、δ13C和δ15N时空分布特征,阐明了沉积物有机质的主要来源,并对贝、藻生物沉积对有机质的贡献进行了定量分析和讨论,为阐明海洋贝、藻养殖对近海碳循环的贡献提供科学依据。
1 材料与方法 1.1 研究区域桑沟湾是位于山东半岛东端的浅层半封闭海湾(37°01ʹ~37°09ʹN, 122°24ʹ~122°35ʹE)。海湾的总面积约为144 km2,海湾基底平坦,地形从中央向外部海岸加深,平均水深约为7.5 m,潮流主要为半日分潮 (赵俊等, 1996)。桑沟湾用于水产养殖已有40余年的历史,是中国北方重要的海水养殖基地。桑沟湾近2/3的区域用于贝藻养殖,海带(Saccharina japonica)年产量估计高达84 500 t (毛玉泽等, 2018),贝类的年产量约为10万t (Zhang et al, 2009)。栉孔扇贝(Chlamys farreri)和长牡蛎(Ostrea gigas)在每年5月开始养殖,养殖周期大约为2年,同时,海带在每年11月播种,次年5月下旬收获。网箱养殖品种主要为大黄鱼(Larimichthys crocea)和许氏 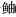
2019年4月(春季)、7月(夏季)、10月(秋季)和12月(冬季)对桑沟湾进行科研调查,共布设21个站位(图1)。其中,D1、D2和D3位于外海海域(OA),D4位于交错带区域(TT),D5、D6、D7、D9和D10位于海藻养殖区(SW),D8、D11和D14位于贝藻混养区(SF–SW),D15、D16和D18位于鱼贝混养区(F–SF),D12、D13、D17、D19、D20和D21位于贝类养殖区(SF)。使用Van Veen抓斗式采泥器采集表层沉积物(0~2 cm),采集完成后,样品放入密封的聚乙烯封口袋中,并立即存放入装满冰块的培养箱中,迅速将样品运送到实验室,并在–20℃下冷冻保存,用于测定沉积物的粒度、TOC、TN、δ13C和δ15N。由于天气原因,4月的D10站、7月的D3、D4和D21站、12月的D4站未采集到沉积物样品。
|
图 1 桑沟湾采样点位置 Fig.1 Sampling stations in Sanggou Bay |
先使用真空冷冻干燥机对沉积物样品进行真空冷冻干燥,再将干燥完的样品取出一部分用于粒度检测,一部分用于TOC、TN、δ13C和δ15N的检测。沉积物粒度采用激光粒度分析仪(Mastersizer 2000, Malven Instruments Ltd., 英国)进行测定。沉积物样品在仪器分析前,通过超声波振荡30 s进行均质。粒度分为5类:黏土(<4 μm)、粉砂(4~63 μm)、极细砂(63~ 125 μm)、细砂(125~250 μm)和中砂(250~500 μm)。然后,使用1 mol/L HCl处理0.2 g沉积物以去除无机碳,之后采用去离子水冲洗,直到滤液pH呈中性,并在–60℃冷冻干燥。使用元素分析仪(VARIO EL Cube, 德国)和稳定同位素比质谱仪(Thermo MAT253, 美国)对样品进行分析,分别测定TOC、TN含量以及δ13C和δ15N组成。同位素比率使用δ符号表示,并根据以下公式(Gu et al, 2018)计算:
| $ δ^{13}C或δ^{15}N(‰)=(R_{\mathrm{sample}}/R_{\mathrm{standard}} –1)×1000‰ $ |
式中,Rsample值和Rstandard值分别为样品和标准品的相应比值(13C/12C或15N/14N)。根据实测的TOC和TN计算出沉积物样品的C/N值,δ13C和δ15N的分析误差分别为±0.2‰和±0.3‰;TOC和TN的测量精度分别为±0.02%和±0.03%。
1.4 统计分析使用Excel 2010软件整理分析数据,采用Surfer 13.0软件绘制站位图和等值线图,并采用IBM SPSSStatistics 25.0统计软件进行皮尔逊相关分析和显著差异性检验。
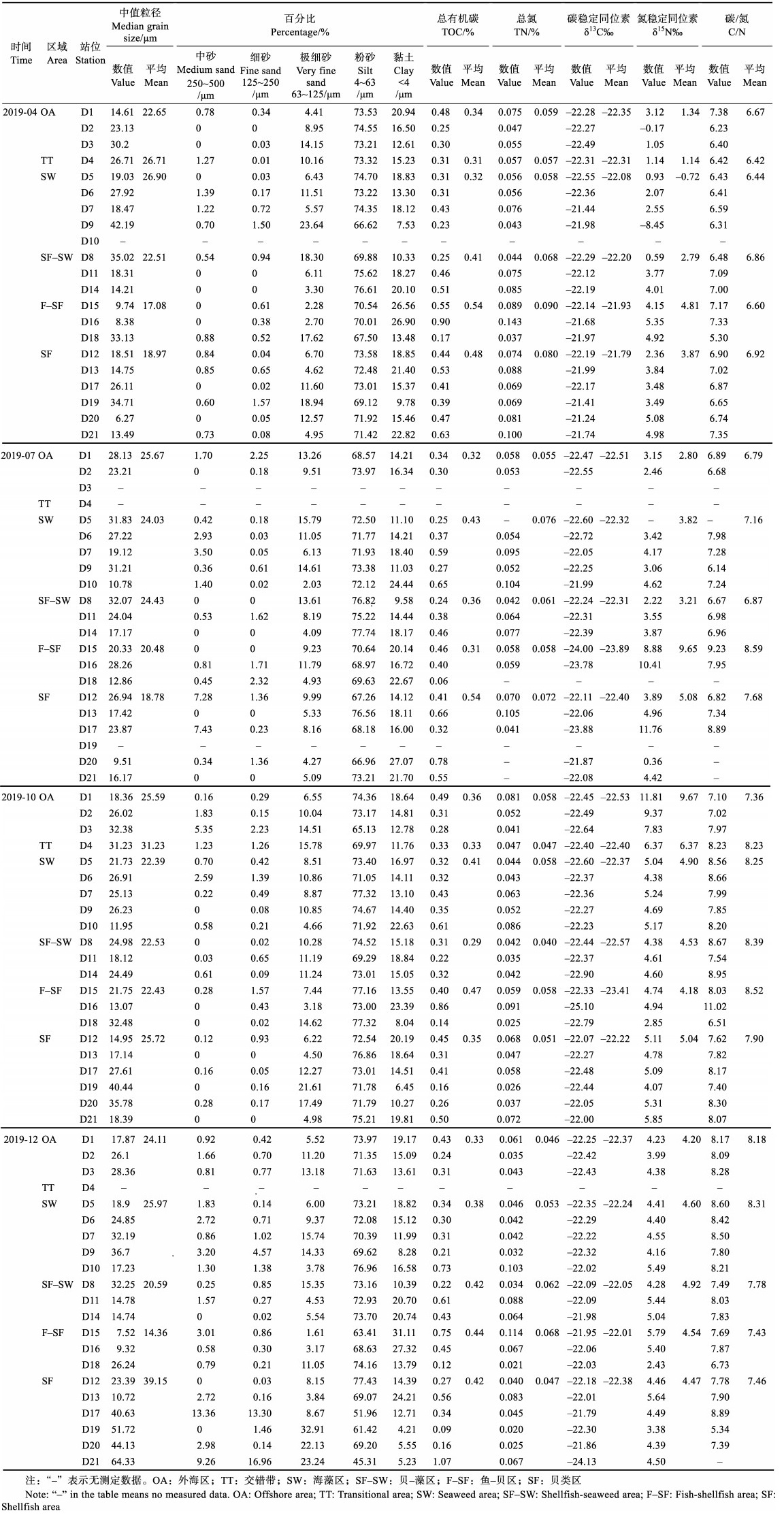
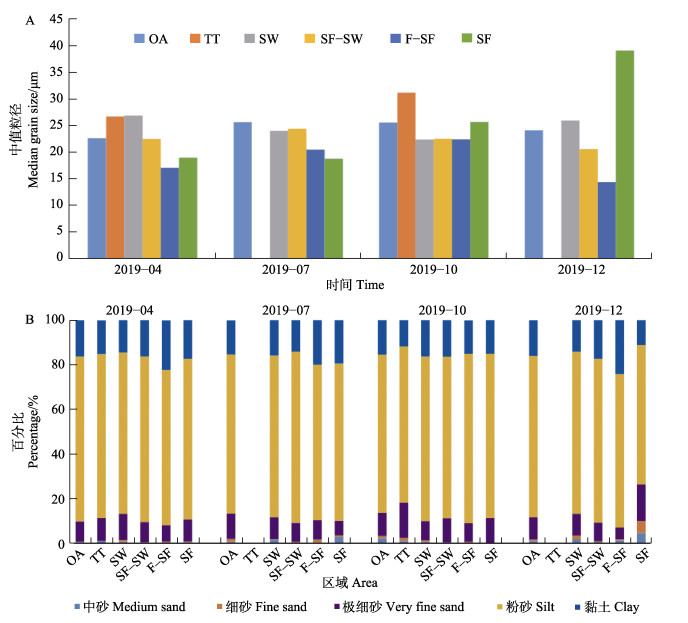
2 结果与讨论 2.1 沉积物粒度分布从表1可以看出,4、7、10和12月桑沟湾表层沉积物的平均中值粒径分别为(21.74±9.93)、(22.23± 7.17)、(24.24±7.54) 和(27.10±14.79) µm,12月最大,4月最小。其中,OA、TT、SW、SF–SW、F–SF和SF区域4个季节表层沉积物的平均粒径分别为(24.40± 5.57)、(28.97±3.20)、(24.72±8.10)、(22.52±7.44)、(18.59± 9.65)和(25.96±14.66) µm (图2A)。TT区域的平均粒径最大,F–SF区域的最小。从表层沉积物粒度组成来看,粉砂在各区域均占主导地位,4、7、10和12月所占比例分别为72.26%、71.97%、73.17%和68.98%,其次是黏土和极细砂(图2B)。沉积物的粒度分布特征主要受控于物源和沉积。桑沟湾大部分区域为养殖区域,与天然沉积物相比,生物沉积导致沉积物具有更细小的结构(Biggs et al, 1984; Franzo et al, 2014)。此外,桑沟湾的水交换能力较弱。史洁等(2009)研究发现,桑沟湾养殖活动导致湾口的流速减小40%,整个海湾平均半交换时间增加71%。所以,桑沟湾沉积物的粒度分布与海水养殖和水动力条件有关。
|
|
表 1 桑沟湾表层沉积物的粒度、TOC、TN. δ13C、δ15N和C/N分布 Tab.1 The grain size, TOC, TN, δ13C, δ15N and C/N in surface sediment of Sanggou Bay, China |
|
图 2 桑沟湾表层沉积物的平均粒度(A)以及不同组分在桑沟湾沉积物中的百分比(B) Fig.2 The median grain size in surface sediments from Sanggou Bay (A) and the percentage of different components in sediments from Sanggou Bay (B), respectively OA:外海区;TT:交错带;SW:海藻区;SF–SW:贝–藻区;F–SF:鱼–贝区;SF:贝类区 OA: Offshore area; TT: Transitional area; SW: Seaweed area; SF–SW: Shellfish-seaweed area; F–SF: Fish-shellfish area; SF: Shellfish area |
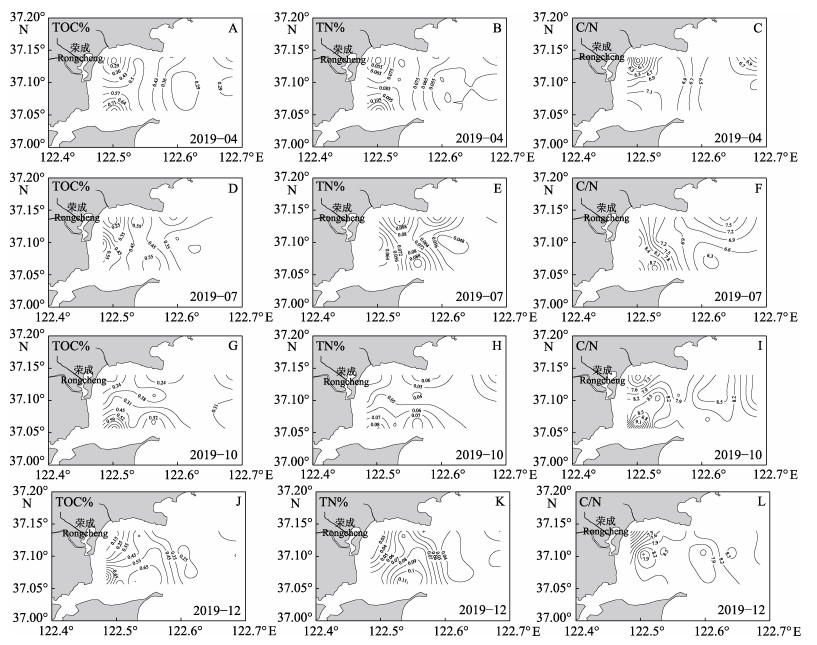
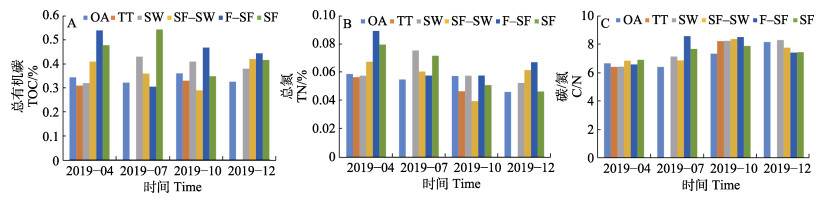
桑沟湾沉积物TOC、TN、δ13C和δ15N结果见表1。从表1可以看出,4、7、10和12月沉积物TOC的平均值分别为(0.42±0.17)%、(0.42±0.18)%、(0.37±0.16)%和(0.40±0.24)%;4、7、10和12月沉积物TN的平均值分别为(0.071±0.024)%、(0.067±0.021)%、(0.053± 0.019)%和(0.054±0.027)%。TOC和TN季节变化呈现出相似性,总体表现为春季最高,秋季最低,季节差异不大。从平面分布进行分析(图3),桑沟湾沉积物TOC和TN呈现出相似的分布趋势,在SF–SW、F–SF和SF区域出现较高值。4月呈现从外海向养殖区增加的趋势 (图3A和图3B);7月呈从外海向SF–SW区增加的趋势(图3D和图3E);10月呈现出从北向南逐渐增加的趋势(图3G和图3H);而在12月呈现从四周向SF区递增的趋势(图3J和图3K)。这主要是由于桑沟湾养殖密度大,养殖品种产量高,鱼、贝排泄物和海带碎屑会积累在表层沉积物中(Sui et al, 2019)。此外,SF区域的TOC和TN在4和7月含量相对较高(图4A和图4B),这主要因为在适宜的环境温度下,贝藻等生物的新陈代谢增强,生物沉积与其生活习性和环境条件存在密切关系(周毅等, 2003)。而对于沉积物的C/N值,在4月呈海湾边缘向海湾内部增加,海湾内部由北向南增加的趋势(图3C);7月呈从海湾边缘到近岸水域增加的趋势(图3F);10月呈从海湾北部向西南逐渐增加的趋势(图3I);12月呈现从四周向海湾中部逐渐增加的趋势(图3L)。
|
图 3 2019年4月(A~C)、7月(D~F)、10月(G~I)和12月(J~L)桑沟湾表层沉积物中TOC%、TN%和C/N的水平分布 Fig.3 Horizontal distribution of TOC%, TN%, and C/N in surface sediments from Sanggou Bay in April (A~C), July (D~F), October (G~I) and December (J~L) of 2019, respectively |
|
图 4 桑沟湾表层沉积物中的TOC (A)、TN (B)和C/N (C)分布特征 Fig.4 TOC (A), TN (B) and C/N (C) in surface sediments of Sanggou Bay, respectively |
从图5A可以看出,中值粒径与TOC的相关系数r=−0.764,呈极显著负相关(P<0.001),这表明沉积物粒度是控制桑沟湾表层沉积物TOC含量的主要因素之一,且粒径越小,TOC含量越大,主要是由于小粒径的贝藻生物沉积物增加了沉积物中TOC的含量。从图5B可以看出,沉积物TOC和TN呈极显著正相关(r=0.955, P<0.001),表明沉积物TOC和TN的来源具有一致性。根据回归方程:

|
图 5 桑沟湾表层沉积物中TOC与中值粒径(A)、TOC与TN (B)的相关性 Fig.5 Correlation between TOC and median grain sizes (A), between TOC and TN (B) in surface sediments of Sanggou Bay |
| $\mathrm{TN} \%=0.1405 \times \mathrm{TOC} \%+0.0057$ |
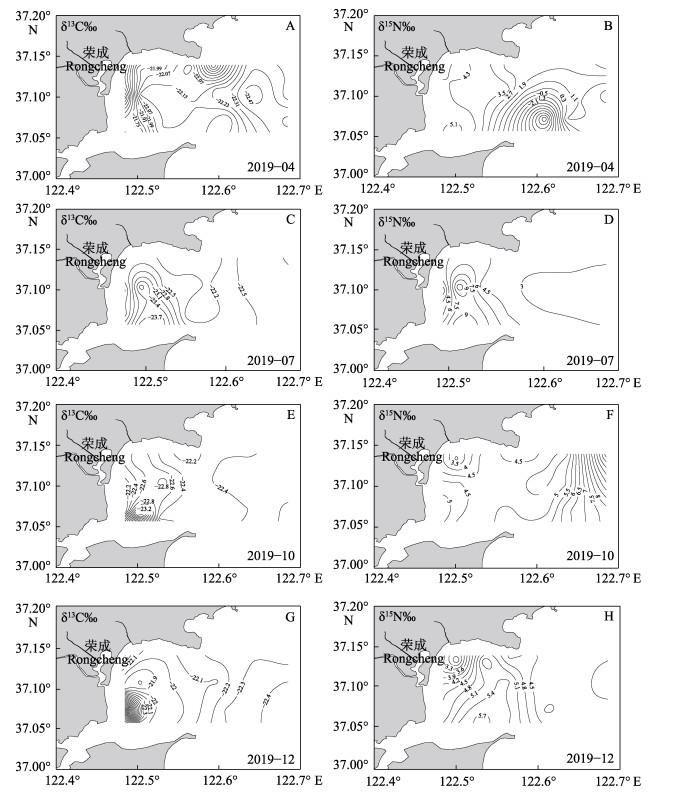
确定沉积物中无机氮(DIN)含量≤0.005 7,表明DIN在表层沉积物中所占比例较小,可以忽略不计。C/N值通常用于识别水生生态系统中有机质的主要来源。研究表明,海洋有机质的C/N值一般<8,陆地有机质的C/N值一般>12 (Bordovskiy, 1965; Prahl et al, 1980; Ogrinc et al, 2004)。水生植物的C/N值一般为6~8或10~30 (Kendall et al, 2001)。本研究中,4月的沉积物C/N值范围为5.30~7.38,平均值为6.70± 0.49;7月的沉积物C/N值在6.14~9.23之间,平均值为7.36±0.87;10月的沉积物C/N值在6.51~11.02之间,平均值为8.08±0.90;12月的沉积物C/N值为5.34~8.89,平均值为7.84±0.78 (表1和图4C)。表明桑沟湾沉积物有机质来源于海源和陆源的混合。稳定同位素(δ13C和δ15N)组成也能用来识别有机质的主要来源。但δ15N与δ13C相比,δ15N更易受到水体中有机质的转化和微生物活动的干扰,不能准确反应有机质的来源(Waser et al, 1998)。已有研究表明,陆源C3和C4植物残渣的δ13C值分别为−33‰~ −25‰和−17‰~ −9‰ (Pancost et al, 2004; Lamb et al, 2005; Yu et al, 2010);土壤有机质的δ13C值范围为−26.0‰~ −21.18‰ (Lu et al, 2013);海藻的δ13C值范围为−22.8‰~ −7.7‰ (Shimoda et al, 2007)。表1中δ13C的结果表明,桑沟湾沉积物有机质来源于海源和陆源,这与C/N结果相一致。δ13C和δ15N的平面分布见图6。从图6可以看出,4月δ13C值从海湾中部向四周逐渐增大,而δ15N值从海湾边缘到近海呈逐渐增加的趋势(图6A和图6B);7月δ13C值从四周向海湾内部逐渐降低,而δ15N值从四周向海湾内部逐渐增加(图6C和图6D);10月δ13C在西南方向呈现较低的值,然后向其他方向逐渐降低,而δ15N值从各个方向向西南方向逐渐增加(图6E和图6F);12月δ13C值从海湾内部向四周逐渐降低,而δ15N值从西北和东北向南部逐渐增加(图6G和图6H)。
|
图 6 2019年4月(A~B)、7月(C~D)、10月(E~F)和12月(G~H)桑沟湾表层沉积物中δ13C‰和δ15N‰的水平分布 Fig.6 Horizontal distribution of δ13C‰ and δ15N‰ in surface sediments from Sanggou Bay in April (A~B), July (C~D), October (E~F) and December (G~H) of 2019, respectively |
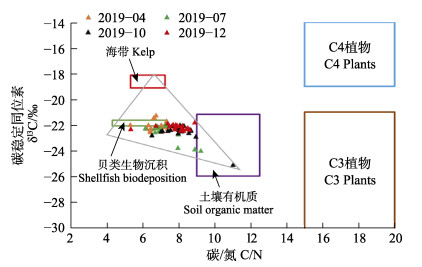
Xia等(2014、2018)和Sui等(2019)研究表明,贝类生物沉积、海藻养殖、陆生高等植物(C3和C4植物)和土壤有机质是海水养殖区沉积物有机质的潜在来源。桑沟湾沉积物有机质的δ13C和C/N值见图7。从图7可以看出,5种可能来源(贝类生物沉积、海带养殖、土壤有机质、C3植物和C4植物)的δ13C和C/N值。从C/N和δ13C的关系可以分析得出,桑沟湾沉积物有机质主要有贝类生物沉积、海带和土壤有机质3个来源,而C3和C4植物在其中的贡献率可以忽略不计(图7)。
|
图 7 桑沟湾沉积有机质δ13C和C/N的关系 Fig.7 The relationship diagram of the δ13C and C/N for the sedimentary organic matter in the Sanggou Bay 实心三角形代表沉积有机质的数据点,矩形代表δ13C和C/N的不同端元值范围。贝类生物沉积(δ13C: −22.08‰~ −21.64‰; C/N: 4.31~7.30)和海带(δ13C: −19.21‰ ~ −18.12‰; C/N: 5.32~7.24)向海洋环境输入的典型δ13C和C/N范围的数据都是由Xia等(2014)编制的;C3植物(δ13C: −32‰~−21‰; C/N: >15)和C4植物(δ13C: −19‰~−9‰;C/N: >15)的数据来自Boutton (1991)和Lamb等(2005);土壤有机质数据(δ13C: −26.0‰~−21.18‰;C/N: 9.0~12.5)引自Lu等(2012) The solid triangle represent the data points of sedimentary organic matter, the rectangles represent the range of different end-member values for δ13C and C/N. The date of typical δ13C and C/N ranges of organic inputs to marine environments for shellfish biodeposition (δ13C: −22.08‰~ –21.64‰; C/N: 4.31~7.30) and kelp (δ13C: −19.21‰~ −18.12‰; C/N: 5.32~7.24) are both compiled from Xia et al (2014) The data for C3 plant (δ13C: −32‰~ −21‰; C/N: >15) and C4 plant (δ13C: −19‰~−9‰; C/N: >15) are compiled from Boutton (1991) and Lamb et al (2005). Data for soil organic matter (δ13C: −26.0‰~ −21.18‰; C/N: 9.0~12.5) are quoted from Lu et al (2012) |
多元混合模型已被广泛用于定量估算陆源和海洋有机质对海洋沉积物的贡献(Hedges et al, 1979; Hu et al, 2006)。本研究采用三元混合模型分析桑沟湾沉积物不同来源的贡献率。基于图7选定的3个端元是贝类生物沉积、海带和土壤有机质,三元混合模型如下:
| $ δ^{13}C_{sample}=δ^{13}C_{B}×f_{B}+δ^{13}C_{A}×f_{A}+δ^{13}C_{S}×f_{S} $ |
| $ C/N_{sample}=C/N_{B}×f_{B}+C/N_{A}×f_{A}+C/N_{S}×f_{S} $ |
| $ 1=f_{B}+f_{A}+f_{S} $ |
式中,δ13C为有机质的稳定碳同位素组成,C/N为有机质中C和N的摩尔比,f为不同来源相对于总有机质的百分比,B为贝类生物沉积源,A为海带源,S为土壤有机质源。前期研究测定了贝类生物沉积中的δ13C和C/N值,扇贝和长牡蛎排泄物的δ13C和C/N平均值分别为−21.86‰和5.8;海带的δ13C和C/N平均值分别为−18.55‰和6.48 (Xia et al, 2014)。土壤有机质δ13C值为−24.2‰,C/N值为10.6 (Lu et al, 2013)。采用三元混合模型估算了贝类生物沉积、土壤有机质和海带对桑沟湾沉积物中有机质的贡献。从图8可以看出,4、7、10和12月桑沟湾沉积物中有机质的主要来源均是贝类生物沉积,平均贡献率分别为79.34% (4月)、77.86% (7月)、58.15% (10月)和57.82% (12月)。贝类生物沉积作用可能对整个近海生态系统的物质循环和能量流动产生了影响。一般来说,每年春季是扇贝和牡蛎收获的季节。
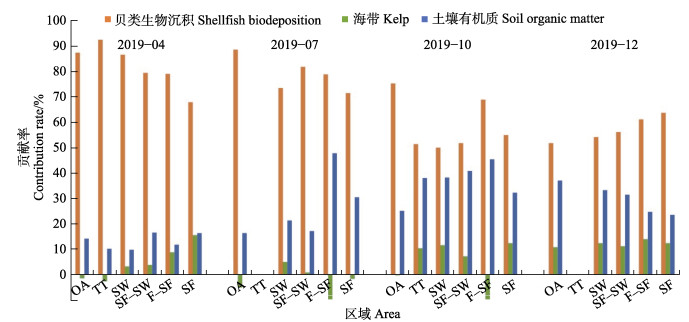
|
图 8 2019年4、7、10和12月不同来源对桑沟湾表层沉积物有机质的贡献率 Fig.8 Contribution rates of the different sources to organic matters in surface sediments from Sanggou Bay in April, July, October and December of 2019, respectively |
因此,收获前,4月贝类沉积的高贡献率(图8)可能与贝类对水产养殖的贡献量大有关,这将导致贝类排泄量增加。秋季扇贝、海带收获后,贝类排泄量也有所下降,土壤有机质的贡献率增加。综合4个季节的调查结果表明,贝类生物沉积、土壤有机质和海带的贡献率分别为67.52%>26.47%>5.97%。由此可以看出,海水养殖是桑沟湾沉积有机质的主要贡献来源,平均贡献率为73.49%。Xia等(2018)对2014和2015年桑沟湾4个季节总体调查分析发现,贝类生物沉积、土壤有机质和海带的贡献率分别为48.53%>37.44%> 14.03%。表明随着时间的推移,桑沟湾海域贝类养殖规模不断壮大,其生物沉积量在持续增加,未来可能会继续增大。
同时,也证实了海水养殖对桑沟湾沉积有机质的重要贡献。另外,剩下的近30%是土壤有机质,这一贡献率相对较大,还有少数几个出现负贡献率的情况,这一情况在卢凤云等(2012)对潮白河上游有机质的碳、氮稳定同位素分析及来源探讨中也有存在,这可能是由于忽略了一些其他来源,例如来自网箱水产养殖的废弃食物、鱼粪和死亡鱼体。在今后的研究中,应进一步调查饲料垃圾和鱼类粪便,为桑沟湾沉积有机质的来源作补充。已有研究也报道了水产养殖区沉积有机质的来源,例如,爱莲湾是中国北方典型的集约化水产养殖区之一,海带和贝类的浮筏养殖是该地区独特的海水养殖方法。Zhe等(2019)研究发现,爱莲湾表层沉积物的沉积类型为黏土和粉砂,表层沉积物以海洋源性有机碳为主,有机碳主要来源于贝藻生物沉积。另外,Sui等(2019)在2016年对桑沟湾不同养殖区不同季节表层沉积物的调查中发现,桑沟湾沉积有机质是海洋浮游植物、陆源和养殖源的混合体,表层沉积物以海水养殖有机碳为主。因此,水产养殖作为沿海地区最重要的人类活动之一,对近海生态系统的碳循环会产生重要影响。
3 结论本研究中,调查了桑沟湾表层沉积物中粒径分布,TOC、TN、δ13C和δ15N的时空分布及来源分析。结果表明,桑沟湾沉积物成分组成以粉砂为主,其次是黏土和极细砂,并且粒度分布与海水养殖模式和水动力学条件密切相关。TOC和TN季节变化呈现出相似性,总体表现为春季最高,秋季最低,季节差异不大。从平面分布进行分析,桑沟湾沉积物TOC和TN呈相似的分布趋势,在贝类养殖区、贝藻混养区和鱼贝混养区出现较高值。沉积物粒度是控制桑沟湾表层沉积物TOC含量的主要因素之一,且粒径越小,TOC含量越大。沉积物TOC和TN呈显著正相关,表明沉积物TOC和TN的来源具有一致性。表层沉积物中有机质的主要贡献来源有贝类生物沉积、海带养殖和土壤有机质。基于三元混合模型得到,贝类生物沉积贡献率为67.52%,土壤有机质贡献率为26.47%,海带贡献率为5.97%。贝类生物沉积是桑沟湾沉积物中有机质的主要来源。所以,除了海水养殖环境中通过贝藻养殖生物体收获产生的可移出的碳汇外,贝藻生物沉积贡献的碳埋藏量也不可忽视,构成养殖环境沉积碳库的重要组成部分。下一步在计量渔业碳汇时,应充分考虑海水养殖区贝藻生物沉积对近海碳埋藏的贡献。
BAUER J E, CAI W J, RAYMOND P A, et al. The changing carbon cycle of the coastal ocean. Nature, 2013, 504(7478): 61-70 DOI:10.1038/nature12857 |
BIGGS R B, HOWELL B A. The estuary as a sediment trap: alternate approaches to estimating its filtering efficiency- science direct. The Estuary as a Filter, 1984, 6(3): 107-129 |
BORDOVSKIY O K. Transformation of organic matter in bottom sediments and its early diagenesis. Marine Geology, 1965, 3(1/2): 83-114 |
BOUTTON T W. Stable carbon isotope ratios of natural materials: Ⅱ. Atmospheric, terrestrial, marine, and freshwater environments. Carbon Isotope Techniques, 1991, 173-185 |
Fisheries and Fisheries Administration Bureau of the Ministry of Agriculture and Rural Affairs. 2020 yearbook of fishery statistics of China, 2020, 6 [农业农村部渔业渔政管理局. 2020年中国渔业统计年鉴, 2020, 6] |
FRANZO A, CIBIC T, NEGRO P D, et al. Microphytobenthic response to mussel farm biodeposition in coastal sediments of the northern Adriatic Sea. Marine Pollution Bulletin, 2014, 79(1/2): 379-388 |
GU Y G, NING J J, KE C L, et al. Bioaccessibility and human health implications of heavy metals in different trophic level marine organisms: A case study of the South China Sea. Ecotoxicology and Environmental Safety, 2018, 163: 551-557 DOI:10.1016/j.ecoenv.2018.07.114 |
HEDGES J I, MANN D C. The lignin geochemistry of marine sediments from the southern Washington coast. Geochimica et Cosmochimica Acta, 1979, 43(11): 1809-1818 DOI:10.1016/0016-7037(79)90029-2 |
HU J, PENG P, JIA G, et al. Distribution and sources of organic carbon, nitrogen and their isotopes in sediments of the subtropical Pearl River estuary and adjacent shelf, Southern China. Marine Chemistry, 2006, 98(2/3/4): 274-285 |
KENDALL C, SILVA S R, KELLY V J. Carbon and nitrogen isotopic compositions of particulate organic matter in four large river systems across the United States. Hydrological Processes, 2001, 15(7): 1301-1346 DOI:10.1002/hyp.216 |
LAMB A L, WILSON G P, LENG M J. A review of coastal palaeoclimate and relative sea-level reconstructions using δ13C and C/N ratios in organic material. Earth-Science Reviews, 2005, 75(1): 29-57 |
LI J Q, ZHANG W W, DING J K, et al. Effect of large-scale kelp and bivalve farming on seawater carbonate system variations in the semi-enclosed Sanggou Bay. Science of the Total Environment, 2020, 753: 142065 |
LU F Y, LIU Z Q, JI H B. Carbon and nitrogen isotopes analysis and sources of organic matter in the upper reaches of the Chaobai River near Beijing, China. Science China Earth Science, 2013, 56(2): 217-227 DOI:10.1007/s11430-012-4525-x |
LU F Y, LIU Z Q, JI H B. Carbon and nitrogen stable isotope analysis of organic matter in the upper reaches of Chaobai River and its sources. Chinese Science:Earth Science, 2012, 42(12): 1912-1922 [卢凤云, 刘竹青, 季宏兵. 潮白河上游有机质的碳、氮稳定同位素分析及来源探讨. 中国科学:地球科学, 2012, 42(12): 1912-1922] |
MAO Y Z, LI J Q, XUE S Y, et al. Ecological functions of the kelp Saccharina japonica in integrated multi-trophic aquaculture, Sanggou Bay, China. Acta Ecologica Sinica, 2018, 38(9): 3230-3237 [毛玉泽, 李加琦, 薛素燕, 等. 海带养殖在桑沟湾多营养层次综合养殖系统中的生态功能. 生态学报, 2018, 38(9): 3230-3237] |
OGRINC N, FONTOLAN G, FAGANELI J, et al. Carbon and nitrogen isotope compositions of organic matter in coastal marine sediments (The Gulf of Trieste, N Adriatic Sea): indicators of sources and preservation. Marine Chemistry, 2004, 95(3): 163-181 |
PANCOST R D, BOOT C S. The palaeoclimatic utility of terrestrial biomarkers in marine sediments. Marine Chemistry, 2004, 92(1): 239-261 |
PRAHL F G, BENNETT J T, CARPENTER R. The early diagenesis of aliphatic hydrocarbons and organic matter in sedimentary particulates from Dabob Bay, Washington. Geochimica et Cosmochimica Acta, 1980, 44(12): 1967-1976 DOI:10.1016/0016-7037(80)90196-9 |
SHI J, WEI H. Numerical simulation of hydrodynamic field in semi closed high density raft culture sea area. Journal of Ocean University of China (Nature Science), 2009, 39(6): 1181-1187 [史洁, 魏皓. 半封闭高密度筏式养殖海域水动力场的数值模拟. 中国海洋大学学报(自然科学版), 2009, 39(6): 1181-1187] |
SHIMODA K, ARAMAKI Y, NASUDA J, et al. Food sources for three species of Nihonotrypaea (Decapoda: Thalassinidea: Callianassidae) from western Kyushu, Japan, as determined by carbon and nitrogen stable isotope analysis. Journal of Experimental Marine Biology and Ecology, 2007, 342(2): 292-312 DOI:10.1016/j.jembe.2006.11.003 |
SUI J J, ZHANG J H, REN S J, et al. Organic carbon in the surface sediments from the intensive mariculture zone of Sanggou Bay: Distribution, seasonal variations and sources. Journal of Ocean University of China, 2019, 18(4): 985-996 DOI:10.1007/s11802-019-3768-y |
TANG Q S, LIU H. Marine fishery carbon sink and its expansion strategy. Engineering Sciences, 2016, 18(3): 68-73 [唐启升, 刘慧. 海洋渔业碳汇及其扩增战略. 中国工程科学, 2016, 18(3): 68-73 DOI:10.3969/j.issn.1009-1742.2016.03.012] |
WALSH J J, ROWE G T, IVERSON R L, et al. Biological export of shelf carbon is a sink of the global CO2 cycle. Nature, 1981, 291(5812): 196-201 DOI:10.1038/291196a0 |
WASER N A D, HARRISON P J, NIELSEN B, et al. Nitrogen isotope fractionation during the uptake and assimilation of nitrate, nitrite, ammonium, and urea by a marine diatom. Limnology and Oceanography, 1998, 43(2): 215-224 DOI:10.4319/lo.1998.43.2.0215 |
XIA B, CUI Y, CHEN B J, et al. Carbon and nitrogen isotopes analysis and sources of organic matter in surface sediments from the Sanggou Bay and its adjacent areas, China. Acta Oceanological Sinica, 2014, 33(12): 48-57 DOI:10.1007/s13131-014-0574-7 |
XIA B, HAN Q, CHEN B J, et al. Influence of shellfish biodeposition on coastal sedimentary organic matter: A case study from Sanggou Bay, China. Continental Shelf Research, 2018, 172: 12-21 |
YU F, ZONG Y, LLOYD J M, et al. Bulk organic δ13C and C/N as indicators for sediment sources in the Pearl River delta and estuary, southern China. Estuarine Coastal and Shelf Science, 2010, 87(4): 618-630 DOI:10.1016/j.ecss.2010.02.018 |
ZHANG L, YIN K, WANG L, et al. The sources and accumulation rate of sedimentary organic matter in the Pearl River estuary and adjacent coastal area, Southern China. Estuarine Coastal and Shelf Science, 2009, 85(2): 190-196 DOI:10.1016/j.ecss.2009.07.035 |
ZHANG M L, ZOU J, MAO Y Z, et al. Contribution of cultured Chlamys farreri to carbon cycle in Sanggou Bay. Fishery Modernization, 2011, 38(4): 13-16 [张明亮, 邹健, 毛玉泽, 等. 养殖栉孔扇贝对桑沟湾碳循环的贡献. 渔业现代化, 2011, 38(4): 13-16 DOI:10.3969/j.issn.1007-9580.2011.04.003] |
ZHANG Y Y, ZHANG J H, LIANG Y T, et al. Formation process and mechanism of carbon sink of aquaculture environment in China's coastal waters. Chinese Science:Earth Science, 2017, 47(12): 1414-1424 [张永雨, 张继红, 梁彦韬, 等. 中国近海养殖环境碳汇形成过程与机制. 中国科学:地球科学, 2017, 47(12): 1414-1424] |
ZHAO J, ZHOU S L, SUN Y, et al. Research on Sanggou Bay aquaculture hydro-environment. Marine Fisheries Research, 1996, 27(2): 68-79 [赵俊, 周诗赉, 孙耀, 等. 桑沟湾增养殖水文环境研究. 海洋水产研究, 1996, 27(2): 68-79] |
ZHE P, GAO Q F, DONG S L, et al. Effects of abalone (Haliotis discus hannai Ino) and kelp (Saccharina japonica) mariculture on sources, distribution, and preservation of sedimentary organic carbon in Ailian Bay, China: Identified by coupling stable isotopes (δ13C and δ15N) with C/N ratio analyses. Marine Pollution Bulletin, 2019, 141: 387-397 DOI:10.1016/j.marpolbul.2019.02.053 |
ZHOU Y, YANG H S, ZHANG F S. Biological deposition and ecological effects of bivalves in seawater. Marine Science, 2003(2): 23-26 [周毅, 杨红生, 张福绥. 海水双壳贝类的生物沉积及其生态效应. 海洋科学, 2003(2): 23-26 DOI:10.3969/j.issn.1000-3096.2003.02.008] |