2. 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 山东 青岛 266071;
3. 上海海洋大学水产与生命学院 上海 201306;
4. 莱州明波水产有限公司 山东 莱州 261418;
5. 福建省逸有水产科技有限公司 福建 漳州 363402
2. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao, Shandong 266071, China;
3. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China;
4. Laizhou Mingbo Aquatic Products Co., Ltd, Laizhou, Shandong 261418, China;
5. Fujian Yiyou Aquatic Science and Technology Co. LTD, Zhangzhou, Fujian 363402, China
体外受精常见于鱼类和两栖类,头足类中除八腕目(Octopoda)外其他种类均属于体外受精,其特征是交配时雄性个体通过茎化腕将精子临时储存到雌性个体内,雌体内的精子可使产出的成熟卵子受精。在头足类生殖活动中,纳精囊和精子囊发挥重要作用。因此,纳精囊作为头足类储存精子的器官具有较高的研究价值。目前,国外关于头足类纳精囊的研究较为广泛,主要涉及玄妙微鳍乌贼(Idiosepius paradoxus) (Sato et al, 2010)、澳大利亚巨乌贼(Sepia apama) (Naud et al, 2005)、福氏枪乌贼(Loligo forbesi) (Lum-kong, 1992)、真蛸(Octopus vulgaris) (Froesch et al, 1975)等头足类,在纳精囊的形态、位置、数量以及精子利用等多方面研究报道,国内仅见茎柔鱼(Dosidicus gigas)(许泓民等, 2013)和金乌贼(Sepia esculenta)(王展等, 2020)纳精囊的研究,主要集中在纳精囊的结构特征和精子储存及利用等研究,尚未涉及莱氏拟乌贼(Sepioteuthis lessoniana)纳精囊的研究。莱氏拟乌贼是我国广东、福建等沿海海域的常见捕捞水产品,具有较高的营养、食用和经济价值(董正之等, 2001)。本文拟通过对莱氏拟乌贼纳精囊进行显微和超显微研究,了解其组织结构特征,探讨其功能和作用,旨在为进一步丰富莱氏拟乌贼繁殖生物学内容以及为其全人工繁育等提供理论参考。
1 材料与方法 1.1 材料野生莱氏拟乌贼雌性样品于2020年8月采自福建海域(117°73′~118°02′E、23°26′~23°48′N),采集工具为底层拖网。本研究共采用实验样本5只,样本体表健康无破损,平均胴长为(17.5±6.4) cm,平均体重为(392±76) g。
1.2 方法 1.2.1 石蜡切片样品的制备使用解剖刀将纳精囊样品中段切割成小块,置于Bouin´s固定液中固定24 h,再使用70%酒精溶液冲洗样品,并保存在70%的酒精溶液中。对样品进行脱水、二甲苯透明、石蜡包埋。使用KD-2508型轮转式切片机连续切片,切片厚度约为5 μm。石蜡切片经脱蜡干燥、HE染色、中性树胶封片后,置于Nikon 80i正置显微镜(日本)拍照并记录分析。
1.2.2 透射电镜样品制备切取体积约为0.5~1 mm³的纳精囊实验样品,在2.5%戊二醛中固定4 h,H3PO4缓冲盐溶液漂洗3次,每次15 min。在0.1 mol/L H3PO4缓冲溶液和1%锇酸的混合溶液中固定2 h,经H3PO4缓冲液漂洗3次,每次约15 min。梯度乙醇溶液脱水,样品先后在50%、70%、80%、90%、95%的乙醇溶液中各15 min,分别在100%的乙醇溶液和100%的丙酮溶液中各30 min。使用Epon812环氧树脂包埋,在37℃、45℃、65℃温箱中固化,时间皆为24 h。固化样品使用Leica UC7型超薄切片机半薄切片,切片厚度为60~80 nm。切片经2%醋酸铀饱和酒精溶液和枸橼酸铅染色,染色时间为15 min。置于HT7700的透射电镜中观察,拍照电压为80 kV。
1.2.3 扫描电镜样品的制备纳精囊取下并剪碎,将剪碎组织加入盛有已过滤海水的离心管中,500 r/min离心5 min,使用吸管去除沉淀物质后,5000 r/min离心5 min,去除上清液后,加入3%戊二醛固定液固定4 h。固定后样品通过0.1 mol/L H3PO4缓冲溶液漂洗,在30%、50%、70%、80%、100%的酒精溶液中依次脱水,其中,100%酒精中脱水2次,每次10 min。乙酸异戊脂置换,50% 1次,100% 2次。使用XD-1型CO2临界点干燥器干燥,IB-3型离子镀金仪喷金镀膜,然后置于VEGA3扫描电镜下拍照。
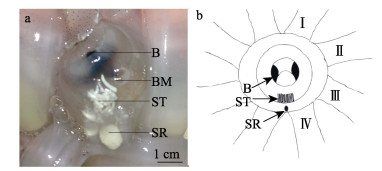
2 结果 2.1 精子囊和纳精囊结构莱氏拟乌贼具有1个纳精囊,是口膜上特殊凸起,位于左侧第Ⅳ腕和右侧第Ⅳ腕中间上方,纳精囊整体呈白色,椭圆形,形状类似大米粒,长和宽分别为0.6和0.3 cm。交配后,雌体莱氏拟乌贼纳精囊内侧的口膜处可见大量精子囊,精子囊呈乳白色,成簇状并集中分布,口膜内的其余位置未发现精子囊(图 1a和图 1b)。
|
图 1 莱氏拟乌贼纳精囊
Fig.1 The seminal receptacle of S. lessoniana
a:纳精囊;b:纳精囊示意 B:角质颚;BM:荚膜;SR:纳精囊;ST:精子囊;Ⅰ:左侧第Ⅰ腕;Ⅱ:左侧第Ⅱ腕;Ⅲ:左侧第Ⅲ腕;Ⅳ:左侧第Ⅳ腕 a: Seminal receptacle; b: Schematic diagram of seminal receptacle B: Beak; BM: Buccal membrane; SR: Seminal receptacle; ST: Spermatangial; Ⅰ: Left first wrist; Ⅱ: Left second wrist: Ⅲ: Left third wrist; Ⅳ: Left fourth wrist |
纳精囊由囊壁组织、储精小囊和少量中心管腔组成(图 2a)。囊壁组织由单层立方上皮、肌肉组织和疏松结缔组织构成,其中,上皮细胞的中央可见圆形细胞核;单层立方上皮与疏松结缔组织间的分界明显,疏松结缔组织厚度约为80~200 μm,颜色较浅;肌肉组织与结缔组织间分界不明显,主要以平滑肌为主,厚度约为140~240 μm (图 2b)。储精小囊是纳精囊的主要部分,数量较多,大多形状不规则,少数呈圆形或椭圆形,直径在180~300 μm之间(图 2a、图 2c和图 2d)。储精小囊的囊壁由单层柱状上皮细胞构成,细胞上着生数量较多的纤毛(图 2c)。储精小囊间充满大量结缔组织和少量肌肉组织(图 2d)。中心管腔由2个或多个储精小囊连接在一起形成,数量较少但空间较大,中心管腔的组织结构特征与储精小囊一致(图 2a和图 2e)。
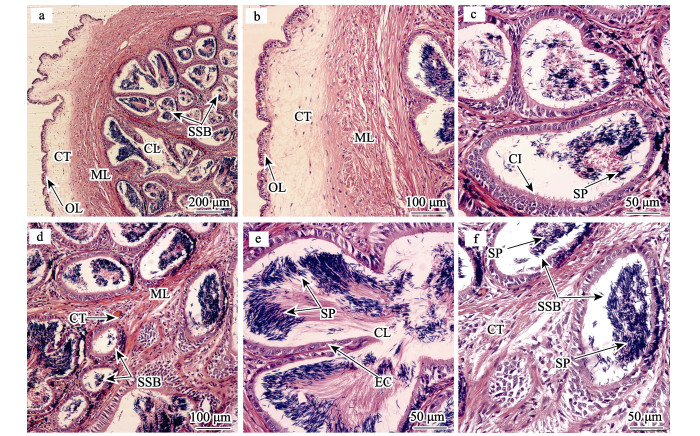
|
图 2 莱氏拟乌贼纳精囊的显微结构 Fig.2 Microstructure of seminal receptacle of S. lessoniana a:纳精囊横切面;b:囊壁组织横切面,示腺壁组织、结缔组织和肌肉组织;c:储精小囊横切面,示储精小囊、纤毛和精子;d:储精小囊横切面,示储精小囊、结缔组织和肌肉组织;e:中心管腔横切面,示上皮细胞和精子;f:储精小囊横切面,示储精小囊和精子CI:纤毛;CL:中央管腔;CT:结缔组织;EC:上皮细胞;ML:肌肉层;OL:腺壁;SP:精子;SSB:储精小囊 a: Transverse section of seminal receptacle; b: Transverse section of cyst wall tissue, showing outer layer, connective tissue and muscle layer; c: Transverse section of sperm storage bulb, showing sperm storage bulb, cilium and sperm; d: Transverse section of sperm storage bulb, showing sperm storage bulb, connective tissue and muscle layer; e: Transverse section of center lumen, showing epithelial cell and sperm; f: Transverse section of sperm storage bulb, showing sperm storage bulb and sperm; CI: Cilium; CL: Center lumen; CT: Connective tissue; EC: Epithelial cell; ML: Muscle layer; OL: Outer layer; SP: Sperm; SSB: Sperm storage bulb |
中心管腔和储精小囊中均存在大量精子,精子的顶体和鞭毛分别被染成深蓝色和红色。多数储精小囊中的精子没有固定朝向,分布较分散,中心管腔中精子排列比较有序,精子头部朝向囊体和管腔壁内侧,精子与管腔壁有一定间隔(图 2e和图 2f)。
2.3 纳精囊的超微结构 2.3.1 储精小囊的上皮细胞储精小囊由单层柱状上皮细胞构成,细胞外充满结缔组织等细胞外基质,与上皮细胞分界明显(图 3a)。上皮细胞的细胞核呈圆形或椭圆形,个体较大,直径约为3~6 μm(图 3b和图 3c)。细胞质中存在滑面和粗面内质网,大量呈椭圆形的线粒体,直径约为0.5~1.0 μm,高尔基复合体由多层弓形扁平囊和分泌小泡组成,分泌小泡破裂后释放大量分泌颗粒(图 3c、图 3d和图 3e)。此外,细胞质中还分布着圆形的囊泡,部分囊泡中充满繁密颗粒,还有部分囊泡已经破裂。储精小囊的囊腔上着生大量纤毛,全长约为7 μm (图 3a、图 3c和图 3e)。
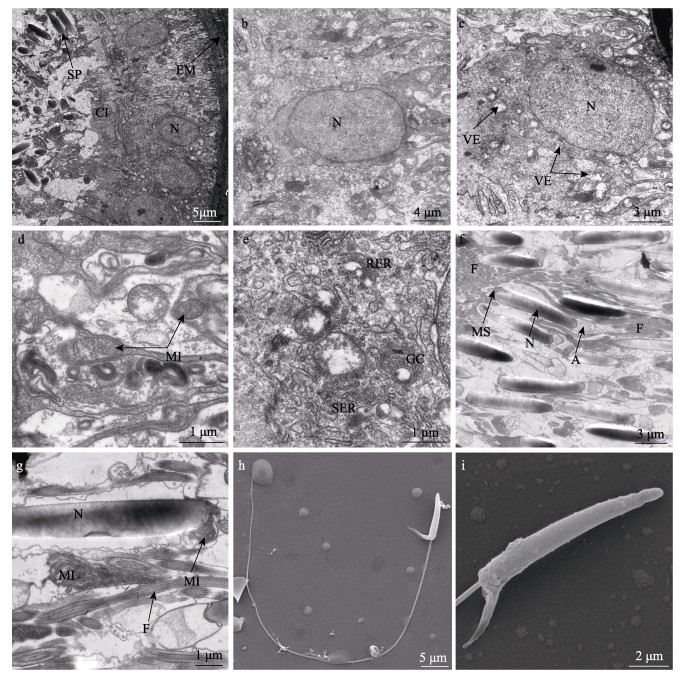
|
图 3 莱氏拟乌贼纳精囊超微结构 Fig.3 Ultrastructure of the seminal receptacle of S. lessoniana a:储精小囊横切面;b:细胞核横切面,示细胞核;c:细胞核横切面,示细胞核和囊泡;d:细胞质横切面,示线粒体;e:细胞质横切面,示内质网和高尔基复合体;f:精子纵切面,示精子顶体、细胞核、线粒体距和鞭毛;g:精子纵切面,示精子线粒体、细胞核和鞭毛;h:精子形态;i:精子头部形态A:顶体;CI:纤毛;F:鞭毛;EM:细胞外基质;GC:高尔基复合体;MI:线粒体;MS:线粒体距;N:细胞核;RER:粗面内质网;SER:滑面内质网;SP:精子;VE:囊泡 a: Transverse section of sperm storage bulb; b: Transverse section of nucleus, showing nucleus; c: Transverse section of nucleus, showing nucleus and vesicle; d: Transverse section of cytoplasm, showing mitochondria; e: Transverse section of cytoplasm, showing endoplasmic reticulum and golgi complex; f: Longitudinal section of sperm, showing acrosome, nucleus, mitochondria spur and flagellum; g: Longitudinal section of sperm, showing mitochondria of sperm, nucleus and flagellum; h: Morphology of sperm; i: Morphology of sperm head A: Acrosome; CI: Cilium; F: Flagellum; EM: Extracellular matrix; GC: Golgi complex; MI: Mitochondria; MS: Mitochondria spur; N: Nucleus; RER: Rough endoplasmic reticulum; SER: Smooth endoplasmic reticulum; SP: Sperm; VE: Vesicle |
储精小囊中精子排列紧密,精子头部朝向上皮细胞的纤毛,精子鞭毛大多朝向囊腔中部。莱氏拟乌贼精子头部长约为13 μm,为圆屋顶形的顶体和细长圆柱形的精核。其中,细胞核颜色较深,线粒体数量较多,集中分布于精核后端并形成袋状的线粒体距,精子尾部为细长的鞭毛(图 3f、图 3g、图 3h和图 3i)。
3 讨论 3.1 纳精囊的结构特征不同种类的头足类,纳精囊的位置、数目和组织构造特征存在较大差异。八腕目的纳精囊成瓶状,位于输卵管腺中,与中央腺和外周腺以输卵管为中心呈轴对称排列(Olivares et al, 2017)。八腕目的纳精囊具备储存精子的功能,纳精囊中排出的精子在输卵管腺中与卵子结合完成受精。八腕目中嘉庚蛸(Octopus tankahkeei)纳精囊一般有24个左右(焦海峰, 2005);负蛸(Octopus mimus)和真蛸(Octopus vulgaris)具有20个纳精囊(Froesch et al, 1975; Olivares et al, 2017)。福氏枪乌贼仅具有1个椭圆形的纳精囊,位于口膜上,交配前纳精囊与口膜颜色接近,交配时口膜变大近乳白色(Lum-kong, 1992)。澳大利亚巨乌贼(Naud et al, 2005)、曼氏无针乌贼(Sepiella maindroni)(叶德锋等, 2011)、金乌贼(王展等, 2020)和欧洲横纹乌贼(Sepia officinalis) (叶德锋等, 2011)等各具有2个纳精囊。其中,曼氏无针乌贼纳精囊位于雌体口膜腹叶,开口于口膜边缘,交配后精子囊附着于雌体左侧第Ⅱ、第Ⅲ腕基部和口膜处(张炯等, 1965);金乌贼纳精囊位于雌体口膜腹面,近似葡萄状,精子囊在口膜表面呈簇状分布(Naud et al, 2005);澳大利亚巨乌贼纳精囊位于雌体角质颚下的椭圆形肉质凸起内,形似一串葡萄(Naud et al, 2005)。茎柔鱼纳精囊为乳白色的椭球状突起,数量达260余个(许泓民等, 2013)。莱氏拟乌贼与福氏枪乌贼接近,纳精囊位于口膜上且仅有1个。除八腕目的纳精囊位于输卵管腺外,其余大部分头足类的纳精囊位于口膜上,但也有少数种类存在特殊情况,Hoving等(2007、2008)研究表明,狼乌贼(Lycoteuthis lorigera)和异鱿乌贼(Heteroteuthis dispar)纳精囊分别位于胴体背部和内脏团末端。头足类纳精囊数量、位置和组织结构等特征具有差异,与不同种类的繁殖策略如交配方式、产卵策略和产卵量等有关。
精子囊是头足类交配过程中,由精荚经过放射等一系列反应形成的(张秀梅等, 2019)。莱氏拟乌贼的精子囊黏附于雌体口膜腹面,头足类的交配选择通常为一雌多雄,交配前雄性个体向雌性个体口膜处喷水,目的是冲刷之前雄体交配后放置的精子囊,以提高自身的父权贡献率。其他头足类的精子囊植入的部位还包括雌性个体的外套腔内或输卵管周围等(张秀梅等, 2019)。精子囊的植入部位与头足类的生活水域、运动方式和繁殖习性等多种因素有关。
3.2 纳精囊的显微结构由于头足类生活、生殖习性不同,纳精囊的结构特征存在差异。莱氏拟乌贼储精小囊由纤毛立方上皮组成,大部分储精小囊由环肌分隔并包裹,也存在少数由多个储精小囊形成较大的中心管腔。澳大利亚巨乌贼纳精囊由单层柱状上皮细胞组成,囊腔外被平滑肌层包裹(Naud et al, 2005);茎柔鱼纳精囊由肌肉组织包裹,囊腔由纤毛立方上皮形成,囊腔间互相连通(许泓民等, 2013),肌肉组织在纳精囊中起到支撑保护的作用。目前,关于精子进入纳精囊的方式有多种解释:(1)依靠纳精囊肌肉收缩。枪乌贼(Loligo vulgaris)纳精囊开口处的杯状细胞使精子活力降低,随即在纳精囊肌肉收缩的帮助下才能进入(Fernández-Álvarez et al, 2018);(2)依靠口膜的扩张。玄妙微鳍乌贼在交配完成后,通过雌性个体口膜的扩张,收集其头部、腕和颈部的精子囊(Sato et al, 2010);(3)依靠纳精囊内纤毛摆动。金乌贼纳精囊的中央管腔中纤毛数量丰富,且精子分布规律,推测可能是精子通过纤毛摆动进入储精小囊(王展等, 2020)。此外,在欧洲横纹乌贼的纳精囊中存在黏液细胞,以及玄妙微鳍乌贼储精小囊底部的液泡,表明粘液细胞和液泡皆具有吸引精子的作用(Sato et al, 2010; Hanlon et al, 1999)。莱氏拟乌贼精子囊呈簇状密集分布,并与纳精囊的位置接近,纳精囊内壁上分布大量纤毛和少量粘液细胞,分析认为,莱氏拟乌贼纳精囊中的精子依靠纤毛摆动和黏液细胞内的分泌物质吸引精子进入储精小囊内。
头足类受精包括体内和体外2种方式,八腕目属于体内受精,受精位置位于输卵管腺内;乌贼目(Sepiida)和枪形目(Teuthida)为体外受精,受精位置与纳精囊和精子囊位置有关,通常位于口下方的纳精囊或外套腔内的输卵管附近(郑小东等, 2009)。头足类在产卵过程利用精子具有一定偏好性,澳大利亚巨乌贼优先利用纳精囊处的精子(Sato et al, 2010),而金乌贼雌性个体优先利用精子囊中的精子,其次是纳精囊,交配后的雌性金乌贼个体,其精子囊中的精子在4~5 d后完全消失(Sato et al, 2010)。头足类交配和产卵是相对独立的,受精和产卵则是连续过程(Rocha et al, 2001)。当头足类雌性个体交配与产卵时间间隔较短时,为保证卵子的较高受精率,雌体优先利用精子囊中的精子使产出的卵子受精;当间隔时间较长时,雌体则通过纳精囊中释放的精子使卵子受精。此外,通过莱氏拟乌贼纳精囊的储精小囊和中心管腔中精子排列状态,推测可能是储精小囊是精子进入的通道,这时精子可能处于游动过程中,而中心管腔则是精子较长时间储存的空间,精子头部受分泌物质吸引全部朝向囊壁。本研究表明,莱氏拟乌贼纳精囊内壁的柱状纤毛上皮具有一定的分泌功能,具有抑制精子活性并营养精子功能。这与曼氏无针乌贼和玄妙微鳍乌贼研究结果相一致,其中,曼氏无针乌贼纳精囊中白色物质可以抑制精子活性(叶德锋等, 2011),而玄妙微鳍乌贼纳精囊内的大量糖类物质可以营养精子(Sato et al, 2010)。
3.3 纳精囊的超微结构在秘鲁鱿鱼(Dosidicus gigas)纳精囊的研究中,纳精囊内精子头部附着于上皮细胞上,囊腔内主要被精子鞭毛占据(Fernández-Álvarez et al, 2018),表明纳精囊内的上皮细胞释放了吸引精子的物质,这与莱氏拟乌贼纳精囊内精子吸附状态一致。莱氏拟乌贼纳精囊的纤毛上皮细胞内散布大量线粒体、内质网和高尔基复合体,有利于分泌物质的合成。其中,内质网和高尔基复合体能合成多种分泌物质,分泌物质包裹在分泌小泡中内胞吐的方式释放到囊腔中,线粒体则为细胞内分泌物质的合成、运输和分泌提供能量保障。控制纳精囊内精子释放可能存在多种因素,Young等(1967)研究表明,章鱼输卵管腺纳精囊中的神经网络在产卵过程中起到协调卵子产出和精子释放的功能。
头足类为适应生态环境、生殖策略,经过长期的生殖进化,导致头足类精子形态构造的异同。莱氏拟乌贼顶体位于精子最前端,呈圆屋顶形,与福氏枪乌贼、欧洲横纹乌贼和锥异尾枪乌贼(Alloteuthis subulata)相一致(Maxwell et al, 1975)。此外,顶体的形状还有钻头形和圆锥形,顶体内包含多种与受精相关的酶,不同形状的顶体受精能力不同(Oflahertv et al, 2004)。精子尾部由线粒体和鞭毛组成,在精子形成过程中,不同种类头足类的线粒体演化后的结构不同,根据线粒体对鞭毛的包裹程度可将线粒体分为线粒体袖套、线粒体鞘和线粒体距。莱氏拟乌贼精子的线粒体为线粒体距,与福氏枪乌贼、欧洲横纹乌贼、锥异尾枪乌贼(Maxwell et al, 1975)、太平洋僧头足贼(Fields et al, 1976)、金乌贼(刘长琳等, 2011)和拟目乌贼(Sepia lycidas)(罗江, 2014)等一致。Wada等(2010)研究表明,线粒体距可发育成线粒体袖套,线粒体距的形成与部分头足类为体外受精的生殖策略相适应。鞭毛为精子的运动器官,在精子进出纳精囊的过程中发挥作用,线粒体为精子运动提供能量。
4 结论莱氏拟乌贼具有1个位于雌体口膜处的纳精囊,由腺壁组织、中心管腔和储精小囊组成。纳精囊内主要为储精小囊,其囊壁由单层上皮细胞组成,细胞内含有多种具有合成分泌物质功能的细胞器,其分泌物质具有吸引精子的功能,囊壁上分布大量纤毛通过摆动对精子进出纳精囊起到一定作用。此外,莱氏拟乌贼的精子顶体呈圆屋顶形,线粒体最终演化为线粒体距。
DONG Z Z. Fauna Sinica-Phylum Mollusca-Class Cephalopoda. Beijing: Science Press, 2001: 104-106 [董正之. 中国动物志软体动物门头足纲. 北京: 科学出版社, 2001: 104-106]
|
FERNÁNDEZ-ÁLVAREZ F Á, VILLANUEVA R, HOVING H J T, et al. The journey of squid sperm. Reviews in Fish Biology and Fisheries, 2018, 28(1): 191-199 DOI:10.1007/s11160-017-9498-6 |
FIELDS W G, THOMPSON K A. Ultrastructure and functional morphology of spermatozoa of Rossia pacifica (Cephalopoda, Decapoda). Canadian Journal of Zoology, 1976(54): 908-932 |
FROESCH D, MARTHY H J. The structure and function of the oviducal gland in octopods (Cephalopoda). Proceedings of the Royal Society of London, 1975, 188(1090): 95-101 |
HANLON R T, AMENT S A, GABR H. Behavioral aspects of sperm competition in cuttlefish, Sepia officinalis (Sepioidea: Cephalopoda). Marine Biology, 1999, 134(4): 719-728 DOI:10.1007/s002270050588 |
HOVING H J T, LAPTIKHOVSKY V, PIATKOWSKI U, et al. Reproduction in Heteroteuthis dispar (Rüppell, 1844) (Mollusca: Cephalopoda): A sepiolid reproductive adaptation to an oceanic lifestyle. Marine Biology, 2008, 154(2): 219-230 DOI:10.1007/s00227-008-0916-0 |
HOVING H J T, LIPINSKI M R, ROELEVELD M A C, et al. Growth and mating of southern African Lycoteuthis lorigera (Steenstrup, 1875) (Cephalopoda; Lycoteuthidae). Reviews in Fish Biology and Fisheries, 2007, 17(2/3): 259-270 |
JIAO H F. Morphology of reproductive system and spermiogenesis in Octopus tankahkeei. Master's Thesis of Ningbo University, 2005 [焦海峰. 嘉庚蛸生殖系统结构和配子发生. 宁波大学硕士研究生学位论文, 2005]
|
LIU C L, ZOU J, LIU J G, et al. Ultrastructure of the spermatozoon of Sepia esculenta. Progress in Fishery Sciences, 2011, 32(3): 1-6 [刘长琳, 邹健, 刘君刚, 等. 金乌贼精子的超微结构. 渔业科学进展, 2011, 32(3): 1-6 DOI:10.3969/j.issn.1000-7075.2011.03.001] |
LUM-KONG A. A histological study of the accessory reproductive organs of female Loligo forbesi (Cephalopoda: Loliginidae). Journal of Zoology, 1992, 226(3): 469-490 DOI:10.1111/j.1469-7998.1992.tb07493.x |
LUO J. Studies on structure of reproductive system and gametogenesis in Sepia lycidas. Master´s Thesis of Ningbo University, 2014 [罗江. 拟目乌贼生殖系统结构和精卵发生的研究. 宁波大学硕士研究生学位论文, 2014]
|
MAXWELL W L. Spermiogenesis of Eusepia officinalis (L. ), Loligo forbesi (Steenstrup) and Alloteuthis subulata (L. ) (Cephalopoda, Decapoda). Proceedings of the Royal Society of London Biological Sciences, 1975, 191(1105): 527-535 |
NAUD M J, SHAW P W, HANLON R T, et al. Evidence for biased use of sperm sources in wild female giant cuttlefish (Sepia apama). Proceedings of the Royal Society B: Biological Sciences, 2005, 272(1567): 1047-1051 DOI:10.1098/rspb.2004.3031 |
OFLAHERTV C, RODRIGUEZ P, SRIVASTAVA S. L-arginine promotes capacitation and acrosome reaction in cryopreserved bovine spermatozoa. Biochim et Biophys Acta, 2004, 1674(2): 215-221 DOI:10.1016/j.bbagen.2004.06.020 |
OLIVARES A, AVILA-POVEDA O H, LEYTON V, et al. Oviducal glands throughout the gonad development stages: A case study of Octopus mimus (Cephalopoda). Molluscan Research, 2017, 37(4): 229-241 DOI:10.1080/13235818.2017.1334275 |
ROCHA F, GUERRA A, GONZALEZ A F. A review of reproductive strategies in cephalopods. Biological Reviews, 2001, 76: 291-304 DOI:10.1017/S1464793101005681 |
SATO N, KASUGAI T, IKEDA Y, et al. Structure of the seminal receptacle and sperm storage in the Japanese pygmy squid. Journal of Zoology, 2010, 282(3): 151-156 DOI:10.1111/j.1469-7998.2010.00733.x |
WADA T, TAKEGAKI T, MORI T, et al. Sperm removal, ejaculation and their behavioural interaction in male cuttlefish in response to female mating history. Animal Behaviour, 2010, 79(3): 613-619 DOI:10.1016/j.anbehav.2009.12.004 |
WANG Z, WANG L L, LI W T, et al. Histological structure of the seminal receptacle, sperm storage and utilization in the golden cuttlefish (Sepia esculenta). Journal of Fisheries of China, 2020, 44(3): 419-428 [王展, 王琳龙, 李文涛, 等. 金乌贼纳精囊组织结构及其精子的储存和利用. 水产学报, 2020, 44(3): 419-428] |
XU H M, CHEN X J, GUAN W B. The structure of seminal vesicle and spermatophore of Dosidicus gigas. Jiangsu Agricultural Sciences, 2013, 41(10): 199-202 [许泓民, 陈新军, 管卫兵. 茎柔鱼精荚与纳精囊的结构与功能. 江苏农业科学, 2013, 41(10): 199-202 DOI:10.3969/j.issn.1002-1302.2013.10.076] |
YE D F. Sperm packaging, transmitting and storing in Sepiella maindroni. Master's Thesis of Zhejiang Ocean University, 2011 [叶德锋. 曼氏无针乌贼精子包装、传递及储存研究. 浙江海洋大学硕士研究生学位论文, 2011]
|
YOUNG J Z. The Visceral nerves of octopus. Philosophical Transactions of the Royal Society of London, 1967, 253(782): 1-22 |
ZHANG J, LU W C. Preliminary observations on the breeding habits of the squid, Sepiella maindroni de rochebrune. Journal of Fisheries of China, 1965, 2(2): 35-44 [张烔, 卢伟成. 曼氏无针乌贼繁殖习性的初步观察. 水产学报, 1965, 2(2): 35-44] |
ZHANG X M, WANG Z. The unique sperm transport method of cephalopods. Periodical of Ocean University of China (Natural Science), 2019, 49(10): 18-27 [张秀梅, 王展. 头足类独特的精子转运方式. 中国海洋大学学报(自然科学版), 2019, 49(10): 18-27] |
ZHENG X D, HAN S, LIN X Z. Research progress in Cephalopod reproductive behaviors. Journal of Fishery Sciences of China, 2009, 16(3): 459-465 [郑小东, 韩松, 林祥志. 头足类繁殖生物学研究现状与展望. 中国水产科学, 2009, 16(3): 459-465 DOI:10.3321/j.issn:1005-8737.2009.03.020] |



