2. 上海海洋大学水产科学国家级实验教学示范中心 上海 201306
2. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China
肌肉生长抑制素(myostatin, mstn)又称GDF-8,为转录生长因子(TGF-β)超家族的成员之一(徐建勇等, 2008)。近年来,关于mstn的研究主要集中于基因克隆(钟其旺, 2007)、表达模式分析及RNA干扰(闫允君等, 2021)等方面。在具有性别二态性鱼类中,有关mstn基因在雌、雄鱼中生长差异表达分析的研究鲜有报道。mstn基因是肌肉生长发育的负调控因子,对成肌细胞的增殖有抑制能力,该基因的缺失可导致骨骼肌质量的增加(Thomas et al, 2000)。在小鼠(Mus musculus)中敲除mstn可使骨骼肌增加2~3倍(Grobet et al, 2003; McPherron et al, 1997)。斑马鱼(Brachydanio rerio)中沉默mstn基因可以导致肌纤维数量、体积增加(Acosta et al, 2005; Amali et al, 2004);mstn基因敲除的牙鲆(Paralichthys olivaceus)表现为体厚增加和肌纤维数量增加(Kim et al, 2019)。
脊椎动物的肌肉生长分为限定性生长与非限定性生长。在哺乳动物和鸟类中,肌纤维的数量在出生前是固定的,出生后,肌肉生长主要取决于已有肌纤维体积的增大,为典型的限定性生长(Choi et al, 2014)。鱼类兼有肌纤维增生生长和肥大生长。肌纤维增生生长及肥大生长对于鱼类生长的贡献取决于鱼的种类和体型(De Almeida et al, 2008)。小型(生长缓慢型)鱼类,如斑马鱼,主要依赖已有肌纤维体积的增大而不是新的肌纤维生成,而大型(生长迅速型)物种,如牙鲆,既依赖于肌纤维增生生长,也依赖于纤维肥大生长(Lee et al, 2019)。
半滑舌鳎(Cynoglossus semilaevis)为高蛋白质、低脂肪、富含维生素的鱼类,深受消费者喜爱,是我国重要的海水养殖对象。半滑舌鳎的生长过程具有明显的性别二态性,1龄雌鱼的体重及生长速度是雄鱼的2~4倍(Chen et al, 2014)。雌鱼为什么比雄鱼生长快?mstn基因在雌、雄鱼生长差异中是否发挥作用?查明这些问题对于半滑舌鳎遗传改良和养殖业发展具有重要意义。尽管半滑舌鳎mstn基因的克隆已经有过报道(钟其旺, 2007),但有关半滑舌鳎mstn基因在雌鱼和雄鱼中的表达差异及其与鱼体生长关系的研究尚未见报道。
为探究mstn基因与半滑舌鳎生长发育的关系,阐明半滑舌鳎雌、雄鱼生长差异的分子机制,本研究选取半滑舌鳎的肝、脾、肠、肾、性腺、鳃、心脏、脑和肌肉9个组织以及不同发育时期的肌肉组织,采用qPCR方法、组织切片染色以及原位杂交方法,对半滑舌鳎雌鱼和雄鱼中mstn的表达模式及表达差异进行系统分析。
1 材料与方法 1.1 材料本研究所用半滑舌鳎取自山东省海阳市黄海水产研究所实验基地。随机选取1龄半滑舌鳎雌、雄鱼各6尾,取肝、脾、肠、肾、性腺、鳃、心脏、脑和肌肉各组织,迅速保存于液氮中备用。不同生长时期的雌、雄鱼各6尾,40 d [雄鱼体重为(0.35±0.08) g,雌鱼体重为(0.34±0.09) g]、60 d [雄鱼体重为(0.74±0.18) g,雌鱼体重为(0.69±0.17) g]、120 d [雄鱼体重为(2.76±0.64) g,雌鱼体重为(2.55±0.76 g)]、180 d [雄鱼体重为(17.40±7.30) g,雌鱼体重为(22.40±8.30) g]、1 y [雄鱼体重为(82.10±15.20) g,雌鱼体重为(376.70±39.30) g]、2 y [雄鱼体重为(207.62± 33.65) g,雌鱼体重为(1 805.00±275.30) g]。取全长中央背部肌肉组织,分别于液氮中速冻保存和4%多聚甲醛(PFA)固定保存。取鳍条保存于无水乙醇中。
1.2 引物设计及合成根据mstn mRNA序列及半滑舌鳎基因组数据(GCA_000525025.1)设计引物,以β-actin作为qPCR的内参基因,引物序列见表 1,引物由北京睿博兴科生物技术有限公司合成。
|
|
表 1 引物序列 Tab.1 The sequence of primers |
基因组DNA的提取按照TIANamp marine animals DNA kit试剂盒(TIANGEN)说明书进行,利用超微量核酸检测仪和琼脂糖凝胶电泳检测DNA的浓度和质量。采用刘洋等(2014)开发的共显性性别特异标记引物scaffold68-2-F/R进行PCR后电泳检测,用于半滑舌鳎遗传性别鉴定。
1.4 总RNA提取及cDNA合成按照TRIzol(Invitrogen)法提取各样本总RNA,采用0.8%琼脂糖凝胶电泳和超微量核酸检测仪测定RNA的质量和浓度。cDNA第一链的合成按照PrimeScript™ RT reagent kit with gDNA easer (Perfect Real Time)(TaKaRa)说明书进行。
1.5 mstn序列验证以1.4制备的肌肉组织cDNA为模板、mstn-F/R为引物,进行PCR扩增。PCR反应程序:95℃预变性3 min;95℃变性30 s,60℃退火30 s,72℃延伸90 s,34个循环;72℃延伸5 min,4℃保存。PCR产物经切胶回收纯化后连接pEASY-T1载体(全式金生物)并转化至大肠杆菌(Escherichia coli)感受态细胞DH5α。筛选阳性克隆送至北京擎科生物技术有限公司测序,将测序结果与基因组数据进行比对分析。
1.6 实时荧光定量PCR实时荧光定量PCR (qRT-PCR)在7500 Fast Real-time PCR仪上进行。qPCR体系参照TB Green® Premix Ex Taq™ (Tli RNaseH Plus) (TaKaRa)说明书,扩增程序:95℃预变性5 min;95℃变性5 s,60℃退火34 s,共40个循环;之后产物进行熔解曲线分析。
1.7 原位杂交半滑舌鳎肌肉组织4%多聚甲醛(PFA)固定不少于24 h后,用75%乙醇脱水(Zhang et al, 2014),送武汉塞维尔生物科技有限公司进行切片制备。设计探针合成引物,SP6和T7启动子序列分别加在正向引物和反向引物的5ʹ端。以肌肉组织cDNA为模板,mstn-ISHF/R为引物进行PCR扩增。随后对PCR产物进行胶回收、连接、转化及测序。以测序正确的PCR纯化产物为模板,参照罗氏体外转录试剂盒(Roche Diagnostics GmbH, 德国)操作说明书进行地高辛标记探针合成,并使用试剂盒(Sigma)进行纯化,纯化产物检测浓度后于–80℃保存。原位杂交具体步骤参考Xu等(2016)的方法。
1.8 数据统计处理采用2–ΔΔCt计算基因相对表达量,其数值采用平均值±标准差(Mean±SD)表示。使用SPSS软件中的单因素方差分析(one-way ANOVA)和t检验进行差异显著检验,显著水平为P < 0.05,使用Prism软件作图。
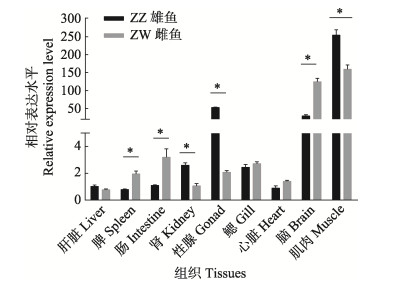
2 结果 2.1 mstn基因各组织性别差异表达1龄半滑舌鳎9个组织中mstn的qPCR结果显示,mstn基因在肌肉中的表达量最高。mstn在雄鱼肌肉中的表达量最高,其次是精巢和脑;雌鱼中,在肌肉和脑中的表达量显著高于其他组织。性别差异表达分析结果显示,mstn表达量在脾、肠、肾、性腺、脑和肌肉组织均存在显著差异(P < 0.05),而在肝脏、鳃和心脏组织中的表达量不存在显著差异(图 1)。
|
图 1 半滑舌鳎mstn基因各组织性别差异表达 Fig.1 Relative expression level of mstn gene in tissues of different gender of Chinese tongue sole *表示存在显著差异(P < 0.05),下同。 Asterisks indicate significant differences (P < 0.05). The same as below. |
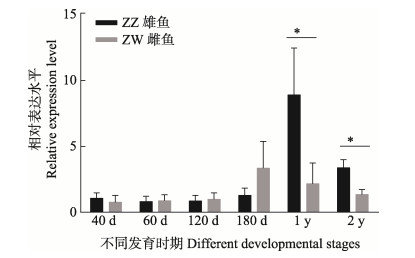
在雌、雄鱼不同生长发育时期,mstn基因在肌肉中的表达模式如图 2所示。结果显示,1 y和2 y雌、雄鱼之间存在差异表达(P < 0.05),雄鱼肌肉中的表达水平明显高于雌鱼肌肉,而在40、60、120和180 d雌、雄鱼之间的表达水平不存在显著差异(P > 0.05)。
|
图 2 半滑舌鳎mstn基因不同发育时期肌肉性别差异表达 Fig.2 Relative expression level of mstn gene in muscle of Chinese tongue sole at different development stages |
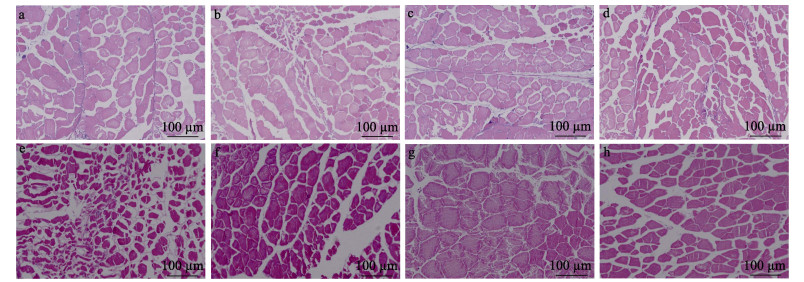
4个时间点(40、60、120和180 d)的肌肉组织切片制备及观察结果如图 3所示,肌纤维的横截面呈现不规则的多角状或圆形,细胞核位于周边。肌纤维聚集成束,其周围包有结缔组织。
|
图 3 不同发育时期的半滑舌鳎肌纤维横切面 Fig.3 Cross section diagram of muscle fibers of Chinese tongue sole at different developmental stages a:40 d雄鱼;b:40 d雌鱼;c:60 d雄鱼;d:60 d雌鱼;e:120 d雄鱼;f:120 d雌鱼;g:180 d雄鱼;h:180 d雌鱼 a: Male fish at 40 d; b: Female fish at 40 d; c: Male fish at 60 d; d: Female fish at 60 d; e: Male fish at 120 d; f: Female fish at 120 d; g: Male fish at 180 d; h: Female fish at 180 d |
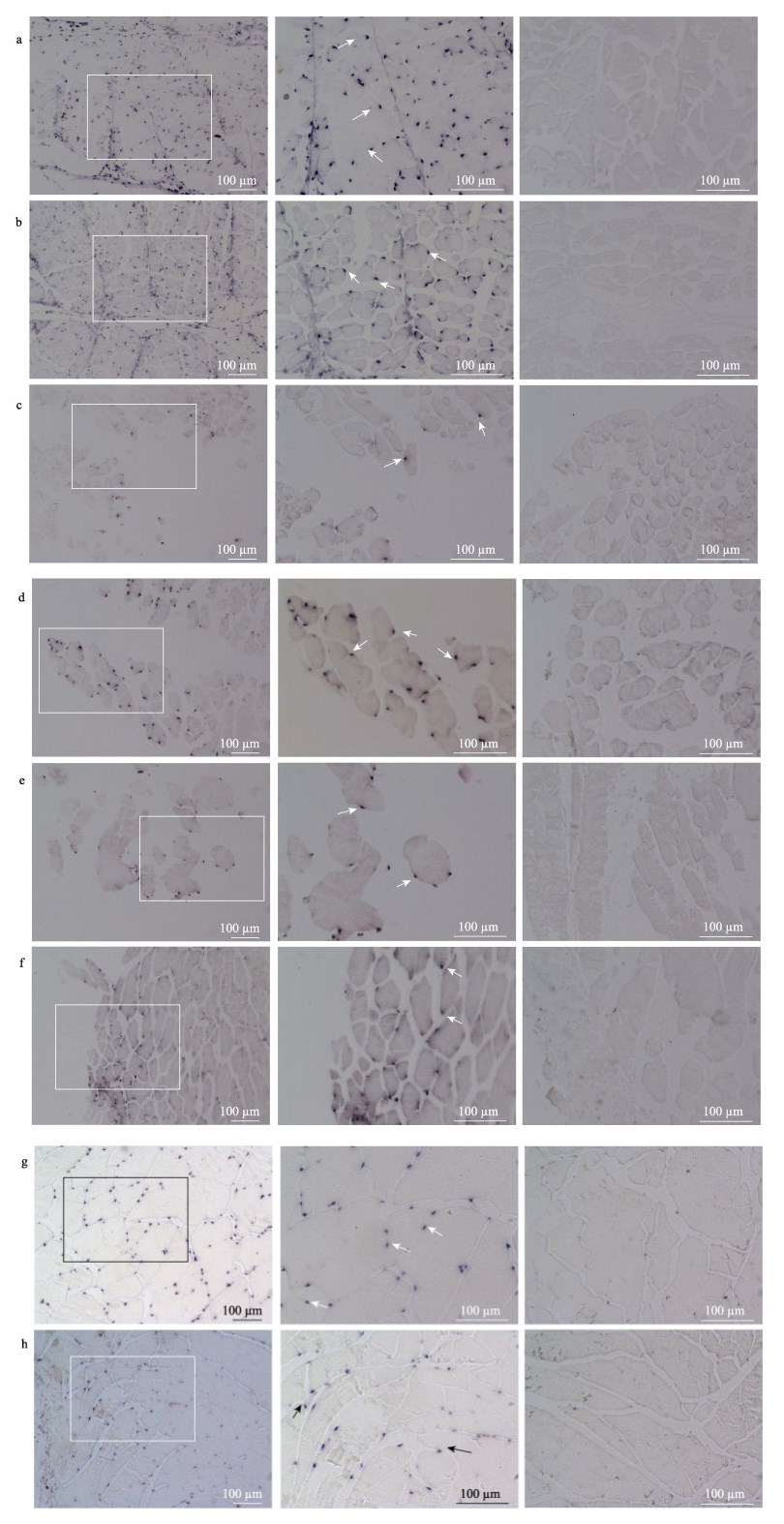
利用合成的RNA探针对60 d、120 d、180 d和1 y半滑舌鳎雌、雄鱼肌肉切片进行原位杂交,结果如图 4显示,反义探针在肌肉组织中存在杂交信号,mstn的表达位置在成肌细胞的边缘,位于肌纤维之间,即成肌细胞增殖、分化的位置;正义探针无杂交信号。
|
图 4 mstn基因原位杂交结果
Fig.4 In situ hybridization of mstn in different days
a:60 d雄鱼;b:60 d雌鱼;c:120 d雄鱼;d:120 d雌鱼;e:180 d雄鱼;f:180 d雌鱼;g:1 y雄鱼;h:1 y雌鱼 每个分图均由2张反义探针杂交图片和1张正义探针杂交图片组成,中间反义探针杂交结果为左侧的放大框区域。 a: 60 d male; b: 60 d female; c: 120 d male; d: 120 d female; e: 180 d male; f: 180 d female; g: 1 y male; h: 1 y female. Each subplot composed of two antisense probe hybridization results and one justice probe hybridization results. The middle antisense probe hybridization result was the zoom box area on the left. |
多种鱼类mstn基因已被克隆,其表达几乎在所有组织中被检测到。本研究在半滑舌鳎的9个组织中均检测到mstn基因的表达,其在肌肉组织的表达量高于其他组织,雄鱼肌肉组织中的表达量高于雌鱼且存在显著差异。半滑舌鳎雌、雄鱼各组织的mstn基因表达模式不同,雄鱼肌肉组织的表达量最高,其次是精巢和脑组织;而雌鱼肌肉和脑组织的表达量高于其他组织。在大刺鳅(Mastacembelus armatus)的成鱼中,mstn在肌肉中表达量最高,其次为眼、脑、性腺和心脏,鳃中表达量最低(钟东明等, 2020)。mstn在团头鲂(Megalobrama amblycephala)成鱼中,肌肉、脑和精巢中存在大量表达,肝胰脏、脾脏和卵巢中少量表达(杜尚可等, 2017)。在淇河鲫(Carassius auratus)的脑组织的表达量最高,其次为肌肉、肝脏、鳃和肾脏,肠中的表达量最低(田雪等, 2017)。mstn在刀鲚(Coilia nasus)肌肉和脑中呈高表达,鳃、肝、脾、肠、肾和头肾中则微量表达(杜富宽等, 2014),与本研究结果相似,mstn在肌肉、脑中表达水平较高。此外,在多种鱼类中发现了mstn基因的亚型,虹鳟(Oncorhynchus mykiss)中2种基因型序列表现为较高的相似性,可达到94% (Ostbye et al, 2001)。斑马鱼中存在mstn-1和mstn-2两个亚型,基因序列比对分析发现,2个基因存在差异(Kerr et al, 2005)。mstn在鱼类不同组织的广泛分布及亚型的存在表明,mstn不仅参与肌肉的生长发育调控,还可能与神经系统及免疫系统的发育相关。
3.2 mstn基因的时空表达特征mstn基因作为肌肉生长发育调控的负调控因子,在鱼类组织的细胞定位主要在胚胎中(濮剑威, 2011),本研究通过对60 d、120 d、180 d和1 y肌肉组织切片原位杂交实验证实,半滑舌鳎mstn基因的表达位置主要位于肌纤维的边缘,即成肌细胞增殖分化的位置。在许氏平鲉(Sebastes schlegelii)中,作为肌肉生长发育的主要正调控基因,myod1s的表达位置在肌纤维的边缘,位于肌纤维之间。除此之外,还发现100 d肌肉组织中的表达myod1s基因的细胞数目显著高于180 d,表明在孵化后100 d肌肉组织具有更高的增殖分化能力(孔祥福等, 2021)。
3.3 mstn基因表达与雌、雄鱼生长差异的关系鱼类的性别二态性在自然界中普遍存在,既有雌鱼生长速度显著高于雄鱼的半滑舌鳎(季相山, 2009);也存在雄鱼明显比雌鱼生长快的现象,例如兰州鲇(Silurus lanzhouensis)(俞兆曦, 2016)和尼罗罗非鱼(Oreochromis niloticus)(朱媛媛, 2012)等。兰州鲇mstn基因在肌肉组织中的表达量最高,雄鱼低于雌鱼,但雌雄个体间差异不显著。生肌决定因子(myogenic determination gene, myod)与myogenin (myog)是肌肉生长发育的主要正调控基因,在肌肉形成过程中起着决定性作用,在兰州鲇肌肉组织中的相对表达量雄鱼高于雌鱼,且雌雄个体间差异显著(俞兆曦, 2016)。
在对半滑舌鳎雌、雄鱼肌肉发育的不同时期mstn表达量的研究表明,雌、雄鱼在1龄和2龄时期雌、雄鱼之间存在差异表达,其他发育时期表达量无显著差异。半滑舌鳎雌、雄鱼体重生长变化研究结果显示,半滑舌鳎在50日龄~5月龄时期,雌、雄鱼之间体重无显著差异;7月龄时,雌鱼生长速度显著快于雄鱼,雌、雄鱼之间体重开始出现差异;12月龄时,雌、雄鱼体重差异最显著;18月龄时,雌鱼平均体重则是雄鱼的4.9倍(季相山, 2009)。对半滑舌鳎体长生长变化的研究表明,6月龄时,雌、雄鱼体长已经出现差异,8月龄时二者之间差异达到显著性水平(李虎等, 2012)。综上所述,半滑舌鳎mstn基因表达量与雌、雄鱼之间的生长差异存在一定的关系,其在雌、雄鱼肌肉组织中的差异表达可能是造成半滑舌鳎雌、雄鱼生长差异的重要因素之一。12月龄雌鱼生长明显快于雄鱼可能与雌鱼mstn表达水平明显低于雄鱼有关。
4 结论本研究采用qPCR方法、组织切片染色以及原位杂交方法,探究半滑舌鳎肌肉生长发育的负调控因子mstn与肌肉生长发育的关联。结果显示,mstn主要在雌、雄鱼肌肉、脑和性腺组织中表达;1龄和2龄时期,雄鱼肌肉组织中mstn表达量高于雌鱼且存在显著差异。原位杂交结果显示,mstn表达位置在成肌细胞边缘,即成肌细胞增殖分化的位置。该研究结果为进一步阐明半滑舌鳎雌雄生长差异提供了思路与基础。
ACOSTA J, CARPIO Y, BORROTO I, et al. Myostatin gene silenced by RNAi show a zebrafish giant phenotype. Journal of Biotechnology, 2005, 119(4): 324-331 DOI:10.1016/j.jbiotec.2005.04.023 |
AMALI A A, LIN C J, CHEN Y H, et al. Up-regulation of muscle-specific transcription factors during embryonic somitogenesis of zebrafish (Danio rerio) by knock-down of myostatin-1. Developmental Dynamics, 2004, 229(4): 847-856 DOI:10.1002/dvdy.10454 |
Bureau of Fisheries and Fisheries Law Enforcement, Ministry of Agriculture and Rural Affairs. China fishery statistical yearbook, 2020. Beijing: China Agriculture Press, 2020 [农业农村部渔业渔政管理局. 2020中国渔业统计年鉴. 北京: 中国农业出版社, 2020]
|
CHEN S L, ZHANG G J, SHAO C W, et al. Whole-genome sequence of a flatfish provides insights into ZW sex chromosome evolution and adaptation to a benthic lifestyle. Nature Genetics, 2014, 46(3): 253-260 DOI:10.1038/ng.2890 |
CHOI Y M, SUH Y, SHIN S, et al. Skeletal muscle characterization of Japanese quail line selectively bred for lower body weight as an avian model of delayed muscle growth with hypoplasia. PLoS One, 2014, 9(4): e95932 DOI:10.1371/journal.pone.0095932 |
DE ALMEIDA F L, CARVALHO R F, PINHAL D, et al. Differential expression of myogenic regulatory factor MyoD in pacu skeletal muscle (Piaractus mesopotamicus Holmberg 1887: Serrasalminae, Characidae, Teleostei) during juvenile and adult growth phases. Micron, 2008, 39(8): 1306-1311 DOI:10.1016/j.micron.2008.02.011 |
DU F K, NIE Z J, XU G C, et al. Cloning and tissue expression of the MSTN gene in Coilia nasus. Journal of Fishery Sciences of China, 2014, 21(4): 684-692 [杜富宽, 聂志娟, 徐钢春, 等. 刀鲚MSTN基因的克隆及其组织表达. 中国水产科学, 2014, 21(4): 684-692] |
DU S K, SHEN R J, CHEN J, et al. Molecular structure and expression of myostatin in Megalobrama amblycephala and its overexpression effects in embryo. Acta Hydrobiologica Sinica, 2017, 41(3): 573-580 [杜尚可, 沈睿杰, 陈杰, 等. 团头鲂MSTN基因cDNA结构、表达及过表达对胚胎发育的影响. 水生生物学报, 2017, 41(3): 573-580] |
GROBET L, PIROTTIN D, FARNIR F, et al. Modulating skeletal muscle mass by postnatal, muscle-specific inactivation of the myostatin gene. Genesis, 2003, 35(4): 227-238 DOI:10.1002/gene.10188 |
JI X S. Induction of gynogenesis, genetic analysis and differential expression of growth-related genes between male and female in half-smooth tongue sole (Cynoglossus semilaevis). Doctoral Dissertation of Shangdong Agricultural University, 2009 [季相山. 半滑舌鳎雌核发育诱导、遗传分析及生长相关基因雌雄差异表达研究. 山东农业大学博士研究生学位论文, 2009]
|
KERR T, ROALSON E H, RODGERS B D. Phylogenetic analysis of the myostatin gene sub-family and the differential expression of a novel member in zebrafish. Evolution and Development, 2005, 7(5): 390-400 DOI:10.1111/j.1525-142X.2005.05044.x |
KIM J, CHO J Y, KIM J, et al. CRISPR/Cas9-mediated myostatin disruption enhances muscle mass in the olive flounder Paralichthys olivaceus. Aquaculture, 2019, 512: 734336 DOI:10.1016/j.aquaculture.2019.734336 |
KONG X F, HE Y, SONG W H, et al. Preliminary functional analysis of MyoD1s genes in regulating the myoblast differentiation in black rockfish (Sebastes schlegelii). Periodical of Ocean University of China (Natural Science), 2021, 51(2): 53-62 [孔祥福, 贺艳, 宋伟豪, 等. 许氏平鲉MyoD1s基因的鉴定及其调控成肌细胞分化功能的初步研究. 中国海洋大学学报(自然科学版), 2021, 51(2): 53-62] |
LEE B, LEE B J, LEE Y, et al. Muscle fiber growth in olive flounder, Paralichthys olivaceus: Fiber hyperplasia at a specific body weight period and continuous hypertrophy. Journal of the World Aquaculture Society, 2019, 50(3): 593-603 DOI:10.1111/jwas.12580 |
LI H, CHEN S Q, LIU H J, et al. Study on sex ratio and comparison of morphological variation between genders of cultured half-smooth tongue sole (Cynoglossus semilaevis). Journal of Fisheries of China, 2012, 36(9): 1331-1336 [李虎, 陈四清, 刘海金, 等. 半滑舌鳎养殖群体的性比与雌雄形态差异比较. 水产学报, 2012, 36(9): 1331-1336] |
LIU Y, CHEN S L, GAO F T, et al. SCAR-transformation of sex-specific SSR marker and its application in half-smooth tongue sole (Cynoglossus semiliaevis). Journal of Agricultural Biotechnology, 2014, 22(6): 787-792 [刘洋, 陈松林, 高峰涛, 等. 半滑舌鳎性别特异微卫星标记的SCAR转化及其应用. 农业生物技术学报, 2014, 22(6): 787-792 DOI:10.3969/j.issn.1674-7968.2014.06.015] |
MCPHERRON A C, LAWLER A M, LEE S J. Regulation of skeletal muscle mass in mice by a new TGF-beta superfamily member. Nature, 1997, 387(6628): 83-90 DOI:10.1038/387083a0 |
OSTBYE T K, GALLOWAY T F, NIELSEN C, et al. The two myostatin genes of Atlantic salmon (Salmo salar) are expressed in a variety of tissues. European Journal of Biochemistry, 2001, 268(20): 5249-5257 DOI:10.1046/j.0014-2956.2001.02456.x |
PU J W. Cloning and function analysis of myostatin-1 in grass crap (Ctenopharyngodon idellus). Master's Thesis of Shanghai Ocean University, 2011 [濮剑威. 草鱼肌肉生长抑制素基因克隆及功能研究. 上海海洋大学硕士研究生学位论文, 2011]
|
THOMAS M, LANGLEY B, BERRY C, et al. Myostatin, a negative regulator of muscle growth, functions by inhibiting myoblast proliferation. Journal of Biological Chemistry, 2000, 275(51): 40235-40243 DOI:10.1074/jbc.M004356200 |
TIAN X, WANG L Y, LIU Y Y, et al. Molecular cloning and expression analysis of myostatin gene in Carassius auratus in Qihe River. Journal of Fisheries of China, 2017, 41(1): 11-20 [田雪, 王良炎, 刘洋洋, 等. 淇河鲫肌肉生长抑制素基因的克隆与表达. 水产学报, 2017, 41(1): 11-20] |
XU J Y, CHEN S L. Cloning and expression analysis of the myostatin (MSTN) gene in Paralichthys olivaceus. Journal of Fisheries of China, 2008, 32(4): 497-506 [徐建勇, 陈松林. 牙鲆肌肉生长抑制素(MSTN)基因克隆. 水产学报, 2008, 32(4): 497-506] |
XU W, LI H, ZHANG N, et al. Expression analysis and characterization of an autosome-localized tesk1 gene in half-smooth tongue sole (Cynoglossus semilaevis). Gene, 2016, 582(2): 161-167 |
YAN Y J, LU X, MENG X H, et al. Screening of genes related to muscle growth under the myostatin regulation by RNA-Seq in Fenneropenaeus chinensis. Progress in Fishery Sciences, 2021, 42(4): 55-63 [闫允君, 卢霞, 孟宪红, 等. 基于转录组分析对中国对虾Myostatin基因调控的肌肉生长相关基因的筛选. 渔业科学进展, 2021, 42(4): 55-63] |
YU Z X. Gene isolation, sequence features and tissue-specific expression associated with growth traits in Silurus lanzhouensis. Master's Thesis of Gansu Agricultural University, 2016 [俞兆曦. 兰州鲇生长性状相关基因的分离、序列特征及组织特异性表达分析. 甘肃农业大学硕士研究生学位论文, 2016]
|
ZHANG L, LIU W, SHAO C, et al. Cloning, expression and methylation analysis of piwil2 in half-smooth tongue sole (Cynoglossus semilaevis). Marine Genomics, 2014, 18: 45-54 |
ZHONG D M, LAI X X, ZHANG M Q, et al. Molecular cloning and expression profiles of myostatin gene in Mastacembelus armatus. Journal of Guangdong Ocean University, 2020, 40(3): 14-21 [钟东明, 赖星星, 张明清, 等. 大刺鳅mstn基因克隆及表达分析. 广东海洋大学学报, 2020, 40(3): 14-21] |
ZHONG Q W. Molecular cloning, expression and sequence analysis of myostatin in four cultured marine flatfishes. Doctoral Dissertation of Ocean University of China, 2007 [钟其旺. 几种鲆鲽鱼类Myostatin基因的克隆及结构和表达分析. 中国海洋大学博士研究生学位论文, 2007]
|
ZHU Y Y. Screening of the AFLP markers linked to the sex locus of Oreochomis niloticus and association between polymorphisms of two genes and growth traits. Doctoral Dissertation of Huazhong Agricultural University, 2012 [朱媛媛. 尼罗罗非鱼性别特异性AFLP标记的筛选及两个基因的多态性与生长性状的相关性分析. 华中农业大学博士研究生学位论文, 2012]
|



