2. 武汉市农业科学院 湖北 武汉 430065
2. Wuhan Academy of Agricultural Sciences, Wuhan, Hubei 430065, China
鳜(Siniperca chuatsi)亦称桂花鱼,属鲈形目(Perciformes)、
 鱼诺卡氏菌(Nocardia seriolae);真菌类,水霉(Saprolegnia) (杨承泰等, 2008);病毒类,传染性脾肾坏死病毒(infectious spleen and kidney necrosis virus, ISKNV)(何建国等, 1998)、大口黑鲈蛙虹彩病毒(largemouth bass Ranavirus, LMBRaIV)、鳜弹状病毒(Siniperca chuatsi rhabdovirus, SCRV)等(梁红茹等, 2021)。其中,病毒病造成的危害最大,几种病毒的发病率普遍在60%以上,发病严重的鱼塘死亡率达100% (付小哲等, 2013)。由于病毒必须在活细胞内才能增殖,因此,建立对病毒敏感的鳜鱼来源细胞系,是进行鳜病毒性病原分离与鉴定、感染与致病机理研究、疫苗制备的重要基础。本研究通过对鳜脑组织细胞的离体培养,建立可连续传代的鳜脑组织细胞系(mandarin fish brain, MFB),并进行了几种常见水生病毒的敏感性实验和外源基因转染实验,旨在为今后开展鳜鱼病毒性疾病的研究奠定前期基础。
鱼诺卡氏菌(Nocardia seriolae);真菌类,水霉(Saprolegnia) (杨承泰等, 2008);病毒类,传染性脾肾坏死病毒(infectious spleen and kidney necrosis virus, ISKNV)(何建国等, 1998)、大口黑鲈蛙虹彩病毒(largemouth bass Ranavirus, LMBRaIV)、鳜弹状病毒(Siniperca chuatsi rhabdovirus, SCRV)等(梁红茹等, 2021)。其中,病毒病造成的危害最大,几种病毒的发病率普遍在60%以上,发病严重的鱼塘死亡率达100% (付小哲等, 2013)。由于病毒必须在活细胞内才能增殖,因此,建立对病毒敏感的鳜鱼来源细胞系,是进行鳜病毒性病原分离与鉴定、感染与致病机理研究、疫苗制备的重要基础。本研究通过对鳜脑组织细胞的离体培养,建立可连续传代的鳜脑组织细胞系(mandarin fish brain, MFB),并进行了几种常见水生病毒的敏感性实验和外源基因转染实验,旨在为今后开展鳜鱼病毒性疾病的研究奠定前期基础。
健康鳜,体长约为(20± 4) cm,体重约为(200±20) g,来源于湖北省武汉市农业科学院养殖基地。鳜传染性脾肾坏死病毒(ISKNV)、鳜蛙虹彩病毒(MFRaIV)、大口黑鲈蛙虹彩病毒(LMBRaIV)、大鲵虹彩病毒(GSIV)、草鱼呼肠孤病毒(GCRV-I)、锦鲤疱疹病毒(KHV)、鲤浮肿病毒(CEV)和鲤疱疹病毒Ⅱ型(CyHV-2)均由本实验室分离保存。
1.1.2 试剂与耗材L-15、RPMI1640、M199、MEM、DMEM培养基、二甲基亚砜(DMSO)、秋水仙素、胎牛血清(FBS)、Antibiotic-Antimycotic (100×)购自Gibco公司;Ⅰ型胶原酶购自上海源叶生物科技有限公司;生长因子bFGF和IGF购自Peprotech公司;含0.25% EDTA的胰蛋白酶溶液购自杭州吉诺生物医药技术公司;Lipofectamine®2000购自Invitrogen公司;HPV碘购自北京渔经生物技术有限责任公司。
1.2 方法 1.2.1 原代培养和传代培养20 mg/L的HPV碘浸泡鳜30 min,然后用75%酒精擦拭鳜鱼体表,在生物安全柜内取鳜鱼脑组织,置于含有2×Antibiotic- Antimycotic的PBS缓冲液中洗涤4~5次后,在无菌培养皿中,用灭菌的眼科剪刀将组织剪成约3 mm3大小的组织块,移至50 mL离心管中,加入适量含0.25% EDTA的胰蛋白酶和胶原酶的消化液,37℃消化0.5~1 h后,用含10% FBS的L-15培养基终止消化,过滤后,1000 r/min离心5 min,加5 mL L-15培养基重悬后移入25 cm2的细胞培养瓶中,培养基中含30%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素、10 ng/mL的bFGF和40 ng/mL IGF,置于28℃培养箱进行原代培养,逐日观察细胞贴壁状况,4 d或5 d后换液,之后每3 d更换1/2培养液。当细胞单层达培养瓶底面积的80%时,参照曾令兵等(2009)的方法对细胞进行传代培养。当传代至第5代后将培养基中FBS的浓度降低至15%;当细胞传代至第10代后,培养基中FBS的浓度降低至10%,并且不再添加生长因子等添加物。
1.2.2 细胞最佳培养条件的确定MFB细胞最佳培养基的确定:选择5种不同的培养基L-15、RPMI1640、M199、MEM和DMEM,分别配制血清体积分数为10%的完全培养基。将细胞密度调整至5×104个/mL,接种到24孔板,每孔1 mL,置于28℃培养箱,每天取3孔计数,连续取7 d,绘制其在不同培养基条件下的生长曲线,确定MFB细胞的最佳培养基。
MFB细胞最适培养温度的确定:用血清体积分数为10%的L-15培养基将消化好的细胞密度调至为5×104个/mL,接种至24孔板,分别置于15℃、22℃、28℃和34℃培养箱中,每天取3孔计数,连续取7 d,绘制其在不同温度下的生长曲线,确定MFB细胞最适培养温度。
MFB细胞最适血清浓度的确定:配制血清体积分数分别为5%、10%、15%和20%的L-15培养基,将消化好的细胞密度调至为5×104个/mL,接种至24孔板,每天取3孔计数,连续取样7 d,绘制其在不同血清浓度条件下的生长曲线,确定MFB细胞最适血清浓度(曾令兵等, 2009; 赵建青等, 2019)。
1.2.3 鳜脑细胞的生长特性测定按照1.2.2的细胞密度和方法将MFB细胞接种至24孔板中,每孔1 mL,置于28℃恒温培养箱培养,培养基为L-15。每隔12 h取出3孔细胞消化后分别计数,连续取7 d并绘制生长曲线;根据T=t×lg2/lg(Nt/N0)计算MFB细胞的群体倍增时间,式中,Nt为t时间的细胞数,N0为接种细胞数。
1.2.4 细胞染色体分析取25代鳜脑组织细胞,培养24 h后更换新鲜培养基,添加终质量浓度为1 µg/mL的秋水仙素,继续培养13~16 h,用Trypsin- EDTA消化细胞单层并离心收集细胞悬液。参照Wang等(2004)和Lu等(2000)的方法进行染色体制片,100倍油镜下观察和统计MFB染色体数目。
1.2.5 28S rRNA基因序列分析与比对设计鳜28S rRNA基因的特异性引物(MF-18SF: 5´-TAGCGA AACCACAGCCAAGG-3´; MF-18SR: 5´-CCAACGCT TGGTGAATTCTG-3´),以MFB细胞总基因组DNA为模板,进行PCR扩增。扩增片段经测序后,于NCBI GenBank数据库中进行Blast比对与分析。
1.2.6 神经元类细胞的免疫荧光鉴定将MFB细胞传至共聚焦皿中,待细胞长至80%,吸净皿中原有培养基,用磷酸盐缓冲溶液(PBS)浸洗3次,每次5 min;4%多聚甲醛室温固定30 min;使用0.2% TritonX-100室温孵育10~15 min,去除TritonX-100后,用PBS浸洗3次,每次5 min;在细胞孔板里滴加按一定比例稀释的一抗:β-tubulin (1∶250)、Neu-N (1∶200),平放于湿盒内4℃孵育过夜。一抗孵育结束后用PBS浸洗3次,每次5 min,去除PBS后,滴加与一抗相应种属的二抗(Cy3稀释比例为1∶2000)稀释液覆盖细胞,室温避光孵育50~120 min;用PBS浸洗3次,每次5 min,去除PBS后在皿中滴加DAPI染液,避光室温孵育10 min;用PBS浸洗3次,每次5 min,在共聚焦显微镜下观察并拍照。
1.2.7 MFB对常见水生病毒的敏感性取39代MFB细胞传至T25细胞培养瓶中,待细胞长至80%时,分别接种ISKNV、MFRaIV、LMBRaIV、GSIV、GCRV-I、KHV、CEV和CyHV-2等8种病毒,每个T25细胞瓶接种0.5 mL病毒液,用无血清培养基补足1 mL,28℃培养箱中孵育1 h后,加4 mL含2% FBS的L-15培养基,在显微镜下观察细胞病变效应(cytopathic effect, CPE)发生情况。能连续产生CPE的病毒传5代后,采用微孔板培养法(李莉娟等, 2013)测病毒滴度。将胰酶消化分散后的MFB细胞接种到96孔板中(Corning, 美国),每孔接种0.1 mL,每孔细胞数约为1×104~2×104个/mL。在离心管中用L-15培养基对病毒液进行连续10倍的稀释。将稀释好的病毒液按梯度分别接种到96孔培养板中,每个稀释度接8孔,每孔接种100 µL。同时设正常细胞对照,逐日观察并记录结果,观察7 d。按Reed-Muench两氏法计算结果(李莉娟等, 2013)。
1.2.8 MFB的瞬时转染效率转染前1 d,将细胞传代1次,使转染当天T25细胞培养瓶中细胞密度达到85%~90%的融合。参照Lipofectamine®2000 Reagent说明书操作,配制DNA-脂质体转染复合物,将配置DNA-脂质体转染复合物逐滴加入培养瓶中并混匀;28℃培养4~6 h后换成含10%胎牛血清的L-15培养基,28℃培养48 h,在倒置荧光显微镜下观察转染水平,随机选取5个视野(100×),计算阳性转染细胞数和总细胞数,取其均值作为转染效率(阳性转染细胞),计算公式如下,
| $ 转染效率/\%=阳性细胞数/视野细胞总数\times 100\% $ |
采用胰酶消化法培养技术,对来源于鳜脑组织的细胞进行原代培养,消化后第2天约有30%的细胞贴壁,7 d左右形成单层,约占瓶底面积的80% (图 1A)。细胞传代后约5 d可形成单层,传代至第5代后细胞生长速度加快,约3~5 d即可传代。鳜脑组织细胞传代后贴壁良好,待传代至第10代时,更换为含10% FBS的L-15培养基。目前,鳜脑组织细胞系已经传至70多代,细胞生长稳定,命名为MFB细胞系(图 1B)。
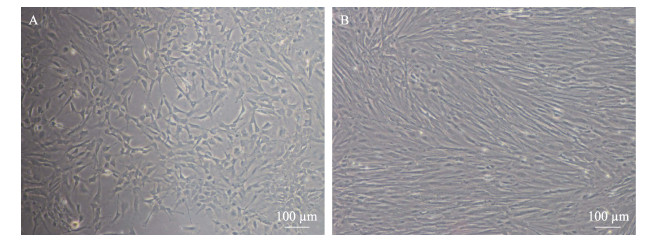
|
图 1 原代培养第7天和第35代的MFB细胞 Fig.1 Primary culture and the 35th passage of MFB cells A:原代培养第7天;B:第35代的MFB细胞 A: Primary culture of MFB cells at day 7; B: The 35th passage of MFB cells |
MFB细胞在L-15、RPMI1640、M199、MEM、DMEM 5种不同培养基中均能稳定生长增殖,细胞计数结果显示:MFB细胞在L-15、M199培养基中增殖速度最快,培养第5天形成致密细胞单层,但从细胞状态以及单层维持时间方面看,L-15培养基要优于M199培养基,细胞数目超过2.5×105个/mL。在RPMI1640和MEM培养基中,MFB细胞能正常生长,不过增殖速度比较缓慢。在DMEM培养基中,MFB细胞不能正常增殖,细胞慢慢开始死亡(图 2)。
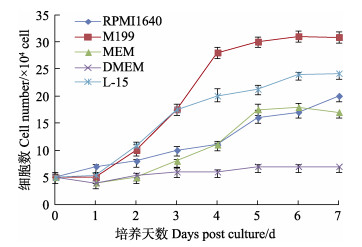
|
图 2 MFB细胞在不同培养基中的生长比较 Fig.2 Comparison of the growth of MFB cells cultured in different medium |
使用L-15培养基,分别添加5%、10%、15%和20%血清,在28℃培养MFB细胞。细胞计数结果显示:在含5%和20%血清的培养基里,MFB细胞均可以正常的贴壁、生长,但细胞的增殖速度缓慢。在含10%血清的L-15培养基里,细胞生长增殖迅速,1—5 d间呈近指数生长,培养至第5天细胞数目超过2.5×105个/mL;但在细胞单层的稳定性及保持时间方面,含10%血清的培养基优于含其他浓度血清的L-15培养基(图 3)。
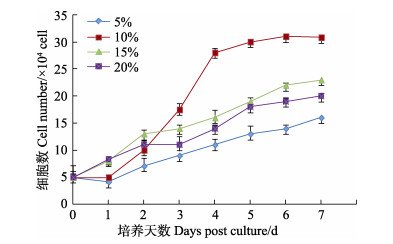
|
图 3 MFB细胞在不同血清浓度下的生长曲线比较 Fig.3 Comparison of the growth of MFB cells cultured with fetal bovine serum of different concentrations |
使用L-15培养基并添加10%胎牛血清,分别在15℃、20℃、28℃、34℃ 4个不同温度条件下培养鳜脑组织细胞的统计计数结果显示:在15℃条件下培养,细胞能正常贴壁,细胞数目最高至8.75×104个/mL,但生长速度缓慢;在28℃条件下培养,细胞生长增殖迅速,MFB细胞到第5天能形成稳定的细胞单层,细胞数目最高至3.0×105个/mL;在20℃和34℃培养条件下,细胞生长至第6天生长数目超过1×105个,随后培养板中出现较多死亡细胞,致密细胞单层开始出现空洞(图 4)。
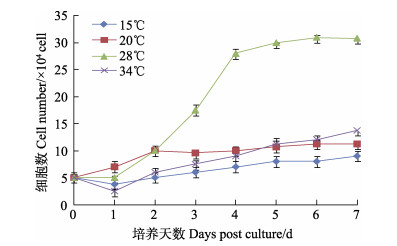
|
图 4 MFB细胞在不同培养温度下的生长曲线比较 Fig.4 Comparison of the growth of MFB cells cultured at different incubation temperature |
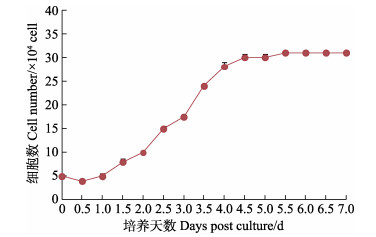
从第30代鳜脑组织细胞的生长曲线(图 5)可以看出,细胞贴壁、生长、增殖前1.5 d为迟缓期,1.5—3.5 d处于对数期,4.5—6.5 d为基本平台期。通过公式计算,第30代脑细胞的群体倍增时间为46.6 h,表明继代培养的鳜脑组织仍表现出旺盛的生长增殖状态。
|
图 5 第30代MFB细胞的生长曲线 Fig.5 Growth curve of MFB cells at the 30th passage |
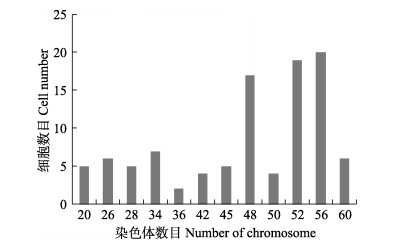
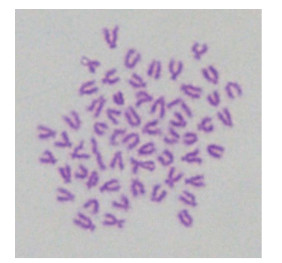
染色体统计计数结果显示,第25代鳜脑组织细胞的染色体数目分布在20~60之间,其中拥有52条染色体的细胞占总细胞数的19%,染色体众数56出现率为20% (图 6),表明第25代MFB细胞的染色体出现了很大的变化,从染色体图片上可以看出,细胞的染色体出现了丢失(图 7)。
|
图 6 第25代MFB细胞染色体分布 Fig.6 Distribution of MFB cell chromosome at 25th passage |
|
图 7 第25代MFB细胞染色体 Fig.7 MFB cell chromosomes at 25th passage chromosome |
以MFB细胞总基因组DNA为模板,设计鳜28S rRNA基因的特异性引物,PCR扩增获得大小为528 bp的部分基因片段,与预期大小相符(图 8)。PCR扩增片段经测序后,于GenBank数据库中进行Blast比对与分析。结果显示,PCR扩增MFB细胞28S rRNA基因528 bp的序列与GenBank中发布的来源于鳜28S rRNA基因(EF120974)的序列同源性为100%,证明此细胞系来源于鳜。

|
图 8 MFB细胞28S rRNA基因PCR扩增产物 Fig.8 PCR amplified products of 28S rRNA gene in MFB cells M:2000 bp分子量标准;1:28S rRNA扩增产物。 M: 2000 bp DNA marker; 1: PCR product of 28S rRNA gene. |
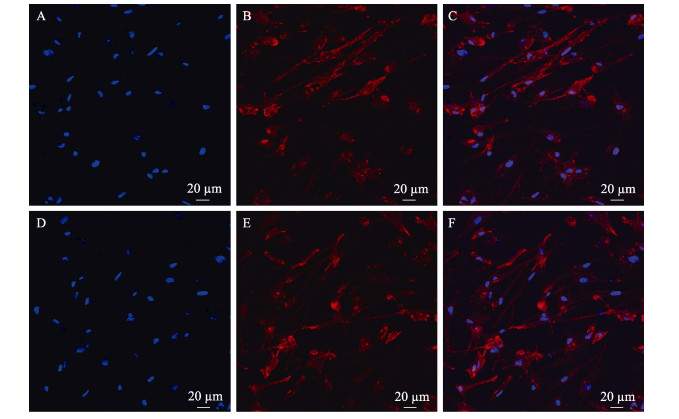
对传代50代后的细胞进行免疫荧光染色鉴定,共聚焦显微镜下观察神经元标志蛋白β-tubulin和神经元特异性蛋白Neu-N表达均为红色,呈阳性。在DAPI染色后,细胞核呈蓝色,整个视野下全部细胞均呈红色阳性表达(图 9),表明建立的MFB细胞为神经元类细胞。
|
图 9 培养5 d的鳜脑神经细胞Neu-N和β-tubulin免疫荧光染色 Fig.9 NeuN and β-tubulin immunofluorescence staining of brain neurons on the 5th day A、D:DAPI;B:Neu-N;C:A与B合并图;E:β-tubulin;F:D与E合并图Neu-N和β-tubulin阳性表达呈红色,DAPI染的细胞核呈蓝色。 A, D: DAPI; B: Neu-N; C: Merged image of A and B; E: β-tubulin; F: Merged image of D and E The positive expression of Neu-N and β-tubulin were red; the nuclei stained by DAPI were blue. |
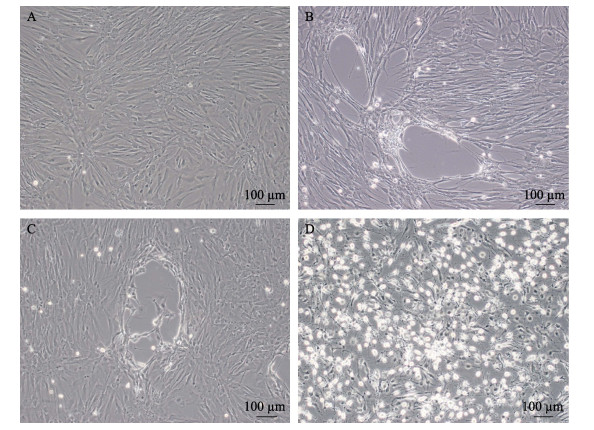
ISKNV、GCRV-I、KHV、CEV和CyHV-2不能在MFB细胞中增殖,病毒接种7 d后均未出现CPE,且盲传培养7次均未出现CPE;MFRaIV、LMBRaIV、GSIV接种MFB细胞,1~2 d后均出现CPE (图 10),病毒滴度依次为108.68±0.12、108.36±0.15、1010.15±1.85 TCID50/mL,对盲传7次后的样品进行PCR检测,结果显示,MFRaIV、LMBRaIV和GSIV均能扩出单一的目的条带,ISKNV、GCRV-I、KHV、CEV和CyHV-2无目的条带。
|
图 10 MFRaIV、LMBRaIV、GSIV细胞毒接种MFB细胞引起的CPE Fig.10 CPE induced by MFB cells inoculated with MFRaIV, LMBRaIV and GSIV cytotoxicity A:正常MFB细胞;B:接GSIV细胞毒24 h的MFB细胞;C:接LMBRaIV细胞毒48 h的MFB细胞;D:接MFRaIV细胞毒48 h的MFB细胞 A: Normal MFB cells; B: CPE of MFB cells 24 hours GSIV post-infection; C: CPE of MFB cells 48 hours LMBRaIV post-infection; D: CPE of MFB cells 48 hours MFRaIV post-infection |
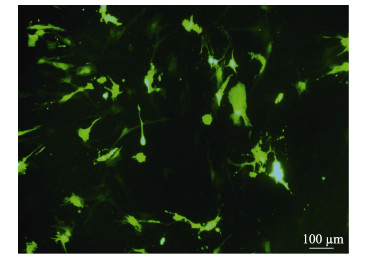
MFB细胞传代50代后,采用脂质体转染pEGFP-N1质粒,转染后48 h在荧光倒置显微镜下观察,可见绿色细胞,以随机5个视野中绿色阳性细胞的数目占总细胞的比例为转染效率,绿色细胞阳性率可达(22.20±1.72)%(图 11)。
|
图 11 荧光显微镜下Lipofectamine®2000转染pEGFP-N1的MFB细胞 Fig.11 Fluorescent field expression of green fluorescent protein (GFP) in mandarin fish MFB cells |
细胞体外培养方法分为组织块移植法、机械分散法和消化分离法,其中消化分离法又分为胰蛋白酶消化法、胶原酶消化法和EDTA消化法(王宣刚等, 2021)。本研究采用含0.25% EDTA的胰蛋白酶和Ⅰ型胶原酶消化法结合机械分离法,消化后获得的细胞量大,且该方式对细胞的损伤也较小(杨银芬等, 2011),可有效地提高细胞生长成稳定单层细胞的速度。此外,该方法相比于组织块移植法,具有快速、操作简单等优点。
培养基种类、血清浓度、培养温度等条件,对细胞的增殖均至关重要,关于细胞培养生长特性的研究主要也集中在这几个方面(代金彩等, 2021)。本研究使用了5种不同培养基、4种不同血清浓度以及4种不同温度进行细胞培养,对不同条件下的细胞生长速度进行比较,发现MFB细胞最佳培养条件为L-15培养基,10%血清浓度,28℃下培养。在最适培养条件下,MFB细胞数目的倍增时间约为46.6 h。与另外一株鳜脑组织细胞(Chinese perch brain cell, CPB)的最佳培养基一致(Fu et al, 2015),但与鳜鱼苗细胞(mandarin fish fry cell, MFF-1)的最适培养基DMEM不同(Dong et al, 2008),这可能与细胞对营养物质的需求和本身生长特性有关,也可能与MFB是神经元类成纤维细胞而MFF是上皮样细胞有关。
染色体核型分析是鉴定细胞系的一个重要指标。染色体分析显示,第25代MFB染色体数分布在20~ 60之间,染色体众数为56,出现频率为20%,与已报道的鳜染色体数2n=48有差异,表明MFB细胞在体外传代过程中,染色体出现畸变、缺失、断裂或重组。一般脊椎动物在传代约50代以后染色体数目才会出现变化(曾令兵等, 2009),而MFB细胞在传代25代后染色体就出现了变化,说明MFB细胞在体外培养的过程中容易受环境的影响,但其机理有待于进一步研究。
Neu-N (neuronal nucleus)是一种神经系统特异性核调节分子,是一种特有的神经元结合蛋白,广泛应用于研究和诊断有丝分裂后的神经元抗原(Lind et al, 2005; Mullen et al, 1992)。β-tubulinⅢ是成熟神经元的标志性骨架蛋白,主要分布在突触和胞浆中(Reynolds et al, 1992; Manochantr et al, 2015)。因此,本研究选取Neu-N和β-tubulinⅢ作为检测指标。对传代50次后的细胞进行免疫荧光染色鉴定,共聚焦显微镜下观察神经元标志蛋白β-tubulin和神经元特异性蛋白Neu-N表达均为红色,并且整个视野下全部细胞均呈红色阳性表达,表明本研究所建立的MFB细胞为神经元细胞。
病毒需要在活细胞内增殖,因此敏感细胞系的建立是开展病毒研究的重要基础(王津津等, 2016)。本研究使用MFB细胞对8种常见水生病毒进行培养,发现MFRaIV、LMBRaIV和GSIV均能产生典型CPE,病毒滴度分别达到108.68±0.12、108.36±0.15、1010.15±1.85 TCID50/mL,说明MFB细胞对MFRaIV、LMBRaIV和GSIV均敏感,且GSIV在MFB细胞中的复制水平高于MFRaIV和LMBRaIV。而MFB细胞对ISKNV、GCRV-I、KHV、CEV和CyHV-2不敏感。国内已经建立的来源于鳜苗的细胞系MFF (Dong et al, 2008)和来源于鳜脑组织的细胞系CPB (Fu et al, 2015)对ISKNV均敏感,滴度分别为106.58~106.62和106.6~107.4 TCID50/mL。本研究建立的MFB细胞接种ISKNV后,不产生CPE,且盲传7代PCR未能检出病毒特异的核酸目的条带,说明本研究的MFB细胞与Fu等建立CPB有一定差异(Fu et al, 2015)。此外,GSIV在MFB细胞中滴度高达1010.15±1.85 TCID50/mL,高于感染鲤鱼上皮瘤细胞的滴度(109.5~10.5 TCID50/mL)(Meng et al, 2014),说明该细胞是一种对GSIV高度敏感的细胞系,具有较高的科研价值和重要的产业应用潜力。将外源基因转染进细胞对于基因的功能研究是非常关键的一步。陈晓武等(2018)研究建立了一种使用体外包装逆转录病毒感染的方法,转染鳜胚胎细胞的效率可达(20±5)%,而另一株鳜脑细胞(CPB)的瞬时转染效率为10% (FU et al, 2015)。本研究使用Lipofectamine®2000将pEGFP-N1转染MFB细胞的效率可达20%以上,表明MFB细胞可作为功能表达研究的工具。
本研究成功建立了鳜脑组织细胞系,并且发现鳜蛙虹彩病毒(MFRaIV)、大口黑鲈蛙虹彩病毒(LMBRaIV)和大鲵虹彩病毒(GSIV)均能在MFB细胞系上产生典型的细胞病变效应(CPE),同时还发现该细胞可用于外源基因的功能研究,不仅丰富了鳜细胞资源,而且为进一步研究鳜病毒感染机理以及疾病防控技术提供了重要的实验材料。
CHEN X W, SHEN Y W, ZHAO J L, et al. Culture and application of Siniperca chuatsi embryo cell line. Journal of Fisheries of China, 2018, 42(10): 1626-1634 [陈晓武, 申亚伟, 赵金良, 等. 鳜胚胎细胞系的建立与应用. 水产学报, 2018, 42(10): 1626-1634] |
DAI J C, NIE Z L, LIU J Y, et al. Preliminary study on the establishment of kidney tissue cell lines in Schizothorax eurystomus. Progress in Fishery Sciences, 2021, 42(6): 61-68 [代金彩, 聂竹兰, 刘洁雅, 等. 宽口裂腹鱼中肾组织细胞系建立的初步研究. 渔业科学进展, 2021, 42(6): 61-68] |
DONG C F, WENG S P, SHI X J, et al. Development of a mandarin fish Siniperca chuatsi fry cell line suitable for the study of infectious spleen and kidney necrosis virus (ISKNV). Virus Research, 2008, 135(2): 273-281 DOI:10.1016/j.virusres.2008.04.004 |
DONG J J, SUN C F, TIAN Y Y, et al. Correlation analysis of the main morphological traits and body weight of mandarin fish (Siniperca chuatsi) and morphological traits between males and females. Progress in Fishery Sciences, 2018, 39(2): 76-84 [董浚键, 孙成飞, 田园园, 等. 翘嘴鳜主要形态性状与体重的相关性及雌雄形态性状差异分析. 渔业科学进展, 2018, 39(2): 76-84] |
FU X Z, LI N Q, PENG Y Y, et al. Cloning and expression of ORF093 gene and the immune effect of its recombinant protein of infectious spleen and kidney necrosis virus in Siniperca chuatsi. Journal of Fishery Sciences of China, 2013, 20(2): 427-433 [付小哲, 李宁求, 彭媛媛, 等. 鳜传染性脾肾坏死病毒ORF093基因的克隆、表达及其重组蛋白的免疫原性分析. 中国水产科学, 2013, 20(2): 427-433] |
FU X Z. Development of a Chinese perch cell line susceptible to ISKNV and mechanism of virus repication relying on glutamine. Doctoral Dissertation of Northwest A & F University, 2017 [付小哲. 鳜传染性脾肾坏死病毒敏感细胞系的建立及病毒增殖依赖于谷氨酰胺的机制研究. 西北农林科技大学博士研究生学位论文, 2017]
|
FU X, LI N, LAI Y, et al. A novel fish cell line derived from the brain of Chinese perch Siniperca chuatsi: Development and characterization. Journal of Fish Biology, 2015, 86(1): 32-45 DOI:10.1111/jfb.12540 |
HE J G, WONG S P, HANG Z J, et al. Identification of outbreak and infectious diseases pathogen of Siniperca chuatsi. Acta Scientiarum Naturalium Universitatis Sunyatseni, 1998, 37(5): 74-77 [何建国, 翁少萍, 黄志坚, 等. 鳜暴发流行病病毒性病原研究. 中山大学学报(自然科学版), 1998, 37(5): 74-77 DOI:10.3321/j.issn:0529-6579.1998.05.018] |
LI L J, LUO Y Z, LIU X Q, et al. Molecular sureillance of Cyprinid herpesvirus 2 in goldfish cultured in China. Journal of Huazhong Agricultural University, 2013, 32(1): 92-96 [李莉娟, 罗杨志, 刘学芹, 等. 金鱼鲤疱疹病毒Ⅱ型的分子诊断. 华中农业大学学报, 2013, 32(1): 92-96 DOI:10.3969/j.issn.1000-2421.2013.01.018] |
LIANG H R, HANG Y C, FU X Z, et al. Development of a duplex PCR for the detection of Siniperca chuatsi ranairidovirus and Siniperca chuatsi rhabdovirus. Chinese Journal of Preventive Veterinary Medicine, 2021, 43(3): 290-295 [梁红茹, 黄瑜聪, 付小哲, 等. 鳜蛙病毒及鳜弹状病毒双重PCR检测方法的建立及应用. 中国预防兽医学报, 2021, 43(3): 290-295] |
LIND D, FRANKEN S, KAPPLER J, et al. Characterization of the neuronal marker NeuN as a multiply phosphorylated antigen with discrete subcellular localization. Journal of Neuroscience Research, 2005, 79(3): 295-302 DOI:10.1002/jnr.20354 |
LU Y, AGUIRRE A A, HAMM C, et al. Establishment, cryopreservation, and growth of 11 cell lines prepared from a juvenile Hawaiian monk seal, Monachus schauinslandi. Methods in Cell Science, 2000, 22: 115-124 DOI:10.1023/A:1009816715383 |
MANOCHANTR S, MARUPANTHORN K, TANTRAWATPAN C, et al. The expression of neurogenic markers after neuronal induction of chorion-derived mesenchymal stromal cells. Neurological Research, 2015, 37(6): 545-552 DOI:10.1179/1743132815Y.0000000019 |
MENG Y, MA J, JIANG N, et al. Pathological and microbiological findings from mortality of the Chinese giant salamander (Andrias davidianus). Archives of Virology, 2014, 159(6): 1403-1412 DOI:10.1007/s00705-013-1962-6 |
MULLEN R J, BUCK C R, SMITH A M. NeuN, a neuronal specific nuclear protein in vertebrates. Development, 1992, 116(1): 201-211 DOI:10.1242/dev.116.1.201 |
REYNOLDS B A, WEISS S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science, 1992, 255(5052): 1707-1710 DOI:10.1126/science.1553558 |
WANG G, LAPATRA S, ZENG L, et al. Establishment, growth, cryopreservation and species of origin identification of three cell lines from white sturgeon, Acipenser transmontanus. Methods in Cell Science, 2004, 25(3/4): 211-220 |
WANG J J, LIU Y, YU L, et al. Characterization of grass carp (Ctenopharyngodon idellus) ovary cell line and its susceptibility to spring viremia of carp virus. Progress in Fishery Sciences, 2016, 37(6): 56-61 [王津津, 刘莹, 于力, 等. 草鱼(Ctenopharyngodon idellus)性腺细胞系(GCO)特性和对鲤春病毒的敏感性. 渔业科学进展, 2016, 37(6): 56-61] |
WANG X G, KONG X F, WANG X T, et al. Isolation, culture, and characterization of macrophages from the head kidney of Japanese flounder (Paralichthys olivaceus). Progress in Fishery Sciences, 2021, 42(5): 55-61 [王宣刚, 孔祥福, 王欣桐, 等. 牙鲆头肾巨噬细胞的分离培养与鉴定. 渔业科学进展, 2021, 42(5): 55-61] |
WU B, FANG C L, ZHANG Y P, et al. The assessment of biological parameters and stock biomass of Siniperca chuatsiin the Poyang Lake. Progress in Fishery Sciences, 2015, 36(4): 21-26 [吴斌, 方春林, 张燕萍, 等. 鄱阳湖翘嘴鳜(Siniperca chuatsi)的生物学参数及资源量的估算. 渔业科学进展, 2015, 36(4): 21-26] |
YANG C T, WANG W M, CAO L. Prevention and treatment of common diseases in mandarin fish culture. Reservoir Fisheries, 2008, 28(3): 104-107 [杨承泰, 王卫民, 曹玲. 鳜鱼养殖中的常见疾病及其防治. 水利渔业, 2008, 28(3): 104-107 DOI:10.3969/j.issn.1003-1278.2008.03.040] |
YANG Y F, KAO G L, GAO A W, et al. The influence of digestive enzymes and fetal bovine serum on culture of bovine mammary epithelial cells. Animal Husbandry and Feed Science, 2011, 32(9/10): 46-48 [杨银芬, 考桂兰, 高爱武, 等. 消化酶及胎牛血清对奶牛乳腺上皮细胞培养的影响. 畜牧与饲料科学, 2011, 32(9/10): 46-48] |
ZENG L B, LI X L, ZHANG L, et al. Establishment and characterization of a cell line derived from kidney of channel catfish, Ictaluris punctatu. Journal of Fishery Sciences of China, 2009, 16(1): 75-81 [曾令兵, 李晓莉, 张林, 等. 斑点叉尾鮰肾脏组织细胞系的建立及其生物学特性. 中国水产科学, 2009, 16(1): 75-81 DOI:10.3321/j.issn:1005-8737.2009.01.011] |
ZHAO J Q, JIA P, LIU W Z, et al. Establishment and characterization of a cell line derived from the kidney of tilapia, Oreochromis niloticus. Journal of Fishery Sciences of China, 2019, 26(2): 382-390 [赵建青, 贾鹏, 刘文枝, 等. 罗非鱼肾脏细胞系的建立及其生物学特性. 中国水产科学, 2019, 26(2): 382-390] |



