随着对虾养殖业的迅猛发展,日益突出的病害问题已成为对虾绿色健康养殖发展的瓶颈问题(孟现尧等, 2020)。目前,对虾病害主要通过应用抗生素达到防治的目标,但抗生素的残留、病原菌抗药性的产生,已经引起国内外学者的广泛关注(Yu et al, 2020)。2019年12月,农业农村部发布194号公告,自2020年1月1日起,我国饲料中全面禁止添加抗生素,全面推行无抗养殖,因此,寻找抗生素的有效替代品迫在眉睫。益生菌作为饲料添加剂受到广泛的关注(敬昭等, 2020; 樊英等, 2021),研究表明,肠道微生物在宿主的消化、免疫和发育等过程中发挥着不可或缺的作用(Rooks, 2016),在饲料中添加益生菌,具有促进凡纳滨对虾(Litopenaeus vannamei)生长、增强免疫、调节肠道菌群的功效和防治病害的作用(练小军等, 2020; 杨运楷等, 2020)。肠道微生物菌群量大、功能丰富,是获得益生菌的重要来源之一,肠道益生菌的筛选已经成为水产养殖研究的热点(邵迎春等, 2018; 崔静等, 2016),但关于铁载体益生菌筛选的研究很少。
铁载体益生菌是一类在缺铁条件下,通过产生更高亲和力的铁载体与致病菌竞争铁元素达到抑菌效果的益生菌。吕艳(2003)从斑节对虾(Penaeus monodon)幼体中分离了一株铁载体高产菌株橙色交替单胞菌(Alteromonas aurantia) PB1,不仅对哈维氏弧菌(Vibrio harveyi)和鳗弧菌(Vibrio anguillarum)有拮抗作用,也能明显抑制中华绒螯蟹(Eriocheir sinensis)的病原菌毛霉亮发菌(Leucothrix mucor) HL-1。李俊峰等(2007)将实验室保存的产铁载体的橙色交替单胞菌A18菌株经过诱变获得了一株高产铁载体的有益菌株J61321,所产铁载体可抑制鱼类病原菌鳗弧菌的生长。本研究从凡纳滨对虾肠道分离鉴定了铁载体高产菌株SDVGH3,分析其对病原菌的拮抗效应,探究在饲料中添加SDVGH3菌株对凡纳滨对虾生理功效的影响,旨在为对虾肠道益生菌筛选与病害防治提供科学依据。
1 材料与方法 1.1 实验材料于山东省东营市东营区渔业示范区养殖池塘选取凡纳滨对虾,从其肠道中筛选铁载体高产菌株。益菌饲料添加实验的凡纳滨对虾购自山东省日照市海贝尔对虾养殖场,在实验室暂养7 d,日投饵3次,日投喂量为对虾体重的5%,日换水量为1/3,连续充气,暂养条件:温度为23~25℃,盐度为29,pH为7.8~8.2,含氧量为5.6~6.2 mg/L。
1.2 凡纳滨对虾肠道铁载体高产菌株的筛选与鉴定 1.2.1 凡纳滨对虾肠道铁载体高产菌株的筛选在无菌条件下,将肠道放入无菌均质器中,在冰浴中研磨获得均一的菌悬液,用无菌生理盐水梯度稀释,浓度为10–6~10–1,然后进行涂布。待菌落出现,挑取不同的菌落采取Z字划线法进行纯化、保种。采用CAS (Chrome Azurol S) Agar平板方法对铁载体高产菌株的进行初筛,该方法只能粗略地表明待测菌株能否产生铁载体,铁载体产量需要通过CAS检测液定量法来检测,铁载体产量的测定参照Yoshida等(2002)的方法,并参考田方等(2008)的方法检测铁载体类型:分别通过Csáky、Arnow和Shenker方法检测异羟肟酸型、儿茶酚型、羧酸盐型铁载体。
1.2.2 铁载体高产菌株SDVGH3的鉴定将SDVGH3菌悬液KMB固体培养基上划线,静置28℃培养,待长出单菌落后,用肉眼观察菌落大小、形状、颜色和透明度等特征。根据《伯杰氏细菌鉴定手册》和《常见细菌系统鉴定手册》进行生理生化检测。参考闫法军(2010)水煮法提取细菌基因组DNA,PCR扩增16S rDNA部分片段。扩增16S rDNA序列所使用的引物为细菌通用引物:27F:5′-AGAGTTTGATC CTGGCTCAG-3′和1492R:5′-TACGGCTACCTTGTT ACGACTT-3′。PCR扩增产物送交生工生物(上海)股份有限公司测序。将测序结果在NCBI网站进行BLAST比对分析,选取同源性最高的序列进行多重序列比较,使用MEGA7软件构建系统发育树。
1.2.3 铁载体高产菌株SDVGH3的安全性评估将过夜培养的待测菌株接种于血平板上,于28℃恒温培养24 h后观察菌株的溶血能力,若菌落周围出现溶血圈,则表明该细菌具有溶血能力。采用纸片琼脂扩散法测定菌株的药敏性,取0.1 mL待测菌悬液均匀涂布于MHA琼脂培养基,将抗生素药敏纸片贴于培养基表面,于28℃恒温培养箱中培养,测定药敏圈的直径。
1.3 铁载体高产菌株SDVGH3的抑菌活性采用大孔径树脂吸附法提取铁载体粗品。首先,将乙酸和乙醇处理过的XAD-2大孔径树脂加入制备好的铁载体上清液中,在20℃、120 r/min条件下震荡过夜,然后,用体积比为1︰1的甲醇以每秒1滴的流速洗脱,将上述的洗脱液在50℃、50 r/min条件下旋转蒸发除去甲醇和水,加5 mL超纯水于球形烧瓶中溶解铁载体,用0.22 μm的膜过滤以除去细菌,于4℃保存。采用滤纸片扩散法测定铁载体高产菌株的抑制病原菌的活性:将100 μL病原菌[副溶血弧菌、金黄色葡萄球菌(Staphylococcus aureus)、溶藻弧菌(Vibrio alginolyticus)、大肠杆菌(Escherichia coli)、鳗弧菌(Vibrio anguillarum)和哈维氏弧菌(Vibrio harveyi)]溶液均匀涂布在2216E板上,将空白无菌滤纸片浸泡于铁载体水溶液中4℃过夜,使其充分吸收铁载体,将该滤纸片置于涂有病原菌的固体培养基上,28℃静置培养24~48 h,观察是否产生抑菌圈。
1.4 铁载体高产菌株SDVGH3培养条件的优化经预实验可知,铁载体高产菌株SDVGH3在48 h达到对数稳定期。实验优化的培养条件为温度、pH、盐度、通气量和Fe3+浓度,每个处理组3个重复,实验前,将各菌株在28℃、160 r/min条件下活化24 h,以1%的比例分别接种到KMB液体培养基中。除去实验设定的因子外,其他的实验条件:温度为28℃,pH为7.5,盐度为0,转速为160 r/min。各因子设置梯度:温度为24℃、28℃、32℃和36℃,pH为4.5、6.0、7.5和9.0,盐度为0、10、20和30;在50 mL三角瓶中的装液量为10、20、30和40 mL的液体培养基。培养基中的Fe3+由FeCl3溶液提供,用0.01 mol/L HCl溶液配制16.7 mmol/L的FeCl3储备液,使用时用0.01 nmol/L HCl稀释成不同浓度FeCl3溶液,Fe3+浓度设置为0.01、0.1、1、10 mmol/L。在特定培养条件下震荡培养72 h,每隔12 h取1次培养液,采用CAS法定量检测铁载体的产量,以铁载体产量为纵坐标,菌株培养时间为横坐标绘制铁载体产量曲线,从而获得铁载体产量最高的培养条件。
1.5 饲料中添加铁载体高产菌株的实验设置凡纳滨对虾在实验室暂养7 d后,挑取肢体完整、活力强的对虾[(2.0±0.1) g]。基础饲料为商业对虾饲料(宁波天邦有限公司),饲料配方见表 1。将基础饲料作为对照组,基础饲料中以料液比5︰0.001和5︰1 (W/g︰V/mL)添加SDVGH3菌液作为实验组Fe1、Fe2,Fe1、Fe2组的最终添加浓度分别为1×107、1×1010 CFU/g,在室温下浸润10 h。养殖周期为42 d,养殖条件与暂养条件一致,取样时间为0、21和42 d。
|
|
表 1 实验饲料配方 Tab.1 Experimental feed formula |
42 d养殖实验结束后进行攻毒实验,所用副溶血弧菌(Vibrio parahaemolyticus)由中国海洋大学水产动物环境生理实验室提供。首先,通过预实验确定副溶血弧菌对凡纳滨对虾的半致死浓度为1×108 CFU/mL,用对虾生理盐水将副溶血弧菌稀释至半致死浓度,实验组用无菌注射器于每尾虾第3与第4腹节连接处注射40 μL的副溶血弧菌悬液,空白对照组每尾虾注射40 μL对虾生理盐水,攻毒后各组分别继续投喂相应的饲料,注射结束后,连续观察7 d,记录对虾死亡数量。
1.6 样品制备血淋巴的取样根据Chand等(2006)的方法进行。采用注射器预先吸取1 mL抗凝剂,按1︰1的比例从对虾腹血窦抽取血淋巴。一部分血淋巴样品用于血细胞计数和吞噬率的测定,剩余部分样品800×g离心,上清液于–80℃保存,用于血浆酚氧化酶活性和抗菌活性的测定。将抽完血的对虾解剖获得其肝胰腺和肠道,分别放入已灭菌的研钵中,加入液氮,将其研磨至粉末状后,称量、分装到冻存管中。移入电动匀浆器内,加入1 mL超纯水匀浆多次直到形成均一的溶液,在4℃、10 000 r/min条件下离心30 min,取上清液,保存于–80℃冰箱。
1.7 实验指标的测定 1.7.1 生长指标的测定测量各组对虾的初始体重和实验结束时的体重,计算各组对虾的特定生长率(SGR)和体重增长率(WGR);统计各实验组凡纳滨对虾的饲料投喂量,计算饲料转化率(FCR)。对虾SGR、FCR和WGR计算公式如下:
| $ {\rm{SGR}} = \left[ {\left( {\ln {W_{\rm{f}}} - \ln {W_{\rm{i}}}} \right)/T} \right] \times 100\% $ |
| $ {\rm{FCR}} = {W_{\rm{t}}}/\left( {{W_{\rm{f}}} - {W_{\rm{i}}}} \right) $ |
| $ {\mathop{\rm WGR}\nolimits} (\% ) = 100 \times \left( {{W_{\rm{f}}} - {W_{\rm{i}}}} \right)/{W_{\rm{i}}} $ |
式中,Wf、Wi分别表示平均终体质量(g)、平均初体质量(g);T表示饲养时间(d);Wt表示实验期间投入饲料量(g)。
1.7.2 对虾体成分的测定对虾体成分分析参照HELRICH等(1990)的方法。水分测定采用烘干(105℃)失重法;粗蛋白含量测定采用半微量凯氏定氮法(N×6.25);粗脂肪含量测定采用索氏抽提法;粗灰分含量测定采用马福炉灰化法(550℃, 12 h)。
1.7.3 消化酶活性的测定参考Zhang等(2021)测定消化酶的方法,测定凡纳滨对虾肠道和肝胰腺蛋白酶、淀粉酶和脂肪酶活性,采用福林酚法测定蛋白酶活性,3, 5-二硝基水杨酸法测定淀粉酶活性,脂肪酶活性的测定基于脂肪酸与铜离子反应的蓝铬络合物的含量,蛋白含量测定采用考马斯亮蓝法。酶的活性以比活力表示,即活性单位每毫克蛋白。
1.7.4 免疫指标的测定血细胞数量的测定采用血球板计数,吞噬率的测定参照Feng等(2010)的方法,抗菌活性采用Hultmark等(1980)的方法,用分光光度法测定血浆中的酚氧化酶(PO)活性。
1.7.5 肠道微生物多样性的测定对所有样本进行肠道菌群DNA提取和检测。然后,将所有样本送至上海美吉生物医药科技有限公司进行分析。使用引物338F (5'-ACTCCTACGGGAGGCAGCAG-3')和806R (5'-GGACTACHVGGGTWTCTAAT-3'),对细菌16S rRNA基因的V4~V5区域进行扩增和测序。测序文库由TruSeq®DNA PCR-Free样品制备生成工具包(美国Illumina公司)。文库质量在Qubit®2.0上进行评估,荧光计(Thermo Scientific)和安捷伦生物分析仪2100系统,并通过实时荧光定量PCR (Quantitative Real-time PCR, q-PCR)进行定量。最后,对文库进行测序。
1.8 数据处理所有实验数据采用SPSS 22.0软件进行分析。实验结果以3个平行组的数据的平均值±标准差(Mean±SD)表示,并采用单因素方差分析(one-way ANOVA)和Duncan检验法进行统计分析,P < 0.05代表差异显著。
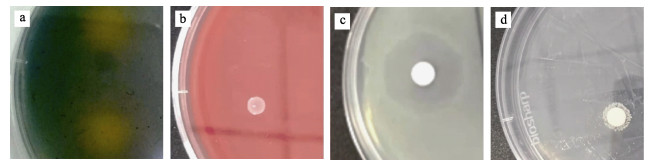
2 结果 2.1 铁载体高产菌株的筛选与鉴定从凡纳滨对虾的肠道分离出的106株菌中筛选出24株产生铁载体晕圈的菌株(图 1a),其中,菌株SDVGH3的铁载体产量最高,高达74.87%,属于异羟肟酸型。SDVGH3的菌落特征为乳黄色、突出、圆形、潮湿、光滑,直杆状细胞,革兰氏阴性和兼性厌氧菌。对菌株SDVGH3的扩增序列在NCBI数据库中进行BLAST比对,结果显示,与泛菌属(Pantoea sp.) 菌株F6-PCAj-T3P21 (GenBank: JN853256.1)的相似度为98.19%。并将菌株SDVGH3的16S rRNA部分基因序列存入GenBank (登录号MZ322505)。在GenBank中挑选与分离菌株相似的8株菌的16S rRNA基因序列,通过MEGA 7.1软件构建系统发育树(图 2)。菌株SDVGH3的生理生化特性见表 2,SDVGH3过氧化氢酶和葡萄糖氧化发酵实验呈阳性,但氧化酶、吲哚、甲基红和脲酶实验呈阴性。结合生理生化和16S rRNA分析结果,初步鉴定SDVGH3为泛菌属。血平板上的菌落周围无透明圈(图 1b),表明该菌株无溶血性,具有应用于水产养殖中的潜力。菌株SDVGH3对恩诺沙星、多西环素、磺胺异恶唑和磷霉素4种抗生素具有耐药性,对6种抗生素敏感,对其他12种抗生素高度敏感(图 1c)。
|
图 1 菌株SDVGH3特性 Fig.1 Characteristics of strain SDVGH3 a:铁载体晕圈;b:溶血实验;c:药敏试验;d:抑菌效果 a: Siderophore halo pattern; b: Hemolysis test; c: Drug sensitivity test; d: Pathogen inhibition |

|
图 2 菌株SDVGH3基于16S rRNA基因的系统发育树 Fig.2 Phylogenetic tree of strain SDVGH3 based on 16S rRNA gene |
|
|
表 2 菌株SDVGH3的生理生化特性 Tab.2 Physiological and biochemical characteristics of the SDVGH3 strains |
菌株SDVGH3的抑菌效果见图 1d。该铁载体对大肠杆菌无抑制作用,对5种病原菌的抑制程度由强到弱依次为:副溶血弧菌 > 哈维氏弧菌 > 鳗弧菌 > 金黄色葡萄球菌 > 溶藻弧菌。
2.3 铁载体高产菌株SDVGH3培养条件的优化不同的培养条件对菌株SDVGH3铁载体产量的影响见图 3。由图 3可知,铁载体高产菌株SDVGH3培养60 h的铁载体产量达到最高。其最适培养条件:温度为28℃,pH为7.5,盐度为0,装液量为10 mL,Fe3+浓度为0.01 mmol/L。

|
图 3 不同培养条件对菌株SDVGH3铁载体产量的影响 Fig.3 Effects of different culture conditions on siderophore yield of strain SDVGH3 |
由表 3可知,Fe2组凡纳滨对虾的WGR为308.37%,显著高于对照组和Fe1组(P < 0.05),WGR较对照组提高33.52%;Fe1组凡纳滨对虾的WGR为269.70%,WGR提高16.78%,显著高于对照组(P < 0.05)。Fe1组和Fe2组凡纳滨对虾的饲料系数分别为1.26和1.20,显著低于对照组(P < 0.05),但Fe1与Fe2组的饲料系数无显著差异(P > 0.05)。Fe2组的粗蛋白含量为19.36%,显著高于对照组和Fe1组(P < 0.05),相较于对照组提高11.55%;各组凡纳滨对虾之间的水分、粗脂肪和粗灰分产量的差异不显著(P > 0.05)。
|
|
表 3 铁载体高产菌株SDVGH3对凡纳滨对虾生长性能和体成分的影响(平均值±标准差, n=3) Tab.3 Effects of high-yielding siderophore strains on growth performance and body composition of L. vannamei (Mean±SD, n=3) |
添加铁载体高产菌株的饲料对凡纳滨对虾肝胰腺和肠道消化酶活性的影响如图 4所示,Fe2组的肝胰腺蛋白酶显著高于Fe1组和对照组;各组的脂肪酶和淀粉酶活性无显著差异(P > 0.05)。在养殖前期,Fe2组肠道中的蛋白酶活性显著升高(P < 0.05);在养殖后期,肠道中Fe2组的蛋白酶和脂肪酶活性均显著高于对照组(P < 0.05)。

|
图 4 铁载体高产菌株SDVGH3对凡纳滨对虾消化酶活性和免疫防御指标的影响 Fig.4 Effects of high-yielding siderophore strain SDVGH3 on digestive enzyme activities and immune defense indexes of L. vannamei 热图中纵坐标数字表示所测定指标含量高低;横坐标:21 d和42 d表示对虾养殖了21 d和42 d;Fe0:对照组;Fe1:饲料中添加1×107 CFU/g的铁载体高产菌株SDVGH3;Fe2:饲料中添加1×1010 CFU/g的铁载体高产菌株SDVGH3。 The ordinate number in the heat map indicates the content of the measured experimental index; Abscissa: 21 d and 42 d represent 21 and 42 days of shrimp culture; Fe0: Control group; Fe1: High-yielding siderophore strain SDVGH3 added with 1×107 CFU/g in feed; Fe2: High-yielding siderophore strain SDVGH3 added with 1×1010 CFU/g in feed. |
添加不同浓度的铁载体高产菌株的饲料对凡纳滨对虾的血细胞数量、吞噬率、PO活性和抗菌活性的影响见图 4。在养殖21 d时,Fe2组的吞噬率、PO活性均显著高于对照组和Fe1组(P < 0.05);实验组的抗菌活性较对照组均有显著升高(P < 0.05)。在养殖42 d时,实验组的对虾均具有较高的吞噬率和抗菌活性(P < 0.05),且在Fe2组中最高。实验组的PO活性在21 d达到峰值,然后呈下降趋势,但仍高于对照组。
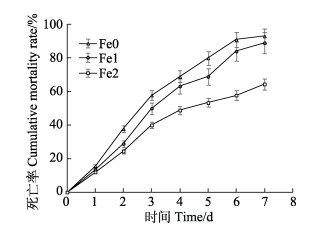
2.5.3 饲料中添加铁载体高产菌株SDVGH3对攻毒后凡纳滨对虾累积死亡率的影响攻毒后凡纳滨对虾累积死亡率如图 5所示。攻毒7 d后对照组的死亡率为93.55%,Fe1组和Fe2组的死亡率分别为82.24%和61.40%,实验组的死亡率显著低于对照组(P < 0.05)。研究结果表明,饲料中添加铁载体高产菌株SDVGH3可显著降低凡纳滨对虾感染副溶血弧菌后的死亡率。
|
图 5 铁载体高产菌株SDVGH3对凡纳滨对虾攻毒实验累积死亡率的影响 Fig.5 Effects of high-yielding siderophore strain SDVGH3 on L. vannamei cumulative mortality in challenge assay |
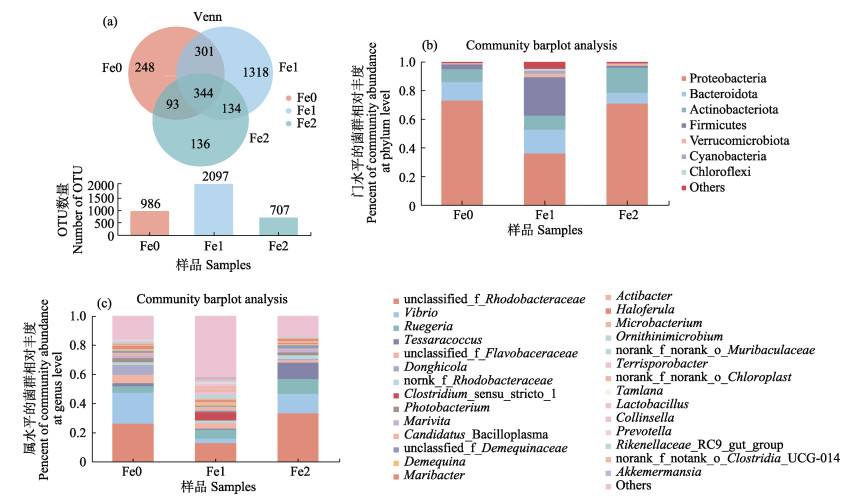
对虾肠道样品中细菌多样性指数见表 4。Coverage指数表示样品的测序深度,3个处理组中的Coverage指数均在0.986~0.993之间,表明样品中被检测到的序列覆盖度高。Chao1和Ace指数是评估菌群丰富度的常用指标,Fe2组的Chao1和Ace指数显著升高(P < 0.05),Fe1组的Ace指数显著低于对照组(P < 0.05)。Shannon和Simpson指数是评估菌群多样性的指标,Simpson指数与Shannon指数呈负相关关系。Fe2组的Shannon指数显著高于对照组(P < 0.05),而Fe1组的Shannon指数高于对照组,但无显著差异。Shannon指数中,3个组由高到低的排序是:Fe1 > Fe2 > 对照组;Simpson指数中由高到低的排序是:对照组 > Fe2 > Fe1。根据97%的相似性将高质量的序列聚为3790个OTU,图 6a显示,对照组中肠道菌群与实验组中共有344个OTU,仅仅占对照组中34.89%,而在Fe1组和Fe2组分别占16.40%和48.65%。
|
|
表 4 基于16S rDNA序列的凡纳滨对虾肠道细菌α-多样性指数(平均值±标准差, n=3) Tab.4 Bacterial α-diversity index of L. vannamei based on 16S rDNA sequence (Mean±SD, n=3) |
|
图 6 铁载体高产菌株SDVGH3对凡纳滨对虾肠道微生物多样性的影响 Fig.6 Effects of high-yielding siderophore strain SDVGH3 on intestinal microbial diversity of L. vannamei a:肠道菌群Ven图;b:肠道“门”水平菌群相对丰度;c:肠道“属”水平菌群相对丰度 a: Venn plot of intestinal flora; b: Relative abundance of horizontal flora of intestinal phylum; c: Relative abundance of horizontal flora of intestinal genus |
凡纳滨对虾肠道的菌群组成在门(Phylum)的水平上(图 6b),以变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)等4个门为主,Fe1组的变形菌门显著低于对照组和Fe2组(P < 0.05);Fe1组的放线菌门显著低于对照组和Fe2组(P < 0.05),Fe1组的厚壁菌门显著高于对照组和Fe2组(P < 0.05),且Fe1组的厚壁菌门显著高于拟杆菌门(P < 0.05)。Fe1组的弧菌属显著低于对照组和Fe2组(P < 0.05),Fe1组的梭菌属(Clostridium prazmowski)显著高于对照组(P < 0.05)(图 6c)。
3 讨论 3.1 凡纳滨对虾肠道中铁载体高产菌株的筛选与鉴定赵翔等(2006)从东湖中筛选得到了一株铁载体高产菌株sp-f,经鉴定为荧光假单胞菌(Pseudomonas fluorescens),其铁载体产量为90%,所产铁载体为儿茶酚铁载体。门晋名(2013)从海鱼的肠道和鳃中共分离纯化出326株细菌,通过固体和液体方法共筛选出52株铁载体高产菌株,铁载体产量均在50%以上。本研究从凡纳滨对虾肠道分离出106株菌,筛选出24株产铁载体的菌株,6株铁载体产量在50%以上,其中,菌株SDVGH3的铁载体产量最高达74.87%,属于异羟肟酸型,经鉴定为泛菌属菌株,且溶血实验和药敏试验显示,该菌株安全性较高。由此说明,铁载体高产菌株广泛存在于水产养殖环境和养殖动物鳃、肠道中。研究表明,铁载体高产菌株作为水产动物一类益生菌,具有应用到水产养殖生产中的可行性。
3.2 铁载体高产菌株SDVGH3的抑菌活性李红芳等(2016)从鱼类肠道筛选的一株铁载体高产菌株CB-EH-2可显著抑制4种致病菌的生长,抑制强度由强到弱依次为金黄色葡萄球菌 > 大肠杆菌 > 鳗弧菌 > 灿烂弧菌(Vibrio splendidus)。Gram等(1999)研究表明,荧光假单胞菌所产铁载体可抑制鳗弧菌的生长。本研究筛选的铁载体高产菌株SDVGH3,对5种病原菌的抑制强度由强到弱依次为:副溶血弧菌 > 哈维氏弧菌 > 鳗弧菌 > 金黄色葡萄球菌 > 溶藻弧菌。这说明不同的铁载体高产菌株抑制病原菌种类和抑制程度均有差异,可能与铁载体菌株生活的宿主肠道环境有关,同时,鳗弧菌是铁载体高产菌株共同的抑制病原菌,推测铁载体高产菌株对一部分致病菌具有广谱的敏感性,仍需进一步研究证实。
3.3 铁载体高产菌株SDVGH3培养条件的优化蒙渊(2011)研究筛选的铁载体高产菌株WMQ-7铁载体产量最高时的pH为7.5,温度为30℃,且通气量越大,铁载体分泌量越高。胡碧惠等(2014)研究发现,沼泽红假单胞菌(Rhodopseudomonas palustris) CQV97在未添加FeCl3时,铁载体产量最高,当Fe3+浓度高于5 μmol/L时,检测不到铁载体,且该菌株在培养108 h时,铁载体产量达到最大。本研究表明,铁载体高产菌株SDVGH3铁载体产量最高培养条件:温度为28℃,pH为7.5,而且铁载体含量也随着培养基体积的降低而升高。在0~36 h范围内,Fe3+浓度为0.01 mmol/L时,菌株铁载体含量最高,Fe3+浓度为10 mmol/L时,菌株铁载体含量最低;且菌株铁载体产量在60 h达到峰值。说明菌株SDVGH3产铁载体是一个耗氧过程,这与上述研究结果相似,同时,菌株铁载体产量随Fe3+浓度升高而降低趋势符合微生物对Fe3+吸收的规律,但不同的菌株受Fe3+浓度影响的程度不同,且铁载体的产量受菌株培养时间的影响较大。
3.4 饲料中添加铁载体高产菌株SDVGH3对凡纳滨对虾生长性能的影响Far等(2012)的研究显示,商业饲料中补充了枯草芽孢杆菌时,凡纳滨对虾呈现出更高的消化酶活性水平;孟阳(2017)研究也表明,使用地衣芽孢杆菌(Bacillus licheniformis)、产朊假丝酵母(Candida utilis)、植物乳杆菌(Lactobacillus plantarum)对基础饲料进行发酵能不同程度地提高凡纳滨对虾胃、肝胰腺和肠道中的4种消化酶的活性。本研究中,Fe2组凡纳滨对虾WGR、粗蛋白含量和肠道蛋白酶活性、脂肪酶活性明显升高,说明饲料中添加铁载体高产菌株SDVGH3能显著促进凡纳滨对虾的生长,这与上述研究结果一致。推测铁载体高产菌株SDVGH3可能诱导了对虾肝胰腺和肠道消化酶的分泌,提高了饲料消化利用效率,生长性能增强显著,其具体机制尚需深入研究。
3.5 饲料中添加铁载体高产菌株SDVGH3对凡纳滨对虾生理健康的影响Gullian等(2004)从凡纳滨对虾肠道中分离出3种益生菌弧菌P62、P63和芽孢杆菌P64,能显著提高血浆酚氧化酶活性;Rengpipat等(2000)使用芽孢杆菌S11菌株喂养斑节对虾,血细胞数量和血浆酚氧化酶和抗菌活性明显提高;血细胞不仅参与凝血,而且还通过酚氧化酶原(proPO)系统参与黑色素的产生,起到重要的防御作用(Bachère, 2004)。本研究表明,铁载体高产菌株SDVGH3益生菌对凡纳滨对虾血细胞数量、吞噬率和血浆酚氧化酶、抗菌活性均有不同程度的提高,这与上述研究结果吻合,说明铁载体高产菌株可明显提高凡纳滨对虾免疫防御能力。
3.6 饲料中添加铁载体高产菌株SDVGH3对凡纳滨对虾肠道微生物的影响王咏梅等(2020)研究发现,凡纳滨对虾肠道的菌群在门水平上的优势菌群为变形菌门、放线菌门、厚壁菌门等;Zhang等(2021)研究显示,饲喂低、中浓度发酵饲料组凡纳滨对虾肠道厚壁菌门丰度均有不同程度的升高;杜静芳(2016)将筛自鱼肠道的乳酸菌添加到凡纳滨对虾饲料中,能显著地降低对虾肠道中的副溶血弧菌数量。本研究表明,凡纳滨对虾肠道菌群组成在门水平上主要为变形菌门、拟杆菌门、放线菌门和厚壁菌门,Fe1组的菌群多样性显著高于对照组,变形菌门和弧菌属显著下降。表明添加低浓度的铁载体高产菌株可提高肠道菌群的多样性,但随着添加益生菌的浓度升高,肠道菌群多样性提高的程度可能降低。研究表明,饲料中添加铁载体高产菌株SDVGH3能改善肠道菌群组成,抑制病原菌的数量。
4 结论本研究从凡纳滨对虾肠道分离获得了一株铁载体高产菌株SDVGH3,其产量高达74.87%,经鉴定属于泛菌属(Pantoea sp.),该菌株无溶血性,且对大部分抗生素敏感,其产铁载体的最佳培养条件:温度为28℃,pH为7.5,盐度为0,装液量为10 mL,Fe3+浓度为0.01 mmol/L;饲料中添加SDVGH3,能显著促进凡纳滨对虾的生长性能、免疫防御能力,提高凡纳滨对虾的肠道菌群多样性,降低弧菌属在肠道菌群中的比例。因此,铁载体高产菌株SDVGH3具有应用于水产养殖的潜力。
BACHÈRE E, GUEGUEN Y, GONZALEZ M, et al. Insights into the anti-microbial defense of marine invertebrates: The penaeid shrimps and the oyster Crassostrea gigas. Immunological Reviews, 2004, 198(1): 149-168 DOI:10.1111/j.0105-2896.2004.00115.x |
CHAND R K, SAHOO P K, KUMARI J, et al. Dietary administration of bovine lactoferrin influences the immune ability of the giant freshwater prawn Macrobrachium rosenbergii (de Man) and its resistance against Aeromonas hydrophila infection and nitrite stress. Fish and Shellfish Immunology, 2006, 21(2): 119-129 DOI:10.1016/j.fsi.2005.10.010 |
CUI J, LI C, SUN X M, et al. The antioxidant effects of extracellular polysaccharide of yeasts from sea cucumber intestine. Journal of Dalian Polytechnic University, 2016, 35(2): 84-87 [崔静, 李成, 孙晓萌, 等. 海参肠道酵母菌产胞外多糖的抗氧化性. 大连工业大学学报, 2016, 35(2): 84-87 DOI:10.19670/j.cnki.dlgydxxb.2016.02.002] |
DU J F. Screening of lactic acid bacteria with antagonistic Vibrio parahaemolyticus and its application in white shrimp Litopenaeus vannamei. Master´s Thesis of Bohai University, 2016 [杜静芳. 拮抗副溶血弧菌乳酸菌的筛选及在南美白对虾中的应用. 渤海大学硕士研究生学位论文, 2016]
|
FAN Y, WANG X L, YU X Q, et al. Effect of Bacillus licheniformis on growth, intestinal digestive enzyme activity, non-specific immunity, and resistance against Aeromonas salraonicida in the fat greenling, Hexagrammos otakii. Progress in Fisheries Science, 2021, 42(1): 63-73 [樊英, 王晓璐, 于晓清, 等. 地衣芽孢杆菌对大泷六线鱼生长, 肠道消化酶, 血清非特异性免疫及抗病力的影响. 渔业科学进展, 2021, 42(1): 63-73] |
FAR H Z, SAAD C R B, DAUD H M, et al. Isolation and identification of bacteria micro flora of white shrimp, Litopenaeus vannamei, with antagonistic properties against Vibrio species. Asian Journal of Animal and Veterinary Advances, 2012, 8(2): 293-300 |
FENG Y, PAN L Q, XIE P, et al. Immune responses and expression of immune-related genes in swimming crab Portunus trituberculatus exposed to elevated ambient ammonia-N stress. Comparative Biochemistry and Physiology Part A: Molecular and Integrative Physiology, 2010, 157(3): 246-251 DOI:10.1016/j.cbpa.2010.07.013 |
GRAM L, MELCHIORSEN J, SPANGGAARD B, et al. Inhibition of Vibrio anguillarum by Pseudomonas fluorescent AH2, a possible probiotic treatment of fish. Applied and Environmental Microbiology, 1999, 65(3): 969-973 DOI:10.1128/AEM.65.3.969-973.1999 |
GULLIAN M, THOMPSON F, RODRIGUEZ J. Selection of probiotic bacteria and study of their immunostimulatory effect in Penaeus vannamei. Aquaculture, 2004, 233(1/2/3/4): 1-14 |
HELRICH K, HELRICH K. Official methods of analysis of the AOAC. 1990
|
HU B H, ZHAO C G, YANG S P. Influence of iron on siderophore and photosynthetic pigments biosynthesis by siderophore-producing Rhodopesudomonnas palustris. Acta Microbiologica Sinica, 2014, 54(4): 408-416 [胡碧惠, 赵春贵, 杨素萍. 铁对产铁载体的沼泽红假单胞菌光合色素与铁载体合成的影响. 微生物学报, 2014, 54(4): 408-416] |
HU Y, TAN B P, MAI K S, et al. Effects of dietary probiotic on growth, immunity and intestinal bacteria of juvenile Litopenaeus vannamei. Journal of Fisheries Sciences of China, 2008, 15(2): 244-251 [胡毅, 谭北平, 麦康森, 等. 饲料中益生菌对凡纳滨对虾生长、肠道菌群及部分免疫指标的影响. 中国水产科学, 2008, 15(2): 244-251] |
HULTMARK D, STEINER H, RASMUSON T, et al. Insect immunity-purification and properties of three inducible bactericidal proteins from hemolymph of immunized pupae of Hyalophora cecropia. European Journal of Biochemistry, 1980, 106(1): 7-16 DOI:10.1111/j.1432-1033.1980.tb05991.x |
JING Z, CHEN H Q, XIAN J A, et al. Application of Chinese herbal medicine additive in the culture of Litopenaeus vannamei. Feed Research, 2020, 43(6): 135-137 [敬昭, 陈惠琴, 冼健安, 等. 中草药添加剂在凡纳滨对虾养殖中的应用. 饲料研究, 2020, 43(6): 135-137] |
LI H F, ZHAI Q Q, MEN J M, et al. Screening and identification of high sidero-carrier high-producing bacteria CB-EH-2 from intestinal tracts of marine fish. Journal of Microbiology, 2016, 36(3): 32-38 [李红芳, 翟秋倩, 门晋名, 等. 鱼类肠道铁载体高产菌株CB-EH-2的筛选与鉴定. 微生物学杂志, 2016, 36(3): 32-38 DOI:10.3969/j.issn.1005-7021.2016.03.006] |
LI J F, LI H F, YAO S M, et al. Research on optimum fermentation conditions of siderophore by strain J61321. Journal of Qingdao University of Science and Technology (Natural Science), 2007, 28(1): 20-24 [李俊峰, 李红芳, 姚淑敏, 等. J61321 (Alteromonas aurantia)菌株产铁载体培养条件的研究. 青岛科技大学学报(自然科学版), 2007, 28(1): 20-24] |
LIAN X J, ZHU K L, ZHANG Q Q, et al. Effects of probiotics- supplemented diets on the growth and survival of Litopenaeus vannamei carrying multiple pathogens. Progress in Fishery Sciences, 2020, 41(2): 121-130 [练小军, 朱开玲, 张庆起, 等. 饲料添加益生菌对多病原阳性的凡纳滨对虾生长与存活的影响. 渔业科学进展, 2020, 41(2): 121-130] |
LÜ Y. Antagonism and inhibitory activities of marine probiotic strain PB1. Master´s Thesis of Ocean University of China, 2003 [吕艳. 橙色交替单胞菌PB1对海洋细菌的拮抗作用及其胞外产物抑菌活性的研究. 中国海洋大学硕士研究生学位论文, 2003]
|
MEN J M. The selection of high-yield siderophpres producing strain and separation and purification of the siderophpres. Master´s Thesis of Qingdao University of Science and Technology, 2013 [门晋名. 铁载体高产菌的筛选及铁载体的分离纯化. 青岛科技大学硕士研究生学位论文, 2013]
|
MENG X Y, ZHU X Z, JIA C C, et al. Effects of Jerusalem artichoke powder and Bacillus licheniformis on growth performance, immunity and intestinal microorganism of Litopenaeus vannamei. China Feed, 2020(15): 77-83 [孟现尧, 朱晓振, 贾晨晨, 等. 菊芋全粉与地衣芽孢杆菌对凡纳滨对虾生长性能、免疫能力及肠道菌群变化的影响. 中国饲料, 2020(15): 77-83] |
MENG Y. Research on screening of the hydrogen-oxidizing bacteria secreting the siderophore and the ACC deaminase and its growth-promoting mechanism. Master´s Thesis of Northwest University, 2011 [蒙渊. 产铁载体和ACC脱氨酶的氢氧化细菌筛选及促生作用研究. 西北大学硕士研究生学位论文, 2011]
|
MENG Y. Study on effect and mechanism of fermented feed on Litopenaeus vannamei. Master´s Thesis of Tianjin University of Science and Technology, 2017 [孟阳. 发酵饲料对凡纳滨对虾的作用效果与机理研究. 天津科技大学硕士研究生学位论文, 2017]
|
RENGPIPAT S, RUKPRATANPORN S, PIYATIRATITIVORAKUL S, et al. Immunity enhancement in black tiger shrimp (Penaeus monodon) by a probiont bacterium (Bacillus S11). Aquaculture, 2000, 191(4): 271-288 |
ROOKS M G, GARRETT W S. Gut microbiota, metabolites and host immunity. Nature Reviews Immunology, 2016, 16: 341-352 |
SHAO Y C, ZUO Z H, SHANG B J, et al. Isolation, screening and identification of intestinal probiotics of Litopenaeus vannamei. Journal of Anhui Agricultural Sciences, 2018, 46(12): 94-97 [邵迎春, 左志晗, 尚碧娇, 等. 凡纳滨对虾肠道益生菌的分离筛选鉴定. 安徽农业科学, 2018, 46(12): 94-97] |
TIAN F, DING Y Q, ZHU H, et al. Screening, identification and antagonistic activity of a siderophore-producing bacteria G-229-21T from rhizosphere of tobacco. Acta Microbiologica Sinica, 2008, 48(5): 631-637 [田方, 丁延芹, 朱辉, 等. 烟草根际铁载体产生菌G-229-21T的筛选、鉴定及拮抗机理. 微生物学报, 2008, 48(5): 631-637] |
WANG Y M, CHEN B, CAO J M, et al. Effects of mulberry leaf flavonoids on intestinal mucosal morphology and intestinal flora of Litopenaeus vannamei. Chinese Journal of Animal Nutrition, 2020, 32(4): 1817-1825 [王咏梅, 陈冰, 曹俊明, 等. 桑叶黄酮对凡纳滨对虾肠道黏膜形态和肠道菌群的影响. 动物营养学报, 2020, 32(4): 1817-1825] |
YANG Y K, SONG X L, WANG H L, et al. Effect of a compound probiotics on the ability of Litopenaeus vannamei to resist Vibrio parahaemolyticus infection. Progress in Fishery Sciences, 2020, 41(3): 133-141 [杨运楷, 宋晓玲, 王海亮, 等. 一种复合益生菌对凡纳滨对虾抗副溶血弧菌感染能力的影响. 渔业科学进展, 2020, 41(3): 133-141] |
YOSHIDA T, HAYASHI K I, OHMOTO H. Dissolution of iron hydroxides by marine bacterial siderophore. Chemical Geology, 2002, 184(1/2): 1-9 |
YU Q R, XIE J, HUANG M X, et al. Growth and health responses to a long-term pH stress in Pacific white shrimp Litopenaeus vannamei. Aquaculture Reports, 2020, 16: 100280 |
ZHANG M Z, PAN L Q, FAN D P, et al. Study of fermented feed by mixed strains and their effects on the survival, growth, digestive enzyme activity and intestinal flora of Penaeus vannamei. Aquaculture, 2021, 530: 735703 |
ZHAO X, CHEN S X, XIE Z X, et al. Isolation, identification and over-siderophores production of Pseudomonas fluorescens sp-f. Acta Microbiologica Sinica, 2006, 46(5): 691-695 [赵翔, 陈绍兴, 谢志雄, 等. 高产铁载体荧光假单胞菌Pseudomonas fluorescens sp-f的筛选鉴定及其铁载体特性研究. 微生物学报, 2006, 46(5): 691-695] |



