2. 中国水产科学研究院东海水产研究所 农业农村部东海与长江口渔业资源环境科学观测实验站 上海 200090;
3. 上海长江口渔业资源增殖和生态修复工程技术研究中心 上海 200090
2. Scientific Observing and Experimental Station of Fishery Resources and Environment of the East China Sea and Yangtze River Estuary, Ministry of Agriculture and Rural Affairs; East China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Shanghai 200090, China;
3. Shanghai Engineering Research Center of Fisheries Resources Enhancement and Ecological Restoration of the Yangtze River Estuary, Shanghai 200090, China
了解渔业物种繁殖期的群体组成及生理变化特征,对于丰富繁殖生物学基础知识以及科学制定合理的渔业资源管理措施具有重要的指导意义。Ogburn等(2015)以雌性蓝蟹(Callinectes sapidus)繁殖期的纳精囊状态、有无抱卵、受精卵颜色等特征指标作为产卵生境的判别依据,明确了蓝蟹在美国南大西洋湾进行产卵繁殖活动的时空分布格局,为进一步调整其渔业规划提供了重要参考。Pardo等(2017)研究发现,高强度选择性捕捞珍宝蟹(Metacarcinus magister)雄蟹会降低繁殖期雌蟹的精子储备和繁殖力水平,因此,开展雄蟹选择性捕捞策略不利于种群繁衍。
中华绒螯蟹(Eriocheir sinensis)是长江流域重要的洄游性经济渔业物种。20世纪80年代中后期,由于环境变迁和过度捕捞等因素影响,长江中华绒螯蟹资源急剧衰退(谷孝鸿等, 2001; 徐东坡等, 2015)。近年来,为扭转中华绒螯蟹自然资源的衰退趋势,国内学者针对中华绒螯蟹资源的增殖养护开展了一系列研究工作,如中华绒螯蟹亲蟹的增殖放流(曹侦等, 2013)、繁育场修复重建(赵峰等, 2020; 黄孝锋, 2016)、繁育场生境特征与早期资源监测(蒋金鹏等, 2014; 耿智, 2018)等,并提出了关于长江口中华绒螯蟹资源管理的措施和建议(王海华等, 2019),对长江中华绒螯蟹资源恢复发挥了重要作用。但目前关于长江口中华绒螯蟹繁殖期的生理特征状况鲜有报道。
长江口是长江水系中华绒螯蟹的唯一繁育场,每年10月上旬的“寒露”至下旬的“霜降”期间,中华绒螯蟹会集中洄游至长江口水域进行繁殖产卵活动,在这里完成交配、产卵、抱卵孵化以及幼体早期发育等重要生活史阶段(陈立侨等, 2017; 堵南山, 2004)。本研究以长江口中华绒螯蟹繁殖群体为研究对象,旨在查明繁殖交配期的种群特征及其生理特征,为丰富中华绒螯蟹繁殖生物学知识、进一步完善中华绒螯蟹资源管理措施提供基础支撑。
1 材料与方法 1.1 样本采集2020年12月,分别在崇明东滩、横沙东滩和九段沙水域(图 1),利用刺网(高1.6 m,长100 m,网目10 cm)采集中华绒螯蟹繁殖群体样本(科研渔业特许捕捞)。采样共分4次,分别为12月7日、11日、16日和22日。调查当天,落潮时放置刺网,涨潮时收网,将各站点样本分开冷冻保存,带回实验室分析。采样区域的水体盐度为7.51~8.66。

|
图 1 中华绒螯蟹繁殖群体的调查站点 Fig.1 Survey stations of reproductive population of Eriocheir sinensis |
根据采集的中华绒螯蟹样本的腹部形态、生殖孔的有无、交接器的有无等特征进行性别区分(徐佳倩等, 2016; 陈立侨等, 2017)和数量统计。然后,测量每只样本的壳宽(carapace width, CW)、壳长(carapace length, CL)和体重(body weight, BW) (抱卵状态下雌蟹的体重为去除受精卵团后的体重),通过解剖称量肝胰腺重(hepatopancreas weight, HW)和性腺重(gonadosomatic weight, GW),在雌蟹的解剖过程中观察并记录纳精囊的形态特征。其中,长度数据精确到0.01 mm,重量数据精确到0.01 g。
中华绒螯蟹雌蟹在长江口水域经历交配、产卵和抱卵孵化等阶段,根据雌蟹样本的解剖结果,并参考宣富君等(2016)的研究,将其繁殖状态分为未交配状态、已交配状态、抱卵状态。具体判断标准:
未交配状态:雌蟹纳精囊空瘪呈条状,无精子储存。
已交配状态:雌蟹纳精囊饱满呈球状,有大量精子储存其中。
抱卵状态:雌蟹腹肢抱卵,体内无性腺组织残留,已完成排卵过程。
1.3 数据统计根据1.2样本处理过程中数据采集的结果,对每只中华绒螯蟹样本进行Fulton条件指数K、肝胰腺指数(hepatopancreas index, HSI)、性腺指数(gonadosomatic index, GSI)进行计算,K、HSI和GSI的计算公式:
| $\begin{aligned} & K\left(\mathrm{~g} / \mathrm{mm}^3\right)=\mathrm{BW} / \mathrm{CW}^3 \times 10^5 \\ & \mathrm{HSI}(\%)=\mathrm{HW} / \mathrm{BW} \times 100 \% \\ & \mathrm{GSI}(\%)=\mathrm{GW} / \mathrm{BW} \times 100 \% \end{aligned} $ |
采用SPSS 25.0软件进行数据统计分析。通过卡方检验分析中华绒螯蟹繁殖群体的性别比例与理论值1∶1的显著差异。使用单因素方差(one-way ANOVA)对生理特征指标进行分析,采用Tukeyxs-b法进行多重比较分析,P < 0.05为差异显著。通过Pearson相关系数检验中华绒螯蟹雄蟹和雌蟹的规格(壳宽)、HSI和GSI之间的相关性。
2 结果与分析 2.1 规格组成中华绒螯蟹繁殖群体的壳宽分布情况如图 2所示,雌蟹的壳宽分布范围为30~85 mm,壳宽优势组为50~55 mm (28.35%),平均壳宽为(58.65±7.76) mm。雄蟹的壳宽分布范围为45~95 mm,壳宽优势组为65~70 mm (22.41%),平均壳宽为(69.01±7.75) mm。在每次采样获取的样本中,雌蟹的平均壳宽均小于雄蟹。随着采样时间的推移,雌蟹和雄蟹在壳宽优势组的分布范围以及平均壳宽的尺寸在总体水平上呈减小的趋势(图 3)。雌蟹的壳宽优势组由12月7日的55~60 mm缩小至12月22日的50~55 mm,平均壳宽由(61.27±8.11) mm减小至(55.88±7.01) mm。雄蟹的壳宽优势组由12月7日的75~80 mm缩小至12月22日的60~65 mm,平均壳宽由(71.60±6.93) mm减小至(66.35±6.64) mm。
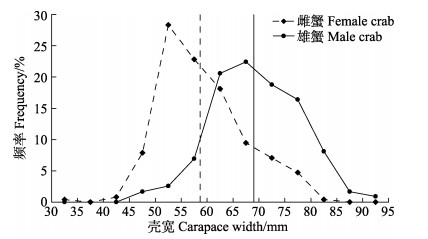
|
图 2 12月中华绒绒螯蟹繁殖群体的壳宽分布 Fig.2 Distribution of carapace width of reproductive population of E. sinensis in December 竖线分别代表雌蟹和雄蟹的平均壳宽。图 3同。 The vertical line represents the average carapace width of female and male crabs. The same as in Fig. 3. |

|
图 3 不同采样时间中华绒螯蟹的壳宽分布 Fig.3 Distribution of carapace width of E. sinensis at different sampling time |
本次调查研究共采集中华绒螯蟹989只,其中,雌蟹275只,雄蟹714只(表 1),雌雄比为0.39∶1,雌雄比例与1∶1显著不同(χ2=101.87,P < 0.05)。在4次的采样调查中,12月16日采集的样本的雌雄比例最高,为0.68∶1,接近1∶1 (χ2=3.81,P > 0.05)。12月22日采集的样本的雌雄比例最低,为0.14∶1,雌蟹数量显著低于雄蟹数量(χ2=85.38,P < 0.05)。
|
|
表 1 12月中华绒螯蟹繁殖群体的数量及雌雄比例随时间的变化 Tab.1 Temporal changes in the number and male to female ratio of the reproductive population of E. sinensis in December |
随着采样的进行,中华绒螯蟹雌蟹样本中出现未交配状态雌蟹的比例总体上逐渐下降,12月7日未交配状态的雌蟹的比例最高,为47%;12月22日最低,为5%,且显著低于12月7日(χ2=11.47,P < 0.05)。抱卵状态的雌蟹仅出现在12月7日和12月22日,存在比例分别为14%和31% (图 4)。

|
图 4 中华绒螯蟹雌蟹不同繁殖状态比例随时间的变化 Fig.4 Proportion variation of different reproductive status of female E. sinensis |
雄蟹和不同繁殖状态下的雌蟹的HSI、GSI和Fulton条件指数K的表现如表 2所示。雌蟹HSI在已交配状态下最低,在抱卵状态下最高(P < 0.05),3种繁殖状态下的HSI均差异显著(P < 0.05)。雌蟹在已交配状态下GSI高于未交配状态(P > 0.05)。雌蟹的K在已交配状态下高于未交配状态(P > 0.05),抱卵状态下雌蟹的K最低,且显著低于其他2种繁殖状态(P < 0.05)。雄蟹的GSI、K与雌蟹差异较大,雄蟹的GSI均显著低于各繁殖状态下的雌蟹(P < 0.05),K均显著高于各繁殖状态下的雌蟹(P < 0.05)。
|
|
表 2 雄蟹和不同繁殖状态雌蟹的生理特征指标状况 Tab.2 Physiological characteristics of male and female E. sinensis in different reproductive status |
中华绒螯蟹在壳宽、HSI、GSI三者之间的相关关系检验中具有明显的性别差异(图 5)。其中,雄蟹的HSI、GSI与壳宽均呈极显著负相关(P < 0.01),而雌蟹的HSI、GSI与壳宽无显著的相关关系。在HSI和GSI的相关性检验中发现,雌蟹的HSI与GSI之间呈极显著负相关(P < 0.01),而雄蟹的HSI与GSI无显著的相关关系。

|
图 5 中华绒螯蟹雄蟹和雌蟹在壳宽、肝胰腺指数、性腺指数之间的相关关系 Fig.5 The correlation between carapace width (CW), hepatopancreas index (HSI) and gonadosomatic index (GSI) of male and female E. sinensis 雌蟹的数据来源为未交配状态和已交配状态下的雌蟹。 The source of data for female crabs is the unmated and mated females. |
在中华绒螯蟹繁殖群体中,雄蟹数量高于雌蟹,且雄蟹的整体规格也远大于雌蟹。这与许多蟹类的繁殖群体的组成相似(Militelli et al, 2020; Lin et al, 2021)。在一定程度上,雄蟹在数量以及规格上占主导地位有利于交配活动的进行,进而保障繁殖群体中雌蟹的生殖潜力(Hines et al, 2003; Kendall et al, 2001)。中华绒螯蟹繁殖群体的雌雄比例随时间的波动,可能与雌蟹的产卵活动有关,雌蟹产卵后会向盐度更高的水域迁移(耿智, 2018)。但中华绒螯蟹的交配与产卵的时间间隔差异较大,短则数小时,长则数月(陈立侨等, 2017)。在本研究中,12月22日发现的雌雄比例最低,这可能由于大部分雌蟹已完成产卵活动并向盐度更高的水域迁移。
随着采样时间的推移,中华绒螯蟹的总体规格逐渐减小,这与刘凯等(2013)的调查研究结果相似。这可能由于规格较大的中华绒螯蟹在洄游期间具有较强的运动能力,能够以较快的速度洄游至长江口水域进行繁殖交配活动。一些关于蟹类运动的研究指出,规格较大的蟹类往往具有较强的运动能力,在应对障碍物所表现的攀爬能力也强于规格较小的蟹类(Lim et al, 2008; Fitri et al, 2017)。此外,在Slotte等(2012)的研究中发现,大西洋鲱鱼(Clupea harengus)在生殖洄游期间,其产卵场的位置及产卵时间与鲱鱼的个体大小有关,个体较大的大西洋鲱鱼能够洄游至较远的位置进行产卵活动。
本研究发现,12月中华绒螯蟹雌蟹未进行交配活动的比例随着时间的推移而逐渐减小。12月11日,76%的雌蟹已经进行了交配活动,12月22日也发现31%的抱卵状态雌蟹。而耿智(2018)的研究也指出,长江口中华绒螯蟹的产卵期主要集中在12月25日以后。因此,结合本研究可以推测,12月中下旬可能是中华绒螯蟹繁殖群体进行交配活动的高峰时期。
3.2 长江口中华绒螯蟹繁殖群体的生理特征状况肝胰腺作为甲壳类动物重要的能量储存组织,具有吸收和储存营养物质的功能,为中华绒螯蟹生殖洄游运动的消耗和性腺组织的发育提供能量来源和物质基础(封强梅等, 2020; 成永旭等, 1998)。因此,通过HSI和GSI能够了解中华绒螯蟹繁殖期的能量储备和性腺发育状况。Fulton条件指数K常用于评估水生生物的生长状况(Amara et al, 2009; Froese et al, 2006),基于中华绒螯蟹的壳宽和体重的计算K值,可以了解雄蟹和不同繁殖状态雌蟹的体重变化及差异状况。HSI、GSI、Fulton条件指数K的应用有助于进一步了解中华绒螯蟹繁殖群体的生理特征状况。
3.2.1 不同繁殖状态下雌蟹的生理特征差异比较鱼类和虾蟹类(Silva et al, 2019; Grande et al, 2016; Castiglioni et al, 2006)在繁殖期均表现出相似的能量分配策略。在繁殖期,鱼类等水生动物会将获取的能量主要以脂质的形式储存在肝脏中,为性腺组织的发育和繁殖产卵活动提供营养物质和能量储备。当中华绒螯蟹洄游至河口水域时,在受到盐度的刺激下,肝胰腺中的脂类物质通过血淋巴转运至性腺组织,为性腺组织的发育提供营养物质(成永旭等, 2007; 陈立侨等, 2017)。本研究发现,雌蟹在交配后的HSI低于交配前,GSI高于交配前。这可能由于雌蟹的性腺发育过程需要肝胰腺为其提供能量。但在交配活动中,雄蟹占据一定的主导权,交配后的雌蟹将精子储存在自身的纳精囊内,不会立即产卵,在持续遭受盐度的刺激下,性腺组织仍能进行发育。雌蟹在交配后Fulton条件指数K高于未交配状态(P > 0.05),这可能由于交配活动中雌蟹将精子储存在体内的纳精囊中,导致自身体重有所增加。本研究中,抱卵状态下雌蟹的HSI显著高于未交配状态和已交配状态(P < 0.05),条件指数K显著低于未交配状态和已交配状态(P < 0.05),这可能由于雌蟹的产卵行为导致自身体重降低,从而使HSI与条件指数K的表现与产卵前相比差异较大。
在雌蟹的壳宽、HSI、GSI的相关关系检验中发现,HSI、GSI与壳宽之间无显著的相关关系,表明规格大小可能不会影响雌蟹的繁殖性能。而HSI与GSI之间呈极显著负相关关系(P < 0.01),这与雌蟹在交配前后的HSI和GSI的状态变化相符,表明肝胰腺在雌蟹性腺发育过程中承担着物质转化的作用。此外,在口虾蛄(Oratosquilla oratoria)、日本蟳(Charybdis japonica)等甲壳动物的研究中也同样发现,雌虾(蟹)在繁殖期其HSI和GSI均呈显著负相关(Bo et al, 2021; 喻杰等, 2016)。
3.2.2 中华绒螯蟹繁殖期雌蟹和雄蟹的生理特征差异比较在雄蟹和雌蟹的生理特征比较中发现,雄蟹的GSI显著低于雌蟹(P < 0.05)。曹萌(2019)研究发现,在各盐度条件下,雌蟹的GSI均远高于雄蟹。雄蟹和雌蟹在繁殖期的GSI巨大差异可能主要与其繁殖期的生殖策略有关。一般认为,雌蟹在繁殖活动中的生殖成本要高于雄蟹,雌蟹会将获取的能量储存在体内以满足性腺组织的发育,而雄蟹在繁殖活动中能量的储存仅用于为雌蟹提供精子来源,精子的生产相较于卵子而言具有生产成本低、数量巨大的特点(Scharf et al, 2013; Levitan et al, 1995; Wedell et al, 2002)。
雄蟹的壳宽、HSI、GSI之间的相关关系检验发现,雄蟹的HSI、GSI与壳宽均呈极显著负相关(P < 0.01),这可能与其交配活动有关。许多蟹类的繁殖交配活动的相关研究指出,雄蟹常可以和多个雌蟹进行繁殖交配活动(Johnson et al, 2010; Waiho et al, 2015; Diesel et al, 2010),而频繁的交配活动会极大地减少雄蟹的精子储备(Colpo et al, 2018),尤其规格越大的雄蟹往往会表现出越高的交配频率。Carver等(2005)研究发现,规格较小的蓝蟹雄蟹在交配中向雌蟹传递的精子较少。Sato等(2005)研究了实验室条件下规格大小和交配频率对短足拟石蟹(Paralithodes brevipes)生殖潜能的影响,发现规格较大的雄蟹表现出较高的交配频率,而频繁交配后的雄蟹其精子再生能力也较低。Sato等(2010)在椰子蟹(Birgus latro)的研究中同样发现,雌性椰子蟹会选择体型较大或体型近似与自己的雄性个体进行交配。以上研究表明,个体较大的雄蟹承担着种群交配繁殖的重任。本研究中,虽然无法直接判断获取的雄蟹是否进行过交配活动,但在每次调查中均发现较高比例的雌蟹进行过交配活动,且每次调查获取的雄蟹的壳宽大于雌蟹。因此,可以推断,在中华绒螯蟹繁殖群体中,规格越大的雄蟹其交配频率也越高,而过高的交配频率会极大地消耗雄蟹自身的精子储备和能量储备,从而雄蟹的GSI、HSI与壳宽之间呈显著负相关。
宣富君等(2016)探究了中华绒螯蟹雄蟹的生殖潜力,结果表明,在室内条件下雄蟹具备完成3次交配活动的生殖潜力,在丧失交配能力前能够贡献出超过60%的精子储备,但多次交配活动并不会对雌蟹的繁殖力产生积极的影响。本研究中,综合考虑中华绒螯蟹繁殖期群体的雌雄比例、壳宽分布以及雄蟹的生理特征等因素,结合其他蟹类繁殖期的生殖特征,可以推断,在中华绒螯蟹繁殖群体中雄蟹存在过度交配现象,雄蟹资源可能未得到充分利用。
综上所述,12月中下旬是中华绒螯蟹繁殖群体进行交配活动的高峰时期,这为制定中华绒螯蟹的禁捕期提供了有效依据。中华绒螯蟹在繁殖交配期所表现的生理特征状况呈现明显的雌雄差异,可能与其自身的生殖特性有关,这也为进一步优化中华绒螯蟹资源增殖放流工作中“放多少”提供了参考价值,但具体科学的实施还应进一步加强野外监测并开展中华绒螯蟹繁殖生物学相关的研究,明确放流数量、雌雄比例等关键问题。在开展中华绒螯蟹繁殖群体的监测应开展大面积的区域调查,以进一步明确中华绒螯蟹河口生活史历程变化的时空分布格局,为制定科学准确的长江口水域中华绒螯蟹的管理策略提供理论支撑。
AMARA R, SELLESLAGH J, BILLON G, et al. Growth and condition of 0-group European flounder, Platichthys flesus as indicator of estuarine habitat quality. Hydrobiologia, 2009, 627(1): 87-98 DOI:10.1007/s10750-009-9717-9 |
BO Q K, LU Y Z, MA C, et al. Reproductive biology and biochemical changes in female mantis shrimp Oratosquilla oratoria (Stomatopoda) with ovary development from the Tianjin coastal zone of Bohai Bay. Aquaculture, 2021, 534: 736239 DOI:10.1016/j.aquaculture.2020.736239 |
CAO M. Effects of salinities on the hemolymph, physiological index and fighting behavior in Eriocheir sinensis. Master′s Thesis of Dalian Ocean University, 2019 [曹萌. 中华绒螯蟹不同盐度下血淋巴内主要生化成分、生理指标与打斗行为的研究. 大连海洋大学硕士研究生学位论文, 2019]
|
CAO Z, FENG G P, ZHUANG P, et al. The physiology adaption of the mature Eriocheir sinensis to the environment of the Yangtze estuary after stocking. Acta Hydrobiologica Sinica, 2013, 37(1): 34-41 [曹侦, 冯广朋, 庄平, 等. 长江口中华绒螯蟹放流亲蟹对环境的生理适应. 水生生物学报, 2013, 37(1): 34-41] |
CARVER A M, WOLCOTT T G, WOLCOTT D L, et al. Unnatural selection: Effects of a male-focused size-selective fishery on reproductive potential of a blue crab population. Journal of Experimental Marine Biology and Ecology, 2005, 319(1/2): 29-41 |
CASTIGLIONI D D S, OLIVEIRA G T D, BONDBUCKUP G. Dinâmica do desenvolvimento das gônadas de Parastacus varicosus (Crustacea, Decapoda, Parastacidae). Iheringia Série Zoologia, 2006, 96(4): 413-417 DOI:10.1590/S0073-47212006000400004 |
CHEN L Q, DU N S. Biology of Eriocheir sinensis. Beijing: Science Press, 2017: 158-160 [陈立侨, 堵南山. 中华绒螯蟹生物学. 北京: 科学出版社, 2017: 158-160]
|
CHENG Y X, DU N S, LAI W. Lipid composition in hepatopancreas of Chinese mitten crab Eriocheir sinensis at different stages. Acta Zoologica Sinica, 1998(4): 45-54 [成永旭, 堵南山, 赖伟. 不同阶段中华绒螯蟹肝胰腺的脂类及脂肪酸组成. 动物学报, 1998(4): 45-54] |
CHENG Y X, WANG Z K, DU N S, et al. The changes of the lipid composition in ovary and hepatopancreas during the period of the ovarian fast development of the Chinese mitten crab Eroicheir sinensis after 3 months starvation. Journal of Fisheries of China, 2007, 31(S): 74-79 [成永旭, 王宗凯, 堵南山, 等. 饥饿对中华绒螯蟹卵巢快速发育阶段的脂类与肝胰腺脂类的影响. 水产学报, 2007, 31(增刊): 74-79] |
COLPO K D, LÓPEZ-GRECO L S. Dynamics of energy reserves and the cost of reproduction in female and male fiddler crabs. Zoology, 2018, 126: 11-19 DOI:10.1016/j.zool.2018.01.004 |
DIESEL R. Sperm competition and reproductive success in the decapod Inachus phalangium (Majidae): A male ghost spider crab that seals off rivals' sperm. Proceedings of the Zoological Society of London, 2010, 220(2): 213-223 |
DU N S. Migration of Eriocheir sinensis. Fisheries Science and Technology Information, 2004, 31(2): 56-57 [堵南山. 中华绒螯蟹的洄游. 水产科技情报, 2004, 31(2): 56-57] |
FENG Q M, LONG X W, JIANG X D, et al. Changes of tissue indices and lipid composition of wild adult Chinese mitten crab (Eriocheir sinensis) during catadromous migration. Journal of Shanghai Ocean University, 2020, 29(2): 234-241 [封强梅, 龙晓文, 姜晓东, 等. 长江野生中华绒螯蟹降海洄游过程中组织系数和脂类组成的变化. 上海海洋大学学报, 2020, 29(2): 234-241] |
FITRI A D P, BOESONO H, SABDONO A, et al. The mud crab (Scylla serrata) behavior in different inclination angles of funnel and escape vent for trap net. Aquaculture, Aquarium, Conservation and Legislation, 2017, 10(2): 191-199 |
FROESE R. Cube law, condition factor and weight-length relationships: History, meta-analysis and recommendations. Journal of Applied Ichthyology, 2006, 22(4): 241-253 DOI:10.1111/j.1439-0426.2006.00805.x |
GENG Z. The environment adaptability and conservation strategy of Eriocheir sinensis in estuarine life stages. Doctoral Dissertation of East China Normal University, 2018 [耿智. 中华绒螯蟹河口生活史阶段的环境适应性及保护策略. 华东师范大学博士研究生学位论文, 2018]
|
GRANDE M, MURUA H, ZUDAIRE I, et al. Energy allocation strategy of skipjack tuna Katsuwonus pelamis during their reproductive cycle. Journal of Fish Biology, 2016, 89(5): 2434-2448 DOI:10.1111/jfb.13125 |
GU X H, ZHAO F S. Resources and culturing situation of Chinese mitten crab (Eriocheir sinensis) and species character conservation. Journal of Lake Sciences, 2001, 13(3): 267-271 [谷孝鸿, 赵福顺. 长江中华绒螯蟹的资源与养殖现状及其种质保护. 湖泊科学, 2001, 13(3): 267-271] |
HINES A H, JIVOFF P R, BUSHMANN P J, et al. Evidence for sperm limitation in the blue crab, Callinectes sapidus. Bulletin of Marine Science, 2003, 72(2): 287-310 |
HUANG X F. Key environment factors demand for juvenile Eriocheir sinensis and construction of artificial replacement habitat in the Yangtze estuary. Doctoral Dissertation of Nanjing Agricultural University, 2016 [黄孝锋. 长江口中华绒螯蟹仔蟹对关键环境因子需求及其人工替代栖息地构建. 南京农业大学博士研究生学位论文, 2016]
|
JIANG J P, FENG G P, ZHANG L Z, et al. Preliminary assessment on habitat suitability of Eriocheir sinensis spawning crabs in Yangtze River estuary. Marine Fisheries, 2014, 36(3): 232-238 [蒋金鹏, 冯广朋, 章龙珍, 等. 长江口中华绒螯蟹抱卵蟹生境适宜度初步评估. 海洋渔业, 2014, 36(3): 232-238 DOI:10.3969/j.issn.1004-2490.2014.03.006] |
JOHNSON S L, BROCKMANN H J. Costs of multiple mates: An experimental study in horseshoe crabs. Animal Behaviour, 2010, 80(5): 773-782 DOI:10.1016/j.anbehav.2010.07.019 |
KENDALL M S, WOLCOTT D L, WOLCOTT T G, et al. Reproductive potential of individual male blue crabs, Callinectes sapidus, in a fished population: Depletion and recovery of sperm number and seminal fluid. Canadian Journal of Fisheries and Aquatic Sciences, 2001, 58(6): 1168-1177 DOI:10.1139/f01-065 |
LEVITAN D R, PETERSEN C. Sperm limitation in the sea. Trends in Ecology and Evolution, 1995, 10(6): 228-231 DOI:10.1016/S0169-5347(00)89071-0 |
LIM S S, LIM C K. Running speed of Uca annulipes (H. Milne Edwards, 1937) and U. vocans (Linnaeus, 1758). Crustaceana, 2008, 81(11): 1367-1380 |
LIN B, BOENISH R, KRITZER J, et al. Reproductive dynamics of a swimming crab (Monomia haanii) in the world's crab basket. Fisheries Research, 2021, 236: 105828 |
LIU K, DUAN J R, XU D P, et al. Studies on current resources and causes of catch fluctuation of brooders of mitten crab in estuary of Changjiang River. Journal of Lake Sciences, 2007, 19(2): 212-217 [刘凯, 段金荣, 徐东坡, 等. 长江口中华绒螯蟹亲体捕捞量现状及波动原因. 湖泊科学, 2007, 19(2): 212-217] |
LIU K, TANG T, DUAN J R, et al. Population characteristics and factors affecting the Chinese mitten crab fishery in Jiuduansha, Yangtze River estuary. Journal of Fishery Sciences of China, 2013, 20(3): 614-623 [刘凯, 汤滔, 段金荣, 等. 长江口九段沙水域中华绒螯蟹汛期特征及影响因子. 中国水产科学, 2013, 20(3): 614-623] |
MILITELLI M I, FIRPO C, MAUNA A C, et al. Reproductive potential of southern king crab (Lithodes santolla) in South Patagonian Sector (south 48°S), a new fishery area. Fisheries Research, 2020, 229: 105595 |
OGBURN M B, HABEGGER L C. Reproductive status of Callinectes sapidus as an indicator of spawning habitat in the South Atlantic Bight, USA. Estuaries and Coasts, 2015, 38(6): 2059-2069 |
PARDO L M, RIVEROS M P, FUENTES J P, et al. High fishing intensity reduces females' sperm reserve and brood fecundity in a eubrachyuran crab subject to sex and size-biased harvest. ICES Journal of Marine Science, 2017, 74(9): 2459-2469 |
SATO T, ASHIDATE M, WADA S, et al. Effects of male mating frequency and male size on ejaculate size and reproductive success of female spiny king crab Paralithodes brevipes. Marine Ecology Progress, 2005, 296: 251-262 |
SATO T, YOSEDA K. Influence of size-and sex-biased harvesting on reproduction of the coconut crab Birgus latro. Marine Ecology Progress Series, 2010, 402: 171-178 |
SCHARF I, PETER F, MARTIN O Y. Reproductive trade-offs and direct costs for males in arthropods. Evolutionary Biology, 2013, 40(2): 169-184 |
SILVA J, COSTA M, ARAÚJO F G. Energy acquisition and allocation to the gonadal development of Cynoscion leiachus (Perciformes, Sciaenidae) in a tropical Brazilian Bay. Marine Biology Research, 2019, 15(2): 1-11 |
SLOTTE A, JOHANNESSEN A. Spawning of Norwegian spring spawning herring (Clupea harengus L. ) related to geographical location and population structure. Progress in Oceanography, 2012, 92: 166-177 |
WAIHO K, MUSTAQIM M, FAZHAN H, et al. Mating behaviour of the orange mud crab, Scylla olivacea: The effect of sex ratio and stocking density on mating success. Aquaculture Reports, 2015, 2: 50-57 |
WANG H H, FENG G P, WU B, et al. Research on management and countermeasures of sustainable utilization of Eriocheir sinensis of Yangtze population. Chinese Journal of Agricultural Resources and Regional Planning, 2019, 40(5): 93-100 [王海华, 冯广朋, 吴斌, 等. 长江水系中华绒螯蟹资源保护与可持续利用管理对策研究. 中国农业资源与区划, 2019, 40(5): 93-100] |
WEDELL N, GAGE M J G, PARKER G A. Sperm competition, male prudence and sperm-limited females. Trends in Ecology and Evolution, 2002, 17(7): 313-320 |
XU D P, LIU K, DUAN J R, et al. Study on Chinese mitten crab resource in the lower reaches of Yangtze River (2007-2011). Resources and Environment in the Yangtze Basin, 2015, 24(1): 39-44 [徐东坡, 刘凯, 段金荣, 等. 长江下游中华绒螯蟹成蟹资源现状(2007-2011年). 长江流域资源与环境, 2015, 24(1): 39-44] |
XU J Q, WU X G, ZHANG P C, et al. Growth, gonadal development and secondary sexual characteristics of pond-reared male Chinese mitten crab (Eriocheir sinensis) during the second year culture. Chinese Journal of Zoology, 2016, 51(3): 434-448 [徐佳倩, 吴旭干, 张鹏超, 等. 池塘养殖中华绒螯蟹二龄雄体生长、性腺发育和第二性征的变化. 动物学杂志, 2016, 51(3): 434-448] |
XUAN F J, HE J, LIU N G, et al. Reproductive potentiality of individual male Chinese mitten crab (Eriocheir sinensis) under the laboratory-reared conditions. Journal of Fisheries of China, 2016, 40(2): 236-242 [宣富君, 何杰, 刘乃更, 等. 室内养殖条件下中华绒螯蟹雄性个体的生殖潜力. 水产学报, 2016, 40(2): 236-242] |
YU J, HAN Y T, JIANG Y S, et al. Ovarian development and mating choice in Asian swimming crab Charybdis japonica. Journal of Dalian Ocean University, 2016, 31(5): 477-481 [喻杰, 韩岳橦, 姜玉声, 等. 两种体色日本蟳卵巢发育及配偶选择的研究. 大连海洋大学学报, 2016, 31(5): 477-481] |
ZHAO F, HUANG X F, SONG C, et al. Selection and use of artificial floating wetland habitat for larval Chinese mitten crab in the Yangtze estuary. Journal of Fishery Sciences of China, 2020, 27(9): 1003-1009 [赵峰, 黄孝锋, 宋超, 等. 长江口中华绒螯蟹幼蟹对人工漂浮湿地生境的选择利用. 中国水产科学, 2020, 27(9): 1003-1009] |



