2. 南方海洋科学与工程广东省实验室(湛江)南海资源大数据中心 广东 湛江 524013;
3. 广东省南海深远海渔业管理与捕捞工程技术研究中心 广东 湛江 524088
2. Marine Resources Big Data Center of South China Sea, Southern Marine Science and Engineering Guangdong Laboratory (Zhanjiang), Zhanjiang, Guangdong 524013, China;
3. Guangdong Provincial Engineering and Technology Research Center of Far Sea Fisheries Management and Fishing of South China Sea, Zhanjiang, Guangdong 524088, China
鱼类通过摄食获得能量以维持自身的生存、生长及繁衍后代,又对群体的行动规律、食物关系、饵料环境及种群数量变动产生影响。鱼类摄食生态是现代鱼类生态学重要基础理论之一,是阐述海洋生态系统结构与功能的重要途径,研究鱼类摄食有助于了解系统中鱼类的种间关系,是海洋食物网构建与系统能量流动分析的基础(窦硕增, 1996; 颜云榕等, 2011)。因此,研究鱼类摄食生态是判断鱼类生长好坏、掌握种群资源动态变化及确定其在海洋生态系统中功能和地位的关键所在,是实施渔业资源管理的重要前提与基础(薛莹, 2005)。
北部湾是南海一个天然的半封闭性海湾,拥有良好的自然条件和优越的地理环境,沿岸河流众多,浮游生物丰富,使得该海域渔业资源丰富,是我国第四大渔场(孙典荣, 2008)。日本金线鱼(Nemipterus japonicus)隶属金线鱼属(Nemiptemy),是北部湾的重要渔获种类之一,在该海域食物网中的营养位置较高,既是消费者,又是高级肉食性鱼类重要的摄食对象,在该生态系统的食物网结构稳定、能量流动转化及能量输出等方面起到重要作用(孙典荣, 2008; 颜云榕, 2010)。国外学者采用传统胃含物分析法对孟买近岸、韦拉沃尔近岸、阿曼海北部及民都鲁近岸等海域的日本金线鱼的摄食习性进行了相关研究(Acharya et al, 1994; Raje, 2002; Seyfabadi, 2013; Manojkumar et al, 2015; Tonnie et al, 2018);而国内专门针对日本金线鱼摄食生态的研究较少,仅在个别食物网研究或渔业资源调查中有涉及其营养级或食性类型分析(邱永松等, 2008; 颜云榕, 2010)。近年来,由于过度捕捞和海洋环境污染等影响(李寇军等, 2007),北部湾渔业资源呈衰退趋势(邓裕坚等, 2021),其中,日本金线鱼的渔获密度大幅度下降(王跃中等, 2008; 粟丽等, 2021),其种群资源遭到破坏的同时,在北部湾食物网中的摄食关系和功能地位也必然产生一定的变化。
本研究利用传统胃含物分析研究北部湾日本金线鱼食物组成和摄食强度,结合碳、氮稳定同位素分析其食物来源与营养级的变化,旨在阐明日本金线鱼摄食生态的变化规律,为合理利用和保护该资源提供基础理论依据。
1 材料与方法 1.1 样品采集与处理2018年1—4月和8—12月(5—7月为南海休渔期,未采集到相应样品)在北海侨港渔港对底拖网作业渔船进行样品采集,共采集248尾日本金线鱼样品(表 1)。按照《海洋调查规范(GB12763.3-91)》测定样品的体长、体重和纯体重等生物学参数,体长等精确到1 mm,体重和纯体重等精确到0.01 g。本次日本金线鱼样品体长范围为63~198 mm,以10 mm为组距的数据符合正态分布,故将其分为6个体长组。
|
|
表 1 北部湾日本金线鱼样品采样信息 Tab.1 Sampling information of N. japonicus in the Beibu Gulf |
解剖后获得97个实胃,进行胃含物分析实验。参考海洋生物分类资料(宋海棠等, 2006; 陈大刚等, 2015),借助双筒解剖镜(Leica Zoom 2000 Z45V)对胃内饵料生物进行种类鉴定,尽可能鉴定至种。用精度为0.001 g的电子天平(Shimadzu Auy220)称量各饵料生物重量,称量前用滤纸吸干饵料生物表面水分。
食物组成分析即通过描述鱼类摄食饵料生物的种类组成,常用相对重要性指数百分比(IRI%)来分析饵料的重要性(Hyslop, 1980),计算公式如下:
| $ \mathrm{IRI}=(W \%+N \%) \times F \% $ |
| $ \mathrm{IRI} \%=\left(\mathrm{IRI} / ∑ \mathrm{IRI}\right) \times 100 $ |
式中,W%、N%和F%分别为饵料种类的重量百分比、个数百分比和出现频率百分比。
将饵料种类合并为8大类群(张波, 2007),使用Primer 5.2软件(Clarke et al, 2001)对日本金线鱼的食物组成进行聚类分析,以饵料重量百分比作为分类指标,分析前先对数据进行平方根转换处理,以便对稀有饵料物种给予一定程度上的加权,得到Bray-Curtis相似性矩阵结果(Schafer et al, 2002)。
摄食强度是研究鱼类摄食生态的重要内容之一,它可以反映鱼类在摄食节律等方面的变化情况。摄食等级、饱满指数和空胃率是反映鱼类摄食强度的重要指标(薛莹, 2005; Weitkamp et al, 2008)。本研究利用胃饱满指数(stomach repletion index, RI)和空胃率(vacuity coefficient, VC)评估日本金线鱼摄食强度随季节的变化,使其描述可以更加准确,计算公式如下:
| $ {\rm{RI}}\%= \frac{食物重量}{纯体重} ×100 $ |
| $ {\rm{VC}}\%= \frac{空胃数}{总胃数} ×100 $ |
鱼类摄食生态位宽度,即鱼类饵料生物组成的多样性,用Shannon-Wiener多样性指数(H')和Pielou均匀度指数(J')表示(Krebs, 1989),计算公式如下:
| $ H' = \mathop \sum \limits_{i{\text{ = 1}}}^s {P_i} \times \ln {P_i} $ |
| $ J'=H'/\ln s $ |
式中,s表示饵料生物种类数量,Pi表示饵料生物i在食物中所占的个数百分比。H'和J'能较好地反映食物组成中优势饵料与其他饵料差异,而且H'对稀有饵料物种更为敏感,适合作为描述鱼类总摄食生态位宽度的指标(Marshall et al, 1997)。H'和J'呈现一致的变化趋势,二者可以更加直观地反映鱼类摄食过程中的食物总生态位宽度。
1.3 稳定同位素分析取不同体长组日本金线鱼的适量背部肌肉,每组取5尾。取得的肌肉通过冷冻干燥机(ALPHA1- 4LDplus)在–50℃恒温条件下冷冻干燥48 h。结束后用肌肉球磨仪(Mini-BeadBeater-16)充分研磨成粉状以备稳定同位素分析。
每个样品称取(0.20±0.02) mg,并在EA Isolink稳定元素分析仪中高温燃烧后产生CO2和N2,气体通过DELTA V 253Plus同位素质谱仪进行稳定同位素分析。为保证仪器和实验结果的准确性,先进行仪器校正,再分别测定相同样品的碳氮稳定同位素。每测定10个样品后,插测1个标准样,并对个别样品进行2~3次复测((Hesslein et al, 1991)。
稳定同位素质谱仪分析样品中15N/14N和13C/12C的比值,δ15N、δ13C及营养级按以下公式计算得出(Post, 2002):
| $ {\mathtt{δ}}^{\text{15}}\text{N=}\left(\frac{{}_{}{}^{\text{15}}\text{N}{\text{/}}^{\text{14}}{\text{N}}_{样品}}{{}_{}{}^{\text{15}}\text{N}{\text{/}}^{\text{14}}{\text{N}}_{大气}}-1\right)\times \text{1000} $ |
| $ {\mathtt{δ}}^{\text{13}}\text{C=}\left(\frac{{}_{}{}^{\text{13}}\text{C}{\text{/}}^{\text{12}}{\text{C}}_{样品}}{{}_{}{}^{\text{13}}\text{C}{\text{/}}^{\text{12}}{\text{C}}_{箭石}}-1\right)\times \text{1000} $ |
| $ \text{TL=}\frac{\mathtt{δ}{}_{}{}^{\text{15}}\text{N}{}_{样品}-\mathtt{δ}{}_{}{}^{\text{15}}\text{N}{}_{\text{0}}}{{}_{}{}^{\text{15}}\text{N}{}_{\text{c}}}\text{+2}\text{.0} $ |
式中,
在R语言软件中,分别以δ13C和δ15N为横、纵坐标,利用稳定同位素混合模型SIAR数据分析包绘制δ13C-δ15N二维点集图,并计算所围成的凸多边形面积(TA)和标准椭圆面积(SEA),其分别表示物种的总生态位和核心生态位,可用来衡量日本金线鱼在食物网中占据的营养生态位宽度,并分别计算δ13C极差(CR)和δ15N极差(NR),其分别表示基础食物来源和营养长度(Layman et al, 2007)。
利用SPSS 19.0软件(Zar, 1999)中的列联表卡方检验分析其空胃率的变化,使用Kruskal-Wallis检验饵料质量、饵料个数的变化情况以及平均饱满指数变化。
2 结果与分析 2.1 食物组成及变化胃含物分析结果显示,北部湾日本金线鱼摄食的饵料包括8个类群(表 2),主要摄食的饵料类群为鱼类(IRI%=62.88%),其次为虾类(IRI%=30.04%)和蟹类(IRI%=3.69%),其余生物类群的IRI%均小于2%。从饵料种类看,少鳞犀鳕(Bregmaceros rarisquamosus)的IRI%最高(19.08%),其次为中国毛虾(Acetes chinensis) (IRI%=6.11%)。
|
|
表 2 北部湾日本金线鱼的食物组成 Tab.2 Diet composition of N. japonicus from the Beibu Gulf |
按重量百分比排序,日本金线鱼主要摄食鱼类(71.13%)、其次为虾类(14.16%)和蟹类(5.02%),其他饵料类群的重量百分比小于5%;按个数百分比,则以虾类最高(60.24%),其次为鱼类(24.77%)和星虫类(6.12%);按出现频率百分比,则以鱼类最高(47.66%),其次为虾类(25.78%)、蟹类(10.16%)、星虫类(6.25%)及多毛类(5.47%)。上层饵料生物种类只有少鳞犀鳕和青带小公鱼(Stolephorus zollingeri),出现频率占比为17.97% (表 2)。
日本金线鱼的食物组成存在明显季节变化,从饵料类群重量百分比可以看出,春季摄食大量虾类(54.41%)和鱼类(35.38%),兼食少量的口足类(5.52%);夏季除摄食大量鱼类(89.46%)外,还摄食少量蟹类(10.54%);秋季摄食大量鱼类(76.40%),兼食少量虾类(7.95%)和头足类(5.65%);冬季主要摄食鱼类(58.53%)。还摄食一定量的虾类(18.03%)、星虫类(12.53%)和蟹类(7.02%)。
鱼类是日本金线鱼的主要摄食对象,其饵料类群重量百分比范围为35.38%~89.46%。其中,夏季比例最高,春季最低。其他饵料类群也存在明显季节变化,其中,摄食虾类比例在春季最高,蟹类在夏季比例最高,头足类在秋季比例最高,冬季摄食星虫类比例较高。口足类、虾类、星虫类及多毛类等除了夏季外的季节均有出现,但双壳类与头足类仅在秋季出现(表 3)。
|
|
表 3 饵料类群重量百分比(W%)的季节变化 Tab.3 Seasonal variation of the weight percentage (W%) for prey items |
经Kruskal-Wallis检验可知,日本金线鱼摄食饵料质量具有显著的体长差异(P < 0.05),摄食饵料个数与体长无显著相关性(P > 0.05)。其摄食饵料质量随体长变化发生明显变化,摄食的饵料平均质量随体长增长而增加。
日本金线鱼摄食的饵料类群随体长变化明显(表 4),其中,鱼类是各体长组主要的摄食饵料,其饵料类群重量百分比范围为46.06%~82.48%;随着日本金线鱼体长的增长,摄食鱼类的重量百分比呈上升趋势,在体长为150~159 mm时摄食鱼类最多(82.48%);对虾类的摄食随着体长的增长而下降,在体长为120~ 129 mm时,虾类的重量百分比达到最大(42.05%)。对口足类和蟹类也存在较大变化,体长≥160 mm的群体摄食口足类最多(10.68%),体长为130~139 mm的群体摄食蟹类最多(9.38%)。
|
|
表 4 饵料类群重量百分比组成(W%)随体长变化 Tab.4 Variations in the percentage weight (W%) for prey items to the diet with different length group |
聚类分析以饵料重量百分比为指标,将不同体长组的日本金线鱼分为2组(图 1):第1组为体长 < 130 mm的日本金线鱼,第2组为≥130 mm的群体,2组相似系数为72.95%。体长 < 130 mm群体主要摄食鱼类(46.06%~50.34%)和虾类(37.05%~42.05%),而体长≥130 mm的群体则主要摄食鱼类(70.25%~ 82.48%),虾类所占比例下降。日本金线鱼摄食8类饵料类群,第1组摄食饵料有6大类群,第2组摄食范围较广泛,且星虫类和双壳类仅在该组出现。Kruskal-Wallis检验结果显示,这2组摄食饵料重量差异显著(P < 0.05)。
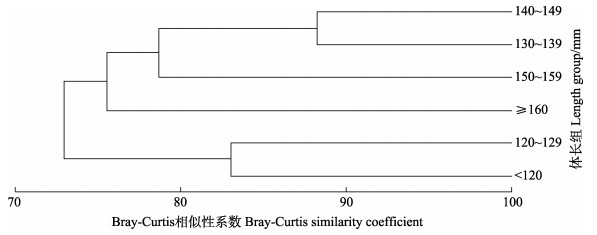
|
图 1 日本金线鱼不同体长组食物组成的聚类分析 Fig.1 Cluster analysis dendrogram of the dietary composition of N. japonicus in different length group |
日本金线鱼全年摄食强度以0级比例(即空胃率)最高,为60.89%,其他依次为1级(17.74%)、2级(14.11%)、3级(4.03%)和4级(3.23%),平均胃饱满指数为2.14%。
经检验,本研究中日本金线鱼的空胃率和胃饱满指数均为极显著差异(P < 0.01),即摄食强度在不同季节存在极显著差异。各季节空胃率均较高,其中冬季比例最高(72.97%)。胃饱满指数和摄食强度为正比,在秋季达到最高值(3.73%),夏季和春季次之,冬季最低(1.05%)(图 2)。
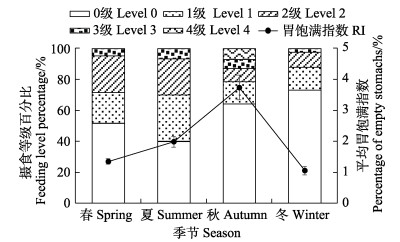
|
图 2 日本金线鱼摄食强度的季节变化 Fig.2 Season variation of feeding intensity of N. japonicas |
计算得到日本金线鱼全年摄食饵料种类多样性较高,Shannon-Wiener多样性指数(H')为1.77,Pielou均匀度指数(J')为0.64,其摄食生态位宽度存在季节和生长变化。
图 3为日本金线鱼H'和J'季节变化,H'值随季节在0.77~2.18之间变化,J'值在0.28~0.79间变化,H'和J'总体上随季节的变化趋势为先上升后急剧下降。H'值秋季最高(2.18),冬季最低(0.77);J'在秋季达到最高值(0.79),冬季达最低值(0.28)。
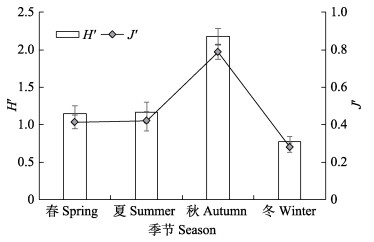
|
图 3 日本金线鱼不同季节饵料多样性指数 Fig.3 Diversity indices of bait of N. japonicus in different seasons |
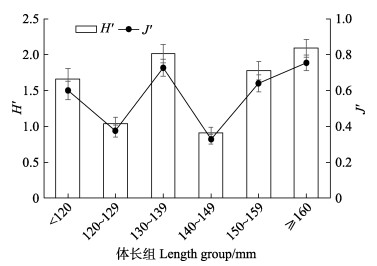
|
图 4 日本金线鱼各体长组饵料多样性指数 Fig.4 Diversity indices of bait of N. japonicus in different length group |
H'值和J'值随体长总体呈上升趋势,H'在0.91~ 2.09之间变化,140~149 mm群体的H'值最低,为0.91,130~139 mm和≥160 mm两个群体的H'值均 > 2,分别为2.01和2.09;J'值最低为0.37,最高为0.75。
2.4 同位素特征、营养级和营养生态位日本金线鱼δ13C值范围为–18.25‰ ~ –15.39‰,平均值为–16.69‰,极差为2.86‰;δ15N值范围13.01‰ ~17.24‰,平均值为15.60‰,极差为4.23‰ (表 5)。Pearson相关性结果显示,体长与δ13C呈显著正相关(P < 0.05),与δ15N呈极显著正相关(P < 0.01),而δ13C与δ15N相关性不显著(P > 0.05)。
|
|
表 5 日本金线鱼δ13C和δ15N值与营养级随体长的变化 Tab.5 The eigenvalues of δ13C, δ15N and trophic levels of N. japonicus in different length group |
根据公式计算得到日本金线鱼的营养级范围为3.21~4.46,平均值为3.97±0.25,各体长组营养级变化范围为3.85~4.17,营养级随体长增长而缓慢上升,体长 < 120 mm的群体营养级最低(3.85)(表 5)。Pearson相关性结果显示,其营养级和体长呈极显著正相关性(P < 0.01)。
基于δ13C和δ15N值构建日本金线鱼营养生态位框架图。从春季到冬季,基础食物来源(CR)随季节先上升后下降,在秋季最大(2.87);营养长度(NR)随季节先下降后上升,在冬季最大(3.86);总生态位(TA)随季节变化呈上升趋势并在冬季达到最大(5.06),对核心生态位(SEA)重叠进行分析,各季节的SEA重叠面积较大,其重叠率较高(图 5)。
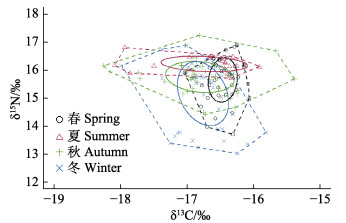
|
图 5 基于碳、氮稳定同位素日本金线鱼在不同季节的生态位结构图 Fig.5 The bio-plots based on stable C and N isotopes of N. japonicus in different season |
|
|
表 6 日本金线鱼不同季节的生态位宽幅 Tab.6 Trophic niche width for N. japonicus in different season |
不同大小群体的CR总体上呈上升趋势,其中130~139 mm群体达到最大(2.34);NR呈先上升后下降的趋势,在120~129 mm群体最大(3.47);TA在不同群体间差异较大,呈先增大后减小的变化趋势,120~129 mm群体最大(4.75),随后逐渐减小;核心生态位重叠分析表明(图 6),各体长组的SEA有一定程度的重叠。
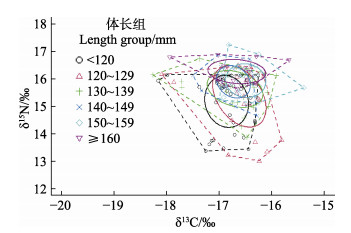
|
图 6 日本金线鱼不同体长组的营养生态位重叠图 Fig.6 The plot trophic niches overlap for N. japonicus in different length groups |
|
|
表 7 日本金线鱼的不同体长组的生态位宽幅 Tab.7 Trophic niche width estimated for N. japonicus in different length groups |
孟买近岸、韦拉沃尔近岸、阿曼海北部及民都鲁近岸等海域的研究表明,日本金线鱼摄食种类较多,食性较广,主要摄食饵料类群为甲壳类、鱼类、软体类、多毛类及棘皮类等(Acharya et al, 1994; Raje, 2002; Seyfabadi, 2013; Manojkumar et al, 2015; Tonnie et al, 2018)。本研究中,北部湾日本金线鱼摄食饵料类群也基本相似,包括鱼类、虾类、蟹类等8大类群生物,但优势饵料群体组成具有一定的差异。另外,不同海域间研究均表明,日本金线鱼为广食性的底栖肉食性动物,饵料生物种类所占比例随季节和生长发育出现变化。
多数鱼类的摄食活动存在明显季节变化,不少鱼类在繁殖季节和冬季会出现摄食强度降低或停食等状况(许莉莉等, 2018),北部湾日本金线鱼具有类似的摄食习性。春冬季水温较低,饵料生物相对较少,同时日本金线鱼个体新陈代谢速率下降,摄食欲下降;其次,相关研究表明,北部湾金线鱼科鱼类的繁殖期较长,主要繁殖季节为春冬季(陈再超等, 1982; Nettely et al, 2016),成熟的性腺占据大部分体腔,导致其摄食强度降低。夏季是北部湾日本金线鱼的繁殖后期,产卵后鱼类个体急需恢复,对能量的强烈需求导致摄食强度上升(严利平等, 2006),同时,随着温度升高,夏季饵料资源相对丰富,日本金线鱼通过大量摄食来补充产卵消耗的能量及满足幼体快速生长的需求,故表现出较高的摄食强度。另外,鱼类产卵前期的摄食强度会大幅度提高(魏秀锦等, 2018)。秋季是日本金线鱼的繁殖前期,其通过增加摄食并将部分能量转化为脂肪,为繁殖及越冬做准备,从而表现出秋季平均摄食强度最高。从食物组成的季节变化来看,鱼类是四季中主要的饵料生物,但在不同季节里,其饵料生物存在不同程度的替换。春冬季摄食虾类的比例较高,且春季摄食的虾类多于鱼类;夏秋季则以鱼类为主要摄食对象。而且,摄食种类数在不同季节也有变化,秋季的种类远多于其他季节;而个别季节的样品较少,可能对饵料种类组成造成一定的偶然性误差。
鱼类摄食习性存在随生长变化的现象,大多数鱼类的饵料种类范围随生长发育而扩大,同种类在不同体长组的优势饵料会产生一定的分隔(张波, 2007; 宿鑫等, 2015)。本研究中,日本金线鱼摄食饵料质量在不同体长间差异显著,其在各个生长阶段均摄食鱼类和虾类,随着体长增加,饵料中鱼类占比逐渐上升,而虾类占比在下降,体长≥130 mm群体的摄食习性从摄食虾类和鱼类转变为以鱼类为主,推测摄食转变体长节点为130 mm。随着消费者体长的增加,消耗的资源种类越来越多(Mascaró et al, 2001)。本研究发现,较大个体的日本金线鱼摄食的饵料种类增多,摄食饵料质量也较大,推测原因是随着个体生长发育,其活动能力和摄食能力增强,对饵料的种类和大小的要求发生变化。这一现象符合Gerking (1994)提出的“最佳摄食理论”,即随着个体不断长大,捕食者会尽可能捕食较大的饵料生物以获得更大的能量,同时也有利于减少不同大小个体对优势饵料的竞争。
3.2 同位素特征值和营养级研究表明,鱼类食性会随生长发育发生改变,δ13C是食物来源的良好追踪指标(Peterson et al, 1987; 鹿志创等, 2016)。本研究中,日本金线鱼体长与δ13C呈显著正相关,说明营养来源随生长发生改变;δ13C极差为2.86‰,表明其基础食物来源广泛;采用每3.4‰的氮同位素富集值为1个营养级,日本金线鱼δ15N极差为4.23‰,营养级跨度大于1个营养级,表明个体间的摄食差异较大。
营养级是反映捕食者在食物链中所处的层次,是确定鱼类摄食关系及在海洋食物网中所处功能位置的重要指示(薛莹, 2005)。δ15N是确定生物营养位置的示踪物(Post, 2002),本研究日本金线鱼体长与δ15N呈极显著正相关,说明营养级随体长增加而增加,营养级范围为3.21~4.46,平均值为3.97±0.25,表明其为高级肉食性动物,属于北部湾食物网的中高营养级鱼种,同时,在北部湾生态系统中又是其他高营养级鱼种的饵料生物,可见日本金线鱼在该生态系统中发挥重要作用(颜云榕, 2010)。但本研究中日本金线鱼的平均营养级略高于颜云榕(2010)测得同海域的结果(3.5),推测由于底层环境受到破坏,导致日本金线鱼的饵料组成发生变化,从主要摄食低营养层次的饵料(甲壳类)转为摄食高营养层次的生物(鱼类),从而导致营养级差异;同时,高于卢伙胜等(2009)估算雷州湾日本金线鱼营养级为2.7~3.2,平均值为3.1,这可能与基线生物和富集度有关,因为选取不同的基线生物和富集度,均会导致估算的营养级产生差异(He et al, 2019)。而卢伙胜等(2009)选取文昌鱼(Branchiostoma belcheri)为基线生物,富集度为2.5‰,本研究与之有明显区别。另外,与采集的研究样品数量和个体大小不同也有关系,一般鱼类营养级随个体生长而增大,本研究的样品个体大小范围覆盖较全,且采集到较大个体的样品,因此,总体营养级较高;本研究中日本金线鱼平均营养级略低于FishBase数据库所收录的结果(4.1),这可能是因为不同海区的日本金线鱼摄食的饵料也不同,这是导致营养级差异的原因之一。本研究结果相对卢伙胜等(2009)和颜云榕(2010)研究结果有所升高,与孙典荣(2008)的研究结果相近,推测可能是日本金线鱼资源虽大幅度下降,但近年来加大对渔业资源的保护产生一定的效果,种群个体大小仍比较大,计算的相应营养级也比较高。
3.3 生态位宽度鱼类摄食生态位宽度大小反映鱼类摄食特化程度的高低,生态位宽度大,表明饵料种类越多;反之,摄食饵料种类越少(薛莹, 2005; 陶雅晋等, 2017)。鱼类摄食生态位宽度常用多样性指数(H')和均匀度指数(J')表示(Krebs, 1989)。本研究中,日本金线鱼在秋季摄食的饵料种类最多,H'和J'也最高,故在秋季的摄食生态位宽度最大。冬季摄食饵料种类数量较多,但生态位宽度最低,推测是由于冬季摄食大量中国毛虾,其质量低、数量多,对计算结果造成一定的误差。摄食饵料种类随着日本金线鱼生长而增多,H'和J'随体长呈增加趋势,体长≥160 mm群体的生态位宽度最大,推断日本金线鱼的食物多样性随个体生长而增加,食性向广食性转变。
胃含物计算得到的H'和J'表示日本金线鱼被捕捞时的摄食生态位宽度,易受到近期摄食饵料种类质量和数量的影响,而碳氮稳定同位素可分析其生活史的营养生态位(Sherwood et al, 2005)。春冬季北部湾日本金线鱼的碳稳定同位素极差CR小于夏秋季,表明春冬季基础食物来源多样性小于夏秋季,但夏季摄食饵料种类偏少,可能是日本金线鱼本身摄食偏好所致;同时,春夏季的氮稳定同位素极差NR大于夏秋季,表明饵料中的主要营养来源跨度高于夏秋季,与优势饵料的季节变化基本一致。核心生态位SEA在4个季节虽有不同程度的重叠,但总生态位TA存在明显季节差异,北部湾日本金线鱼的生态位差异说明对饵料生物资源既存在一定的相似,也存在特定的差异,这可能与不同季节的饵料组成有一定的关系,有利于缓解该鱼种对优势饵料的季节性压力。
另外,本研究中日本金线鱼不同体长组的CR随个体生长总体呈上升趋势,表明其食物来源多样性随着生长而增加;NR在体长 > 130 mm后呈下降趋势,说明个体生长到一定阶段后,群体平均营养层次比较集中;不同大小群体的SEA重叠率较高,但也存在一定分离,表明不同生长阶段的日本金线鱼群体间存在明显的食物竞争,但也通过生态位的特异性分化,减轻种内竞争,这与胃含物分析结果一致。营养生态位差异能减轻不同个体间对优势饵料的竞争(魏秀锦等, 2019)。不同大小的群体间的TA存在明显差异,这也有利于减轻种内竞争压力,与日本金线鱼摄食优势饵料种类会随着个体变化而变化一致。
ACHARYA P, JAISWAR A K, PALANISWAMY R, et al. A study on food and feeding habits of Nemipterus japonicus (Bloch) off Bombay coast. Journal of the Indian Fisheries Association, 1994, 24: 73-80 |
CHEN D G, ZHANG M Z. Marine fishes of China. Qingdao: China Ocean University Press, 2015 [陈大刚, 张美昭. 中国海洋鱼类. 青岛: 中国海洋大学出版社, 2015]
|
CHEN Z C, LIU J X. Economic fish in South China Sea. Guangzhou: Guangdong Science and Technology Press, 1982 [陈再超, 刘继兴. 南海经济鱼类. 广州: 广东科技出版社, 1982]
|
CLARKE K R, GORLEY R N. PRIMER v5: User manual/ tutorial. Plymouth, UK: PRIMER-E Limited, 2001
|
DENG Y J, YI M R, LI B, et al. Biological characteristics and inter-annual changes of Saurida tumbil in spring in the Beibu Gulf, South China Sea. Progress in Fishery Sciences, 2021, 42(2): 36-44 [邓裕坚, 易木荣, 李波, 等. 北部湾春季多齿蛇鲻生物学特征及其年际变化. 渔业科学进展, 2021, 42(2): 36-44 DOI:10.19663/j.issn2095-9869.20191212002] |
DOU S Z. Feeding ecology of fish—A critical review on theories, methods and their application. Oceanologia et Limnologia Sinica, 1996, 27(5): 556-561 [窦硕增. 鱼类摄食生态研究的理论及方法. 海洋与湖沼, 1996, 27(5): 556-561] |
GERKING S D. Feeding ecology of fish. San Diego: Academic Press, 1994
|
HE X B, ZHU D W, ZHAO C X, et al. Feeding habit of Asian moon scallop (Amusium pleuronectes) and as an isotopic baseline indicator in the Beibu Gulf, South China Sea. Journal of Shellfish Research, 2019, 38(2): 245-252 DOI:10.2983/035.038.0204 |
HESSLEIN R H, CAPEL M J, FOX D E, et al. Stable isotopes of sulfur, carbon, and nitrogen as indicators of trophic level and fish migration in the Lower Mackenzie River Basin, Canada. Canadian Journal of Fisheries and Aquatic Sciences, 1991, 48(11): 2258-2265 DOI:10.1139/f91-265 |
HYSLOP E J. Stomach contents analysis—A review of methods and their application. Journal of Fish Biology, 1980, 17(4): 411-429 DOI:10.1111/j.1095-8649.1980.tb02775.x |
KREBS C J. Ecological methodology. New York: Harper Collins Publishers, 1989
|
LAYMAN C A, ARRINGTON D A, MONTANA G G, et al. Can stable isotope ratios provide for community-wide measures of trophic structure?. Ecology, 2007, 88(1): 42-48 DOI:10.1890/0012-9658(2007)88[42:CSIRPF]2.0.CO;2 |
LI K J, QIU Y S, WANG Y Z. Influence of natural environment variation on fishery resources in Beibu Gulf. South China Fisheries Science, 2007, 3(1): 7-13 [李寇军, 邱永松, 王跃中. 自然环境变动对北部湾渔业资源的影响. 南方水产, 2007, 3(1): 7-13] |
LU H S, OU F, YAN Y R, et al. Study on trophic level of main fishes in the Leizhou Bay with stable nitrogen isotope techniques. Acta Oceanologica Sinica, 2009, 31(3): 167-174 [卢伙胜, 欧帆, 颜云榕, 等. 应用氮稳定同位素技术对雷州湾海域主要鱼类营养级的研究. 海洋学报, 2009, 31(3): 167-174] |
LU Z C, TIAN J S, WANG Z H, et al. Using stable isotope technique to study feeding habits of the finless porpoise (Neophocaena asiaeorientalis ssp. sunameri). Acta Ecologica Sinica, 2016, 36(1): 69-76 [鹿志创, 田甲申, 王召会, 等. 应用碳氮稳定同位素技术研究江豚(Neophocaena asiaeorientalis ssp. sunameri)食性. 生态学报, 2016, 36(1): 69-76] |
MANOJKUMAR P P, PAVITHRAN P P, RAMACHANDRAN N P. Food and feeding habits of Nemipterus japonicus (Bloch) from Malabar Coast, Kerala. Indian Journal of Fisheries, 2015, 62(1): 64-69 |
MARSHALL S, ELLIOTT M. A comparison of univariate and multivariate numerical and graphical techniques for determining inter-and intraspecific feeding relationships in estuarine fish. Journal of Fish Biology, 1997, 51(3): 526-545 DOI:10.1111/j.1095-8649.1997.tb01510.x |
MASCARÓ M, SEED R. Foraging behavior of juvenile Carcinus maenas (L.) and Cancer pagurus (L.). Marine Biology, 2001, 139(6): 1135-1145 DOI:10.1007/s002270100677 |
NETTELY T, RAJAEE A H, DENIL N A, et al. Reproductive biology of Nemipterus japonicus (Bloch, 1791) from the coastal waters of Bintulu (South China Sea), Sarawak, Malaysia. Journal of Environmental Biology, 2016, 37(4): 715-724 |
PETERSON B J, FRY B. Stable isotopes in ecosystem studies. Annual Review of Ecology and Systematics, 1987, 18(1): 293-320 DOI:10.1146/annurev.es.18.110187.001453 |
POST D M. Using stable isotopes to estimate trophic position: Models, methods, and assumptions. Ecology, 2002, 83(3): 703-718 DOI:10.1890/0012-9658(2002)083[0703:USITET]2.0.CO;2 |
QIU Y S, ZENG X G, CHEN T, et al. Fishery resources and fishery management in the South China Sea. Beijing: China Taxation Publishing House, 2008 [邱永松, 曾晓光, 陈涛, 等. 南海渔业资源与渔业管理. 北京: 中国税务出版社, 2008]
|
RAJE S G. Observations on the biology of Nemipterus japonicus (Bloch) from Veraval. Indian Journal of Fisheries, 2002, 49(4): 433-440 |
SCHAFER L N, PLATELL M E, VALESINI F J, et al. Comparisons between the influence of habitat type, season and body size on the dietary compositions of fish species in nearshore marine waters. Journal of Experimental Marine Biology and Ecology, 2002, 278(1): 67-92 DOI:10.1016/S0022-0981(02)00337-4 |
SEYFABADI J. Age determination and feeding habits of Nemipterus japonicus (Bloch, 1791) in the Northern Oman Sea. Iranian Journal of Fisheries Sciences, 2013, 12(2): 248-264 |
SHERWOOD G D, ROSE A G. Stable isotope analysis of some representative fish and invertebrates of the Newfoundland and Labrador continental shelf food web. Estuarine, Coastal and Shelf Science, 2005, 63(4): 537-549 DOI:10.1016/j.ecss.2004.12.010 |
SONG H T, YU C G, XUE L J, et al. Economic shrimps and crabs of East China Sea. Beijing: Maritime Press, 2006 [宋海棠, 俞存根, 薛利建, 等. 东海经济虾蟹类. 北京: 海洋出版社, 2006]
|
SU L, CHEN Z Z, ZHANG K, et al. Establishment of quality status evaluation system of fishery resources in Beibu Gulf based on bottom trawl survey data. Journal of Guangdong Ocean University, 2021, 41(1): 10-16 [粟丽, 陈作志, 张魁, 等. 基于底拖网调查数据的渔业资源质量状况评价体系构建——以北部湾为例. 广东海洋大学学报, 2021, 41(1): 10-16] |
SU X, LI Y D, HE X B, et al. Feeding habits and ontogenetic diet shifts of mackerel tuna (Euthynnus affinis) in the Beibu Gulf, South China Sea. Progress in Fishery Sciences, 2015, 36(4): 65-72 [宿鑫, 李永东, 何雄波, 等. 北部湾鲔(Euthynnus affinis)的摄食习性及其随生长发育的变化. 渔业科学进展, 2015, 36(4): 65-72] |
SUN D R. A study on fishery resources and sustainable fishery development in the Beibu Bay. Masterxs Thesis of Ocean University of China, 2008 [孙典荣. 北部湾渔业资源与渔业可持续发展研究. 中国海洋大学硕士研究生学位论文, 2008]
|
TAO Y J, MO M, HE X B, et al. Feeding habits and ontogenetic diet shifts of yellowfin tuna (Thunnus albacores) in the South China Sea. Progress in Fishery Sciences, 2017, 38(4): 1-10 [陶雅晋, 莫檬, 何雄波, 等. 南海黄鳍金枪鱼(Thunnus albacores)摄食习性及其随生长发育的变化. 渔业科学进展, 2017, 38(4): 1-10] |
TONNIE N, HENA M, IDRIS M H, et al. Food and feeding habits of Nemipterus japonicus and Nemipterus peronii from coastal water of Bintulu, Sarawak, South China Sea. Journal of Environmental Biology, 2018, 39(5): 857-864 |
VANDER ZANDEN J M, JOSEPH B R. Variation in δ15N and δ13C trophic fractionation: Implications for aquatic food web studies. Limnology and Oceanography, 2001, 46(8): 2061-2066 DOI:10.4319/lo.2001.46.8.2061 |
WANG YZ, YUAN WW. Changes of demersal trawl fishery resources in northern South China Sea as revealed by demersal trawling. South China Fisheries Science, 2008, 4(2): 26-33 [王跃中, 袁蔚文. 南海北部底拖网渔业资源的数量变动. 南方水产, 2008, 4(2): 26-33] |
WEI X J, ZHANG B, SHAN X J, et al. Feeding habits of small yellow croaker Larimichthys polyactis in the Bohai Sea. Journal of Fishery Sciences of China, 2018, 25(6): 1289-1298 [魏秀锦, 张波, 单秀娟, 等. 渤海小黄鱼摄食习性. 中国水产科学, 2018, 25(6): 1289-1298] |
WEI X J, ZHANG B, SHAN X J, et al. Trophic levels and feeding habits of silver pomfret Pampus argenteus in the Bohai Sea. Journal of Fishery Sciences of China, 2019, 26(5): 904-913 [魏秀锦, 张波, 单秀娟, 等. 渤海银鲳的营养级及摄食习性. 中国水产科学, 2019, 26(5): 904-913] |
WEITKAMP L A, STURDEVANT M V. Food habits and marine survival of juvenile Chinook and coho salmon from marine waters of Southeast Alaska. Fisheries Oceanography, 2008, 17(5): 380-395 |
XU L L, XUE Y, XU B D, et al. Feeding ecology of Hexagrammos otakii in Haizhou Bay. Journal of Fishery Sciences of China, 2018, 25(3): 608-620 [许莉莉, 薛莹, 徐宾铎, 等. 海州湾大泷六线鱼摄食生态研究. 中国水产科学, 2018, 25(3): 608-620] |
XUE Y. Studies on the feeding ecology of dominant fishes and food web of fishes in the central and southern Yellow Sea. Doctoral Dissertation of Ocean University of China, 2005 [薛莹. 黄海中南部主要鱼种摄食生态和鱼类食物网研究. 中国海洋大学博士研究生学位论文, 2005]
|
YAN L P, LI J S, SHEN D G, et al. Variations in diet composition and feeding intensity of small yellow croaker Larimichthys polyactis Bleeker in the southern Yellow Sea and northern East China Sea. Marine Fisheries, 2006, 28(2): 117-123 [严利平, 李建生, 沈德刚, 等. 黄海南部、东海北部小黄鱼饵料组成和摄食强度的变化. 海洋渔业, 2006, 28(2): 117-123] |
YAN Y R, LU H S, JIN X S. Marine fish feeding ecology and food web: Progress and perspectives. Journal of Fisheries of China, 2011, 35(1): 145-153 [颜云榕, 卢伙胜, 金显仕. 海洋鱼类摄食生态与食物网研究进展. 水产学报, 2011, 35(1): 145-153] |
YAN Y R. Feeding ecology and food relations of the main fishes in the Beibu Gulf, South China Sea. Doctoral Dissertation of Institute of Oceanology of the Chinese Academy of Sciences, 2010 [颜云榕. 北部湾主要鱼类摄食生态及食物关系的研究. 中国科学院研究生院(海洋研究所)博士研究生学位论文, 2010]
|
ZAR J H. Biostatistical analysis. Pearson Education India, 1999
|
ZHANG B. Diet composition and ontogenetic variation in feeding habits of Cleithenes herzensteini in central Yellow Sea. Chinese Journal of Applied Ecology, 2007, 18(8): 1849-1854 [张波. 黄海中部高眼鲽的摄食及随体长的变化. 应用生态学报, 2007, 18(8): 1849-1854] |




 虎鱼Trypauchen vagina
虎鱼Trypauchen vagina