2. 大洋渔业资源可持续开发教育部重点实验室 国家远洋渔业工程技术研究中心 农业农村部大洋渔业开发重点实验室 农业农村部大洋渔业资源环境科学观测实验站 上海 201306
2. Ministry of Education Key Laboratory of Sustainable Exploitation of Oceanic Fisheries Resources; National Engineering Research Center for Oceanic Fisheries; Key Laboratory of Oceanic Fisheries Exploration, Ministry of Agriculture and Rural Affairs; Scientific Observing and Experimental Station of Oceanic Fishery Resources, Ministry of Agriculture and Rural Affairs, Shanghai 201306, China
生物体因环境的不同而产生表型变化是一种普遍现象(Scharnweber, 2020),对生物体的个体发育研究有助于充分认识生物体结构的形态变化规律,从而了解生物体结构的功能性与形态间的相关关系及生物体的生活环境变化。几何形态测量学(geometric morphometrics)是研究生物体形态变异的重要分析方法,能够很好地描述生物体的几何外形轮廓(白明等, 2007; 张申增等, 2020),被广泛应用于生物个体发育研究中。目前,针对鱼类、甲壳类和头足类等重要渔业资源物种的个体发育变化研究较多,Kouttouki等(2006)研究发现,尖吻重牙鲷(Diplodus puntazzo)的鳍、尾柄和腹侧部形态变化较大,为主要发育部位。在蟹类中,雄性的蟹螯会产生特殊的拱形,用来吸引异性增加个体交配的机会(Claverie et al, 2010)。Jones等(2019)分析发现,成熟期巴塔哥尼亚枪乌贼(Doryteuthis gahi)有着更大的鳍和更细长的胴体,这种体型变化与游泳能力的增强相关。因此,基于几何形态测量法研究生物体形态的个体发育可以进一步加强对物种生活史过程的了解,为资源管理提供参考。
剑尖枪乌贼(Uroteuthis edulis)属枪形目(Teuthoidea)、闭眼亚目(Myopsida)、枪乌贼科(Loliginidae)、尾枪乌贼属(Uroteuthis),是典型的近海暖温性头足类,体型较大,广泛分布于西太平洋海域(董正之, 1988; 陈新军等, 2009),主要分布于菲律宾群岛、日本南部海域、中国南海和东海等海域(Jereb et al, 2010)。20世纪50年代末,各国开展了针对该物种的商业捕捞。近些年来,我国东海海域年产量范围在2×104~4×104 t,是我国重要的经济头足类资源之一(李楠等, 2020a)。角质颚(beak)是头足类的摄食器官,具有形态结构稳定、耐腐蚀等特点,能有效记录头足类在不同生活史阶段的生态信息(Clarke, 1962),因此,被广泛应用于年龄生长(刘必林等, 2014)、摄食生态(Hobson et al, 2006; Fang et al, 2016)、种类鉴定(Fang et al, 2018; 马迪等, 2018; 瞿俊跃等, 2018)和种群划分(陈芃等, 2015; 方舟, 2016; 郑芯瑜等, 2021)等研究。剑尖枪乌贼在不同发育阶段的摄食习性不同,其在发育过程中的洄游特征导致生活环境的变化(李楠等, 2020a、b),因而,个体的食物可利用性所发生的改变也会直接影响角质颚形态。同时,环境的变化也会间接影响角质颚形态,即表型可塑性(phenotypic plasticity)。但目前对上述因素对角质颚形态所产生的影响及规律仍不清楚。
本研究利用几何形态测量法(Bookstein, 1991),并结合剑尖枪乌贼不同发育阶段的生活习性、摄食差异等,分析该物种不同发育阶段角质颚的形态变化及趋势,有助于揭示其可能的生态作用,进而了解剑尖枪乌贼的生活史,为其后续的资源管理提供一定的科学依据。
1 材料与方法 1.1 样本来源剑尖枪乌贼样本采样时间为2018年9月—2019年3月,作业渔船为“浙岭渔23860号”,随机采样,采样海域的范围为123°E~127°E、28°N~31.5°N的中国东海海域,样本经冷冻保存后运回实验室。在完成基础生物学测定后,用镊子取出位于头部口球内的角质颚,清洗后使用游标卡尺分别测量上、下颚的头盖长、脊突长、喙长、喙宽、侧壁长、翼长共12个形态参数(高小迪等, 2021),测量完成后放入盛有75%乙醇溶液的玻璃瓶中,编号后保存备用。
东海海域剑尖枪乌贼的生命周期约为270 d (Natsukari et al, 1988),140 d为其最早成熟的日龄,240 d为完全成熟的日龄(Wang et al, 2010),因此,将其划分为3个阶段:未成熟期A,即个体日龄小于140 d;亚成熟期B,即个体日龄为140~240 d;成熟期C,即个体日龄大于240 d。通过李楠等(2021)对东海剑尖枪乌贼的日龄研究,对近4年的样本进行年龄估算,共选出246个样本,其中,230对角质颚样本用于形态研究,样本信息见表 1,基本形态信息见表 2。
|
|
表 1 剑尖枪乌贼不同发育阶段的样本信息 Tab.1 Sample information of U. edulis at different ontogenetic stages |
|
|
表 2 剑尖枪乌贼不同发育阶段的角质颚形态参数 Tab.2 Beak morphologic parameters of U. edulis at different ontogenetic stages |
将摄影棚安装好,调节补光灯亮度并放入比例卡尺。使用三脚架固定Nikon D750相机(日本),拍摄镜头为Micro 105 mm f/2.8。调试好位置并准备好需要拍摄的角质颚样本,将其逐一从玻璃瓶中取出,摆放好位置后立即拍摄,所获取的标准图像用于后续地标点的建立。图像采集时保持三脚架、相机、样本及相机对焦位置在同一水平线上。为了方便软件的图像数据读取,保证后续形态分析的响应效率,对图像进行批处理,以确保图像中角质颚边缘的清晰度。
1.3 几何形态测量分析 1.3.1 地标点的建立与提取地标点在形态分析中一般分为3种类型(Bookstein, 1991):Ⅰ型地标点,指不同组织间的交点;Ⅱ型地标点,结构中的凹凸点;Ⅲ型地标点,结构中的极值点。研究发现,剑尖枪乌贼的角质颚样本为50~300对时,27个地标点可以更好地呈现其形态变化(王超等, 2021),依据该研究结果确定了本研究中上、下颚的地标点标定方案(图 1),上、下颚各地标点的定义和类型的分类见表 3。然后,使用R语言Geomorph包中的“readland.tps”函数对角质颚图像建立地标点(Adams et al, 2013a),此过程重复2次,以避免测量误差(Viscosi et al, 2011),获取地标点坐标数据取平均值后用于下一步形态分析。
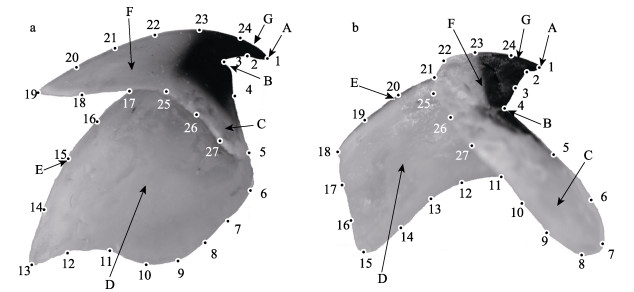
|
图 1 剑尖枪乌贼角质颚形态描述和地标点示意图 Fig.1 Beak morphology description and landmark positions of squid U. edulis a:上颚;b:下颚A:喙顶点;B:颚角;C:翼部;D;侧壁;E:脊突;F:头盖;G:喙部。数字代表地标点编号,详见表 3。 a: Upper beak; b: Lower beak. A: Rostral tip; B: Jaw angle; C: Wing; D: Lateral wall; E: Crest; F: Hood; G: Rostrum. The number represents the landmark number detailed inTab.3. |
|
|
表 3 剑尖枪乌贼角质颚形态的地标点类型和定义 Tab.3 Landmark types and definition of beak morphology of squid U. edulis |
使用广义普鲁克提斯分析(generalized procrustes analysis, GPA)对所有样本的地标点进行旋转、平移和缩放,来消除由非形态变化产生的影响(Rohlf et al, 1990)。所有地标点到质心距离的平方和开方后的值被定义为质心大小(centroid size),质心大小用来表示生物体结构的大小(陈新军等, 2017),因此,本研究利用基于角质颚形态的地标点数据获得质心大小作为角质颚的大小指标。通过对角质颚的质心大小分析,来比较不同发育阶段剑尖枪乌贼角质颚大小变化。基于形态变量进行多元方差分析(multivariate analysis of variance, MANOVA),用来分析角质颚在不同发育阶段和性别间其形态的差异显著性(Adams et al, 2018)。利用地标数据进行主成分分析(principal component analysis, PCA),降低数据空间的维数,去除多余的形态信息,对不同发育阶段的角质颚形态差异进行比较(Dryden et al, 1998)。使用薄板样条变形网格(thin-plate spline, TPS)可视化不同发育阶段角质颚的形态变化(Claude, 2008)。最后,利用多元回归模型(multivariate regression)分析角质颚形态的多元变化模式,即通过角质颚形态与质心大小之间的关系来比较不同发育阶段角质颚的异速生长模式(Adams et al, 2010、2013b)。
以上所有研究均采用R4.0.5“geomorph”包进行分析(Adams et al, 2013a)。
2 结果 2.1 角质颚的地标点叠印与平均形将所有角质颚上颚和下颚的数字化地标形态进行广义普鲁克提斯分析,得到所有样本地标点的叠印数据,并计算所有样本的平均形(图 2)。所有地标点的叠印效果良好,未出现明显的偏移点,地标点叠印后的标准化数据用于后续数据分析。图 2反映了剑尖枪乌贼角质颚的平均形态,由此可见,上颚:喙部顶点尖锐,喙与翼部的夹角较小,头盖较长,头盖顶部有明显的凸点,侧壁下部有明显的凹陷;下颚:喙部顶点也较尖,喙与翼部夹角较大;头盖较短。
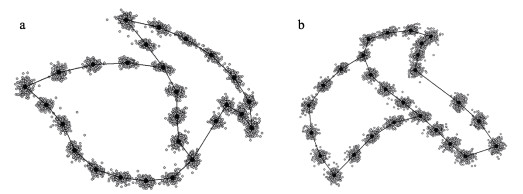
|
图 2 剑尖枪乌贼角质颚所有地标点叠印和平均形 Fig.2 All landmarks superimposed and mean shape of the upper beak and lower beak of squid U. edulis a:上颚;b:下颚。小的灰色点为所有地标点,大的黑色点为平均地标点。 a: Upper beak; b: Lower beak. Small grey dots for all landmarks, big black dots for mean landmark. |
几何形态测量法能够有效去除由于个体大小对形态所造成的影响,而专注于其几何形态变化本身(Cardini et al, 2015)。随着个体发育,剑尖枪乌贼角质颚不断增大,上颚质心大小略大于下颚,在不同发育阶段雌性和雄性的角质颚均出现异常值。对于上、下颚,除了上颚中未成熟阶段的雌、雄个体质心大小差异较小,其余发育阶段雌性的质心大小要大于雄性,但质心大小的范围相差较小(图 3)。
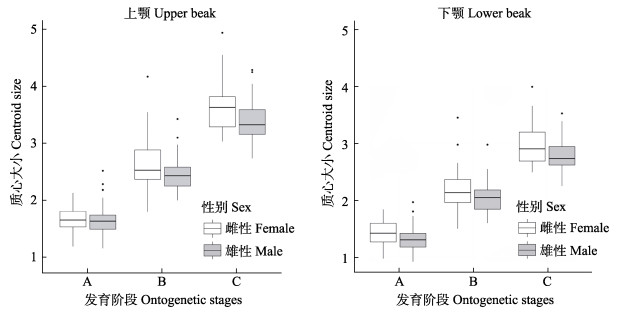
|
图 3 剑尖枪乌贼不同发育阶段角质颚质心大小变化 Fig.3 Beak centroid size variation in different ontogenetic stages of squid U. edulis. A:未成熟期;B:亚成熟期;C:成熟期。黑色点为异常值。 A: Immature; B: Maturing; C: Mature. Black point is an abnormal value. |
本研究以大小、发育阶段和性别作为多元方差分析的因子,分析剑尖枪乌贼角质颚形态在不同性别和发育阶段是否存在差异(表 4)。分析发现,不同发育阶段的上、下颚形态存在极显著差异(P < 0.01),这可能是由薄板样条变形网格观察到的未成熟和亚成熟期上、下颚更窄的翼部,成熟期上、下颚更宽的翼部,下颚更尖的喙部所导致(图 6)。上、下颚在不同性别间差异不显著(P > 0.05),即没有发现性二态性现象。上、下颚在大小和发育阶段,2个因子的交互作用均存在显著差异(P < 0.01),下颚大小和性别2个因子间的交互作用存在差异(P < 0.05),其余因子间没有出现交互作用。由于上、下颚形态不存在性二态性现象,因此,后续角质颚形态的生长变化研究不考虑雌雄之间的差异。
|
|
表 4 剑尖枪乌贼在不同发育阶段角质颚形态的多元方差分析 Tab.4 MANOVA of the beak morphology in different developmental stages of squid U. edulis |
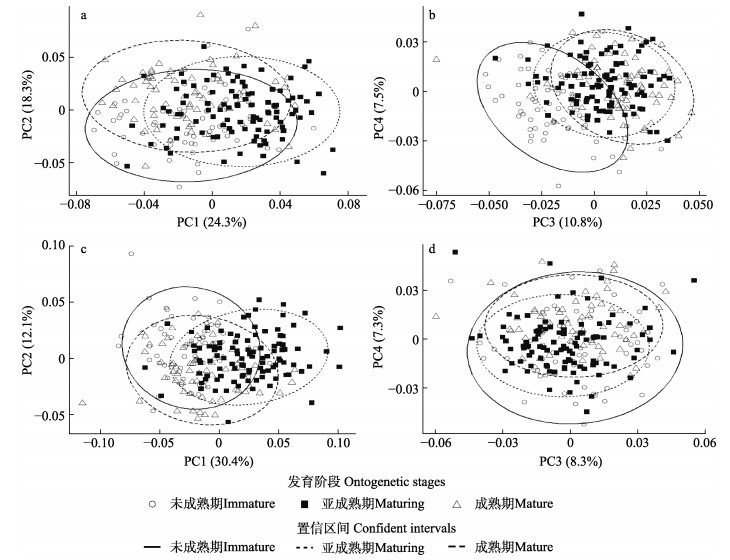
上颚前4个主成分的变化贡献率占总贡献率的60.9%,下颚前4个主成分的变化贡献率占总贡献率的58.8%(图 4),上颚和下颚前4个主成分的贡献率均接近或超过60%,因此,可以认为这4个主成分能概括不同发育阶段角质颚的形态变化。上颚和下颚的主成分散点图能较好区分不同发育阶段的个体,部分空间位置有一定的重叠区域(图 5)。
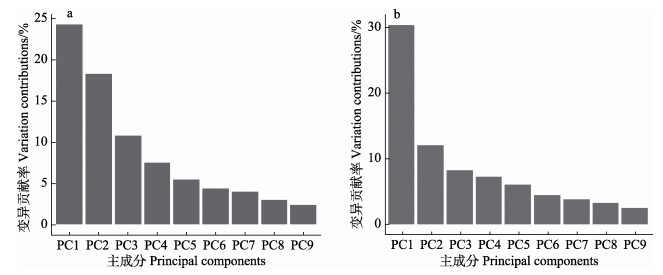
|
图 4 剑尖枪乌贼角质颚主成分分析的主成分解释变化的占比 Fig.4 The proportion of the principal component interpretation variation in the principal component analysis of the beak of U. edulis a:上颚;b:下颚 a: Upper beak; b: Lower beak |
|
图 5 剑尖枪乌贼角质颚主成分分析 Fig.5 The principal component analysis for beak of U. edulis a:上颚PC1与PC2;b:上颚PC3与PC4;c:下颚PC1与PC2;d:下颚PC3与PC4。椭圆表示95%置信区间。 a: PC1 and PC2 of the upper beak; b: PC3 and PC4 of the upper beak; c: PC1 and PC2 of the lower beak; d: PC3 and PC4 of the lower beak. Ellipses represent 95% confident intervals. |
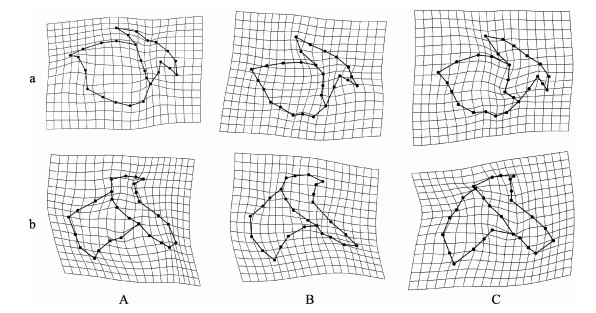
显示,不同发育阶段剑尖枪乌贼的角质颚形态变化位置有所不同(图 6)。在未成熟期,上颚形态变化主要表现在颚角(地标点3)、翼部(地标点4、5、26和27)、头盖后部(地标点22)和侧壁的部分位置(地标点7、8、11和13),下颚形态变化主要体现在翼部(地标点6、7、8和9)和侧壁的部分位置(地标点12、15、18和19)。而在亚成熟期,上颚的形态变化位置有所变化,主要形态变化位置为喙部(地标点1、2和3),下颚则仍为翼部(地标点4和5),但形态变化的方向有所改变。在成熟期的个体,上颚的形态变化位置主要为头盖与侧壁连接位置(地标点25和26)和脊突(地标点16和17),下颚形态变化则主要集中在喙部(地标点1、2、4和24)、头盖后缘(地标点22)。
|
图 6 剑尖枪乌贼不同发育阶段角质颚的形态变化 Fig.6 Variation of beak morphology in different ontogenetic stages of U. edulis a:上颚;b:下颚。A:未成熟期;B:亚成熟期;C:成熟期 a: Upper beak; b: Lower beak. A: Immature; B: Maturing; C: Mature |
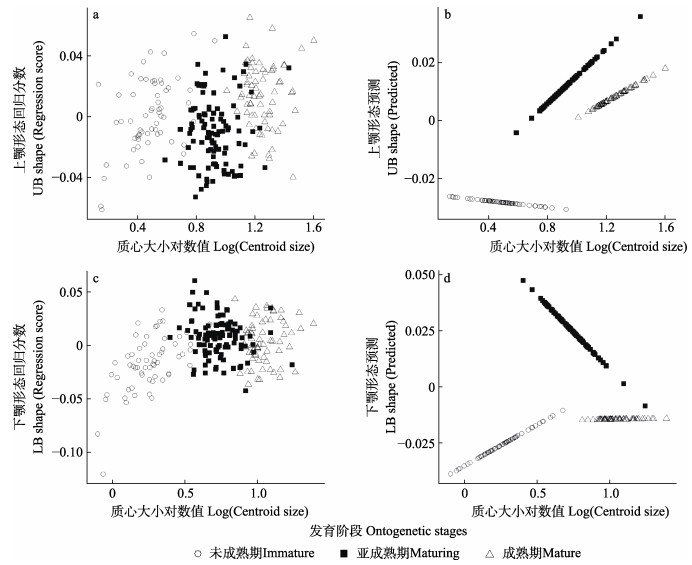
基于多元回归模型得出不同发育阶段角质颚的异速生长模式,下颚比上颚的形态回归散点更集中,不同发育阶段的角质颚大小差异显著,散点图分区明显(图 7)。上颚在未成熟期质心大小对数值与形态预测值为负相关关系,在亚成熟期和成熟期质心大小对数值与形态预测值为正相关关系(图 7b)。亚成熟期和成熟期的形态变化趋势相似,未成熟期的形态变化则有着相反的趋势且变化速率较慢,表明未成熟期形态变化程度相对较小(图 7b)。下颚未成熟期和成熟期质心大小对数值与形态预测值为负相关关系,亚成熟期为正相关关系(图 7d)。下颚在3个发育阶段的形态变化趋势均有较大差异,未成熟期和亚成熟期形态变化速率较快,成熟期较慢,表明下颚在未成熟期和亚成熟期形态变化程度较大,成熟期形态变化程度较小(图 7d)。因此,上、下颚在不同发育阶段具有明显的异速生长现象,并且上颚和下颚的生长模式有一定差异。
|
图 7 剑尖枪乌贼角质颚形态回归分数和预测值与质心大小对数值的相关关系 Fig.7 Correlation of the regression scores of beak morphology and predicted values versus log(centroid size) of U. edulis a、b:上颚;c、d:下颚。图中斜率的大小代表角质颚形态变化的速率。 a and b: Upper beak; c and d: Lower beak. The magnitude of the slope in the diagram represents the rate of the beak morphology variation. |
从本研究结果来看,地标点法对于分析不同发育阶段剑尖枪乌贼角质颚的形态变化模式十分有效,能揭示角质颚的发育变化规律。Ⅰ型地标点是具有高同源性的不同组织间的交点,是选取地标点最常用的类型,Ⅱ型地标点为结构的凹凸点,Ⅲ型地标点为结构的极值点(Bookstein, 1991)。本研究采用了3种类型共27个地标点,通过Ⅱ型和Ⅲ型地标点与Ⅰ型地标点的结合使用可以更加充分地表示角质颚形态,有效捕捉角质颚形态的细微变化(白明等, 2007)。
本研究采用几何形态测量学中的地标点法,对不同发育阶段的剑尖枪乌贼角质颚大小、形态和异速生长模式进行分析。结果显示,剑尖枪乌贼不同发育阶段的角质颚大小和形态具有极显著差异(P < 0.01),多元回归分析表明上、下颚在不同发育阶段具有明显的异速生长现象。剑尖枪乌贼生长发育与栖息环境息息相关,并且其摄食习性随其生长发育的不同阶段而发生变化(Natsukari et al, 1991; 李楠等, 2020a),因此,剑尖枪乌贼在不同发育阶段角质颚的形态差异可能是其对摄食策略的响应。性别选择、生态差异等都可能会造成生物体雌雄个体大小和形态产生差异,不同性别间的生物个体生长过程中的形态分化被称为性二态性现象(Giri et al, 2002)。在头足类中,由于环境差异等因素,一些种类在不同种群间存在性二态性(胡贯宇等, 2016; 马迪等, 2018)。本研究发现,剑尖枪乌贼不同性别间的角质颚形态差异不显著(表 4),即角质颚形态未出现性二态性。可能是由于东海海域的剑尖枪乌贼雌雄个体生活海域差异较小,有着相似的海洋环境,食物可获得性和食物组成基本相似,因此,雌雄个体角质颚形态并未产生分化。剑尖枪乌贼雌性个体的角质颚大于雄性个体(图 3),该差异可能是由于雌性个体性成熟先于雄性,导致角质颚的生长速率不一致,与该种类的繁殖策略有关。
主成分分析结果显示,不同发育阶段的角质颚形态分区较为明显,椭圆面积较为接近,表明不同发育阶段角质颚形态存在一定差异,其形态多样性程度相近(图 5),这在多元方差分析结果中也有体现(表 3)。剑尖枪乌贼个体角质颚形态由未成熟至成熟期呈现渐变规律(图 6),上、下颚在发育过程中,其头盖、翼部和喙部均发生了较大的变化。角质颚位于头足类口球中(buccal mass),与角质颚相连的肌肉和其他组织用来控制其产生相对运动(方舟等, 2014a、b)。随着剑尖枪乌贼不断发育,由于其摄食食物的硬度和体积更大,这就需要更大的角质颚和更强劲的撕咬能力。控制角质颚运动的肌肉包括上颚肌、侧肌和下颚肌,上、下颚的头盖、脊突和翼部被这些肌肉包围(Kear, 1994),因此,可以认为,上、下颚头盖、脊突和翼部的增大有助于提高角质颚的咬合能力。由于东海海域剑尖枪乌贼性成熟后主要摄食鲭科(Scombrida)等鱼类的仔稚幼鱼(李楠等, 2020a),其在成熟期更加尖锐的上颚喙部有助于快速固定猎物,方便进食(高小迪等, 2021);角质颚的镶嵌模式为下颚嵌盖上颚(方舟等, 2014a),造成下颚变得迟钝的原因可能是暴露在外侧的下颚喙部产生了更大的磨损。
多元回归分析表明,上颚和下颚在不同生长发育阶段的形态变化规律略有不同(图 7)。其他头足类的角质颚上颚和下颚发生时间并不同步,这可能与在其胚胎发育早期的上下颚形成时间不同有关(Wakabayashi et al, 2005; Boletzky, 2007)。剑尖枪乌贼的摄食习性在不同发育阶段有所区别(李楠等, 2020a),摄食种类的差异可能导致角质颚形态的适应性变化和生长速率的变化,也直接导致角质颚的异速生长特征。除了角质颚内在的发生机制和摄食习性的差异因素外,外界环境也可能会对角质颚的生长产生影响。由于东海海域的剑尖枪乌贼受我国大陆沿岸流、黑潮及西南、东北季风的影响较大,其洄游范围较广,发育过程中的栖息环境多变(贾晓平等, 2004; Wang et al, 2013),因此,不同发育阶段角质颚形态所产生的变化,也是对不同时期海洋环境的适应性过程,这也是头足类表型可塑性的体现之一。
综上所述,剑尖枪乌贼在发育过程中,不同性别角质颚形态并不存在差异,而不同发育阶段的角质颚形态差异显著,随着其个体不断发育,角质颚形态呈渐变规律,同时,角质颚存在异速生长现象,可能与剑尖枪乌贼发育过程中摄食和环境变化有关。本研究结合摄食因素等分析了不同发育阶段角质颚的形态变化,后续研究还应该深入探讨角质颚发育过程中影响形态变化的遗传因素、环境因子等,为更全面了解头足类表型可塑性及其生态意义提供基础。
ADAMS D C, COLLYER M L. Multivariate phylogenetic comparative methods: Evaluations, comparisons, and recommendations. Systematic Biology, 2018, 67(1): 14-31 DOI:10.1093/sysbio/syx055 |
ADAMS D C, NISTRI A. Ontogenetic convergence and evolution of foot morphology in European cave salamanders (Family: Plethodontidae). BMC Evolutionary Biology, 2010, 10: 1-10 DOI:10.1186/1471-2148-10-1 |
ADAMS D C, OTAROLA-CASTILLO E. Geomorph: An r package for the collection and analysis of geometric morphometric shape data. Methods in Ecology and Evolution, 2013a, 4(4): 393-399 DOI:10.1111/2041-210X.12035 |
ADAMS D C, ROHLF F J, SLICE D E. A field comes of age: Geometric morphometrics in the 21st century. Hystrix, 2013b, 24: 7-14 |
BAI M, YANG X K. Application of geometric morphometrics in biological researches. Chinese Bulletin of Entomology, 2007, 44(1): 143-147 [白明, 杨星科. 几何形态测量法在生物形态学研究中的应用. 昆虫知识, 2007, 44(1): 143-147] |
BOLETZKY S. Origin of the lower jaw in cephalopods: A biting tissue. Paläontologische Zeitschrift, 2007, 81(3): 328-333 DOI:10.1007/BF02990182 |
BOOKSTEIN F L. Morphometric tools for landmark data: Geometry and biology. Cambridge University Press, Cambridge, 1991
|
CARDINI A, SEETAH K, BARKER G. How many specimens do I need? Sampling error in geometric morphometrics: Testing the sensitivity of means and variances in simple randomized selection experiments. Zoomorphology, 2015, 134(2): 149-163 DOI:10.1007/s00435-015-0253-z |
CHEN P, FANG Z, CHEN X J. Population identification of Ommastrephes bartramii based on beakxs external morphological characters. Marine Fisheries, 2015, 37(1): 1-9 [陈芃, 方舟, 陈新军. 基于角质颚外部形态学的柔鱼种群判别. 海洋渔业, 2015, 37(1): 1-9 DOI:10.13233/j.cnki.mar.fish.2015.01.001] |
CHEN X J, FANG Z, CHEN Y Y, et al. Application of geometric morphometrics in aquatic animals. Beijing: Science Press, 2017 [陈新军, 方舟, 陈洋洋, 等. 几何形态测量学在水生生物中的应用. 北京: 科学出版社, 2017]
|
CHEN X J, LIU B L, WANG Y G. Cephalopods of the world. Beijing: Ocean Press, 2009 [陈新军, 刘必林, 王尧耕. 世界头足类. 北京: 海洋出版社, 2009]
|
CLARKE M R. The identification of cephalopod "beaks" and the relationship between beak size and total body weight. Bulletin of the British Museum of Natural History, Zoology, 1962, 8: 419-480 |
CLAUDE J. Morphometrics with R. Springer, New York, 2008
|
CLAVERIE T, SMITH I P. Allometry and sexual dimorphism in the chela shape in the squat lobster Munida rugosa. Aquatic Biology, 2010, 8(2): 179-187 |
DONG Z Z. Fauna of China Mollusca Cephalopoda. Beijing: Science Press, 1988 [董正之. 中国动物志软体动物门头足纲. 北京: 科学出版社, 1988]
|
DRYDEN I L, MARDIA K V. Statistical shape analysis. Wiley, West Sussex, 1998
|
FANG Z, CHEN X J, LU H J, et al. Progress of beak in cephalopod Ⅰ: Morphogenesis, biochemistry and growth. Marine Fisheries, 2014a, 36(1): 78-89 [方舟, 陈新军, 陆化杰, 等. 头足类角质颚研究进展Ⅰ——形态、结构与生长. 海洋渔业, 2014a, 36(1): 78-89 DOI:10.13233/j.cnki.mar.fish.2014.01.002] |
FANG Z, CHEN X J, LU H J, et al. Progress of beak in cephalopod Ⅱ: Movement, taxonomy and ecology. Marine Fisheries, 2014b, 36(2): 183-192 [方舟, 陈新军, 陆化杰, 等. 头足类角质颚研究进展Ⅱ——运动、分类与生态. 海洋渔业, 2014b, 36(2): 183-192 DOI:10.13233/j.cnki.mar.fish.2014.02.013] |
FANG Z, FAN J T, CHEN X J, et al. Beak identification of four dominant octopus species in the East China Sea based on traditional measurements and geometric morphometrics. Fisheries Science, 2018, 84(6): 975-985 DOI:10.1007/s12562-018-1235-0 |
FANG Z, THOMPSON K, JIN Y, et al. Preliminary analysis of beak stable isotopes (δ13C and δ15N) stock variation of neon flying squid, Ommastrephes bartramii, in the North Pacific Ocean. Fisheries Research, 2016, 177: 153-163 DOI:10.1016/j.fishres.2016.01.011 |
FANG Z. Fisheries ecology of neon flying squid Ommastrephes bartramii in North Pacific Ocean based on beak. Doctoral Dissertation of Shanghai Ocean University, 2016 [方舟. 基于角质颚的北太平洋柔鱼渔业生态学研究. 上海海洋大学博士研究生学位论文, 2016]
|
GAO X D, FANG Z, CHEN X J, et al. Variation in beak morphology of Dosidicus gigas in different waters of the eastern equatorial Pacific. Journal of Fisheries of China, [2021-05-28]. https://kns.cnki.net/kcms/detail/31.1283.s.20210528.1454.002.html [高小迪, 方舟, 陈新军, 等. 东太平洋赤道不同海域茎柔鱼角质颚形态差异. 水产学报, [2021-05-28]. https://kns.cnki.net/kcms/detail/31.1283.s.20210528.1454.002.html]
|
GIRI F, COLLINS P A. A geometric morphometric analysis of two sympatric species of the family Aeglidae (Crustacea, Decapoda, Anomura) from the La Plata Basin. Italian Journal of Zoology, 2002, 71(1): 85-88 |
HOBSON K A, CHEREL Y. Isotopic reconstruction of marine food webs using cephalopod beaks: New insight from captively raised Sepia officinalis. Canadian Journal of Zoology, 2006, 84(5): 766-770 DOI:10.1139/z06-049 |
HU G Y, CHEN X J, FANG Z. Effect of individual growth on beak morphometry of jumbo flying squid, Dosidicus gigas off the Peruvian exclusive economic zone. Journal of Fisheries of China, 2016, 40(1): 36-44 [胡贯宇, 陈新军, 方舟. 个体生长对秘鲁外海茎柔鱼角质颚形态变化的影响. 水产学报, 2016, 40(1): 36-44] |
JEREB P, ROPER C F E. Cephalopods of the world: An annotated and illustrated catalogue of cephalopod species known to date. Volume 2. Myopsid and Oegopsid squids: FAO Species Catalogue for Fishery Purposes. Rome, Italy: FAO, 2010
|
JIA X P, LI Y Z, LI C H, et al. Fishery ecological environment and resources in the EEZ and continental shelf of South China Sea. Beijing: Science Press, 2004 [贾晓平, 李永振, 李纯厚, 等. 南海专属经济区和大陆架渔业生态环境和渔业资源. 北京: 科学出版社, 2004]
|
JONES J B, PIERCE G J, SABORIDO-REY F, et al. Size-dependent change in body shape and its possible ecological role in the Patagonian squid (Doryteuthis gahi) in the Southwest Atlantic. Marine Biology, 2019, 166(5): 54 DOI:10.1007/s00227-019-3501-9 |
KEAR A J. Morphology and function of the mandibular muscles in some coleoid cephalopods. Journal of the Marine Biological Association of the United Kingdom, 1994, 74(4): 801-822 DOI:10.1017/S0025315400090068 |
KOUTTOUKI S, GEORGAKOPOULOU E, KASPIRIS P, et al. Shape ontogeny and variation in the sharpsnout seabream, Diplodus puntazzo (Cetti 1777). Aquaculture Research, 2006, 37(7): 655-663 DOI:10.1111/j.1365-2109.2006.01475.x |
LI N, FANG Z, CHEN X J. Fishery of swordtip squid Uroteuthis edulis: A review. Journal of Dalian Ocean university, 2020a, 35(4): 637-644 [李楠, 方舟, 陈新军. 剑尖枪乌贼渔业研究进展. 大连海洋大学学报, 2020a, 35(4): 637-644 DOI:10.16535/j.cnki.dlhyxb.2019-208] |
LI N, FANG Z, CHEN X J. Fisheries biology characteristics of Uroteuthis edulis of the northern East China Sea. Journal of Shanghai Ocean University, 2020b, 29(4): 622-631 [李楠, 方舟, 陈新军. 东海北部外海剑尖枪乌贼渔业生物学特征. 上海海洋大学学报, 2020b, 29(4): 622-631] |
LI N, YU J, FANG Z, et al. Age, growth and population structure of swordtip squid (Uroteuthis edulis) in the East China Sea based on statolith age information. Journal of Fisheries of China, 2021, 45(6): 887-898 [李楠, 俞骏, 方舟, 等. 基于耳石日龄信息的东海海域剑尖枪乌贼(Uroteuthis edulis) 种群结构及日龄生长研究. 水产学报, 2021, 45(6): 887-898] |
LIU B L, CHEN X J, FANG Z, et al. Study of age and growth of cephalopod using their beaks. Journal of Shanghai Ocean University, 2014, 23(6): 930-936 [刘必林, 陈新军, 方舟, 等. 利用角质颚研究头足类的年龄与生长. 上海海洋大学学报, 2014, 23(6): 930-936] |
MA D, JIN Y, CHEN P, et al. Species identification of Sepioidea in the East China Sea based on beak morphology. Journal of Shanghai Ocean University, 2018, 27(4): 594-602 [马迪, 金岳, 陈芃, 等. 基于角质颚形态的东海2种常见乌贼类的种类判别. 上海海洋大学学报, 2018, 27(4): 594-602] |
NATSUKARI Y, NAKANOSE T, ODA K. Age and growth of loliginid squid Photololigo edulis (Hoyle, 1885). Journal of Experimental Marine Biology and Ecology, 1988, 116(2): 177-190 DOI:10.1016/0022-0981(88)90054-8 |
NATSUKARI Y, TASHIRO M. Neritic squid resources and cuttlefish resources in Japan. Marine Behaviour and Physiology, 1991, 18(3): 149-226 DOI:10.1080/10236249109378785 |
QU J Y, LI J H, CHEN P, et al. The morphology and growth characteristics of beaks of European common cuttlefish (Sepia officinalis) in the coast of West Africa. Progress in Fishery Sciences, 2018, 39(2): 164-170 [瞿俊跃, 李建华, 陈芃, 等. 西非沿岸乌贼角质颚形态及生长特征. 渔业科学进展, 2018, 39(2): 164-170 DOI:10.19663/j.issn2095-9869.20170103002] |
ROHLF F J, SLICE D. Extensions of the procrustes method for the optimal superimposition of landmarks. Systematic Zoology, 1990, 39(1): 40-59 DOI:10.2307/2992207 |
SCHARNWEBER K. Morphological and trophic divergence of lake and stream minnows (Phoxinus phoxinus). Ecology and Evolution, 2020, 10(15): 8358-8367 DOI:10.1002/ece3.6543 |
VISCOSI V, CARDINI A. Leaf morphology, taxonomy and geometric morphometrics: A simplified protocol for beginners. PLoS One, 2011, 6(10): e25630 DOI:10.1371/journal.pone.0025630 |
WAKABAYASHI T, TSUCHIYA K, SEGAWA S. Morphological changes with growth in the paralarvae of the diamondback squid Thysanoteuthis rhombus Troschel, 1857. Phuket Marine Biological Center Research Bulletin, 2005, 66: 167-174 |
WANG C, FANG Z. A preliminary study on the quantitative of beak landmark of cephalopod: Uroteuthis edulis as a case. Chinese Journal of Zoology, 2021, 56(5): 756-769 [王超, 方舟. 头足类角质颚地标点定量初步研究: 以剑尖枪乌贼为例. 动物学杂志, 2021, 56(5): 756-769] |
WANG K Y, CHANG K Y, LIAO C H, et al. Growth strategies of the swordtip squid, Uroteuthis edulis, in response to environmental changes in the southern East China Sea: A cohort analysis. Bulletin of Marine Science, 2013, 89(3): 677-698 DOI:10.5343/bms.2012.1044 |
WANG K Y, LEE K T, LIAO C H. Age, growth and maturation of swordtip squid (Photololigo edulis) in the southern East China Sea. Journal of Marine Science and Technology- Taiwan, 2010, 18(1): 99-105 |
ZHANG S Z, MAI G M, CHEN Z J, et al. Performance of otolith landmarks on identifying fish species and stocks for two cultured Lutjanus spp. Journal of Guangdong Ocean University, 2020, 40(2): 35-43 [张申增, 麦广铭, 陈志劼, 等. 红鳍笛鲷和紫红笛鲷种类和群体的矢耳石地标点法识别. 广东海洋大学学报, 2020, 40(2): 35-43] |
ZHENG X Y, LIU B L, KONG X H, et al. Pattern of recognition beaks in Sthenoteuthis oualaniensis based on K-means dynamic clustering. Progress in Fishery Sciences, 2021, 42(4): 64-72 [郑芯瑜, 刘必林, 孔祥洪, 等. 基于K-means动态聚类的鸢乌贼角质颚模式识别. 渔业科学进展, 2021, 42(4): 64-72] |



