2. 中国水产科学研究院黄海水产研究所 农业农村部海洋渔业可持续发展重点实验室 青岛海洋科学与 技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 山东 青岛 266071;
3. 上海海洋大学 上海 201306;
4. 大连海洋大学 辽宁 大连 116023
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences; Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture and Rural Affairs; Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao, Shandong 266071, China;
3. Shanghai Ocean University, Shanghai 201306, China;
4. Dalian Ocean University, Dalian, Liaoning 116023, China
凡纳滨对虾(Litopenaeus vannamei)是我国最重要的对虾养殖品种,2020年其海水养殖产量达119.7万t,占全国虾类海水养殖总产量的80.5% (农业农村部渔业渔政管理局等, 2021)。凡纳滨对虾养殖产业的发展经历了池塘养殖、温棚养殖、高位池养殖、工厂化养殖等养殖模式(朱林等, 2019)。随着凡纳滨对虾集约化养殖技术的不断发展,放养密度和饲料投喂量的增加,养殖动物的产量和养殖水域的利用率明显提高(陈明康等, 2020),但是大量残饵、粪便、肥料和药物的投入使养殖水环境日益恶化,负面环境效应非常突出,导致对虾疫病肆虐横行、环境污染严重(祁真等, 2004)。因此,发展无公害生态养殖,推动工厂化循环水养殖,高效可持续的生物净化系统研究已成为当今凡纳滨对虾集约化养殖研究的热点之一。
循环水养殖模式是将养殖水经物理、化学及生物净化处理后重复使用的新型养殖方式(王峰等, 2013),在水资源节约、养殖废弃物处理、对虾疾病控制以及减少生态污染等方面具有明显的优势(张龙等, 2019; 张健龙等, 2017)。生物净化是循环水水处理的核心环节,滤料是生物净化设施的重要组成部分,不同滤料因为材质、比表面积、耐冲刷能力、水力特性等差异造成其表面生物群落的不一致,从而影响对养殖水的处理效果(蔡云龙等, 2005)。而养循环水养殖系统中的有益微生物菌群在净化水质、降低氨氮(NH4+-N)和亚硝态氮(NO2–-N)(邵青等, 2001; Fan et al, 2019)、营养循环(Cornejo-Granados et al, 2018)、病原防控(Rungrassamee et al, 2016)及养殖物种健康(樊英等, 2017)等方面也发挥着重要的作用。目前的研究主要集中在生物净化滤料的单因素对水质的效应研究,其对环境及养殖对虾微生物菌群的研究较少。
因此,本研究通过分析对虾工厂化循环水养殖系统中水质指标、水体及对虾肠道微生物菌群结构的变化,探讨工厂化循环水系统生物净化对养殖对虾的影响,为对虾工厂化循环水养殖系统和养殖模式的构建提供基础参数。
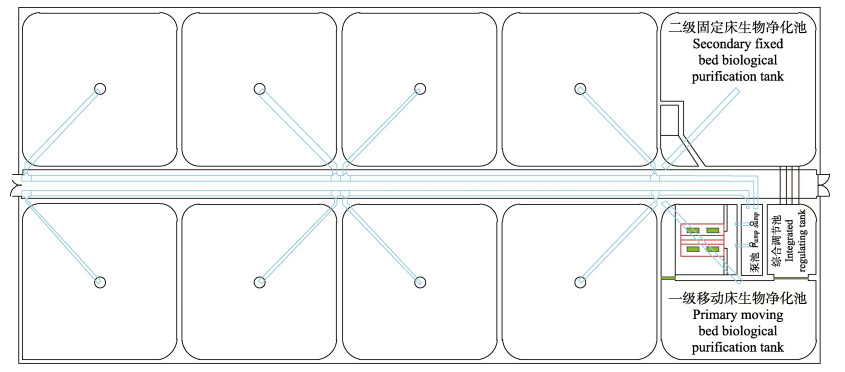
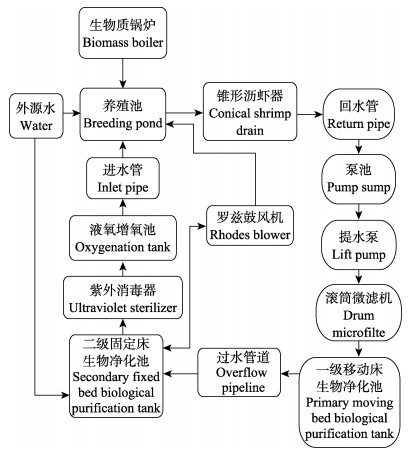
1 材料与方法 1.1 养殖系统的组成与构建实验在山东省海阳市黄海水产有限公司养殖基地进行,对虾工厂化循环水养殖系统由原石斑鱼(Epinephelinae)养殖车间升级改造,总面积为800 m2,有效养殖水体为600 m3。8个规格相同的水泥养殖池(长9 m、宽9 m、深2 m, 养殖水体600 m3)通过回水管道和进水管道与水处理系统相连构成封闭循环水养殖系统。水处理系统是由中国水产科学研究院海水陆基工厂化养殖创新团队自主设计构建,主要由2个养殖池改建而成,1个养殖池分隔成泵池、微滤机池、一级移动床生物净化池和综合调节池4部分,一级移动床生物净化池生物滤料为多孔PE填料(比表面积约为600 m2/m3);另1个养殖池分隔成二级固定床生物净化池、紫外消毒池和集中增氧池3部分,二级固定床生物净化池生物滤料为立体弹性填料(比表面积约为150 m2/m3) (图 1)。整个养殖系统配备2台3.0 kW、气压为39.2 kPa的罗茨鼓风机,满足对虾工厂化养殖6.0 mg/L以上的溶氧和生物净化所需的溶氧与曝气要求,养殖系统工艺流程如图 2所示。养殖用水为天然海水,经沉淀、砂滤、调温和增氧处理后使用。
|
图 1 凡纳滨对虾循环水养殖系统 Fig.1 Recirculating aquaculture system of L. vannamei |
|
图 2 凡纳滨对虾循环水养殖系统工艺流程 Fig.2 Process flow diagram of RAS for L. vannamei |
实验凡纳滨对虾苗种由海南正泰一号水产种苗有限公司培育,实验于2020年10月16日开始,初始放养密度为500尾/m3,虾苗平均体质量为(0.6±0.1) g。各组养殖水循环量为6 h循环1次,每天4个循环,每天补充水量为水体的3%左右。根据对虾的生长情况,投喂不同颗粒大小的凡纳滨对虾配合饲料(粗蛋白≥42%、粗脂肪≥4%、粗纤维≥3%) (青岛正大农业发展有限公司)。养殖实验初期22 d,投喂粒径为0.5 mm的配合饲料,22 d后,投喂粒径为1 mm的配合饲料,4次/d,投喂时间分别为07:00、12:00、17:00和22:00,日投喂量为对虾体质量的10%,养殖后期投饲率降至4%。
在养殖实验的第80天,采集一级移动净化池水体(FMW)、二级固定床生物净化池水体(SIW)、养殖池水体(PC)以及多孔PE填料(FMB)、立体弹性填料(SIB)和对虾肠道样品。在上午投喂4 h后,从每个处理池分别选择池中心以及周边2点采集水面以下50 cm处的水样500 mL,用0.22 µm聚碳酸酯过滤器过滤,滤膜放入无菌离心管–20℃冷冻保存,用于分析微生物菌群结构,过滤后的水用于测水质指标;取一级移动床生物净化池多孔PE填料5片,取二级固定床生物净化池立体弹性填料10 cm,分别用500 mL纯净水进行振荡、抽滤,滤膜放入无菌离心管–20℃冷冻保存,用于分析微生物菌群结构。随机从8个养殖池中挑选18尾对虾,分别采集肠道(LVT)样品,混合成3个样品放入无菌离心管,–20℃冷冻保存,用于分析微生物菌群结构。
1.3 测定与计算方法 1.3.1 水质指标水体的水温、溶氧、pH和盐度使用水质检测仪(YSI556, 美国)测定;总氮(TN)、硝态氮(NO3–-N)、亚硝态氮(NO2–-N)和氨氮(NH4+-N)的浓度使用营养盐流动分析仪(Skalar, 荷兰)测定。
1.3.2 微生物菌群检测水体和对虾实验样品中的微生物总DNA的提取采用TAB/SDS法进行,利用1%琼脂糖凝胶电泳检测样品的基因组DNA,检测出清晰的DNA条带,然后用NanoDrop 2000c微量核酸检测仪NC20检测其DNA纯度,其OD260 nm/OD280 nm= 1.9~2.0,符合Ilumina MiSep测序要求。使用16S rDNA基因V4区带有barcode的特异引物对DNA进行PCR扩增,引物为515F (5’-GTGCCAGCMGCCGCGG-3’)和806R (5’-GGACTACHVGGGTWTCTAAT-3’)。PCR扩增在ABI GeneAmp® 9700型PCR仪中进行。PCR反应体系为30 μL,包括DNA模板10 ng、15 μL of Phusion® High-Fidelity PCR Master Mix、0.2 μmol/L正反向引物。PCR反应程序为98℃ 1 min;98℃10 s,50℃ 30 s,72℃ 60 s,30个循环;72℃ 5 min。PCR扩增产物经2%琼脂糖凝胶电泳检测,等比例混合后,利用GeneJET Gel Extraction Kit (Thermo Scientific)纯化回收目的片段。使用NEB Next® Ultra™ DNA Library Prep Kit for Illumina (NEB, 美国)进行测序文库构建。测序文库经Qubit@ 2.0 Fluorometer (Thermo Scientific)和Agilent Bioanalyzer 2100 system检测合格后,在Illumina MiSeq平台进行测序。
1.3.3 生物信息学分析利用FLASH软件对基于barcode所得样品的有效序列进行质控过滤。使用UPARSE软件进行序列分析,并以≥97%的相似度定义操作分类单位(OTUs)。使用UCHIME软件确定嵌合序列。利用Mothur软件使用97%相似度的OTUs,利用R语言工具绘制所有微生物样本稀释曲线。使用Mothur软件根据Chao1、辛普森(Simpson)和香浓(Shannon)指数计算菌群α-多样性。使用R语言工具分析和绘制维恩(Venn)图,用于分析各组微生物样本共有和独有的OTUs数量。使用R软件包基于加权和非加权unifrac距离的主坐标进行降维分析(PCoA)评估菌群β-多样性。利用R语言工具在门和属水平上分别统计细菌群落相对丰度。利用Metastats软件分析各组细菌分类学的丰度差异。采用LEfSe软件,使用线性判别分析(LDA)和效应大小(LEfSe)分析,对不同组内的生物标志物进行定量分析。根据各个OTU的丰度概况,使用Cytoscape软件构建菌群生态网络。使用RandomForest软件包进行RandomForest分析。生物信息学分析由明科生物技术(杭州)有限公司提供技术支持。
1.3.4 数据分析所得数据以平均值±标准误(Mean±SE)表示,采用SPSS 25.0软件进行方差分析(ANOVA)和多重比较(LSD法和Duncan法),P < 0.05表示差异显著。
2 结果 2.1 生物净化系统对养殖水体水质的影响生物净化对循环水养殖系统水体无机营养盐和有机质质量浓度的影响见表 1。净化池和养殖池的水温保持在28.5℃,盐度为31,pH为7.8~8.2,溶氧保持在5.0 mg/L以上,系统内各水处理单元间差异不显著(P > 0.05)。二级固定床生物净化池(SIW)养殖水体中的NH4+-N和NO2–-N质量浓度均显著低于一级固定床净化池(FMW)和养殖水池(PC)处理组(P < 0.05),其质量浓度分别在0.85和0.21mg/L,FMW与PC处理组水体中NH4+-N和NO2–-N的质量浓度差异不显著(P > 0.05)。不同水处理单元的NO3–-N、硅(Si)、TN、总磷(TP)的质量浓度差异不显著(P > 0.05)。结果显示,不同生物净化处理对降低NH4+-N和NO2–-N质量浓度具有显著差异。
|
|
表 1 生物净化池及养殖池水质指标 Tab.1 Water quality index of culture pond and biological purification unit |
经16S rDNA基因V4片段Illumina MiSeq测序并优化质控后,21个微生物样本共得1 296 349条有效序列,平均每个样本61 731条,长度主要在201~ 300 bp之间,平均为255 bp。基于97%相似性水平划分OTUs的稀释曲线结果显示,每个样本测序深度超过50 000条reads,且曲线趋于平缓,表明对虾工厂化养殖系统的微生物测序深度已接近实际菌群情况,满足下一步分析需求。
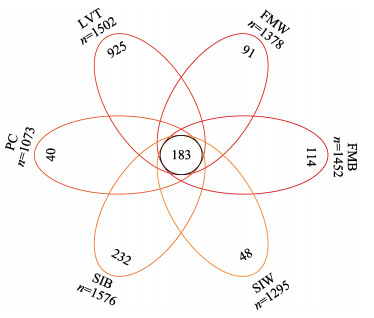
2.3 微生物丰富度和多样性分析基于对虾工厂化养殖系统菌群OTUs绘制Venn图(图 3),用于分析各组OTU的相关性。结果显示,所有的微生物样品中共鉴定出8276个OTUs,所有的样品共有的OTUs为183个。生物净化载体样品(FMB、SIB)处理组中独有OTUs数高于水体样品(FMW、SIW),其中SIB处理组最高(P < 0.05);对虾LVT处理组的独有OTUs数量显著高于水体样品(FMW、SIW) (P < 0.05)。为评估不同处理间微生物群落的α多样性,分析Chao1、Shannon和Simpson指数,结果显示,SIB处理组的Chao1指数、Shannon指数显著高于对虾LVT处理组的指数(P < 0.05) (表 2)。
|
图 3 养殖系统中水体、生物净化载体和肠道微生物菌群OTUs维恩图 Fig.3 Venn diagram analysis of microbial with OTUs of water, biological carrier and intestine |
|
|
表 2 对虾循环水养殖系统和对虾肠道菌群α多样性分析 Tab.2 α-Diversity of microbial of recirculating aquaculture system and intestine of shrimp |
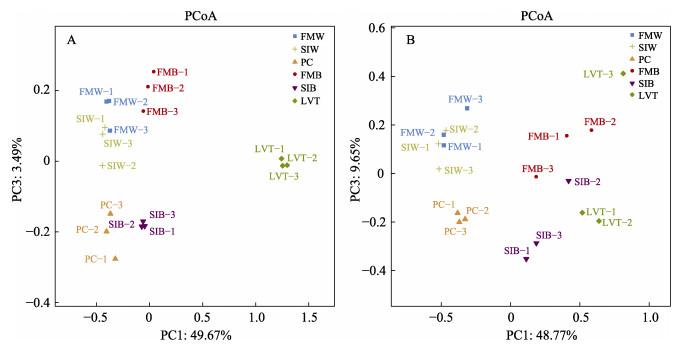
基于权重和非权重的PCoA分析各处理组微生物菌群β多样性,结果显示,不同净化池水体和生物净化载体样品与对虾肠道微生物之间表现出明显的差异(图 4)。
|
图 4 水体、生物净化载体和肠道微生物菌群PCoA分析 Fig.4 Principal coordinates analysis (PCoA) of microbial of water, biological carrier and shrimp intestine A:权重unifrac分析;B:非权重unifrac分析 A: Weighted unifrac analysis; B: Unweighted unifrac analysis |
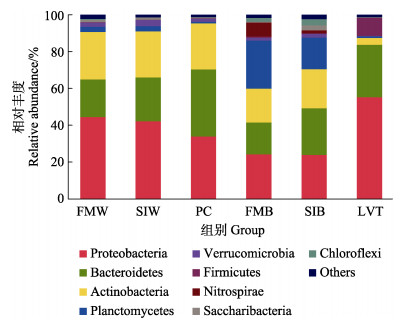
所有微生物样品中共鉴定出46个细菌门,其中水体和虾肠道中的优势门不同。水体(FMW、SIW、PC)中优势菌为变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)和放线菌门(Actinobacteria),生物净化载体中优势菌为变形菌门、拟杆菌门、放线菌门和浮霉菌门(Planctomycetes),而对虾肠道优势菌为变形菌门、拟杆菌门和厚壁菌门(Firmicutes)。不同生物净化载体(FMB和SIB)中浮霉菌门以及硝化螺旋菌门的丰度显著高于其他处理组(P < 0.05);对虾肠道(LVT)中变形菌门和厚壁菌门丰度显著高于水体和生物净化载体(P < 0.05),而放线菌门丰度显著低于水体和生物净化载体(P < 0.05) (图 5)。
|
图 5 水体、生物净化载体和肠道中微生物菌群门水平相对丰度 Fig.5 Relative abundance of microbial of water, biological carrier and shrimp intestine at the phyla level |
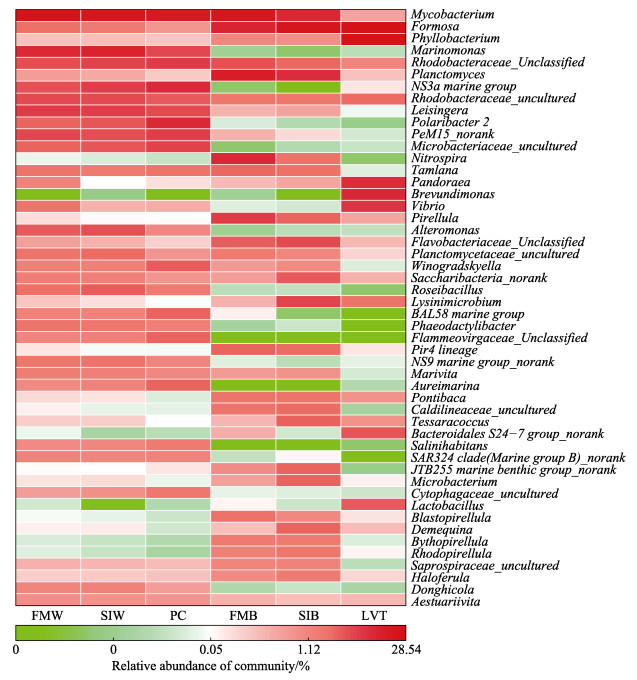
在已鉴定的947个属中,可以看出某些菌属丰度在水体、生物净化载体和对虾肠道中存在明显差异。例如,弧菌属(Vibrio)在生物净化载体中丰度较低,而在水体(FMW、SIW)和肠道中丰度较高。从图 6可以看出,一级净化水体中的弧菌属的丰度高于二级净化水体,而二级净化水体高于养殖水体,浮霉菌属(Planctomyces)的丰度在生物净化载体样品中比在水体和虾肠道中要高,乳酸杆菌属(Lactobacillus)的丰度在对虾肠道的丰度最高,在水体中丰度最低,但在水体中含量极低。FMW、SIW、FMB和SIB处理组中分枝杆菌属(Mycobacterium)的丰度均高于肠道,肠道中的短波单胞菌属(Brevundimonas)的丰度高于水体(FMW、SIW)和生物净化载体样品(FMB、SIB)中的丰度,LVT处理组中潘多拉菌属(Pandoraea)和叶杆菌属(Phyllobacterium)的丰度高于水体和生物净化载体(图 6)。
|
图 6 水体、生物净化载体以及对虾肠道中微生物群落热图 Fig.6 Heatmap of the microbial communities in water, biological carrier and shrimp intestine |
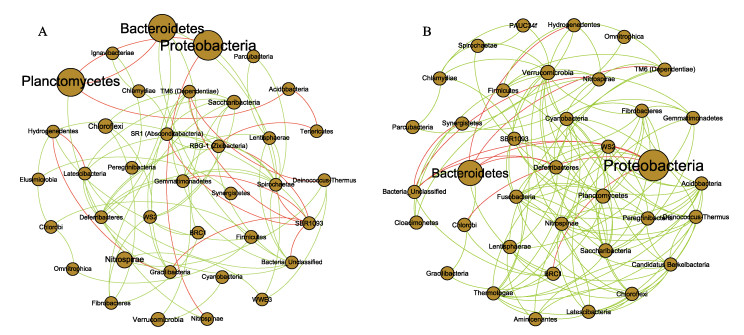
分析水体和生物净化载体菌群的相关性网络。结果显示,生物净化载体比水体具有更复杂的菌群网络。一级、二级净化水体(FMW、SIW)中,变形菌门和绿菌门(Chlorobi)呈负相关,拟杆菌门和变形菌门呈负相关;厚壁菌门和浮霉菌门呈正相关。生物净化载体(FMB、SIB)中,变形菌门和硝化螺旋菌门(Nitrospirae)呈负相关,拟杆菌门和浮霉菌门呈负相关(图 7),且生物净化载体样品的微生物菌群相关性更加复杂。
|
图 7 基于细菌门水平的微生物群落关联网络分析 Fig.7 Relevance network analysis of microbial community based on the bacterial phylum level A:水体;B:生物净化载体节点代表门,节点大小表示每个分类单元的相对丰度。2个节点之间的边表示相关性:绿色表示正相关性,红色表示负相关性。 A: Water; B: Biological carrier The nodes represent the phylum, and the node size indicates the relative abundance of each taxon. The edges between two nodes represent the correlation: Green indicates a positive correlation, and red indicates a negative correlation. |
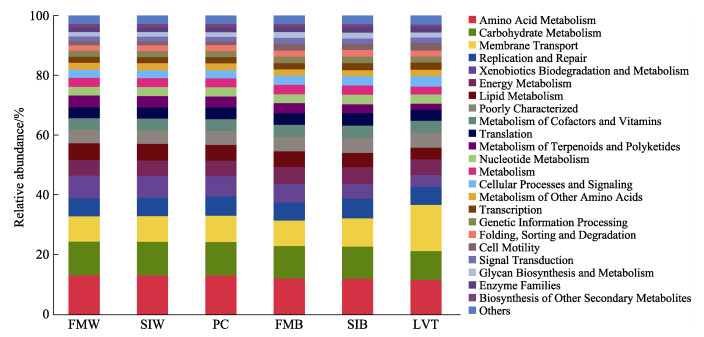
使用PICRUSt预测分析菌群的KEGG功能。结果显示,各组菌群的代谢功能相似,均与“氨基酸代谢”(amino acid metabolism)、“碳水化合物代谢”transport)、“复制与修复”(replication and repair)、“外源生物降解与代谢”(xenobiotics biodegradation and (carbohydrate metabolism)、“膜运输”(membrane metabolism)和“能量代谢”(energy metabolism)等相关(图 8)。
|
图 8 水体、生物净化载体和肠道中微生物菌群KEGG功能预测 Fig.8 KEGG function analysis of microbial of water, biological carrier and intestine |
肠道菌群KEGG随机森林分析进一步表明,与LVT相比,其他几组样品的菌群“GnRH信号通路”(GnRH signaling pathway)、“细胞内吞”(endocytosis)、“生物合成”(betalain biosynthesis)、“聚糖生物合成”(N-glycan biosynthesis)、“1, 1, 1-三氯-2, 2-二(4-氯苯基)乙烷(DDT)降解”[1, 1, 1-trichloro-2, 2-bis(4-chlorophenyl) ethane (DDT) degradation]的功能升高了;但“转录相关蛋白”(transcription related proteins)、“磷酸转移酶系统”(phosphotransferase system)功能降低了(图 9)。
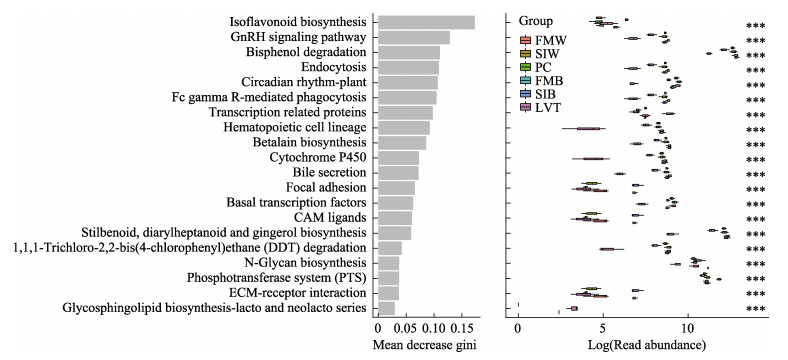
|
图 9 对虾循环水养殖系统菌群KEGG随机森林gini图 Fig.9 Random forest KEGG classification of microbial of recirculating aquaculture system of shrimp ***表明各组之间存在极显著差异(P < 0.001) ***shows that there are highly significant differences among the groups (P < 0.001) |
生物净化在对虾工厂化循环水养殖系统中具有重要的作用(徐如卫等, 2015)。本研究通过对比养殖水体和生物净化载体上的细菌群落结构组成发现,二者的细菌群落结构组成基本一致。目前,在人工水产养殖系统中,由于放养密度高,投喂的饲料和粪便造成水中有毒的氨氮和亚硝酸盐浓度上升,水体中的硝化细菌通过硝化作用可将氨转变为亚硝酸、将亚硝酸转变为硝酸,因此,硝化细菌在循环水系统扮演着十分重要的角色(安晓宇, 2010)。本研究的各级生物滤池中亚硝酸盐含量相差不大,其浓度无明显的积累现象,养殖系统氨氮和亚硝酸盐浓度相对较低,且均在凡纳滨对虾安全养殖范围内,循环水养殖系统中水质状况良好。
微生物作为水生生态系统的重要组成部分,有助于保持水质的稳定和水生动物的健康状况(Piedrahita, 2003)。对虾对营养物质的消化吸收依赖于肠道微生物群的稳定性,其失衡将直接影响投喂饲料的利用、水产养殖环境的污染增加等问题(郁维娜等, 2018)。因此,了解虾类养殖生态系统的微生物特征,建立有效的微生物调控策略,对于对虾工厂化养殖具有重要的作用。
本研究发现,变形菌门、放线菌门和拟杆菌门是养殖水体样品和生物净化载体样品共同的优势细菌门,这与竺山湾和湖泊水体的浮游细菌的研究结果一致(Eiler et al, 2004; Tamaki et al, 2005; 薛银刚等, 2018),也与谭八梅等(2021)发现的辽宁长海刺参(Apostichopus japonicus)养殖池塘水体菌群同季节第一优势菌门均为变形菌门,次优势菌门为拟杆菌门相一致,且变形菌门在肠道中的丰度高于在水体和生物净化载体中,变形菌门是一种多功能细菌,在废水中具有很高的丰度,能够去除氮和磷,降解有机物和减少化学需氧量(Cottrell et al, 2000; Klase et al, 2019)。本研究中,变形菌门在肠道中的丰度高于水体,在生物净化载体中丰度最低;放线菌可降解有机物,包括淀粉、蛋白质等大分子,并产生抗生素等抗菌物质(Wexler, 2007; Zothanpuia et al, 2018)。本研究中,水体中放线菌门丰度很高,而在对虾肠道内含量较低,有利于养殖水体有机物和氮的分解。拟杆菌门包括拟杆菌纲(Bacteroidia)、黄杆菌纲(Flavobacteria)和鞘脂杆菌纲(Sphingobacteria)三大类,其中,拟杆菌纲主要存在于动物肠道和粪便中,可有效促进碳水化合物的代谢(Shin et al, 2015);而黄杆菌纲主要存在于水生环境中,鞘脂杆菌纲的重要类群为噬胞菌属(Cytophaga),在海洋细菌中占有较大比例,可降解纤维素。本研究中,拟杆菌门在水体、生物净化载体和肠道中的丰度差别不明显,但可以看出,其在养殖水体中含量较高。
本研究的生物净化载体样本中的浮霉菌门为最优势菌门。浮霉菌门细菌含有丰富的固氮菌群,能够在缺氧环境下利用亚硝酸盐(NO2–-)、氧化铵离子(NH4+-)生成N2来获得能量,因此,称作厌氧氨氧化菌,对全球氮循环具有重要意义,也是污水处理中重要的细菌(许志强, 2006; 安晓宇, 2010)。本研究中,浮霉菌门聚集在生物净化载体上,这有利于生物净化系统对水中氨氮浓度的调控,使养殖水体的氨氮浓度保持在凡纳滨对虾健康养殖范围内(王梦亮等, 2001)。其次,本研究发现,硝化螺旋菌门也聚集于生物净化载体。Lahav等(2009)对海水金头鲷(Sparusaurata)循环水养殖系统的移动床生物膜反应器的生物膜分析发现,在生物滤池中起硝化作用的是亚硝化单胞菌和硝化螺旋菌。本研究中,生物净化载体样品中含有一定丰度的硝化螺旋菌门细菌,尤其在生物净化载体上的比例较高,明显高于其在水体样品中细菌群落的比例,表明硝化螺旋菌门细菌与对虾循环水养殖水的硝化作用有关。生物净化载体上聚集净化水质的有益菌,在生长代谢过程中可抑制水体中氨氮或亚硝酸氮的增加,间接预防疾病的发生,营造良好的生长环境。
厚壁菌门主要富集在对虾的肠道,可有效吸收饵料中的能量(O'Sullivan et al, 2002; Wexler, 2007; Turnbaugh et al, 2009)。本研究中,厚壁菌门是对虾肠道的优势菌,这与Gillilland等(2012)和吴欢欢等(2019)的研究结果一致。厚壁菌门在肠道中定植,有利于对虾更有效地吸收饵料中的热量,促进肠道益生菌的合成。另外,作为厚壁菌门的主要分类纲,乳酸杆菌在肠道中的丰度也较高,这与李建柱等(2016)在研究鱼菜共生模式下,不同鱼类肠道微生物的菌落结构时发现的乳酸杆菌属为水体有益优势菌群的研究结果一致,肠道乳酸杆菌有利于对虾对饲料营养物质的消化吸收。
本研究发现,对虾养殖循环水系统中生物净化载体上的细菌物种含量比水样中的细菌物种少,但微生物多样性高于养殖水体,相对来说,生物净化载体中微生物具有低丰度和高多样性的特点,这可能是由于环境相关的功能菌在生物净化载体上丰度增加,而一些对环境响应小的菌群种类减少,导致出现生物膜细菌种类聚集现象。另外,本研究还发现,水体和生物净化载体中也含有一定量的弧菌、分枝杆菌等致病菌,循环系统的优势在于改善优势菌的丰度,抑制有害菌的定植,从而创造更加良好的生长环境。因此,在对虾养殖过程中,需要通过调控水环境和虾肠道中的病原菌含量,保证对虾健康养殖。
4 结论生物净化在凡纳滨对虾循环水养殖系统中的应用可降低对虾循环水养殖系统中NH4+-N和NO2–-N质量浓度,有效调控养殖水体水质指标。水体、生物净化载体以及对虾体内的优势菌群不同,变形菌和拟杆菌在水体、生物净化载体和肠道中均占优势,而浮霉菌主要聚集于生物净化载体,厚壁菌主要定植在肠道中,放线菌主要存在于水中。不同养殖环境微生物种类分布特征可为对虾循环水养殖微生物资源开发和养殖水质调控提供理论依据。
AN X Y. Partial nitrification process of sewage treatment technology of ecological control of microorganisms. Master's Thesis of Heibei University of Science and Technology, 2010 [安晓宇. 污水处理过程中短程硝化的微生物生态调控技术研究. 河北科技大学硕士研究生学位论文, 2010]
|
Bureau of Fisheries, Ministry of Agriculture and Rural Affairs, National Fisheries Technology Extension Center, China Society of Fisheries. China fishery statistical yearbook 2020. Beijing: China Agriculture Press, 2021 [农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 2020中国渔业统计年鉴. 北京: 中国农业出版社, 2021]
|
CAI Y L, ZANG W L, YAO Q Z, et al. Effects of removing ammonia with four filters. Journal of Shanghai Fisheries University, 2005, 14(2): 138-142 [蔡云龙, 臧维玲, 姚庆祯, 等. 四种滤料去除氨氮的效果. 上海水产大学学报, 2005, 14(2): 138-142] |
CHEN M K, LI G, PAN Y Z, et al. Analysis of water environment variations for industrialized Penaeus vannamei culture system. Hebei Fisheries, 2020, 11061106(10): 45-49 [陈明康, 李耕, 潘玉洲, 等. 南美白对虾工厂化养殖水环境变化分析. 河北渔业, 2020, 11061106(10): 45-49] |
CORNEJO-GRANADOS F, GALLARDO-BECERRA L, LEONARDO-REZA M, et al. A meta-analysis reveals the environmental and host factors shaping the structure and function of the shrimp microbiota. PeerJ, 2018, 6: e5382 DOI:10.7717/peerj.5382 |
COTTRELL M T, Kirchman D L. Natural assemblages of marine proteobacteria and members of the Cytophaga-Flavobacter cluster consuming low- and high-molecular-weight dissolved organic matter. Applied and Environmental Microbiology, 2000, 66(4): 1692-1697 DOI:10.1128/AEM.66.4.1692-1697.2000 |
EILER A, BERTILSSON S. Composition of freshwater bacterial communities associated with cyanobacterial blooms in four Swedish lakes. Environmental Microbiology, 2004, 6(12): 1228-1243 DOI:10.1111/j.1462-2920.2004.00657.x |
FAN L F, WANG Z L, CHEN M S, et al. Microbiota comparison of Pacific white shrimp intestine and sediment at freshwater and marine cultured environment. Science of the Total Environment, 2019, 657: 1194-1204 DOI:10.1016/j.scitotenv.2018.12.069 |
FAN Y, WANG X L, LI L, et al. Analysis of aquaculture-water and gut from Fenneropenaeus chinensis in different systems on bacterial diversity based on high-throughput sequencing technology. Journal of Guangxi Academy of Sciences, 2017, 33(4): 261-267 [樊英, 王晓璐, 李乐, 等. 基于高通量测序的不同养殖系统下凡纳滨对虾肠道和水体中微生物的多样性. 广西科学院学报, 2017, 33(4): 261-267] |
GILLILLAND M G, ERB-DOWNWARD J R, BASSIS C M, et al. Ecological succession of bacterial communities during conventionalization of germ-free mice. Applied and Environmental Microbiology, 2012, 78(7): 2359-2366 DOI:10.1128/AEM.05239-11 |
KLASE G, LEE S, LIANG S, et al. The microbiome and antibiotic resistance in integrated fishfarm water: Implications of environmental public health. Science of the Total Environment, 2019, 649: 1491-1501 DOI:10.1016/j.scitotenv.2018.08.288 |
LAHAV O, MASSADA I B, YACKOUBOV D, et al. Quantification of anammox activity in a denitrification reactor for a recirculating aquaculture system. Aquaculture, 2009, 288(1/2): 76-82 |
LI J Z, HOU J, ZHANG P F, et al. Comparative study of intestinal microbial community structure in different species of carp in aquaponics system. South China Fisheries Science, 2016, 12(6): 42-50 [李建柱, 侯杰, 张鹏飞, 等. 鱼菜共生模式中不同鱼类肠道微生物群落结构的比较. 南方水产科学, 2016, 12(6): 42-50] |
O'SULLIVAN L A, WEIGHTMAN A J, FRY J C. New degenerate Cytophaga-Flexibacter-Bacteroides-specific 16S ribosomal DNA-targeted oligonucleotide probes reveal high bacterial diversity in River Taff epilithon. Applied and Environmental Microbiology, 2002, 68(1): 201-210 DOI:10.1128/AEM.68.1.201-210.2002 |
PIEDRAHITA R H. Reducing the potential environmental impact of tank aquaculture effluents through intensification and recirculation. Aquaculture, 2003, 226(1/2/3/4): 35-44 |
QI Z, YANG J P, LIU Y. Studies on the water quality dynamics in the recycling ponds for Penaeus vannamei. Reservoir Fisheries, 2004, 24(3): 37-39 [祁真, 杨京平, 刘鹰. 封闭循环水养殖南美白对虾的水质动态研究. 水利渔业, 2004, 24(3): 37-39] |
RUNGRASSAMEE W, KLANCHUI A, MAIBUNKAEW S, et al. Bacterial dynamics in intestines of the black tiger shrimp and the Pacific white shrimp during Vibrio harveyi exposure. Journal of Invertebrate Pathology, 2016, 133: 12-19 |
SHAO Q, ZHUANG Y F, WANG H T, et al. Experimental research on effect of effective microorganisms on removal of ammonia and nitrogen. Engineering Journal of Wuhan University, 2001, 11061106(02): 77-80 [邵青, 庄艳峰, 王洪涛, 等. EM脱除氨氮效果试验研究. 武汉大学学报(工学版), 2001, 11061106(2): 77-80] |
SHIN N R, WHON T W, BAE J W. Proteobacteria: Microbial signature of dysbiosis in gut microbiota. Trends in Biotechnology, 2015, 33(9): 496-503 DOI:10.1016/j.tibtech.2015.06.011 |
TAMAKI H, SEKIGUCHI Y, HANADA S, et al. Comparative analysis of bacterial diversity in freshwater sediment of a shallow eutrophic lake by molecular and improved cultivation-based techniques. Applied and Environmental Microbiology, 2005, 71(4): 2162-2169 |
TAN B M, WANG L, PEI H L, et al. The seasonal structural and functional characteristics of bacterial community in Apostichopus japonicus culture pond water. Progress in Fishery Sciences, 2021, 42(3): 77-88 [谭八梅, 王荦, 裴泓霖, 等. 不同季节刺参养殖池塘水体菌群结构与功能特征研究. 渔业科学进展, 2021, 42(3): 77-88] |
TURNBAUGH P J, HAMADY M, YATSUNENKO T, et al. A core gut microbiome in obese and lean twins. Nature, 2009, 457(7228): 480-484 |
WANG F, LEI J L, GAO C R, et al. Research progress of water conditioning in industry recirculating aquaculture mode at home and abroad. Engineering Science, 2013, 15(10): 16-23 [王峰, 雷霁霖, 高淳仁, 等. 国内外工厂化循环水养殖模式水质处理研究进展. 中国工程科学, 2013, 15(10): 16-23] |
WANG M L, MA Q R, LIANG S K. The effect of photosynthetic bacteria on aquatic ecosystem of carps production. Acta Hydrobiologica Sinica, 2001, 25(1): 98-101 [王梦亮, 马清瑞, 梁生康. 光合细菌对鲤养殖水体生态系统的影响. 水生生物学报, 2001, 25(1): 98-101] |
WEXLER H M. Bacteroides: The good, the bad, and the nitty-gritty. Clinical Microbiology Reviews, 2007, 20(4): 593-621 |
WU H H, WANG W J, LÜ D, et al. Turbot (Scophthalmus maximus) biodiversity assessment using high-throughput illumina sequencing to analyze juvenile turbot intestines and their bacterial cultures. Progress in Fishery Sciences, 2019, 40(4): 84-94 [吴欢欢, 王伟继, 吕丁, 等. 应用高通量测序技术分析大菱鲆幼鱼肠道及其养殖环境的微生物群落结构. 渔业科学进展, 2019, 40(4): 84-94] |
XU R W, YANG F S, YU Q L, et al. Marine ecological compensation mechanism in China. Hebei Fisheries, 2015, 43(3): 25-28 [徐如卫, 杨福生, 俞奇力, 等. 凡纳滨对虾循环水养殖可行性研究. 河北渔业, 2015, 43(3): 25-28] |
XU Z Q. The application of the immobilized PSB on the aquaculture of the Takifugu Obscurus. Master's Thesis of Nanjing Normal University, 2006 [许志强. 固定化光合细菌在暗纹东方鲀养殖中的应用. 南京师范大学硕士研究生学位论文, 2006]
|
XUE Y G, LIU F, SUN M, et al. Community Structure and Influencing Factors of Bacterioplankton in Spring in Zhushan Bay, Lake Taihu. Environmental Science, 2018, 39(3): 1151-1158 [薛银刚, 刘菲, 孙萌, 等. 太湖竺山湾春季浮游细菌群落结构及影响因素. 环境科学, 2018, 39(3): 1151-1158] |
YU W N, DAI W F, TAO Z, et al. Characterizing the compositional and functional structures of intestinal micro- flora between healthy and diseased Litopenaeus vannamei. Journal of Fisheries of China, 2018, 42(3): 399-409 [郁维娜, 戴文芳, 陶震, 等. 健康与患病凡纳滨对虾肠道菌群结构及功能差异研究. 水产学报, 2018, 42(3): 399-409] |
ZHANG J L, JIANG M, WANG C F, et al. Microbial diversity in bio-filter of the recirculating aquaculture system for Litopenaeus vannamei. Progress in Fishery Sciences, 2017, 38(5): 73-82 [张健龙, 江敏, 王城峰, 等. 凡纳滨对虾(Litopenaeus vannamei)循环水养殖塘挂膜式生物滤器内微生物的多样性. 渔业科学进展, 2017, 38(5): 73-82] |
ZHANG L, CHEN Z, WANG L, et al. Study on application of recirculating aquaculture system for Litopenaeus vannamei. Fishery Modernization, 2019, 46(2): 7-14 [张龙, 陈钊, 汪鲁, 等. 凡纳滨对虾循环水养殖系统应用研究. 渔业现代化, 2019, 46(2): 7-14] |
ZHU L, CHE X, LIU X G, et al. Research progress of industrial farming of shrimp. Journal of Shanxi Agricultural Sciences, 2019, 47(7): 1288-1290 [朱林, 车轩, 刘兴国, 等. 对虾工厂化养殖研究进展. 山西农业科学, 2019, 47(7): 1288-1290] |
ZOTHANPUIA A K P, VINCENT V L, Preetic C, et al. Bioprospection of actinobacteria derived from freshwater sediments for their potential to produce antimicrobial compounds. Microbial Cell Factories, 2018, 17(1): 68 |



