2. 青岛海洋科学与技术国家实验室海洋生物学与生物技术功能实验室 山东 青岛 266071;
3. 大连天正实业有限公司 辽宁 大连 116600;
4. 威海银泽生物科技有限公司 山东 威海 264404
2. Laboratory for Marine Biology and Biotechnology, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao, Shandong 266071, China;
3. Dalian Tianzheng Aquaculture Co., Ltd., Dalian, Liaoning 116600, China;
4. Weihai Yinze Biological Co., Ltd, Yantai, Shandong 264404, China
鱼类的生长和繁殖受环境条件的调节,气候的变化可能给海水网箱养殖鱼类带来不利影响。已有大量研究表明,冬季的低温易导致鱼类生长性能降低,甚至大量死亡(Abdel-Tawwab et al, 2014; Wen et al, 2017; Islam et al, 2019、2020)。红鳍东方鲀(Takifugu rubripes)主要分布在我国沿海地区、朝鲜半岛和日本海域,其肉质鲜美、营养丰富,已成为我国重要的经济型海水养殖鱼类之一。红鳍东方鲀作为暖温性鱼类,其适宜的生长温度为16~25℃,然而,冬季水温的下降严重影响其生长性能,需要采用室内加热水进行养殖,但由于加热升温的方法会带来成本上升、环境压力等问题,养殖水温仍只能维持在较低水平。因此,研究该物种冷适应的分子机制及培育具有耐寒特性的品种,有助于减少因低温而出现大面积死亡的情况发生,从而提高养殖产量,提升经济效益。
受益于分子生物学手段的不断提升,针对鱼类低温耐受分子机制的研究越来越深入,一些与鱼类低温耐受相关的基因得以被发现及应用。本课题组前期通过分析红鳍东方鲀的低温转录组差异基因,筛选得到4个与低温耐受相关的基因。抗冻蛋白(AFP)基因作为研究较为深入的抗寒基因,普遍存在于鱼类、植物、昆虫、细菌和真菌中(Duman et al, 1993; 崔杰等, 2019; 徐凯等, 2019; 张俊芳等, 2020)。AFP对冰晶具有较高的亲和力,能够附着到冰晶表面,阻止冰晶长大,从而达到抗寒的目的(Raymond et al, 1977; 汪少芸等; 2012)。在鱼类中,已有大量的相关研究,鱼源抗冻蛋白也得到了广泛应用(钟其旺等, 2002; 蔡路昀等, 2018)。冷诱导RNA结合蛋白(CIRP)是一种进化上保守的RNA结合蛋白,CIRP基因作为一种分布广泛、作用性强的功能基因,参与机体抵御外界低温的过程,通过提高mRNA的稳定性,介导多种基因的转录翻译,从而保护机体免受低温损伤(Al-Fageeh et al, 2006)。近年来,研究发现,CIRP参与了一些鱼类的低温胁迫应答过程,包括黄姑鱼(Nibea albiflora) (Xu et al, 2018)、牙鲆(Paralichthys olivaceus) (胡金伟等, 2015)、大黄鱼(Larimichthys crocea) (苗亮等, 2017)等。高速迁移蛋白家族蛋白(HMGB1)作为一种高度保守的非组蛋白染色质相关蛋白,其功能是稳定核小体的形成(Lange et al, 2009),并充当转录因子样蛋白,通过弯曲DNA和促进获得特定DNA靶点上的转录蛋白来调控基因的表达(Park et al, 2003),包括一些与低温相关的基因(Vornanen et al, 2005)。Y-box结合蛋白1 (YB-1)属于冷休克蛋白家族成员,在进化上高度保守(Swamynathan et al, 1998),是一类重要的功能蛋白。其可以作为转录因子与DNA、mRNA结合,也可以与其他转录因子发生蛋白互作,来完成基因转录与翻译的调控,进而参与机体的生理调控作用(Kloks et al, 2002; Eliseeva et al, 2011)。YB-1基因作为一种胁迫响应基因,对不同物种的多种胁迫都会产生响应,包括冷胁迫、氧化应激、缺氧等(Rauen et al, 2016; Li et al, 2018)。关于HMGB1基因和YB-1基因的相关研究报道在海洋生物中较少,且集中在鱼类免疫方面(Cai et al, 2014; Xie et al, 2014; Cai et al, 2018; He et al, 2019)。
本文以红鳍东方鲀为研究对象,采用荧光定量PCR的方法研究上述4种抗寒基因在不同温度、不同组织中的响应情况,从分子水平理解红鳍东方鲀的低温适应性,初步分析红鳍东方鲀幼鱼的抗寒分子机制,以期为筛选抗寒分子标记提供候选基因,进而为红鳍东方鲀耐低温育种研究和应用奠定基础。
1 材料与方法 1.1 实验材料实验用红鳍东方鲀取自大连天正实业有限公司,挑选体长为(15.0±0.5) cm、体格健壮、无损伤、活力好的360尾幼鱼,于12个实验桶(500 L)暂养,静水充气方式饲养,每日换水1次,暂养2周。设置4个温度梯度(18℃、13℃、8℃和5℃),18℃作为对照组,每个温度梯度设置3个平行,每个平行30尾幼鱼。暂养结束后,采用急性换水降温的方法,排掉海水的同时加入事先调至实验温度的海水,直到温度达到实验温度,使用亚美光411-H钛质加热器,控制温度在实验温度范围内,每隔2 h观察水温。实验过程中不投喂饵料,溶解氧为(6.80±0.12) mg/L,自然光照,胁迫24 h后结束实验。每个养殖桶取3尾,使用200 mg/L MS-222麻醉后,迅速在冰上完成解剖,每尾鱼分别取肝、脾、肾、脑、心、肠、肌肉、皮肤和性腺,浸入10倍体积的RNA保存液中(TIANGEN),4℃静置24 h后于–80℃保存。
1.2 总RNA的提取及cDNA第一链合成使用TIANGEN总RNA提取试剂盒(DP419)进行RNA提取,琼脂糖凝胶电泳检测RNA质量,使用紫外分光光度仪检测浓度。取1 μg总RNA,按照TransScript反转录试剂盒(AT311-03)说明书合成cDNA第一链,将产物于–80℃冰箱保存,待下一步实验。
1.3 实时荧光定量PCR采用实时荧光定量PCR (RT-qPCR)的方法检测目的基因的表达情况,使用Primer express 3.0设计定量引物,由生工生物工程(上海)股份有限公司合成,引物序列见表 1。参照TransStart说明书,在96孔板中配制20 μL体系:2×SuperReal PreMix Plus 10 μL,50×ROX Reference Dye 0.4 μL,RNase-free ddH2O 7.4 μL,上、下游引物各0.6 μL,cDNA模板1 μL。RT-qPCR反应在ABI StepOne plus平台进行,PCR反应程序:94℃预变性30 s,二步法PCR (94℃ 5 s, 60℃ 30 s, 40个循环),反应结束后绘制熔解曲线以确保扩增的特异性和准确性。
|
|
表 1 RT-qPCR用到的引物序列 Tab.1 Primers used for RT-qPCR |
β-actin作为内参基因,采用2–ΔΔCT法计算相对表达量。采用SPSS 22.0软件进行统计分析,采用单因素方差分析(one-way ANOVA)和Duncan检验比较各实验组之间的差异,P < 0.05表示存在显著性差异。
2 结果 2.1 低温胁迫下AFP基因在各组织中的表达红鳍东方鲀AFP基因在18℃的表达情况如图 1所示,在所检测的组织中,该基因呈现广泛性表达,在肌肉中表达量最高(P < 0.05),皮肤、肾脏中次之,在性腺中表达量较低。各组织不同温度处理24 h后的结果如图 2所示,随着温度降低,各组织中AFP基因的表达量基本呈显著升高的趋势,在5℃组达到最高值,相比对照组表达量升高且差异显著(P < 0.05),增幅较大,增幅最低的肾脏也在18倍以上;在脑、心、肝、肌肉、性腺和皮肤中,5℃组表达量显著高于8℃组(P < 0.05),在肾、肠、脾中8℃组和5℃组之间无显著差异。

|
图 1 AFP基因的组织表达
Fig.1 Tissue-specific expressions of AFP gene
B:脑;H:心;I:肠;K:肾;L:肝;M:肌肉;SP:脾;SK:皮;GO:性腺。 不同字母代表差异显著(P < 0.05)。下同。 B: Brain; H: Heart; I: Intestine; K: Kidney; L: Liver; M: Muscle; SP: Spleen; SK: Skin; GO: Gonad. Different letters represent significant differences (P < 0.05). The same as below. |
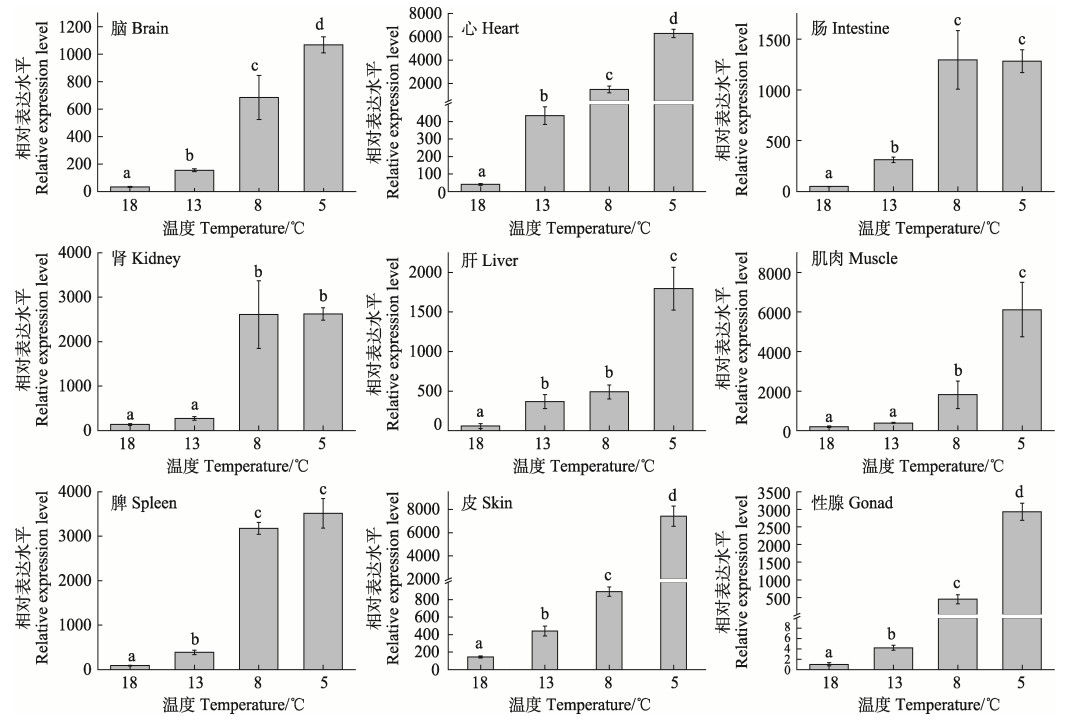
|
图 2 不同温度条件下AFP基因在红鳍东方鲀各组织中的表达 Fig.2 Expression of AFP gene in different tissues of T. rubripes at different temperatures |
红鳍东方鲀CIRP基因在18℃的表达情况如图 3所示,在所检测的组织中该基因均有不同程度的表达,在肌肉中表达量最高(P < 0.05),在肠中表达量较低。各组织不同温度处理24 h后的结果如图 4所示,随着温度的降低,各组织中CIRP基因的表达量的升降程度有所不同,肝、肾、脑的表达量呈先升高后降低再升高的趋势,在13℃组表达量显著高于对照组;心、肠和皮的表达量呈先升高后降低的趋势,在8℃组达到最大值,且8℃组和5℃组都显著高于对照组(P < 0.05);在脾、肌肉和性腺中表达量呈上升趋势,在5℃组达到最高值,显著高于对照组(P < 0.05)。

|
图 3 CIRP基因组织表达 Fig.3 Tissue-specific expressions of CIRP gene |
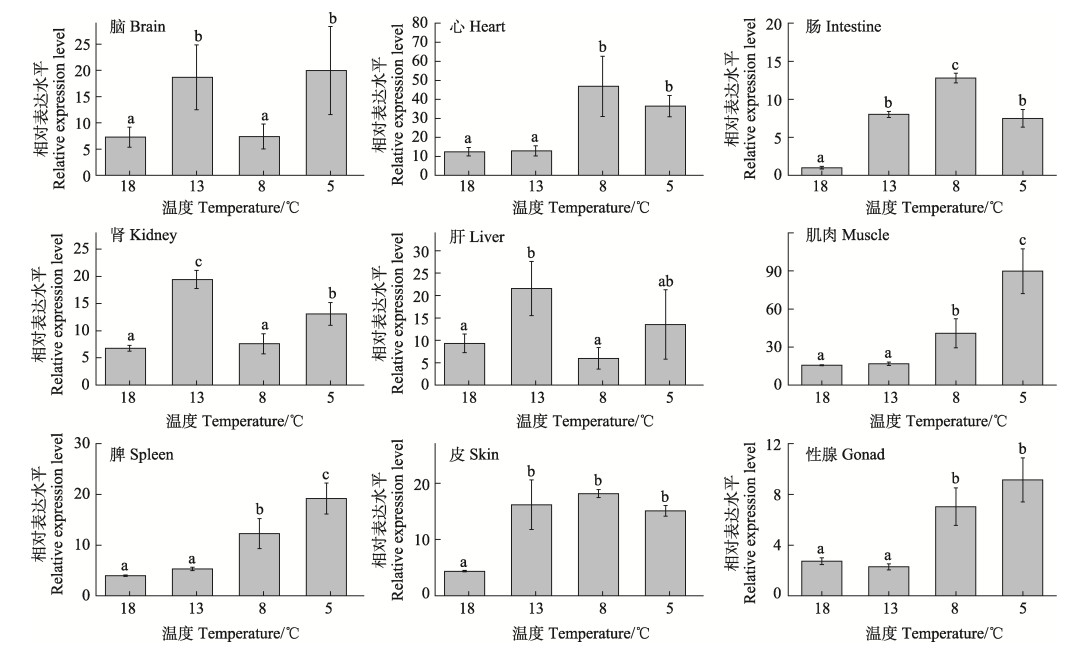
|
图 4 不同温度条件下CIRP基因在红鳍东方鲀各组织中的表达 Fig.4 Expression of CIRP gene in different tissues of T. rubripes at different temperatures |
红鳍东方鲀HMGB1基因在18℃的表达情况如图 5所示,在所检测的组织中该基因均有不同程度的表达,在肌肉中表达量最高(P < 0.05),在脑、心、肝和皮肤中也有较高的表达量,在其他组织中表达量较低。各组织不同温度处理24 h后的结果如图 6所示,随着温度的降低,除肝脏外各组织中HMGB1基因的表达量基本呈先升高后降低的趋势,并在8℃组达到最大值,显著高于其他各组(P < 0.05),其中,最小的增幅出现在肌肉组织,增幅3倍以上;最大增幅出现在肠组织中,增幅70倍以上;肝脏中HMGB1基因的表达量在13℃组和8℃组表达量显著高于对照组(P < 0.05),两组间无显著差异。

|
图 5 HMGB1基因组织表达 Fig.5 Tissue-specific expressions of HMGB1 gene |
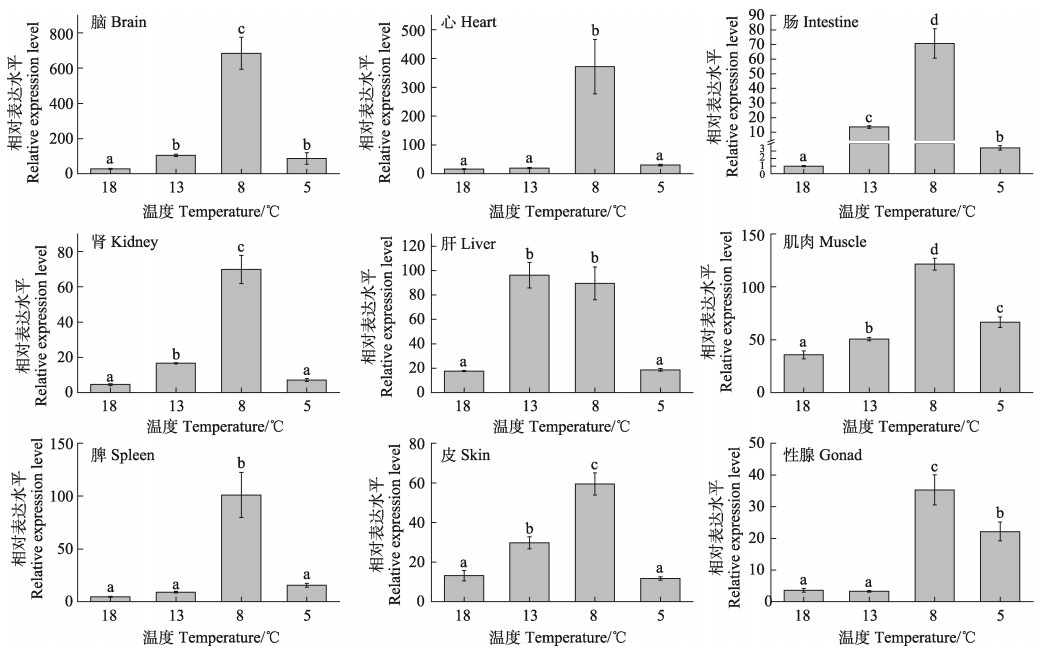
|
图 6 不同温度条件下HMGB1基因在红鳍东方鲀各组织中的表达 Fig.6 Expression of HMGB1 gene in different tissues of T. rubripes at different temperatures |
红鳍东方鲀YB-1基因在18℃的表达情况如图 7所示,该基因在肌肉中表达量最高(P < 0.05),在其他组织中表达量较低。各组织不同温度处理24 h后的结果如图 8所示,随着温度的降低,各组织中YB-1基因的表达量的升降程度有所不同,在大部分组织中(脑、心、肠、肾、肝、肌肉和脾)表达量呈先升高后降低再升高的趋势,在8℃组达到最小值,其中,主要表达组织(肌肉)中的表达量降幅超过5倍;除肠外,其他各组织在8℃组的基因表达量都显著低于其他各组(P < 0.05);在皮肤和性腺中,该基因的表达量在5℃组达到最大值,显著高于其他各组(P < 0.05)。

|
图 7 YB-1基因组织表达 Fig.7 Tissue-specific expressions of YB-1 gene |
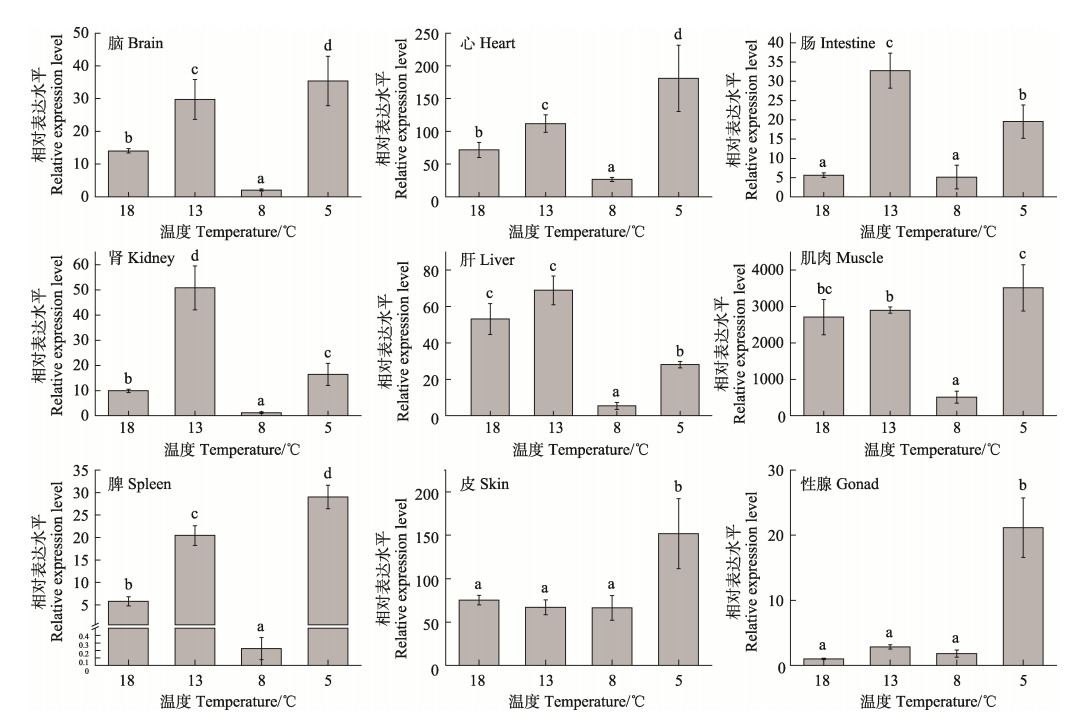
|
图 8 不同温度条件下YB1基因在红鳍东方鲀各组织中的表达 Fig.8 Expression of YB-1 gene in different tissues of T. rubripes at different temperatures |
抗冻蛋白具有控制冰晶的形成以及调节冰晶状态的作用,分布比较广泛,在动物、植物以及微生物中均可以发现AFP的存在(Duman et al, 2001; Bale et al, 2002; Davies et al, 2016)。在抗寒应用方面,转基因烟草、马铃薯获得了更高的抗冻能力(黄永芬等, 1997; 沈立晓等, 1998)。在斑马鱼胚胎的早期阶段,将AFPs导入斑马鱼胚胎可增强细胞的冷冻保护(Martínez-Páramo et al, 2009)。在红鳍东方鲀中,关于AFP基因与抗寒性关系的研究尚未见报道。本研究发现,在所检测的组织中(肝、脾、肾、脑、心、肠、肌肉和性腺),该基因呈现广泛性表达模式,这与Low等(1998)在杜父鱼(Myoxocephalus scorpius)中的研究结果相一致。同时,随着温度的降低,各组织中AFP基因的表达量基本呈显著升高的趋势,这可能是由于鱼类作为变温动物,当环境温度降低时,内部各组织都需面临低温的风险,AFP基因在应对低温胁迫时具有组织广适性,对各个组织都具有保护功能,其广泛分布以及低温诱导表达有利于对各组织的保护。另外,在本研究中,低温胁迫下AFP基因表达在各组织中的变化趋势一致,且都在最低温度5℃组达到最高值,据此推测,红鳍东方鲀AFP基因更多是通过直接保护组织免受冻害的方式来完成其抗寒性能。
3.2 低温胁迫下CIRP基因在各组织的表达分析冷诱导RNA结合蛋白CIRP最早在哺乳动物中发现,是一种参与机体应激调节的蛋白(Nishiyama et al, 1997),其基因表达量在冷刺激下急剧增加,具有介导冷诱导细胞生长抑制作用,因此,被视为冷诱导的标记基因(Nishiyama et al, 1998)。本研究中,CIRP基因在所检测的组织中均有不同程度的表达,在肌肉中表达量最高。这种广泛性表达的模式在多种鱼类的研究中都有发现,如牙鲆CIRP基因在脑、鳃、心、肌肉、肝、肠等组织都有不同程度的表达,具有较广的表达谱(胡金伟等, 2015);大黄鱼CIRP基因在肝脏中表达量最高,在肌肉、肾、鳃、皮肤、肠、脑、脾和心等组织中也有一定的表达(苗亮等, 2017),大西洋鲑(Salmo salar)肝、肾、心中也都能检测到CIRP基因表达,且组织间不存在显著差异(Feng et al, 2004)。以上结果表明,CIRP基因的组织分布呈现广泛性,又具有物种特异性。另外,本研究还发现,随着温度的降低,各组织中CIRP基因的表达量的升降程度有所不同,呈现出不同的表达谱,这可能与不同组织的生理特性、行使的生物学功能不同等因素有关。皮肤和肌肉中CIRP基因在低温下都呈现升高的趋势,且3个低温组都显著高于对照组,这与大黄鱼(苗亮等, 2017)的研究结果相类似,大黄鱼皮肤和肌肉CIRP基因在整个降温过程中呈持续升高趋势,且在最低温度组中表达量最高。另外,苗亮等(2017)发现,脾和肠中CIRP基因的表达量较低,且表达量随温度降低而降低,与本研究的结果有所不同,其原因可能是2种鱼类的抗寒性能不同。本研究涉及到的低温过程并未超越红鳍东方鲀的耐受能力,在实验期间,CIRP基因在大多组织中仍然能够发挥正常的调控作用。
3.3 低温胁迫下HMGB1基因在各组织的表达分析HMGB1是一种染色质相关的非组蛋白,对核小体形成、转录调控和炎症反应具有重要作用。在哺乳动物中,核HMGB1在核小体结构稳定性、DNA错配修复和基因表达调控中发挥重要作用(Bustin et al, 1999; Stros et al, 2010; Tang et al, 2010)。在硬骨鱼中也有报道,其在鱼类早期发育以及免疫应答方面起到重要作用(Zhao et al, 2011; Cai et al, 2014)。本研究发现,在所检测的组织中,该基因均有不同程度的表达,在肌肉中表达量最高,在脑、心、肝和皮肤中也有较高表达量,在其他组织中表达量较低。类似表达模式在多种鱼类中有报道,如牙鲆(胡金伟等, 2015)、红笛鲷(Lutjanus sanguineus) (Cai et al, 2014)、草鱼(Ctenopharyngodon idella) (Yang et al, 2013)、金鱼(Carassius auratus) (Xie et al, 2014)等。本研究还发现,随着温度的降低,除肝脏外,各组织中HMGB1基因的表达量基本呈先升高后降低的趋势,并在8℃组达到最大值,显著高于其他各组;在肝脏中也呈现相同的趋势,最高值出现在13℃组且与8℃组无显著差异。一方面,说明在低温胁迫下HMGB1基因发挥了调控功能(Vornanen et al, 2005);另一方面,5℃对红鳍东方鲀来说已经是难于生存的温度,因此,HMGB1基因在5℃组的低表达可能超越了该基因的调控极限。目前,在低温胁迫下鱼类HMGB1基因的研究报道仍然较少,更多的反应调节机制需要进一步研究。
3.4 低温胁迫下YB-1基因在各组织的表达分析YB-1基因作为一个胁迫响应基因,不同种类的应激,如冷休克、氧化剂应激、重金属应激、缺氧和紫外线照射等都能触发YB-1基因的响应(Koike et al, 1997; Kohno et al, 2003; Rauen et al, 2016; Li et al, 2018),在这些过程中,YB-1基因可以作为转录因子调节应激反应基因的转录,也可以同mRNA结合调节翻译过程。本研究中,YB-1基因在肌肉中表达量最高,显著高于在其他组织中的表达量。这种表达模式同其他物种的结果有所不同,如红螯螯虾(Cherax quadricarinatus) Y-box基因转录活性最强的组织是神经,在心、肠和肌肉中的表达量很低(孟庆国等, 2012);Y-box基因在中间球海胆(Strongylocentyotus intermedius)体腔液、管足、围口膜、雄性性腺、雌性性腺、肌肉和肠7个不同组织中均有表达,但差异不显著(田燚等, 2013);小鼠的YB-1基因在性腺中表达量最高,其次是肾、心、肌肉、肝等。以上结果表明,不同物种Y-box基因应对环境变化的方式有所不同,红鳍东方鲀YB-1基因可能在肌肉中发挥重要的环境调控作用。本研究还发现,在大多数组织中(其中包括主要的表达组织肌肉),8℃组的表达量最低,显著低于对照组,并且这些组织中5℃组YB-1基因表达又有不同程度的回升,这些结果一方面说明YB-1基因在红鳍东方鲀中受冷诱导,在肌肉中以降低表达的方式应对低温胁迫;另一方面,8℃时该基因发挥主要的调节作用。
4 结论本研究通过荧光定量PCR技术对红鳍东方鲀肝、脾、肾、脑、心、肠、肌肉、性腺和皮肤中4个与低温相关基因的表达量进行检测,结果显示,4个基因在不同温度条件下、不同组织中均有不同程度的表达,其中,皮肤和肌肉普遍呈现高表达,且在低温胁迫下存在显著性变化,这说明皮肤和肌肉作为外界环境的密切接触者,在应对温度变化方面发挥重要的作用。另外,从不同温度下4个基因的表达变化规律来看,8℃可能是红鳍东方鲀应对低温胁迫的关键调控点,过低的温度会造成其调控紊乱,此结果可为研究红鳍东方鲀低温应答调控机制提供相关依据。
ABDEL-TAWWAB M, WAFEEK M. Influence of water temperature and waterborne cadmium toxicity on growth performance and metallothionein-cadmium distribution in different organs of Nile tilapia, Oreochromis niloticus (L.). Journal of Thermal Biology, 2014, 45: 157-162 DOI:10.1016/j.jtherbio.2014.09.002 |
AL-FAGEEH M B, SMALES C M. Control and regulation of the cellular responses to cold shock: the responses in yeast and mammalian systems. Biochemical Journal, 2006, 397(2): 247-259 DOI:10.1042/BJ20060166 |
BALE J S. Insects and low temperatures: From molecular biology to distributions and abundance. Philosophical Transactions of the Royal Society of London, 2002, 357(1423): 849-862 DOI:10.1098/rstb.2002.1074 |
BUSTIN M. Regulation of DNA-dependent activities by the functional motifs of the high-mobility-group chromosomal proteins. Molecular Cell Biology, 1999, 19: 5237-5246 DOI:10.1128/MCB.19.8.5237 |
CAI J, XIA H, HUANG Y, et al. Molecular cloning and characterization of high mobility group box1 (Ls-HMGB1) from humphead snapper, Lutjanus sanguineus. Fish and Shellfish Immunology, 2014, 40(2): 539-544 DOI:10.1016/j.fsi.2014.08.004 |
CAI L Y, NIAN L Y, CAO A L, et al. Research progress in the structure-function relationship of aquatic antifreeze proteins and its application in food processing and storage. Science and Technology of Food Industry, 2018, 39(22): 346-352 [蔡路昀, 年琳玉, 曹爱玲, 等. 水产源抗冻蛋白构效关系及在食品加工储藏中应用的研究进展. 食品工业科技, 2018, 39(22): 346-352 DOI:10.13386/j.issn1002-0306.2018.22.060] |
CAI X, GAO C, SU B, et al. Expression profiling and microbial ligand binding analysis of high-mobility group box-1 (HMGB1) in turbot (Scophthalmus maximus L.). Fish and Shellfish Immunology, 2018, 78: 100-108 DOI:10.1016/j.fsi.2018.04.025 |
CUI J, LI J L, WANG Z Y, et al. Cloning of gene of carrot antifreeze protein and its transformation to sugar beet. China Beet and Sugar, 2019(3): 18-22 [崔杰, 李俊良, 王琮玉, 等. 胡萝卜抗冻蛋白基因克隆及对甜菜遗传转化的研究. 中国甜菜糖业, 2019(3): 18-22] |
DAVIES P L. Antarctic moss is home to many epiphytic bacteria that secrete antifreeze proteins. Environmental Microbiology Reports, 2016, 8(1): 1-2 DOI:10.1111/1758-2229.12360 |
DUMAN J G, OLSEN T M. Thermal hysteresis protein activity in bacteria, fungi, and phylogenetically diverse plants. Cryobiology, 1993, 30(3): 322-328 DOI:10.1006/cryo.1993.1031 |
DUMAN J G. Antifreeze and ice nucleator proteins in terrestrial arthropods. Annual Review of Physiology, 2001, 63: 327-357 DOI:10.1146/annurev.physiol.63.1.327 |
ELISEEVA I A, KIM E R, GURYANOV S G, et al. Y-box- binding protein 1 (YB-1) and its functions. Biochemistry (Moscow), 2011, 76(13): 1402-1433 DOI:10.1134/S0006297911130049 |
FENG P, ZARATE J, CHOUDHURY A, et al. Osmotic stress of salmon stimulates upregulation of a cold inducible RNA binding protein (CIRP) similar to that of mammals and amphibians. Biochimie, 2004, 86(7): 451-461 DOI:10.1016/j.biochi.2004.06.006 |
HE J, XIE T L, LI X, et al. Molecular cloning of Y-box binding protein-1 from mandarin fish and its roles in stress-response and antiviral immunity. Fish and Shellfish Immunology, 2019, 93: 406-415 DOI:10.1016/j.fsi.2019.07.069 |
HU J W, YOU F, WANG Q, et al. Cloning and expression analysis of cold-tolerance related genes, CIRP and HMGB1, in Paralichthys olivaceus. Marine Sciences, 2015, 39(1): 29-38 [胡金伟, 尤锋, 王倩, 等. 牙鲆耐寒相关基因CIRP、HMGB1的克隆及表达特征分析. 海洋科学, 2015, 39(1): 29-38] |
HUANG Y F, WANG Q Y, FU G R, et al. The research on introducing flounder antifreeze protein gene (afp) into tomato. Chinese Biochemical Journal, 1997, 13(4): 418-422 [黄永芬, 汪清胤, 付桂荣, 等. 美洲拟鲽抗冻蛋白基因(afp)导入番茄的研究. 生物化学杂志, 1997, 13(4): 418-422] |
ISLAM M A, UDDIN M H, UDDIN M J, et al. Temperature changes influenced the growth performance and physiological functions of Thai pangas Pangasianodon hypophthalmus. Aquaculture Reports, 2019, 13: 100179 DOI:10.1016/j.aqrep.2019.100179 |
ISLAM M J, SLATER M J, BÖGNER M, et al. Extreme ambient temperature effects in European seabass, Dicentrarchus labrax: Growth performance and hemato- biochemical parameters. Aquaculture, 2020, 522: 735093 DOI:10.1016/j.aquaculture.2020.735093 |
KLOKS C P A M, SPRONK C, LASONDER E, et al. The solution structure and DNA-binding properties of the cold-shock domain of the human Y-box protein YB-1. Journal of Molecular Biology, 2002, 316(2): 317-326 DOI:10.1006/jmbi.2001.5334 |
KOHNO K, IZUMI H, UCHIUMI T, et al. The pleiotropic functions of the Y-box-binding protein, YB-1. Bioessays, 2003, 25(7): 691-698 DOI:10.1002/bies.10300 |
KOIKE K, UCHIUMI T, OHGA T, et al. Nuclear translocation of the Y-box binding protein by ultraviolet irradiation. FEBS Letters, 1997, 417(3): 390-394 DOI:10.1016/S0014-5793(97)01296-9 |
LANGE S S, VASQUEZ K M. HMGB1: The jack of all trades protein is a master DNA repair mechanic. Molecular Carcinogenesis: Published in cooperation with the University of Texas MD Anderson Cancer Center, 2009, 48(7): 571-580 |
LI G, WANG L, WANG Y, et al. Developmental characterization and environmental stress responses of Y-box binding protein 1 gene (AccYB-1) from Apis cerana cerana. Gene, 2018, 674: 37-48 DOI:10.1016/j.gene.2018.06.071 |
LOW W K, MIAO M, EWART K V, et al. Skin-type antifreeze protein from the shorthorn sculpin, Myoxocephalus scorpius. Expression and characterization of am r9, 700 recombinant protein. Journal of Biological Chemistry, 1998, 273(36): 23098-23103 DOI:10.1074/jbc.273.36.23098 |
MARTÍNEZ-PÁRAMO S, BARBOSA V, PÉREZ-CEREZALES S, et al. Cryoprotective effects of antifreeze proteins delivered into zebrafish embryos. Cryobiology, 2009, 58(2): 128-133 DOI:10.1016/j.cryobiol.2008.11.013 |
MENG Q G, CHEN J, HUANG Y Q, et al. Molecular cloning and expression analysis of the cold shock protein Y-box coding gene of red claw crayfish, Cherax quadricarinatus. Freshwater Fisheries, 2012(6): 16-22 [孟庆国, 陈静, 黄艳青, 等. 红螯螯虾冷休克蛋白Y-box编码基因的克隆及表达分析. 淡水渔业, 2012(6): 16-22] |
MIAO L, LI M Y, CHEN Y Y, et al. Cloning of cold inducible RNA-binding protein(CIRP) gene in Larimichthys crocea and its expression analysis under cold treatments. Journal of Fisheries of China, 2017, 41(4): 481-489 [苗亮, 李明云, 陈莹莹, 等. 大黄鱼冷诱导结合蛋白(CIRP)基因cDNA克隆及低温胁迫对其时空表达的影响. 水产学报, 2017, 41(4): 481-489] |
NISHIYAMA H, ITOH K, KANEKO Y, et al. A glycine-rich rna-binding protein mediating cold-inducible suppression of mammalian cell growth. Journal of Cell Biology, 1997, 137(4): 899-908 DOI:10.1083/jcb.137.4.899 |
NISHIYAMA H, XUE J H, SATO T, et al. Diurnal change of the cold-inducible RNA-binding protein (CIRP) expression in mouse brain. Biochemical and Biophysical Research Communications, 1998, 245(2): 534-538 DOI:10.1006/bbrc.1998.8482 |
PARK J S, ARCAROLI J, YUM H K, et al. Activation of gene expression in human neutrophils by high mobility group box 1 protein. American Journal of Physiology-Cell Physiology, 2003, 284(4): C870-C879 DOI:10.1152/ajpcell.00322.2002 |
RAUEN T, FRYE B C, WANG J, et al. Cold shock protein YB-1 is involved in hypoxia-dependent gene transcription. Biochemical and biophysical research communications, 2016, 478(2): 982-987 DOI:10.1016/j.bbrc.2016.08.064 |
RAYMOND J A, DEVRIES A L. Adsorption inhibition as a mechanism of freezing resistance in polar fishes. Proceedings of the National Academy of Sciences, 1977, 74(6): 2589-2593 DOI:10.1073/pnas.74.6.2589 |
SHEN L X, CHEN L G. Research progress of cold resistance genetic engineering of plant. Journal of Biology, 1998, 15(6): 2-4 [沈立晓, 陈力耕. 植物抗寒基因工程的研究进展. 生物学杂志, 1998, 15(6): 2-4] |
STROS M. HMGB proteins: Interactions with DNA and chromatin. Biochim Biophys Acta 2010, 1799(1/2): 101-113 |
SWAMYNATHAN S K, NAMBIAR A, GUNTAKA R V. Role of single-stranded DNA regions and Y-box proteins in transcriptional regulation of viral and cellular genes. FASEB Journal, 1998, 12(7): 515-522 DOI:10.1096/fasebj.12.7.515 |
TANG D, KANG R, ZEH H J, et al. High-mobility group box 1, oxidative stress, and disease. Antioxidants and Redox Signaling, 2010, 14(7): 1315-1335 |
TIAN Y, ZHANG B L, CHANG Y Q, et al. Molecular characteristics and expression analysis of Y-box gene from sea urchin Strongylocentyotus intermedius. Journal of Fisheries of China, 2013, 37(3): 376-389 [田燚, 张丙龙, 常亚青, 等. 中间球海胆Y-box基因分子特性和表达分析. 水产学报, 2013, 37(3): 376-389] |
VORNANEN M, HASSINEN M, KOSKINEN H, et al. Steady- state effects of temperature acclimation on the transcriptome of the rainbow trout heart. American Journal of Physiology, Regulatory, Integrative and Comparative Physiology, 2005, 289(4): R1177-R1184 |
WANG S Y, LI X K, ZHOU Y F, et al. Research progress in antifreeze mechanism and genetic engineering of antifreeze protein. Journal of Beijing Technology and Business University (Natural Science), 2012, 30(2): 58-63 [汪少芸, 李晓坤, 周焱富, 等. 抗冻蛋白的作用机制及基因工程研究进展. 北京工商大学学报(自然科学版), 2012, 30(2): 58-63] |
WEN B, JIN S R, CHEN Z Z, et al. Plasticity of energy reserves and metabolic performance of discus fish (Symphysodon aequifasciatus) exposed to low-temperature stress. Aquaculture, 2017, 481: 169-176 |
XIE J, HODGKINSON J W, LI C, et al. Identification and functional characterization of the goldfish (Carassius auratus L.) high mobility group box 1 (HMGB1) chromatin- binding protein. Developmental and Comparative Immunology, 2014, 44(1): 245-253 |
XU D, YOU Q, CHI C, et al. Transcriptional response to low temperature in the yellow drum (Nibea albiflora) and identification of genes related to cold stress. Comparative Biochemistry and Physiology Part D: Genomics and Proteomics, 2018, 28: 80-89 |
XU K, CHEN D H, WANG Z, et al. Sequencing analysis and expression characteristics of AFP gene in Bombus terriestris. Journal of Shanxi Agricultural University (Natural Science), 2019, 39(5): 74-81 [徐凯, 陈东海, 王志, 等. 熊蜂抗冻蛋白基因序列分析及表达特性研究. 山西农业大学学报(自然科学版), 2019, 39(5): 74-81] |
YANG C, PENG L, SU J. Two HMGB1 genes from grass carp Ctenopharyngodon idella mediate immune responses to viral/bacterial PAMPs and GCRV challenge. Developmental and Comparative Immunology, 2013, 39(3): 133-146 |
ZHANG J F, TAO X F, HAN B S. Function, evolution, and application of antifreeze proteins in Antarctic fish. Journal of Fishery Sciences of China, 2020, 27(3): 355-361 [张俊芳, 陶筱帆, 韩兵社. 南极鱼抗冻蛋白功能和进化及其应用研究进展. 中国水产科学, 2020, 27(3): 355-361] |
ZHAO X, KUJA-PANULA J, ROUHIAINEN A, et al. High mobility group box-1 (HMGB1; amphoterin) is required for zebrafish brain development. Journal of Biological Chemistry, 2011, 286(26): 23200-23213 |
ZHONG Q W, FAN Q J. Advances in fish antifreeze protein research. Acta Biochimica et Biophysica Sinica, 2002, 34(2): 124-130 [钟其旺, 樊廷俊. 鱼类抗冻蛋白的研究进展. 生物化学与生物物理学报(英文版), 2002, 34(2): 124-130] |



