 渔业生物学特征研究
渔业生物学特征研究
2. 青岛市海洋科学与技术试点国家实验室海洋生态与环境科学功能实验室 山东 青岛 266237;
3. 东营市自然资源和规划局东营港经济开发区分局 山东 东营 257020;
4. 东营市海洋发展研究院 山东 东营 257091
 (Liza haematocheila)的渔业生物学特征及资源状况,本研究根据2020年4—11月黄河口渔业生产定置网的采样数据,研究了黄河口水域重要渔业种类
(Liza haematocheila)的渔业生物学特征及资源状况,本研究根据2020年4—11月黄河口渔业生产定置网的采样数据,研究了黄河口水域重要渔业种类 群体的体长体重分布、体长–体重关系、繁殖、生长和死亡等渔业生物学特征和开发率。结果显示,
群体的体长体重分布、体长–体重关系、繁殖、生长和死亡等渔业生物学特征和开发率。结果显示, 体长分布范围为45~460 mm,优势体长组为55~185 mm;体重范围为2~1100 g,优势体重组为2~80 g。方差分析表明,
体长分布范围为45~460 mm,优势体长组为55~185 mm;体重范围为2~1100 g,优势体重组为2~80 g。方差分析表明, 的平均体长、体重均存在显著的月间差异;各月及全年
的平均体长、体重均存在显著的月间差异;各月及全年 的体长–体重关系均呈显著的幂函数关系,生长类型为负异速生长。黄河口近岸海域,
的体长–体重关系均呈显著的幂函数关系,生长类型为负异速生长。黄河口近岸海域, 在7月肥满度最大,而6月最小;产卵盛期为4—5月。
在7月肥满度最大,而6月最小;产卵盛期为4—5月。 的生长速率为0.31 a−1,总死亡系数为1.42 a−1,自然死亡系数估算结果为0.51 a−1,捕捞死亡系数为0.91 a−1,其开发率为0.64,
的生长速率为0.31 a−1,总死亡系数为1.42 a−1,自然死亡系数估算结果为0.51 a−1,捕捞死亡系数为0.91 a−1,其开发率为0.64, 种群资源被过度利用。定置网渔业生产对于黄河口渔业资源有一定的破坏作用,尤其对幼鱼和补充群体资源影响较大,应对定置网渔业生产采取必要的管理措施。
种群资源被过度利用。定置网渔业生产对于黄河口渔业资源有一定的破坏作用,尤其对幼鱼和补充群体资源影响较大,应对定置网渔业生产采取必要的管理措施。 渔业生物学特征
渔业生物学特征 2. Pilot National Laboratory for Marine Science and Technology (Qingdao), Laboratory for Marine Ecology and Environmental Science, Qingdao, Shandong 266237, China;
3. Dongying Natural Resources and Planning Bureau Dongying Port Economic Develop Area Substation, Dongying, Shandong 257020;
4. Marine Development Research Institute, Dongying, Shandong 257091, China
黄河口及其邻近海域受到黄河调水调沙、污水排放、过度捕捞等人类活动以及气候变化的影响,渔业生物栖息环境遭到破坏,渔业生物正常繁殖和生长受到了严重的影响,渔业资源向着低营养级群体发展。同时,资源结构也有较大变化,自20世纪80年代以来,黄河口海域渔业资源持续衰退,具有较高经济价值的传统捕捞鱼类如带鱼(Trichiurus lepturus)、小黄鱼(Larimichthys polyactis)等资源显著衰退(张旭等, 2009),价值低的小型鱼类和虾蟹类成为该水域的主要渔获物(朱鑫华等, 2001; 杨涛等, 2018)。为促进生态环境修复和渔民增收,渔业管理部门开展了增殖放流、限制捕捞等资源养护措施。因此,开展鱼类生物学特征研究,可为渔业资源合理利用和增殖养护提供科学依据,为制定相关渔业政策提供支持。








本研究根据2020年4—11月黄河口近岸海域定置网采样数据,研究

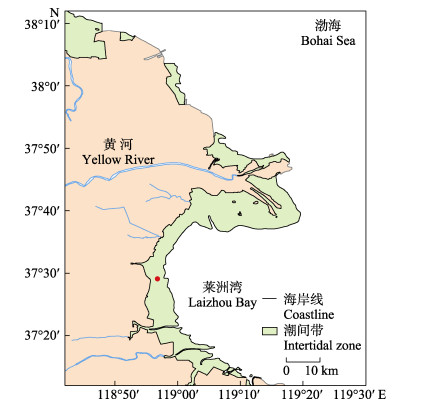
渔获数据来源于2020年4—11月在东营黄河口近岸海域(37°26′52″N, 118°57′59″E附近)(图 1)逐月进行的定置网渔业生产调查。每月调查时间在大潮期(农历初三或十八)进行,每网次作业时间约为24 h,共采集4个网次。调查采样的须子网主尺度为250 m (网长) × 1.78 m (网高),囊网网目为18 mm。
|
图 1 黄河口定置网调查站位 Fig.1 Set nets survey station in Yellow River estuary waters 图中实心圆表示调查采样点。 The solid circle in the figure indicates the survey sampling point. |
依据《海洋调查规范第6部分:海洋生物调查》(GB/T12763.6–2007)对渔获物进行分类、种类鉴定和生物学测定。每个网次随机取50尾样品,测量
|
|
表 1  |
利用频率分布法对


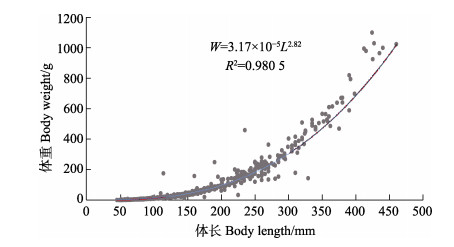
| $ W=aL^{b } $ | (1) |
式中,W为鱼体重(g),L为鱼体长(mm),a和b为待确定的参数。a表示鱼类生长的条件因子,b为异速生长因子,可以反映鱼类生长发育的不均匀性。当b=3时,为等速生长,体重体长同速增长;当b < 3时,为负异速增长,体重较体长增长慢;当b > 3时,为正异速生长,体重较体长增长快(Froese, 2006)。
采用协方差分析(ANCOVA)检验全年及月间个体体长−体重关系参数的差异,使用t检验分析参数b与3的差异,检验公式:
| $ t = \frac{{{\text{SD}}(L)}}{{SD(W)}} \times \frac{{|b - 3|}}{{\sqrt {1 - {r^2}} }} \times \sqrt {n - 2} $ | (2) |
式中,SD(L)、SD(W)分别为体长、体重对数的标准差,n、r分别为样本量和相关系数(Morey et al, 2003)。
1.3.3 肥满度肥满度作为反映鱼类生长情况的指标,一定程度上也可以反映鱼类生长环境的优劣。采用以下公式进行计算(Froese, 2006):
| $ F = \frac{{W \times 100}}{{{L^3}}} $ | (3) |
式中,F为鱼类肥满度,W为鱼类体重(g),L为鱼类体长(mm)。
1.3.4 性腺成熟度性腺成熟度根据《海洋调查规范第6部分:海洋生物调查》(GB/T12763.6-2007)要求,目测法进行划分,统计
采用生长方程VBGF来描述
| $ {L_t} = {L_\infty }\{ 1 - {\text{exp}}[ - K(t - {t_0})]\} $ | (4) |
式中,
理论初始年龄t0根据Pauly经验公式进行估算(Pauly, 1979; Pauly et al, 1981):
| $ {\text{ln}}(- {t_0}) = - 0.392\;2 - 0.275{\text{ }}2{\text{ln}}{L_\infty } - 1.038{\text{ln}}K $ | (5) |
式中,
利用体长转换渔获曲线(length converted catch curves)计算总死亡系数(Z) (Pauly, 1979),公式如下:
| $ {\text{ln(}}{N_t}{\text{/}}\Delta t) = a + bt' $ | (6) |
式中,Nt为t体长组鱼类的尾数,Δt为相应体长组中鱼类从最小体长生长至最大体长的时间,t′为相应体长组对应的相对年龄(years–t0),拟合的数据点以“回归不采用未全部补充的年龄段和靠近渐近体长的年龄段”为选取原则(Pauly, 1990),总死亡系数(Z)为拟合出曲线的相反数(−b)。
一般使用Pauly经验公式来概算自然死亡系数(M) (Pauly, 1980):
| $ \begin{gathered} {\text{lg}}M = - 0.006{\text{ }}6 - 0.279{\text{ }}0{\text{ lg}}{L_\infty } + \hfill \\ \;\;\;\;\;\;\;\;\;0.654{\text{ }}3{\text{ lg}}K + 0.463{\text{ }}4{\text{ lg}}T \hfill \\ \end{gathered} $ | (7) |
式中,
捕捞死亡系数(F)计算公式为:
| $ F=Z–M $ | (8) |
开发率(E)计算公式为:
| $ E=F/Z $ | (9) |
一般认为最适开发率为0.5,并以此来衡量鱼类开发利用的程度(Gulland, 1971)。
捕捞选择性(S)是根据渔获曲线方程计算而得,为线性回归中未被用到的数据点所对应的观测值和期望值的比值(何宝全等, 1988),开捕体长(L50)为S=0.5时所对应的体长。捕捞选择性和鱼类体长的关系表示为:
| $ {S_j} = \frac{1}{{1 + {e^{ - r({L_j} - {L_{50}})}}}} $ | (10) |
式中,Lj为体长,Sj为对应的选择性,L50为开捕体长,r为常数。
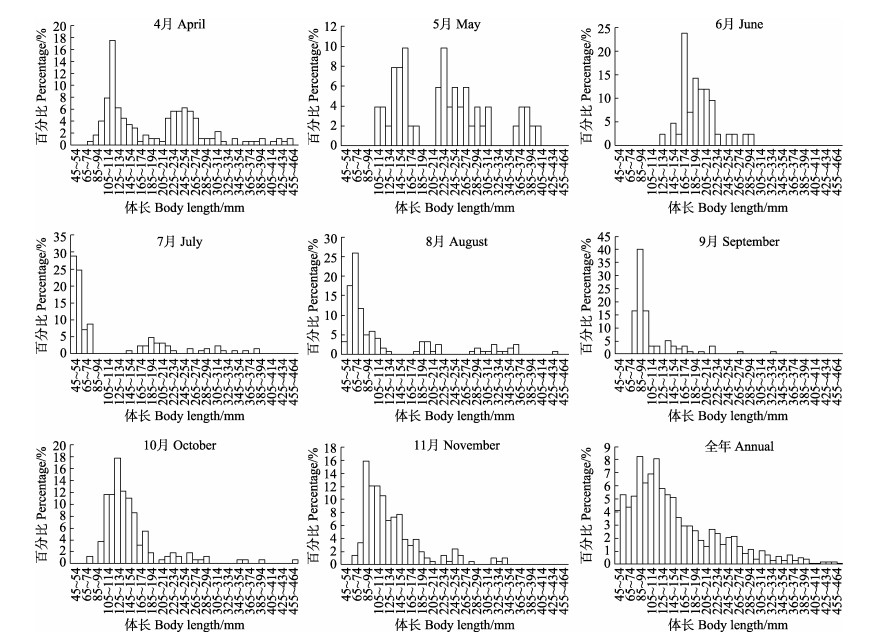
2 结果 2.1 体长、体重组成4—11月,黄河口近岸海域

|
图 2 4—11月黄河口近岸海域 |
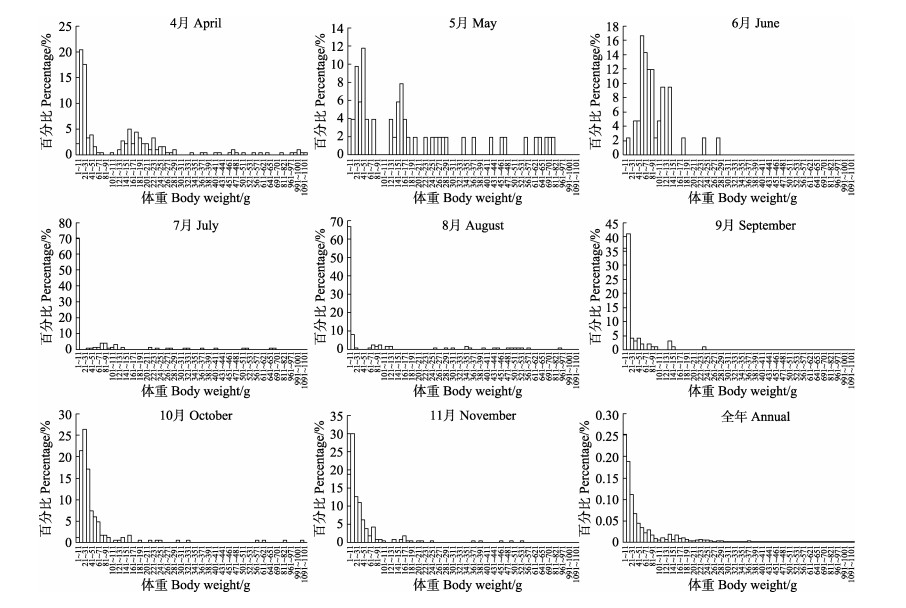
调查期间,

|
图 3 4—11月黄河口近岸海域 |
黄河口近岸海域


|
图 4 黄河口近岸海域 |
|
|
表 2 4—11月黄河口近岸海域 |
黄河口近岸海域



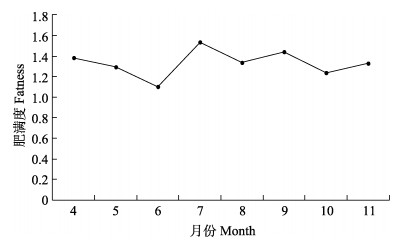
|
图 5 4—11月黄河口近岸海域 |
不同月


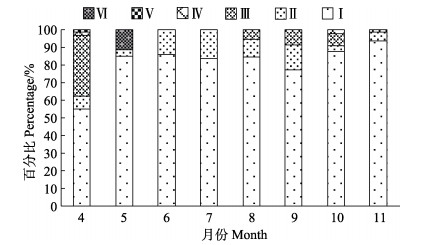
|
图 6 黄河口近岸海域 |
利用ELEFAN方法拟合

| $ L_{t}=608(1–e^{–0.31(t+0.39)}) $ |
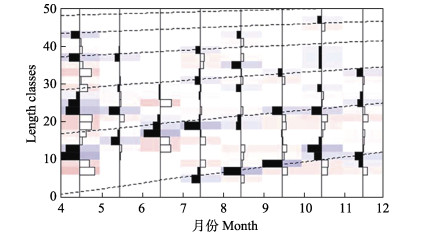
|
图 7 黄河口近岸海域 |




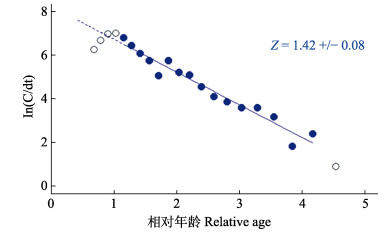
|
图 8 黄河口近岸海域 |
根据渔获曲线,利用公式7,求得现阶段黄河口近岸海域生产调查中
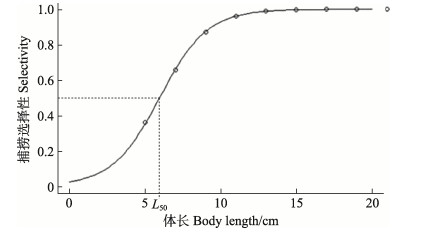
|
图 9 黄河口近岸海域 |
研究表明,黄河口近岸海域





黄河口近岸海域捕获的






黄河口近岸海域








研究表明,渐近体长L∞的大小一定程度上可以反映鱼类种群构成的变化趋势,过度捕捞会导致鱼类种群结构小型化和低龄化,鱼类的渐近体长也会随之减小(林龙山, 2009; 叶金清等, 2020)。黄河口近岸海域定置网调查获取的



本研究结果表明,







对




在加强对


CHENG Q T, ZHOU C W. Fishes of Shandong. Ji' nan: Shandong Science and Technology Press, 1997: 243-244 [成庆泰, 周才武. 山东鱼类志. 济南: 山东科学技术出版社, 1997: 243-244]
|
DONG J, WANG C, TANG M Z, et al. Relationship between body length and body weight of Pacific sand lance in the Yellow Sea. Fisheries Science, 2004, 23(10): 9-11 [董婧, 王冲, 唐明芝, 等. 黄海区玉筋鱼体长和体重的关系. 水产科学, 2004, 23(10): 9-11 DOI:10.3969/j.issn.1003-1111.2004.10.003] |
FABENS A J. Properties and fitting of Von Bertalanffy growth curve. Growth, 1965, 29(3): 265-289 |
FROESE R. Cube law, condition factor and weight-length relationships: History, meta-analysis and recommendations. Journal of Applied Ichthyology, 2006, 22(4): 241-253 DOI:10.1111/j.1439-0426.2006.00805.x |
GULLAND J A. The fish resources of the oceans. FAO Fisheries Technical Paper No. 97, 1971, 425
|
HE B Q, LI H Q. Stock assessment of Collichthys lucidus in Pearl River estuary. Journal of Fisheries of China, 1988, 12(2): 124-134 [何宝全, 李辉权. 珠江河口棘头梅童鱼的资源评估. 水产学报, 1988, 12(2): 124-134] |
HU Z J, SHAN X J, YANG T, et al. Preliminary evaluation of summer fishing moratorium in the Bohai Sea. Progress in Fishery Sciences, 2020, 41(5): 13-21 [胡芷君, 单秀娟, 杨涛, 等. 渤海伏季休渔效果初步评价. 渔业科学进展, 2020, 41(5): 13-21 DOI:10.19663/j.issn2095-9869.20190623001] |
JI Y, ZHAO F, YANG Q, et al. Sagittal otolith morphology and the relationship between its mass and the age of Liza haematocheila in the Yangtze estuary, China. Chinese Journal of Applied Ecology, 2018, 29(3): 953-960 [纪严, 赵峰, 杨琴, 等. 长江口  矢耳石形态特征及质量与年龄的关系. 应用生态学报, 2018, 29(3): 953-960] 矢耳石形态特征及质量与年龄的关系. 应用生态学报, 2018, 29(3): 953-960] |
LI M D, WANG Z W. The age and growth of mullet in Bohai Sea. Acta Oceanologica Sinica, 1982, 4(4): 508-515 [李明德, 王祖望. 渤海梭鱼的年龄与生长. 海洋学报(中文版), 1982, 4(4): 508-515] |
LIN L S. Study on the fishery biology and management strategy of Larimichthys polyactis in the southern Yellow Sea and the East China Sea. Doctoral Dissertation of Ocean University of China, 2009 [林龙山. 黄海南部和东海小黄鱼渔业生物学及其管理策略研究. 中国海洋大学博士研究生学位论文, 2009]
|
LUAN J, XU B D, XUE Y, et al. Size distribution and length weight relationships in Pholis fangi in Haizhou Bay. Journal of Fishery Sciences of China, 2017, 24(6): 1323-1331 [栾静, 徐宾铎, 薛莹, 等. 海州湾方氏云鳚体长与体重分布特征及其关系. 中国水产科学, 2017, 24(6): 1323-1331] |
Ministry of Agriculture of the People's Republic of China. Biological resource conservation provisions in the Bohai Sea. Gazette of the Ministry of Agriculture of the People' s Republic of China, 2004(4): 4-9 [中华人民共和国农业部. 渤海生物资源养护规定. 中华人民共和国农业部公报, 2004(4): 4-9] |
MOREY G, MORANTA J, MASSUTÍ E, et al. Weight-length relationships of littoral to lower slope fishes from the western Mediterranean. Fisheries Research, 2003, 62(1): 89-96 DOI:10.1016/S0165-7836(02)00250-3 |
PAN H J. Artificial reproduction technology of Liza haematocheila. Journal of Aquaculture, 2005, 26(2): 24-26 [潘海军. 梭鱼的人工繁殖技术. 水产养殖, 2005, 26(2): 24-26 DOI:10.3969/j.issn.1004-2091.2005.02.008] |
PAULY D, David N. ELEFAN I. A BASIC program for the objective extraction of growth parameters from length- frequency data. Meeresforschung, 1981, 28(4): 205-211 |
PAULY D. Length-converted catch curves and the seasonal growth of fishes. Fishbyte, 1990, 8(3): 33-38 |
PAULY D. Length-converted catch curves: A powerful tool for fisheries research in the Tropics (part 2). Fishbyte, 1984, 2(2): 24-30 |
PAULY D. On the relationships between natural mortality, growth parameters and mean environmental temperature in 175 fish stocks. ICES Journal of Marine Science, 1980, 39(2): 175-192 DOI:10.1093/icesjms/39.2.175 |
PAULY D. Theory and management of tropical multispecies stocks: A review, with emphasis on the Southeast Asian demersal fisheries. Metro Manila: ICLARM, 1979
|
RICKER W E. Linear regressions in fishery research. Journal of the Fisheries Research Board of Canada, 1973, 30(3): 409-434 DOI:10.1139/f73-072 |
XU Q C, LI X S, SUN S, et al. Selectivity of codend mesh of beam trawl in Laizhou Bay in autumn. Progress in Fishery Sciences, 2020, 41(6): 19-27 [许庆昌, 李显森, 孙珊, 等. 秋季莱州湾弓子网网囊网目尺寸选择性研究. 渔业科学进展, 2020, 41(6): 19-27] |
YANG T, SHAN X J, JIN X S, et al. Long-term changes in keystone species in fish community in spring in Laizhou Bay. Progress in Fishery Sciences, 2018, 39(1): 1-11 [杨涛, 单秀娟, 金显仕, 等. 莱州湾春季鱼类群落关键种的长期变化. 渔业科学进展, 2018, 39(1): 1-11] |
YE J Q, LIU G Z, YUAN X T, et al. Exploitation and protection of mullet Liza haematocheila stocks in Liaohe estuary based on biological characteristics. Journal of Dalian Ocean University, 2020, 35(2): 302-307 [叶金清, 柳圭泽, 袁秀堂, 等. 基于生物学特征的辽河口  资源开发与保护. 大连海洋大学学报, 2020, 35(2): 302-307] 资源开发与保护. 大连海洋大学学报, 2020, 35(2): 302-307] |
ZHANG G Z, LI X S, ZHU J C, et al. The growth characteristics of small yellow croaker Larimichthys polyactis (Bleeker, 1987) under yearling in the central and southern Yellow Sea. Progress in Fishery Sciences, 2010, 31(3): 15-22 [张国政, 李显森, 朱建成, 等. 黄海中南部小黄鱼当年幼鱼生长特征的研究. 渔业科学进展, 2010, 31(3): 15-22] |
ZHANG X, ZHANG X M, GAO T X, et al. Composition of catches by beam trawl and its seasonal variations in Yellow River estuary. Progress in Fishery Sciences, 2009, 30(6): 118-124 [张旭, 张秀梅, 高天翔, 等. 黄河口海域弓子网渔获物组成及其季节变化. 渔业科学进展, 2009, 30(6): 118-124] |
ZHU L X, HOU G, LIANG Z L. Parameter estimation of the weight-length relationship of Japanese anchovy in the north Yellow Sea using Bayesian methods. Journal of Fishery Sciences of China, 2015, 22(4): 757-769 [朱立新, 侯刚, 梁振林. 基于贝叶斯方法的黄海北部鳀鱼体长与体重关系式参数估计. 中国水产科学, 2015, 22(4): 757-769] |
ZHU X H, LIAO F, LIU D, et al. Spatiotemporal pattern and dominant component of fish community in the Yellow River estuary and its adjacent waters. Studia Marina Sinica, 2001, 141-151 [朱鑫华, 缪锋, 刘栋, 等. 黄河口及邻近海域鱼类群落时空格局与优势种特征研究. 海洋科学集刊, 2001, 141-151] |
ZHU Y D, ZHANG C L, CHENG Q T. Fishes of the East China Sea. Beijing: Science Press, 1963: 199-200 [朱元鼎, 张春霖, 成庆泰. 东海鱼类志. 北京: 科学出版社, 1963: 199-200]
|
ZHUANG P, WANG Y H, LI S F, et al. Fishes of Yangtze River estuary. Shanghai: Shanghai Scientific and Technical Publishers, 2006: 188-190 [庄平, 王幼槐, 李圣法, 等. 长江口鱼类(精). 上海: 上海科技出版社, 2006: 188-190]
|



