2. 中国水产科学研究院南海水产研究所农业农村部南海渔业资源开发利用重点实验室 广东省渔业生态环境重点实验室 广东 广州 510300;
3. 宁夏泰嘉渔业有限公司 宁夏 石嘴山 753000;
4. 中国水产科学研究院东海水产研究所 上海 200090
2. South China Sea Fisheries Research lnstitute, Chinese Academy of Fishery Sciences; Key Laboratory of South China Sea Fishery Resources Exploitation and Utilization, Ministry of Agriculture and Rural Affairs; Guangdong Provincial Key Laboratory of Fishery Ecology and Environment, Guangzhou, Guangdong 510300, China;
3. Ningxia Taijia Fisheries Limited Company, Shizuishan, Ningxia 753000, China;
4. East China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Shanghai 200090, China
浮游微藻是养殖池塘生态系统物质循环中不可或缺的重要组成部分之一,它们可以调节池塘水体的透明度、酸碱度,吸收水体的营养盐,增加水中溶解氧(DO),为养殖生物提供优质活饵料等(Muller-Feuga, 2000; 彭聪聪等, 2010)。不同地区、不同类型养殖水体的浮游微藻群落组成有所不同。彭聪聪等(2012)研究发现,珠江河口区的罗非鱼(Oreochromis mossambicus)主要以颤藻(Oscillatoria sp.)、平裂藻(Merismopedia sp.)等蓝藻(Cyanophyta)和小球藻(Chlorella sp.)、空星藻(Coelastrum sp.)等绿藻(Chlorophyta)为优势种,而生物量优势种多为裸藻(Euglenophyta)、甲藻(Dinophyta)和隐藻(Cryptophyta)。查广才等(2006)、彭聪聪等(2011)研究表明,低盐度集约化养殖池塘以绿藻和蓝藻为主,其次是硅藻(Bacillarionphyta),在养殖中后期,蓝藻数量和生物量均为绝对优势种。侯兴等(2021)研究发现,在北方桑沟湾水域中,浮游植物以硅藻为绝对优势种,其中,具槽帕拉藻(Paralia sulcate)为全年优势种。乔玲等(2021)研究表明,山东省虾–蟹–鱼混养池和贝养殖池的海水池塘生态养殖系统浮游植物群落组成中,绿藻和隐藻为主要优势类群。浮游微藻群落结构与养殖水质、养殖生物的健康生长密切相关。Carmichael等(2001)研究表明,微囊藻(Microcystis)、鱼腥藻(Anabaena)、颤藻等蓝藻均可分泌毒素,危害养殖生物。亚历山大藻(Alexandrium)、裸甲藻(Gymnodinium)、盾甲藻(Pyrodinium)等甲藻可分泌神经毒性生物碱类藻毒素,经食物链传播积累于鱼类、贝类体内,影响其生理状态(张海涛等, 2023)。Cao等(2014)研究发现,养殖对虾产量与池塘中蓝藻的优势度呈显著的负相关关系,即在养殖过程中,如果形成以有害蓝藻为优势的微藻群落结构,将严重影响对虾养殖产量。马清扬等(2021)研究表明,蓝藻水华会影响中华绒螯蟹(Eriocheir sinensis)肠道和鳃的菌群结构及其养殖环境。黄翔鹄等(2002)研究表明,以波吉卵囊藻(Oocystis borgei)为优势种的浮游微藻藻相可降低水体中氨氮(NH4+-N)和亚硝酸盐氮(NO2–-N)的浓度,有效调节水体中的pH。
宁夏回族自治区位于我国西北部,其水产养殖主要有土池养殖、稻田养殖、大棚养殖、棚塘接力养殖等养殖模式,养殖品种主要有鲤鱼(Cyprinus carpio)、草鱼(Ctenopharyngodon idella)、鲢鱼(Hypophthalmichthys molitrix)等,近年来,发展了
本研究选择了宁夏地区棚塘接力(PT)、土池养殖(TC)、稻渔种养(DY) 3种模式的典型养殖池塘,分析浮游微藻群落特征和池塘水质因子特征,以期为宁夏地区养殖池塘的浮游微藻调控提供基础数据支持。
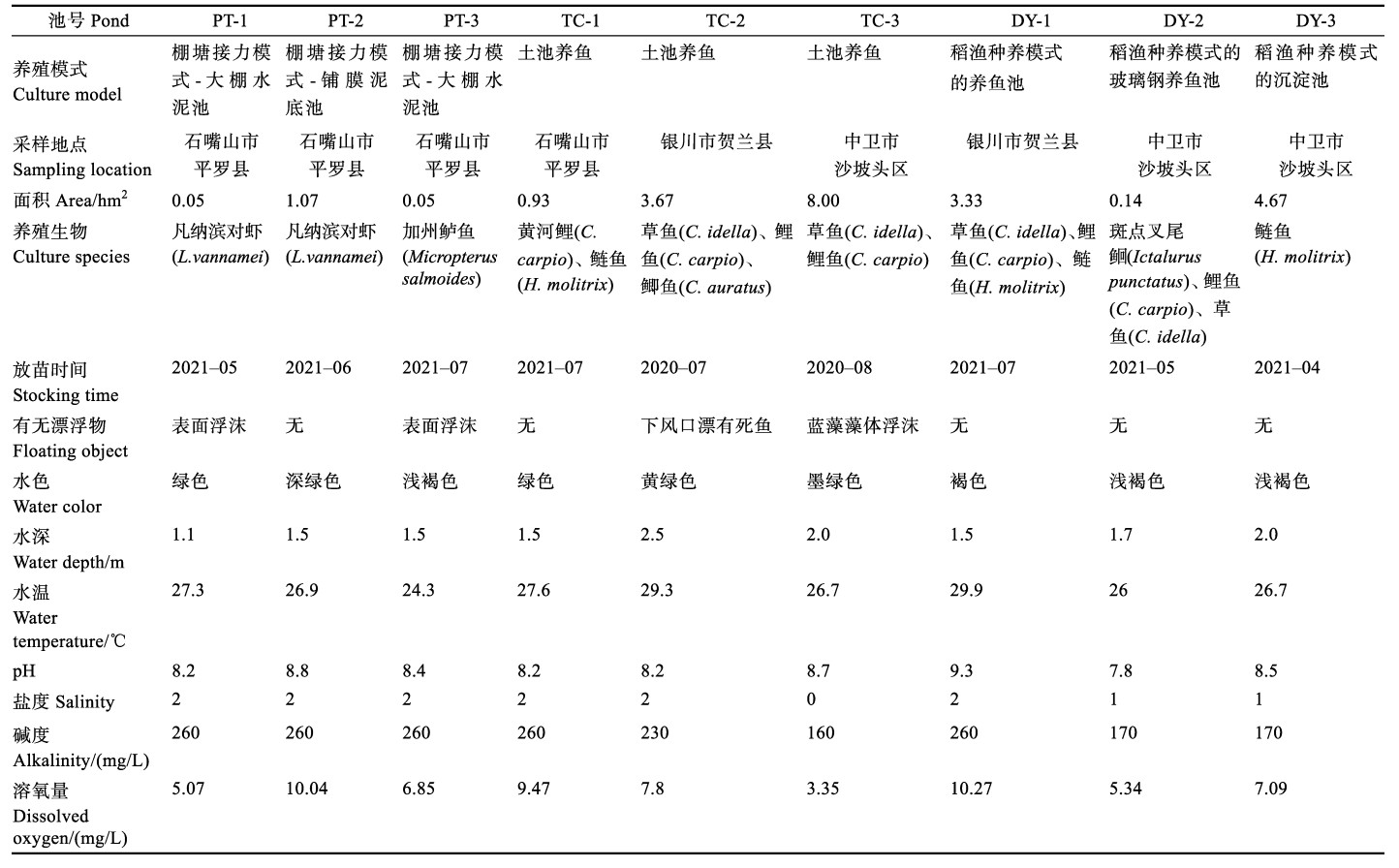
1 材料与方法 1.1 采样地点与养殖池塘情况2021年7月在宁夏回族自治区采集棚塘接力、土池养殖、稻渔种养3种模式共9口养殖池塘样品,分别编号为PT-1、PT-2、PT-3、TC-1、TC-2、TC-3、DY-1、DY-2和DY-3。9口池塘分别位于石嘴山市平罗县、银川市贺兰县、中卫市沙坡头区,各池塘基本情况详见表 1。
|
|
表 1 池塘基本情况 Tab.1 Basic information of ponds |
白天光照下的池塘水温为24.3~29.9℃,pH在7.8~9.3之间,盐度为0~2。PT-1、PT-2、PT-3、TC-1、TC-2和Y-1共6口池塘位于宁夏西北及北部,水体碱度相对较高,为230~260 mg/L;DY-2、DY-3和TC-3池塘位于宁夏中部河套平原地区,水体碱度相对较低,为160~170 mg/L。PT-1池塘养殖的凡纳滨对虾于6月初由水泥池转至大棚养殖;PT-3池塘养殖的凡纳滨对虾于6月底从大棚转至池塘养殖,采用生态养殖方式,未投料;TC-3池塘水为典型蓝藻水,肉眼可见微藻密度大。
1.2 浮游微藻样品的采集与处理2021年7月28—30日对养殖池塘微藻进行采样。采样时,在每个池塘四周及中央使用2.5 L采水器各采水样1份并充分混匀,取1 L倒入聚乙烯塑料瓶,加入5%甲醛溶液固定,静置浓缩至10 mL后,在显微镜下于浮游生物计数框中进行藻类鉴定和细胞计数。
1.3 水样的采集与检测在池塘四周及中央水下0.5 m处使用采水器采集水样,混匀后按不同的理化指标检测要求分装水样,冷藏样品带回实验室检测。其中,NH4+-N采用纳氏试剂分光光度法测定(HJ/T535-2009),硝酸盐氮(NO3–-N)使用紫外分光光度法测定(HJ/T346-2007),NO2–-N采用分光光度法测定(GB/T7493-1987),总无机氮(TIN)为以上无机三氮之和,总氮(TN)采用碱性过硫酸钾消解分光光度法测定(GB/T11894-1989),磷酸盐(PO43–-P)采用磷钼蓝分光光度法测定(《水和废水监测分析方法》),总磷(TP)采用钼酸铵分光光度法测定(GB/T11893-1989),化学需氧量(COD)采用重铬酸盐法测定(GB/T11914-1989)。
1.4 浮游微藻样品分析参考《中国淡水藻类》(胡鸿钧, 1980)、《藻类学》(福迪等, 1980)的方法,在光学显微镜下,对浮游微藻进行定性鉴定与定量计数。在多样性分析(沈国英, 2003)中,采用Shannon计算数量多样性指数(Hq´),公式如下:
| $ Hq' = - \mathop \sum \limits_{i = 1}^s {Q_i}{\text{lo}}{{\text{g}}_2}{Q_i} $ |
生物量多样性指数(Hb´)的计算公式:
| $ Hb' = - \mathop \sum \limits_{i = 1}^s {B_i}{\text{lo}}{{\text{g}}_2}{B_i} $ |
在优势度分析中,数量优势度Y
式中,
生物量的计算是在显微镜检视中采用目微尺实测藻体长度、宽度、厚度等,然后依据微藻细胞的形状拟合模型计算出藻体体积,再乘以微藻的比重1.1换算为微藻生物量(孙军等, 2004)。其中,优势属定义为每次取样中微藻数量或生物量占总量比例在10%以上,常见属在1%~10%范围内,稀有属在1%以下或只在个别水样中出现(麦雄伟, 2003)。
1.5 数据分析采用SPSS软件对藻类总数量、总生物量、各门藻类生物量与养殖池塘水质理化因子进行双变量相关性分析,并计算相关系数。
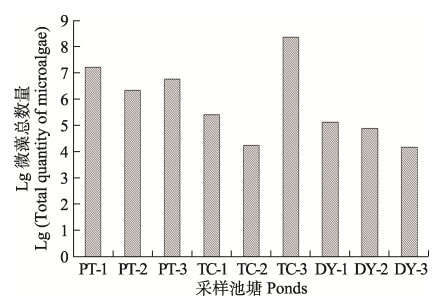
2 结果与分析 2.1 各池塘浮游微藻属类组成及优势属共鉴定出浮游微藻5门27属。其中,蓝藻7属,绿藻13属,硅藻5属,裸藻1属,甲藻1属(图 1)。棚塘接力模式池塘浮游微藻的总数量在106~107 ind./L之间;土池养殖模式中,3口池塘浮游数量变化较大,在104~108 ind./L之间,其中,TC-3池达到2.39×108 ind./L;稻渔种养模式浮游微藻的总数量在104~105 ind./L之间。从整体来看,棚塘接力模式养殖池中浮游微藻总数量较土池养殖模式和稻渔种养模式偏多。
|
图 1 浮游微藻总数量 Fig.1 Total quantity of planktonic microalgae |
各池塘浮游微藻属种类组成以丰富度反映其数量优势度(表 2),生物量优势属见表 3。在棚塘接力养殖模式中,各池塘的浮游微藻群落结构没有明显的共同特征,PT-1的数量优势属为微囊藻属、鱼腥藻属、平裂藻属等蓝藻,生物量优势属为盘星藻属(Pediastrum)、卵囊藻属(Oocystis)等绿藻;PT-2中,除颤藻属、鱼腥藻属等蓝藻为数量优势属和盘星藻属、实球藻属(Pandorina)等绿藻为生物量优势属外,其数量和生物量优势属还有硅藻门(Bacillarionphyta)的小环藻属(Cyclotella);PT-3的数量和生物量优势属均为蓝藻门(Cyanophyta)的拟鱼腥藻属(Anabaenopsis)。在土池养殖模式中,各池塘的浮游微藻优势属较为单一,TC-1的数量优势属为盘星藻属、小环藻属,同时,盘星藻属也是生物量优势属;TC-2的数量和生物量优势属均为小球藻属;TC-3的数量和生物量优势属均为微囊藻属。在稻渔种养养殖模式中,各池塘的数量和生物量优势属均为绿藻或硅藻。DY-1的数量优势属为小球藻属,生物量优势属为栅藻属(Scenedesmus)、小球藻属和卵囊藻属;DY-2的数量优势属为小球藻属、小环藻属和菱形藻属(Nitzschia),生物量优势属为小环藻属、盘星藻属和栅藻属;DY-3的数量优势属为小球藻属和小环藻属,生物量优势属为盘星藻属和刚毛藻属(Cladophora)。研究表明,优势属和常见属多见于蓝藻门、绿藻门(Chlorophyta)和硅藻门,甲藻门(Dinophyta)和裸藻门(Euglenophyta)均为稀有属。所有养殖池塘中,除PT-3、DY-2和TC-3外,其余6口池塘的生物量优势属均为绿藻。其中,4口池塘为盘星藻,即3种不同养殖模式的养殖池塘中绿藻均为主流优势藻。DY-2池塘中硅藻门小环藻属的数量和生物量优势度较高;而PT-3和TC-3池塘则以蓝藻的数量和生物量占绝对优势,分别为拟鱼腥藻属和微囊藻属。尤其是TC-3池塘的微囊藻属大量繁殖,其数量和生物量优势度均 > 0.95。
|
|
表 2 池塘的浮游微藻种类组成 Tab.2 Composition of planktonic microalgae genera in ponds |
|
|
表 3 浮游微藻优势属 Tab.3 Dominant genera of planktonic microalgae |
物种多样性包括数量多样性和生物量多样性。物种多样性指数可反映生物群落的异质性与稳定性,其生态信息含量及抗干扰能力与该指数呈正相关关系(孙耀等, 1998)。采用Shannon指数对微藻的数量和生物量进行统计(图 2),根据生物多样性阈值(陈清潮等, 1994)(表 4)进行比对。结果显示,除PT-3和TC-3外,其他样品的数量多样性为2.1~3.5,数量多样性较好或丰富(Ⅲ~Ⅳ级)。PT-3的数量和生物量多样性为Ⅰ~Ⅱ级;TC-3的藻类生物多样性尤为单一,数量和生物量多样性指数仅有0.03和0.29。此外,DY-1的多样性指数最高,生物量多样性指数高达3.58。在蓝藻占优势的养殖池塘中,浮游微藻的物种多样性会大大降低;而绿藻或硅藻占优势的养殖池塘中,微藻多样性较高,微藻群落结构较为健康。从整体来看,浮游微藻多样性指数排序:稻渔种养模式 > 棚塘接力模式 > 土池养殖模式。棚塘接力模式和土池养殖模式池塘的微藻数量多样性低于稻渔种养模式养殖池塘;且土池养殖模式养殖池塘的微藻生物量多样性低于棚塘接力模式和稻渔种养模式养殖池塘。

|
图 2 浮游微藻多样性指数 Fig.2 The diversity index of planktonic microalgae |
|
|
表 4 生物多样性阀值的分级评价标准 Tab.4 Evaluation standard for biodiversity threshold |
各池塘水质指标见表 5。从表 5可以看出,棚塘接力模式养殖池塘的TN浓度在6.40~8.45 mg/L之间,平均值为7.17 mg/L;TIN浓度在1.08~3.20 mg/L之间,平均值为2.12 mg/L;NH4+-N浓度在0.95~ 3.07 mg/L之间,平均值为1.96 mg/L;3口池塘的NO2–-N浓度相比无明显差异,在0.005~0.007 mg/L之间,平均值为0.006 mg/L;NO3–-N浓度在0.12~ 0.20 mg/L之间,3口池塘的NO3–-N浓度相比无明显差异,平均值为0.15 mg/L;TP浓度为0.63~1.19 mg/L,平均值为0.93 mg/L;PO43–-P浓度在0.14~0.32 mg/L之间,平均值为0.24 mg/L;COD在73.00~106.00 mg/L之间,平均值为88.00 mg/L。
|
|
表 5 池塘水质指标 Tab.5 Water quality index of ponds |
土池养殖模式池塘的TN浓度为2.28~9.71 mg/L,平均值为5.40 mg/L;TIN浓度为0.32~1.96 mg/L,平均值为0.94 mg/L;NH4+-N的浓度为0.20~0.75 mg/L,平均值为0.40 mg/L;NO2–-N浓度为0.003~0.588 mg/L,平均值为0.220 mg/L;NO3–-N浓度在0.08~0.62 mg/L之间,平均值为0.33 mg/L;TP浓度在0.38~1.08 mg/L之间,平均值为0.65 mg/L;PO43–-P浓度在0.03~0.21 mg/L之间,平均值为0.12 mg/L;COD在55.00~195.00 mg/L之间,平均值为106.00 mg/L。
稻渔种养模式的3口养殖池塘的TN浓度相比差异不大,在3.03~3.29 mg/L之间,平均值为3.14 mg/L;TIN浓度为0.46~1.35 mg/L,平均值为0.84 mg/L;NH4+-N浓度为0.37~1.15 mg/L,平均值为0.71 mg/L;NO2–-N浓度为0.003~0.068 mg/L,平均值为0.025 mg/L;3口池塘的NO3–-N浓度相比无显著差异,在0.08~ 0.13 mg/L之间,平均值为0.10 mg/L;TP浓度在0.29~ 0.59 mg/L之间,平均值为0.42 mg/L;PO43–-P浓度在0.10~0.33 mg/L之间,平均值为0.22 mg/L;COD在32.00~68.00 mg/L之间,平均值为46.00 mg/L。
所有池塘中,棚塘接力模式的PT-2的NH4+-N浓度最高,达到3.07 mg/L。土池养殖模式的TC-2的PO43–-P浓度显著低于其他池塘,仅为0.03 mg/L。土池养殖模式TC-3的NO3–-N和NO2–-N显著高于其他池塘,分别高达0.62和0.588 mg/L,其TN、TP和COD浓度也达到较高水平。从整体来看,稻渔种养模式养殖池塘的TN和COD含量相对于棚塘接力模式和土池养殖模式偏低。
2.4 浮游微藻与水质因子的相关性浮游微藻的群落结构会受到养殖池塘水体各种理化因子的影响,如温度、光照、盐度、pH和营养盐浓度等(彭聪聪等, 2010)。藻类总数量、总生物量、各门藻类生物量与水质理化因子的相关分析发现,各养殖池塘的温度、pH、碱度与微藻的总量及其群落结构无显著相关关系。藻类总数量、总生物量和蓝藻生物量与盐度存在显著的负相关关系(P < 0.05)。在营养盐方面,藻类总数量、总生物量及蓝藻生物量与水体的NO3–-N、NO2–-N、COD浓度呈极显著正相关关系(P < 0.01);绿藻的生物量与各指标浓度均无明显的相关关系;硅藻的生物量则与TP浓度呈显著正相关关系(P < 0.01)(表 6)。从表 6可以看出,在池塘水体中,藻类总数量和总生物量受蓝藻的影响较大,一旦蓝藻大量增殖,将在微藻群落中占绝对优势。蓝藻生物量与水体中NO3–-N、NO2–-N、有机物浓度呈极显著正相关(P < 0.01)。
|
|
表 6 浮游微藻与水质因子的相关性分析 Tab.6 Correlation coefficient between microalgae and water quality factors |
盐碱水属于咸水范畴,由于其成因与地理环境、地质土壤、气候等有关,其水化学组成复杂,类型繁多;与海水和淡水相比,盐碱水大都具有高pH、高碳酸盐碱度、高离子系数的特点(王慧等, 2003)。盐碱水体因高pH、高碱度的特点,水质调控成为盐碱养殖的要点和难点。宁夏回族自治区位于我国西北地区,其养殖池塘多为西北硫酸盐型盐碱池塘。邱小琮等(2011)研究表明,宁夏沙湖浮游微藻的种类依季节而异,春季优势种的种类较多,蓝藻、硅藻和绿藻均有分布,夏、秋季以蓝藻占绝对优势,而冬季则以绿藻为主。宁夏地区夏季高温,日照长,硫酸盐型盐碱水体等地区特征和养殖生物量、养殖品种等生物因素,都会成为影响当地养殖池塘浮游微藻群落结构的因素。从生物量优势上来看,在本次采样的3种养殖模式池塘中,稻渔种养模式养殖池塘的数量和生物量优势种为盘星藻、小球藻、栅藻等绿藻或小环藻等硅藻;而棚塘接力模式和土池养殖模式均有一口池塘出现蓝藻为数量和生物量优势种的情况,分别为拟鱼腥藻和微囊藻。这表明尽管大部分池塘中的浮游微藻群落结构以绿藻、硅藻为优势藻,但部分棚塘接力模式和土池养殖模式池塘仍存在蓝藻过度繁殖并成为单一优势藻的情况。因此,宁夏地区夏季养殖池塘中形成蓝藻水华的问题仍然需要得到重视。
3.2 蓝藻与水体理化因子及养殖生物的关系微囊藻、鱼腥藻、颤藻等有害蓝藻在养殖池塘中大量增殖易形成水华,会对水质环境造成不良影响,危害养殖生物的生命健康(李媛等, 2015)。首先,蓝藻大量繁殖时形成的水华散发腥臭,恶化池塘水体的通风和光照条件,败坏水质并影响水体的正常功能,同时,挤压其他藻类和水生动物的生存空间;其次,蓝藻的繁殖及死亡后分解将消耗大量DO,水体缺氧则导致鱼类大量死亡的“泛塘”现象(姚雁鸿等, 2007)。蓝藻产生的藻毒素、大量羟胺及H2S等有毒物质,会直接对水产养殖生物造成生命威胁(Cremen et al, 2007)。简言之,发生蓝藻水华时,养殖池塘水体的理化指标往往超出养殖生物的耐受限度而引发大量死亡,造成经济损失和池塘水体环境污染。Cao等(2014)研究发现,养殖对虾产量与池塘中蓝藻的优势度呈显著的负相关关系,即在养殖过程中,如果形成以有害蓝藻为优势的微藻群落结构,将严重影响对虾养殖产量。因此,在养殖生产中,应防控水体形成以有害蓝藻为优势的微藻藻相。在本次取样的池塘中,蓝藻的数量和生物量均占绝对优势的养殖池塘为棚塘接力模式的PT-3和土池养殖模式的TC-3,优势属分别为拟鱼腥藻属和微囊藻属。
水温和光照是影响蓝藻水华产生的主要物理因素(姚雁鸿等, 2007)。蓝藻形成水华的最适温度通常是20~35℃,其中,微囊藻属、鱼腥藻属、颤藻属等的最适生长水温在25℃及以上(Reynolds, 1990)。同时,许多蓝藻种类对强光有较强的忍受力。Huisman等(1999)研究表明,蓝藻的光照需求大于绿藻,且达到一定光照强度时,绿藻种群减少而蓝藻种群开始增加。在我国西北内陆如宁夏干旱与半干旱地区,夏季往往干旱高温持续数日,光照度强和光照时间长,在棚塘接力模式和土池养殖模式中,大棚的温室效应和土池直接受长时间强光日照等因素,易使环境温度保持在较高水平,因此,夏季强光、高温的养殖池塘水体状态在一定程度上抑制了其他藻类生长,蓝藻却恰逢其时大量增殖。
水中营养盐浓度同样影响着藻类的生长繁殖,如N、P营养盐是决定蓝藻是否暴发的重要因素(Edwards et al, 2011; Mellard et al, 2012; Wen et al, 2012)。鱼腥藻类可以通过其自身的异形孢进行固氮作用,因此,对水环境中的氮浓度要求较低,磷浓度是显著影响鱼腥藻类生长的营养盐因子(梁恒等, 2010),高P环境有利于其生长,反之则抑制其生长。在PT-3中,水体中PO43–-P水平达到0.32 mg/L,与其他采样池塘相比较高,为拟鱼腥藻大量生长繁殖提供有利条件。富营养化的池塘水体有利于微囊藻的增殖,较高的N、P浓度明显促进微囊藻的生长(孔繁翔, 2011)。在TC-3水体中,TN和TP浓度分别为9.71和1.08 mg/L,显著高于其他采样池塘中的N、P水平,直接引起微囊藻水华的暴发。相关性分析表明,蓝藻生物量与水体中NO3–-N、NO2–-N、有机物浓度相比呈显著正相关(P < 0.01)。由此表明,水体N、P营养高的养殖池塘更易形成微囊藻、拟鱼腥藻等蓝藻优势藻。
盐碱池塘水体较高的pH和碱度条件也是影响微藻生长的重要环境因子。黄钰玲等(2008)研究认为,水体pH值与蓝藻水华生消密切相关,在其他条件适宜的情况下,pH为8左右的偏碱性水体可促进蓝藻水华发生。曹煜成(2014)以温度、盐度、pH等生态因子作为基本切入点,分析了蛋白核小球藻(Chlorella pyrenoidosa)、条纹小环藻(Cyclotella striata)、绿色颤藻(Oscillatoria chlorine)和铜绿微囊藻(Microcystis aeruginosa) 4种微藻的生态适应性。结果显示,绿色颤藻、蛋白核小球藻和条纹小环藻在pH=10时无法生长,铜绿微囊藻在pH=10时仍可生长,表明其pH适应性更强。许海等(2009)研究了不同初始pH和不同固定pH对3种蓝藻和绿藻生长的影响。结果表明,藻类可通过自身生命活动改变水体pH,不同初始pH对藻类生长的影响不明显;但加pH缓冲剂固定初始pH后,藻类的生长反应很明显,适宜的pH范围各不相同,但蓝藻适宜的pH并不都比绿藻高。碱度对浮游植物的生长同样有显著影响(张树林等, 2008)。潘翰等(2017)分析了碱性湖泊呼伦湖地区浮游植物组成及水化学环境因子,认为碱度会导致水体透明度降低、光照减少,蓝藻的自身适应能力可以耐受碱度更大的水环境。杨威等(2007)研究表明,铜绿微囊藻的竞争生长能力在高碱度组中弱于四尾栅藻(Scenedesmus quadricauda),但在极低碱度组中强于四尾栅藻。在本研究中,不同模式养殖池塘的pH和碱度与蓝藻生物量暂无显著相关关系。因此,在错综复杂的自然环境因子及其相互作用下,高pH和碱度的养殖池塘中有害蓝藻是否具有生长优势有待进一步探究。
除环境理化因素外,影响蓝藻生长的生物因素也不容忽视。水产养殖生物的品种和生物量会影响池塘浮游微藻群落结构。鲢、鳙等滤食性鱼类特有鳃耙、腭皱等器官,能直接滤食大于鳃孔的藻类,可有效降低富营养化水体中的蓝藻数量(Xie et al, 2001; 此里能布等, 2012)。而鱼类自身的生理活动及排泄物则会使水体中的营养盐浓度升高,创造有利于蓝藻生长的水质条件。养殖生物量大,养殖生物产生的粪便及饵料的投放量相应增多,更易形成富营养化水体。在本次采样的土池养殖模式TC-3池塘中,鱼类放苗时间较其他2种养殖模式池塘更早,鱼类生物量更大,可能成为促使其水体中N、P浓度更高的原因。
3.3 养殖池塘中优良藻相的构建在养殖生产中,池塘中的蓝藻若过度增殖会造成微藻种类过于单一,打破藻相平衡,出现不良藻相结构;而通常以绿藻、硅藻为优势种的池塘水质较稳定,微藻种类丰富,水色优良,养殖生物病害少且生长较好,为优良藻相(曹煜成等, 2007)。
9口池塘中,除PT-3、TC-3以外的其余7口池塘均以绿藻或硅藻为生物量优势藻,尽管其中部分池塘中仍有鱼腥藻属、颤藻属为数量优势属,但并未影响藻类群落结构的多样化,尤其是以栅藻属、小球藻属和卵囊藻属为生物量优势属的稻渔种养模式DY-1,藻类生物多样性极其丰富。在稻渔种养模式中,鱼类等水产养殖生物可将氮元素转化为水稻易吸收的氨态氮,提高了水稻对N、P的利用率和对富营养化水体的净化能力,降低了水中的N、P污染(杨玲霞, 2020),不易形成微囊藻等有害蓝藻生长的适宜环境。因此,在本次取样的稻渔种养模式养殖池塘中均未发生有害蓝藻大量增殖的情况,较其他2种养殖模式具有更良好的藻相。
在本研究中,以小球藻、栅藻、盘星藻、卵囊藻等绿藻或以小环藻、菱形藻等硅藻占优势的微藻群落结构为优良藻相,可增加水体的DO,促进水体中营养盐的分解和转化,保持良好的水体肥度,减少有机污染物的存在,为养殖生物提供新鲜的天然饵料等,有利于养殖生物的健康生长。因此,养殖户应做好养殖池塘的水质调控,避免形成以蓝藻占绝对优势的不良藻相,构建以绿藻和硅藻为优势的优良藻相。
4 结论在夏季光照强温度高的宁夏地区,部分养殖池塘会出现以微囊藻、拟鱼腥藻等蓝藻占绝对优势的不良藻相,形成蓝藻水华,对养殖生产造成危害;以小球藻、盘星藻、栅藻、卵囊藻等绿藻或小环藻、菱形藻等硅藻占优势为当地养殖池塘的优良藻相。稻渔种养模式养殖池塘相比于棚塘接力模式和土池养殖模式具有更高的浮游微藻多样性指数和优良藻相。蓝藻生物量与水体中NO3–-N、NO2–-N、有机物浓度呈现显著正相关。水体中C、N营养高的养殖池塘更易形成以微囊藻、拟鱼腥藻等蓝藻为优势的藻相;合理调控养殖池塘水质,抑制蓝藻成为优势,形成以绿藻和硅藻为优势藻的优良藻相更有利于养殖生产。
Bureau of Fisheries, Ministry of Agriculture and Rural Affair, National Fisheries Technology Extension Center, China Society of Fisheries. China Fishery Statistical Yearbook 2022. Beijing: China Agriculture Press, 2022 [农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 2022中国渔业统计年鉴. 北京: 中国农业出版社, 2022]
|
CAO Y C, LI Z J, YANG Y Y, et al. Research progress on technology of microalgae ecological management in shrimp culture. South China Fisheries Science, 2007, 3(4): 70-73 [曹煜成, 李卓佳, 杨莺莺, 等. 浮游微藻生态调控技术在对虾养殖应用中的研究进展. 南方水产, 2007, 3(4): 70-73 DOI:10.3969/j.issn.2095-0780.2007.04.012] |
CAO Y C, WEN G L, LI Z J, et al. Effects of dominant microalgae species and bacterial quantity on shrimp production in the final culture season. Journal of Applied Phycology, 2014, 26(4): 1749-1757 DOI:10.1007/s10811-013-0195-0 |
CAO Y C. Experimental study on the regulatory mechanisms of dominant microalgae population in shrimp culture ponds. Doctoral Dissertation of Sun Yat-sen University, 2014 [曹煜成. 虾池微藻优势种群调控机理. 中山大学博士研究生学位论文, 2014]
|
CARMICHAEL W W. Health effects of toxin-producing cyanobacteria: "The CyanoHABs". Human and Ecological Risk Assessment: An International Journal, 2001, 7(5): 1393-1407 DOI:10.1080/20018091095087 |
CHEN Q C, HUANG L M, YIN J Q, et al. Zooplankton diversity in water around South China Sea Islands, the multidisciplinary oceanographic expedition team of Chinese Academy of sciences to Nansha Islands. Research on marine biodiversity in the South China Sea Islands and its adjacent sea areas I. Beijing: Ocean Press, 1994: 42-50 [陈清潮, 黄良民, 尹健强, 等. 南海群岛海区浮游动物多样性研究, 中国科学院南沙综合科学考察队.南海群岛及其邻近海区海洋生物多样性研究I. 北京: 海洋出版社, 1994: 42-50]
|
CI L N B, MAO J Z, HUANG S F. Theory and application of biomanipulation and non-traditional biomanipulation. Ecological Science, 2012, 31(1): 87-91 [此里能布, 毛建忠, 黄少峰. 经典与非经典生物操纵理论及其应用. 生态科学, 2012, 31(1): 87-91] |
CREMEN M C M, MARTINEZ-GOSS M R, CORRE V L, et al. Phytoplankton bloom in commercial shrimp ponds using green-water technology. Journal of Applied Phycology, 2007, 19(6): 615-624 DOI:10.1007/s10811-007-9210-7 |
EDWARDS K F, KLAUSMEIER C A, LITCHMAN E. Evidence for a three-way trade-off between nitrogen and phosphorus competitive abilities and cell size in phytoplankton. Ecology, 2011, 92(11): 2085-2095 DOI:10.1890/11-0395.1 |
FOTT B, LUO D A. Algenkunde. Shanghai: Shanghai Scientific and Technical Publishers, 1980 [福迪 B, 罗迪安. 藻类学. 上海: 上海科学技术出版社, 1980]
|
HOU X, GAO Y P, DU M R, et al. Temporal and spatial variation in phytoplankton community structure and their relationship with environmental factors in Sanggou Bay. Progress in Fishery Sciences, 2021, 42(2): 18-27 [侯兴, 高亚平, 杜美荣, 等. 桑沟湾浮游植物群落结构时空变化特征及影响因素. 渔业科学进展, 2021, 42(2): 18-27] |
HU H J, WEI Y X. The freshwater algae of China. Beijing: Science Press, 1980 [胡鸿钧, 魏印心. 中国淡水藻类. 北京: 科学出版社, 1980]
|
HUANG X H, LI C L, LIU C W, et al. Studies on two microalgae improving environment of shrimp pond and strengthening anti-disease ability of Penaeus vannamei. Acta Hydrobiologica Sinica, 2002, 26(4): 342-347 [黄翔鹄, 李长玲, 刘楚吾, 等. 两种微藻改善虾池环境增强凡纳对虾抗病力的研究. 水生生物学报, 2002, 26(4): 342-347 DOI:10.3321/j.issn:1000-3207.2002.04.005] |
HUANG Y L, JI D B, CHEN M X, et al. Influence of water pH on cyanobacterial bloom generation and elimination. Yangtze River, 2008, 11061106(2): 63-65 [黄钰铃, 纪道斌, 陈明曦, 等. 水体pH值对蓝藻水华生消的影响. 人民长江, 2008, 11061106(2): 63-65 DOI:10.3969/j.issn.1001-4179.2008.02.023] |
HUISMAN J, JONKER R R, ZONNEVELD C, et al. Competition for light between phytoplankton species: Experimental tests of mechanistic theory. Ecology, 1999, 80(1): 211-222 DOI:10.1890/0012-9658(1999)080[0211:CFLBPS]2.0.CO;2 |
KONG F X, SONG L R. Study on the formation process of cyanobacterial bloom and its environmental characteristics. Beijing: Science Press, 2011 [孔繁翔, 宋立荣. 蓝藻水华形成过程及其环境特征研究. 北京: 科学出版社, 2011]
|
LI Q, SUN Z J, QIN P. Summary of Ningxia saline status and improved measures. Journal of Anhui Agricultural Sciences, 2007, 35(33): 10808-10810 [李茜, 孙兆军, 秦萍. 宁夏盐碱地现状及改良措施综述. 安徽农业科学, 2007, 35(33): 10808-10810 DOI:10.3969/j.issn.0517-6611.2007.33.113] |
LI Y, ZHANG J W, WEI J, et al. Advances in mechanism of the occurrence, hazard, and prevention/control utilization of Cyanophytic blooms in China. Journal of Microbiology, 2015, 35(4): 93-97 [李媛, 张家卫, 魏杰, 等. 我国蓝藻水华的发生机理、危害及防控利用研究进展. 微生物学杂志, 2015, 35(4): 93-97 DOI:10.3969/j.issn.1005-7021.2015.04.016] |
LIANG H, CHEN Z L, QU F S, et al. Regression equations between algae propagation and physico-chemical factors under microcosm environment. Journal of Harbin Institute of Technology, 2010, 42(6): 841-844 [梁恒, 陈忠林, 瞿芳术, 等. 微宇宙环境下藻类生长与理化因子回归研究. 哈尔滨工业大学学报, 2010, 42(6): 841-844] |
MA Q Y, WANG Y, LI C B, et al. Influence of cyanobacterial bloom dominated by Planktothrix sp. and Cylindrospermopsis raciborskii on microflora structure of intestine, gill and culture environment of cultured Eriocheir sinensis. Marine Fisheries, 2021, 43(5): 595-606 [马清扬, 王元, 李传步, 等. 以拉氏拟柱胞藻和浮丝藻为主的蓝藻水华对中华绒螯蟹肠道和鳃及其养殖环境微生物群落结构的影响. 海洋渔业, 2021, 43(5): 595-606 DOI:10.3969/j.issn.1004-2490.2021.05.009] |
MAI X W. Aquatic ecological characteristics of Litopenaeus vannamei in desalination culture ponds with greenhouse. Master's Thesis of Sun Yat-sen University, 2003 [麦雄伟. 南美白对虾温棚化养殖水体生态特征研究. 中山大学硕士研究生学位论文, 2003]
|
MELLARD J P, YOSHIYAMA K, KLAUSMEIER C A, et al. Experimental test of phytoplankton competition for nutrients and light in poorly mixed water columns. Ecological Monographs, 2012, 82(2): 239-256 DOI:10.1890/11-0273.1 |
MULLER-FEUGA A. The role of microalgae in aquaculture: Situation and trends. Journal of Applied Phycology, 2000, 12(3/4/5): 527-534 |
PAN H, LIU Y R, MA C X. Characteristics and physical factors of cyanobacteria outbreak in northern cold region inland alkaline water. Journal of Northeast Forestry University, 2017, 45(7): 79-83 [潘翰, 刘琰冉, 马成学. 北方寒冷内陆碱性水体蓝藻暴发特点及影响因子. 东北林业大学学报, 2017, 45(7): 79-83 DOI:10.3969/j.issn.1000-5382.2017.07.016] |
PENG C C, LI Z J, CAO Y C, et al. A review of water environment regulation by planktonic microalgae in shrimp ponds. South China Fisheries Science, 2010, 6(5): 74-80 [彭聪聪, 李卓佳, 曹煜成, 等. 虾池浮游微藻与养殖水环境调控的研究概况. 南方水产, 2010, 6(5): 74-80 DOI:10.3969/j.issn.1673-2227.2010.05.012] |
PENG C C, LI Z J, CAO Y C, et al. Change of dominant species of planktonic microalgae in Litopenaeus vannameixs semi-intensive culture ponds and its impact on the culture environment. Marine Environmental Science, 2011, 30(2): 193-198 [彭聪聪, 李卓佳, 曹煜成, 等. 凡纳滨对虾半集约化养殖池塘浮游微藻优势种变动规律及其对养殖环境的影响. 海洋环境科学, 2011, 30(2): 193-198 DOI:10.3969/j.issn.1007-6336.2011.02.010] |
PENG C C, LI Z J, CAO Y C, et al. The community characteristics of planktonic microalgae in Tilapaixs culture ponds near the Pearl River estuary. Journal of Agro- Environment Science, 2012, 31(10): 2019-2030 [彭聪聪, 李卓佳, 曹煜成, 等. 珠江河口区罗非鱼养殖池塘中浮游微藻的群落特征. 农业环境科学学报, 2012, 31(10): 2019-2030] |
QIAO L, CHANG Z Q, LI J, et al. Comparison of phytoplankton community diversity in the ecologicalaquaculture system of a marine pond using morphological analysis and high- throughput sequencing. Progress in Fishery Science, 2022, 43(2): 32-43 [乔玲, 常志强, 李健, 等. 基于形态学和高通量测序的海水池塘生态养殖系统中浮游植物多样性比较. 渔业科学进展, 2022, 43(2): 32-43] |
QIU X C, ZHAO H X. Community structure and biodiversity of phytoplankton in Shahu Lake, Ningxia. Journal of Hydroecology, 2011, 32(1): 20-26 [邱小琮, 赵红雪. 宁夏沙湖浮游植物群落结构及多样性研究. 水生态学杂志, 2011, 32(1): 20-26] |
REYNOLDS C S. Cyanobacteria in fish ponds. Aquaculture, 1990, 88(1): 1-20 DOI:10.1016/0044-8486(90)90315-E |
SHEN G Y, SHI B Z. Marine ecology. Beijing: Science Press, 2003 [沈国英, 施并章. 海洋生态学. 北京: 科学出版社, 2003]
|
SUN J, LIU D Y, QIAN S B. Study on phytoplankton biomass I: Phytoplankton measurement biomass from cell volume or plasma volume. Acta Oceanologica Sinica, 2004, 21(2): 75-85 [孙军, 刘东艳, 钱树本. 浮游植物生物量研究Ⅰ: 工作浮游植物生物量细胞体积转化法. 海洋学报, 2004, 21(2): 75-85] |
SUN Y, LI F, LI J, et al. Phytoplankton community characteristics and their relationship with nutrient saltsin shrimp ponds. Marine Fisheries Research, 1998, 19(2): 45-51 [孙耀, 李锋, 李健, 等. 虾塘水体中浮游植物群落特征及其与营养状况的关系. 海洋水产研究, 1998, 19(2): 45-51] |
WANG H, LAI Q F, FANG W H, et al. Study on aquaculture in different type of saline-alkali water, Sustainable Aquaculture—Resources, Envinronment and Quality——2003 Aquatic Technology Forum. Beijing: Ocean Press, 2003: 123-127 [王慧, 来琦芳, 房文红, 等. 不同类型咸水的水产养殖研究, 可持续水产养殖—资源、环境、质量2003水产科技论坛论文集. 北京: 海洋出版社, 2003: 123-127]
|
WEN Y S, RUI W S, MEI W H, et al. Interspecific competition among Cyanophyta, Chlorophyta and Diatom in response to pulse supply of nitrate. International Journal of Environment and Waste Management, 2012, 10(1): 13-24 |
XIE P, LIU J K. Practical success of biomanipulation using filter- feeding fish to control cyanobacteria blooms: A synthesis of decades of research and application in a subtropical hypereutrophic lake. Scientific World Journal, 2001, 1: 337-356 |
XU H, LIU Z P, YUAN L, et al. Effect of pH on growth of several freshwater algae. Environmental Science & Technology, 2009, 32(1): 27-30 [许海, 刘兆普, 袁兰, 等. pH对几种淡水藻类生长的影响. 环境科学与技术, 2009, 32(1): 27-30] |
YANG L X. Study on the effect of rice co-cropping in low-lying saline-alkali land. Master's Thesis of Ningxia University, 2020 [杨玲霞. 低洼盐碱地稻渔共作效应研究. 宁夏大学硕士研究生学位论文, 2020]
|
YANG W, SUN L, YUAN Y C, et al. Effects of alkalinity on growth and competition of Microcystis aeruginosa and Scenedesmus quadricauda. Journal of Agro-Environment Science, 2007, 11061106(4): 1264-1268 [杨威, 孙凌, 袁有才, 等. 碱度水平对铜绿微囊藻和四尾栅藻生长和竞争的影响. 农业环境科学学报, 2007, 11061106(4): 1264-1268] |
YAO Y H, HE W H, YU L N. Mechanism of forming of Cyanobacteria bloom and its effects on aquaculture. Acta Agriculturae Jiangxi, 2007, 11061106(4): 98-100 [姚雁鸿, 何文辉, 余来宁. 池塘蓝藻水华的产生及对养殖的危害. 江西农业学报, 2007, 11061106(4): 98-100] |
ZHA G C, MAI X W, ZHOU C Q, et al. Study on the planktonic algae community in low salinity culture ponds of Litopenaeus vannamei. Marine Fisheries Research, 2006, 27(1): 1-7 [查广才, 麦雄伟, 周昌清, 等. 凡纳滨对虾低盐度养殖池浮游藻类群落研究. 海洋水产研究, 2006, 27(1): 1-7] |
ZHANG H T, WU H Y, ZHENG G C, et al. Accumulation and transformation of paralytic shellfish toxin in mussel Mytilus galloprovincialis exposed to Alexandrium catenella. Progress in Fishery Sciences, 2023, 44(1): 181-191 [张海涛, 吴海燕, 郑关超, 等. 链状亚历山大藻暴露下紫贻贝体内麻痹性贝毒蓄积转化规律. 渔业科学进展, 2023, 44(1): 181-191] |
ZHANG S L, XING K Z, CHEN B. Studies on the relationship between phytoplankton and environmental factors of the alkalinities composed of HCO3- type in shrimp pond. Acta Agriculturae Boreali-Sinica, 2008, 11061106(1): 145-148 [张树林, 邢克智, 陈斌. 重碳酸盐型盐碱虾池浮游植物与理化因子的相关关系. 华北农学报, 2008, 11061106(1): 145-148] |