溶氧是水产养殖的重要环境因子,受气候、天气、光照、风力、水温等因素影响导致水体溶氧水平呈现季节性、昼夜性、持续性、短暂性低氧现象(刘海英等, 2005; 戴恒鑫等, 2013)。在水产养殖过程中,昼夜发生低氧循环比急性低氧或持续性低氧更频繁,这种情况在夏季更明显(Graham et al, 1990; Stierhoff et al, 2003)。养殖过程中,周期性低氧会影响鱼类代谢、生长和繁殖能力(Yang et al, 2013; Bera et al, 2017; Targett et al, 2019; Obirikorang et al, 2020)。葡萄糖代谢是鱼类机体内重要的代谢途径之一,也是生成ATP的主要途径。正常溶氧下,葡萄糖通过有氧代谢为机体提供大量ATP,受到低氧胁迫的鱼类会从有氧代谢转变为无氧代谢,减少对O2的需求(Hemre et al, 2015, 曹梅等, 2021)。代谢方式的改变会导致机体ATP水平的下降,影响机体的正常功能。同时,肝脏葡萄糖代谢不仅为机体提供能量,而且其代谢产物也是脂肪、氨基酸等物质的合成前体,葡萄糖代谢的减少可能会影响机体脂类和蛋白质的合成,影响生长发育(王镜岩等, 2011)。
鳜(Siniperca chuatsi)是我国重要的淡水经济鱼类,在夏季养殖过程中易暴发疾病。赖子尼等(2001)研究表明,鳜养殖池塘水体理化因子昼夜变化的溶氧直接影响鳜养殖;赖子尼等(2004、2008)和程炜轩等(2011)通过分析夏季池塘水体理化因子发现,较低溶氧水平引起生态因子如亚硝酸、氨氮(NH4+-N)等浓度升高,逐渐形成毒性,影响养殖鳜的健康。而鳜养殖模式主要以池塘为主,池塘养殖模式下普遍存在溶氧昼夜变化现象,一般情况下,池塘溶氧下午最高,晨昏最低(高银爱等, 1999)。同时,鳜具有独特的摄食习性,导致鳜最大耗氧率出现于池塘溶氧最低时。所以,研究池塘昼夜溶氧变化下葡萄糖代谢的变化规律对于鳜健康养殖具有重要意义。因此,本研究通过测定不同时间点鳜肝脏葡糖糖代谢相关酶活性及血浆、肝脏生化生理指标变化来评估在昼夜溶氧变化的环境下对鳜葡萄糖代谢及血糖含量的影响。
1 材料与方法 1.1 实验材料鳜和饵料鱼均来自上海浦东孙农水产养殖场,选取体重为(39.15±3.18) g,体长为(14.42±1.34) cm的鳜放入池塘网箱暂养7 d,网箱内溶氧水平保持在5 mg/L以上。分别在08:00和19:00足量投喂体重为(8.35±0.21) g,体长为(5.03±0.56) cm的草鱼(Ctenopharyngodon idella)。实验前24 h及实验过程中停止投喂。
实验在上海浦东孙农水产养殖场标准化养殖池塘(20 m×30 m×2.5 m)网箱中进行,在池塘的左右两侧各架3个网箱(1 m×1 m×1 m),每个网箱中随机放入20尾鱼。对照组在池塘一侧,使用增氧机(赛尔力霸,S-30B)持续24 h充氧,保持网箱内溶氧在5~8 mg/L;实验组位于池塘另一侧,不设增氧设备。实验期间,分别在网箱位置测定水面上层(5 cm)、中层(50 cm)和下层(100 cm)的溶氧。所用仪器为S9 Seven2GoTM Pro便携式溶氧仪(梅特勒托利特公司,瑞士),每隔1 h测量1次溶氧、水温,连续测量3 d,每天均为晴天。
根据前期测得的溶氧变化曲线,以最高和最低溶氧水平设置采样时间点。即为高氧(T1-17:00)、中氧(T2-23:00)、低氧(T3-次日07:00)、中氧(T4-11:00)、高氧(T5-17:00)。
1.2 实验方法在各采样时间点,分别从对照组和实验组网箱中随机捞取8尾鱼。MS-222麻醉后,使用一次性注射器尾静脉取血,迅速置于3 500 r/min、4 ℃条件下离心10 min,收集血浆,放入−80 ℃冰箱中保存备用。然后解剖并取出肝脏,液氮速冻后放入−80 ℃冰箱中保存,用于酶活性测定和基因表达分析。
1.3 生化指标测定组织匀浆:取适量肝脏组织,使用预冷的PBS缓冲液(0.01 mol/L, pH=7.4)冲洗。按1∶9的比例加入PBS缓冲液,冰浴匀浆5 min,4 ℃下2 000 r/min冷冻离心20 min,离心取上清液,−20℃保存。
血糖、乳酸和肝糖原含量测定:分别取8尾鱼的血浆和肝脏的上清液,使用上海酶联生物公司检测试剂盒,按照说明书方法操作,每尾鱼分别做1次检测。其他指标的检测方式与生化指标的检测方式一致。
酶活测定:己糖激酶(HK)、磷酸果糖激酶(PFK)、丙酮酸激酶(PK)、柠檬酸合酶(CS)、乳酸脱氢酶(LDH)、糖原磷酸化酶(GP)使用上海酶联生物公司检测试剂盒,按照说明书方法操作,均采用酶标仪(Synergy H1, BioTek,美国)测定吸光度值,建立标准曲线回归方程,计算样品酶活性。
1.4 ATP含量测定采用碧云天生物有限公司生产的ATP检测试剂盒。取肝脏组织20 mg,加入约100~200 μL ATP检测裂解液,充分匀浆,确保肝脏组织被完全裂解后,于4 ℃12 000 r/min,离心5 min,取上清液。检测孔内先加入100 μL ATP检测工作液,室温放置3~5 min;再加入20 μL待测样品,迅速使用移液枪混匀,至少间隔2 s后,采用酶标仪(Synergy H1, BioTek,美国)测定RLU值,根据标准曲线计算出样品中ATP的浓度。
1.5 荧光定量PCR采用Trizol法提取肝脏总RNA,使用1%的琼脂糖凝胶电泳检测RNA的完整性,采用OD-1000+分光光度计(Onedrop)检测RNA浓度和A260 nm/A280 nm值。取OD值在1.9~2.1之间的样本,使用反转录试剂盒(PrimeScript RT reagent kit with gDNA eraser,TaKaRa)将RNA反转录为cDNA,−20 ℃保存。
根据本实验室鳜肝脏转录组数据(未发表),采用Primer Express 5.0软件设计hk、pfk、pk、cs、ldh-a、gp和葡萄糖转运蛋白glut2基因引物序列,引物由金维智(苏州)生物科技有限公司合成。
根据所设计的引物,以β-actin为内参基因进行荧光定量PCR。反应体系为20 μL,TB Green Premix Tap Ⅱ 10 μL,正反引物各0.8 μL,cDNA模板1.6 μL,无菌水6.8 μL。反应程序为95 ℃,30 s;95 ℃ 5 s,58 ℃ 30 s,40个循环;95 ℃ 10 s,65 ℃ 5 s。采用2–ΔΔCt计算不同采样点各基因mRNA的相对表达量(表 1)。
|
|
表 1 葡萄糖代谢相关基因的引物序列 Tab.1 Primer sequences of glucose metabolism-related genes |
实验数据均以平均值±标准误(Mean±SE)表示。采用SPSS 22.0软件进行方差检验和单因素方差分析(one-way ANOVA),若达到显著水平,则进行LSD和Tukey's多重比较,P < 0.05为显著性水平。
2 结果 2.1 池塘溶氧与温度昼夜变化从图 1可以看出,在24 h中,池塘上、中、下溶氧水平变化趋势均呈“∽”型。其中,17:00—次日07:00是池塘溶氧的下降阶段,07:00时溶氧水平最低,上、中、下层溶氧平均为0.74、1.09、0.96 mg/L;07:00~17:00是池塘溶氧上升的阶段,17:00时溶氧水平最高,上、中、下层溶氧平均为16.29、9.15、6.32 mg/L。

|
图 1 实验池塘溶氧、温度昼夜变化 Fig.1 Diel variation of dissolved oxygen and temperature in the pond |
各层水温在21:00—次日09:00内,池塘上、中、下层水温基本一样,10:00之后,各层水温才有差异。上、中、下层水温白天最高水温平均为32.30、31.53、31.07 ℃,晚上平均最低水温为29.73、30.00、30.00 ℃,昼夜温差为2.57、1.53、1.07 ℃。
2.2 血浆和肝脏生化指标的变化鳜昼夜血糖的变化见图 2a。从图 2a可以看出,对照组血糖相对稳定,24 h内无显著变化(P > 0.05);实验组血糖呈先下降后上升的趋势,低氧(T3)和中氧(T4)时,血糖显著下降(P < 0.05),且中氧(T4)时,实验组血糖显著小于对照组(P < 0.05)。实验组血浆中乳酸变化呈先上升后下降的趋势,低氧(T3)和中氧(T4)时,实验组乳酸含量显著大于对照组(P < 0.05)(图 2b)。
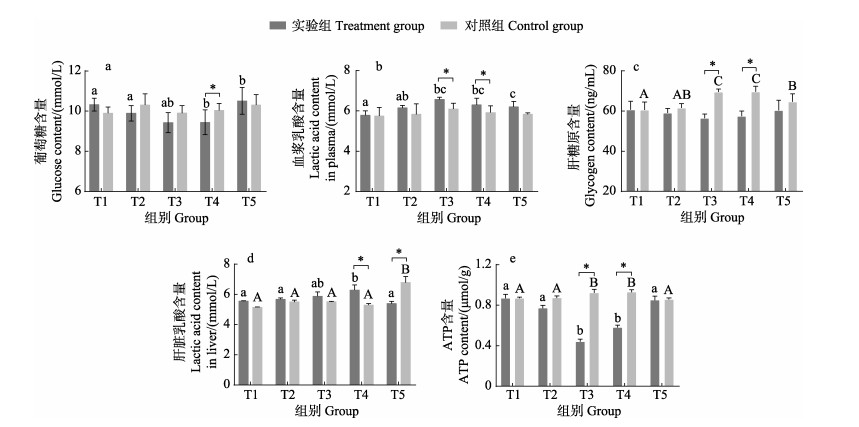
|
图 2 昼夜溶氧变化对鳜血浆及肝脏生化指标的影响 Fig.2 The effect of diel variation of dissolved oxygen on plasma and liver biochemical indexes in S. chuatsi 小写字母表示实验组组间差异显著(P < 0.05),大写字母表示对照组组间差异显著(P < 0.05),*表示同一时间点实验组与对照组差异显著(P < 0.05)。下同。 Lowercase letters indicate significant differences between treatment groups (P < 0.05), uppercase letters indicate significant differences between control groups (P < 0.05), * indicates significant difference between experimental and control group at the same time (P < 0.05). The same as below. |
对照组肝糖原含量呈显著上升的趋势(P < 0.05)(图 2c),而实验组肝糖原含量呈先下降后上升的趋势,但无显著变化(P > 0.05),低氧(T3)和中氧(T4)显著小于对照组(P < 0.05)。肝脏乳酸含量在低氧(T3)和中氧(T4)时显著上升,中氧(T4)时,实验组乳酸含量显著大于对照组(P < 0.05)(图 2d)。低氧(T3)和中氧(T4)时,实验组肝脏ATP含量显著小于对照组(P < 0.05)(图 2e)。
2.3 肝脏葡萄糖代谢相关酶活性变化溶氧昼夜变化过程中,实验组糖酵解酶HK活性在低氧(T3)、高氧(T5)时显著大于对照组(P < 0.05) (图 3a);PFK活性在中氧(T4)时显著大于对照组(P < 0.05)(图 3b);PK活性在低氧(T3)时显著大于对照组(P < 0.05)(图 3c)。
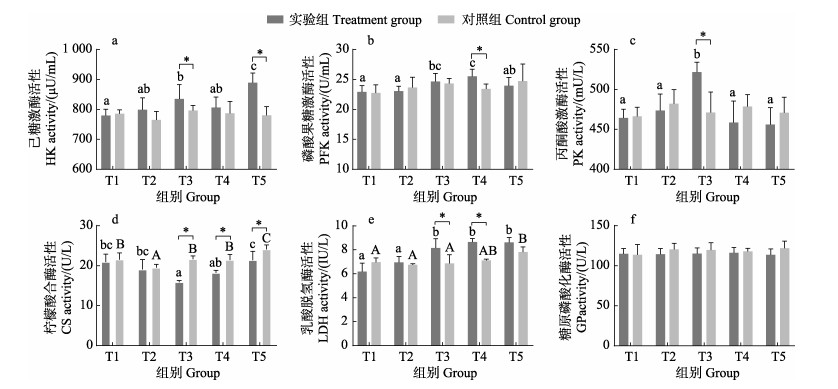
|
图 3 昼夜溶氧变化对鳜葡萄糖代谢酶活性的影响 Fig.3 The effect of diel variation of dissolved oxygen on glucose metabolism enzyme activity in S. chuatsi |
实验组中,CS活性在低氧(T3)、中氧(T4)和高氧(T5)时均显著小于对照组(P < 0.05)(图 3d);LDH活性逐渐升高,在低氧(T3)和中氧(T4)时显著大于对照组(P < 0.05)(图 3e)。实验组中,GP活性与对照组相比无显著变化(P < 0.05)(图 3f)。
2.4 肝脏葡萄糖代谢相关酶、葡萄糖转运蛋白基因相对表达量的变化实验组中,鳜糖酵解酶相关基因的表达量均呈显著上升的趋势,与对照组相比无显著变化(P>0.05)。实验组hk相对表达量在低氧(T3)和中氧(T4)时显著升高(P < 0.05)(图 4a);pfk相对表达量在T3时显著升高(P < 0.05)(图 4b);pk相对表达量在低氧(T3)和中氧(T4)时显著升高(P < 0.05)(图 4c)。
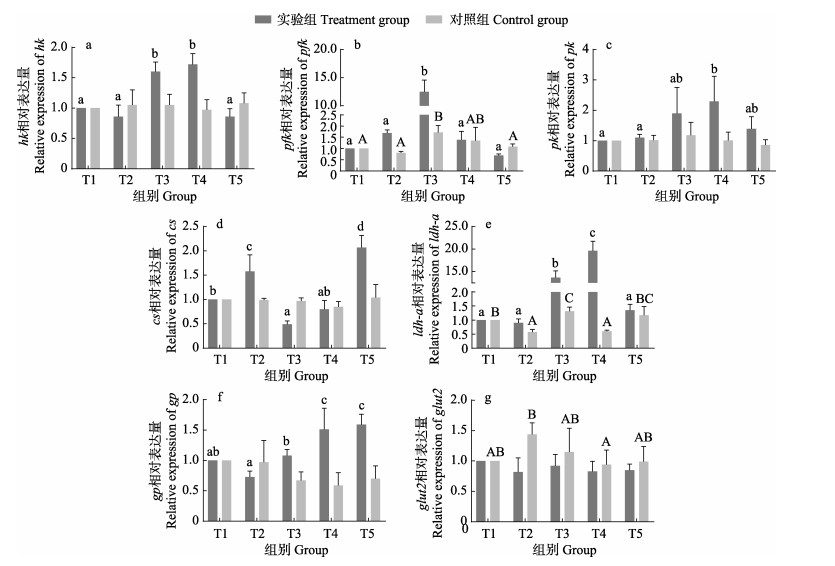
|
图 4 昼夜溶氧变化对鳜葡萄糖代谢相关基因表达的影响 Fig.4 The effect of diel variation of dissolved oxygen on the expression of genes related to glucose metabolism in S. chuatsi |
实验组有氧代谢酶cs的相对表达量在低氧(T3)时最低,高氧(T5)时最高(P < 0.05)(图 4d),与对照组相比无显著差异(P>0.05);实验组无氧代谢酶ldh-a的相对表达量在低氧(T3)和中氧(T4)时显著升高(P < 0.05)(图 4e)。
低氧(T3)、中氧(T4)和高氧(T5)时,实验组糖原分解酶gp的表达水平显著升高(P < 0.05)(图 4f);实验组中葡萄糖转运蛋白glut2表达量相比无显著变化(P > 0.05)(图 4g)。
3 讨论 3.1 池塘溶氧昼夜变化对鳜葡萄糖代谢的影响从图 1可以看出,实验中,池塘昼夜溶氧变化是一个动态的“常氧–低氧”周期性变化过程。池塘溶氧受光周期和呼吸周期的影响,07:00—17:00时,由于光照强度的逐渐增加,藻类及水生植物光合作用的产氧量大于鱼类等呼吸作用的耗氧量,因此,在日落之前,池塘溶氧积累到最高值;17:00—次日07:00时,太阳光逐渐减弱,浮游植物停止光合作用,由生产者转变为消费者,这时池塘中的产氧量小于耗氧量,水体中溶氧量逐渐减少,经过整晚消耗到早上减到最低值(徐宁等, 1998)。同时也可以看出,池塘上层水昼夜溶氧差值较大,下层水差值较小。白天上层水阳光直射光照强度大,光合速率强;下层水光照强度小,光合速率弱,下层水中的溶氧量主要依靠风力作用导致溶氧从上层水向下层水运动和扩散,但这一过程非常缓慢,所以,下层溶氧比上层溶氧低得多,因而底层溶氧的昼夜变化没有表层溶氧昼夜变化那样剧烈(卢迈新等, 1992)。
正常溶氧情况下,葡萄糖糖酵解后被有氧代谢酶氧化磷酸化产生大量ATP;在低氧条件下,葡萄糖糖酵解后,由于有氧代谢受到抑制,机体通过无氧代谢分解丙酮酸产生少量的ATP,暂时满足能量需求(Wenger et al, 2002)。CS是三羧酸(TCA)循环中的关键酶,其活性一般可作为评价有氧代谢的指标(Ding et al, 2020)。LDH能在无氧情况下催化丙酮酸转化为乳酸(LA),其活性反映了无氧代谢的强度(Wang et al, 2022; 王盼等, 2021)。
昼夜变化过程中,对照组鳜葡萄糖代谢酶活性及表达量相比无显著变化,表明在溶氧充足情况下,鳜葡萄糖代谢水平处于相对稳定的状态,均以有氧代谢方式进行。高氧(T1)和中氧(T2)时,实验组鳜葡萄糖代谢相关酶活性及表达量与对照组相比无显著差异,表明这一时间段内葡萄糖代谢方式与对照组大致相同,主要以有氧代谢方式进行。低氧(T3)时,实验组肝脏中有氧代谢酶CS的活性及表达量呈下降趋势,鳜有氧代谢受到抑制,ATP生成量下降;同时,无氧代谢酶LDH活性及表达量上升,无氧代谢能力增强。齐明等(2020)、Sun等(2020)研究表明,鳜和大口黑鲈(Micropterus salmoides)、鲤(Cyprinus carpio var qingtianensis)等鱼类一样,通过改变代谢方式来适应低氧环境。代谢方式转变引起肝脏和血浆中无氧代谢产物乳酸的积累,也导致机体内ATP含量的下降,为了满足机体正常的能量需求,鳜糖酵解酶HK、PFK和PK活性及表达量呈上升趋势,糖酵解能力增强产生少量ATP。中氧(T4)时,实验组有氧代谢酶CS活性及表达量开始上升,肝脏内ATP含量也开始升高,但血糖水平、ATP含量以及无氧代谢酶LDH活性及表达量与同一溶氧水平的T2时间点存在明显的差异,可能是因为低氧恢复至中氧时,鳜机体内生理存在滞后性,也就是说溶氧水平恢复,鳜体内葡萄糖代谢水平仍处于无氧代谢阶段,未恢复至正常水平。生理滞后性在三疣梭子蟹(Portunus trituberculatus) (王林等, 2016)和条纹鲶鱼(Pangasianodon hypophthalmus) (Rachael et al, 2021)中也有相关报道。高氧(T5)时,池塘溶氧又恢复到最大值,实验组鳜葡萄糖代谢酶活性及ATP含量也恢复到正常水平,鳜葡萄糖代谢转变为有氧代谢。
3.2 池塘溶氧昼夜变化对鳜血糖含量的影响葡萄糖通过有氧和无氧代谢产生ATP,是机体所需能量的主要来源。持续低血糖在细胞和机体水平上造成不良和不可逆的有害影响。鱼类一般是通过反馈机制来保持血糖平稳,维持能量代谢,它依赖于糖酵解、糖原合成与分解、糖异生等途径中关键酶的活性调节(Pilkis et al, 1992)。这种反馈机制旨在使物种的血糖水平保持在特定值范围内(Polakof et al, 2011)。
葡萄糖被糖酵解时,一分子葡萄糖生成2个ATP,由于产能较低,所以,在低氧情况下,底物葡萄糖会被大量分解引起血糖浓度下降。研究表明,大口黑鲈(Yang et al, 2019)在溶氧为1.2 mg/L时,急性胁迫4、8、12和24 h以及大黄鱼(Pseudosciaena crocea) (Gu et al, 2011)在溶氧为1.5和2.0 mg/L时,慢性胁迫6、12、24、48 h,血浆中葡萄糖含量均显著上升,肝糖原含量显著下降。罗非鱼(Oreochromis mossambicus) (Li et al, 2018)、花鲈(Lateolabrax maculatus) (Yan et al, 2020)等鱼类在低氧状态下,都会通过大量分解肝糖原来补充血糖浓度。而本实验结果中,低氧时,血浆葡萄糖含量显著下降与上述研究结果相反。实验组鳜血糖变化与池塘溶氧密切相关,血糖水平随溶氧的减少而下降,呈先下降后上升的变化趋势。实际上鳜血糖的变化主要受葡萄糖代谢的影响,低氧时,鳜有氧代谢受到抑制,只能依靠大量的糖酵解途径提供ATP,导致实验组鳜血糖含量下降。肝糖原的主要作用是维持血糖稳定,当血糖下降时,肝糖原在糖原分解酶的催化下分解成葡萄糖,经glut2转运到血液中维持血糖平衡。在本研究中,肝糖原含量和糖原分解酶活性无显著变化,glut2也无大量表达,表明实验组鳜血糖下降并没有引起肝糖原的分解。可能是因为实验组鳜血糖下降值处于机体正常的波动范围,并没有促使糖原分解酶分解肝糖原,也可能是因为其他生糖途径参与维持血糖平衡。
BERA A, SAWANGT P B, DASGUPTA S, et al. Diel cyclic hypoxia alters plasma lipid dynamics and impairs reproduction in goldfish (Carassius auratus). Fish Physiology and Biochemistry, 2017, 43(6): 1677-1688 DOI:10.1007/s10695-017-0401-0 |
CAO M, WANG X Q, QIN C X, et al. Transcriptome analysis of Palaemon carincauda subjected to hypoxic stress. Progress in Fishery Sciences, 2021, 42(2): 112-123 [曹梅, 王兴强, 秦传新, 等. 脊尾白虾对低氧响应的转录组学分析. 渔业科学进展, 2021, 42(2): 112-123] |
CHENG W X, LIANG X F, FU Y, et al. Research on water quality of ponds for Siniperca chuatsi and bait fish in hot season. South China Fisheries Science, 2011, 7(4): 43-48 [程炜轩, 梁旭方, 符云, 等. 高温季节鳜及饵料鱼池塘水质调查研究. 南方水产科学, 2011, 7(4): 43-48 DOI:10.3969/j.issn.2095-0780.2011.04.007] |
DAI H X, LI Y S, MA X Z, et al. The research of dissolved oxygen distribution in the crab ecological culture ponds. Journal of Shanghai Ocean University, 2013, 22(1): 66-73 [戴恒鑫, 李应森, 马旭洲, 等. 河蟹生态养殖池塘溶解氧分布变化的研究. 上海海洋大学学报, 2013, 22(1): 66-73] |
DING J, LIU C, LUO S Y, et al. Transcriptome and physiology analysis identify key metabolic changes in the liver of the large yellow croaker (Larimichthys crocea) in response to acute hypoxia. Ecotoxicology and Environmental Safety, 2021, 189: 109957 |
GAO Y A, ZENG K W, XIA X P, et al. Preliminary study on the variation of main water quality factors in the main cultivation pond of mandarin fish during the growing season. Journal of Hydroecology, 1999, 19(4): 47-49 [高银爱, 曾可为, 夏小平, 等. 鳜主养池塘生长旺季主要水质因子变化规律初步研究. 水利渔业, 1999, 19(4): 47-49] |
GRAHAM J B. Ecological, evolutionary, and physical factors influencing aquatic animal respiration. Integrative and Comparative Biology, 1990, 30(1): 137-146 |
GU X, XU Z. Effect of hypoxia on the blood of large yellow croaker (Pseudosciaena crocea). Chinese Journal of Oceanology and Limnology, 2011, 29(3): 524-530 DOI:10.1007/s00343-011-0109-4 |
HEMRE G I, MOMMSEN T P, KROGDA H L. Carbohydrates in fish nutrition: Effects on growth, glucose metabolism and hepatic enzymes. Aquaculture Nutrition, 2015, 8(3): 175-194 |
LAI Z N, SHI C B, WU S B, et al. Daily variation and correlation of physicochemical factors in Siniperca chuatsi ponds. Journal of Dalian Fisheries University, 2001, 16(1): 61-66 [赖子尼, 石存斌, 吴淑勤, 等. 鳜塘水体理化因子昼夜变化及相关性研究. 大连海洋大学学报, 2001, 16(1): 61-66 DOI:10.3969/j.issn.1000-9957.2001.01.011] |
LAI Z N, YU Y M, PANG S X, et al. Study on the relations between aquatic eco factors and health of Siniperca chuatsi. Journal of Fisheries of China, 2004, 28(3): 273-278 [赖子尼, 余煜棉, 庞世勋, 等. 水生态因子与鳜的健康关系. 水产学报, 2004, 28(3): 273-278] |
LAI Z N, YU Y M, WU S Q, et al. Study on key aquatic ecosystem factors for culturing Siniperca chuatsi by regulating model optimization. Journal of Fisheries of China, 2008, 32(4): 601-607 [赖子尼, 余煜棉, 吴淑勤, 等. 影响池养鳜健康的关键水生态因子. 水产学报, 2008, 32(4): 601-607 DOI:10.3321/j.issn:1000-0615.2008.04.014] |
LI M, WANG X, QI C, et al. Metabolic response of Nile tilapia (Oreochromis niloticus) to acute and chronic hypoxia stress. Aquaculture, 2018, 495: 187-195 DOI:10.1016/j.aquaculture.2018.05.031 |
LIU H Y, QU K M, MA S S. Survey of both the variation and the absorption and consumption budget of dissolved oxygen in culture ponds. Marine Fisheries Research, 2005, 26(2): 79-84 [刘海英, 曲克明, 马绍赛. 养殖水体中溶解氧的变化及收支平衡研究概况. 海洋水产研究, 2005, 26(2): 79-84] |
LU M X, OUYANG H, HUANG Z H, et al. Study on the dynamic and management of dissolved oxygen in the ecological system of fish pond. Freshwater Fisheries, 1992(4): 3-6 [卢迈新, 欧阳海, 黄樟翰. 池塘生态系统中溶氧动态和管理. 淡水渔业, 1992(4): 3-6] |
OBIRIKORANG K A, ACHEAMPONG J N, DUODU C P, et al. Growth, metabolism and respiration in Nile tilapia (Oreochromis niloticus) exposed to chronic or periodic hypoxia. Comparative Biochemistry and Physiology Part A: Molecular and Integrative Physiology, 2020, 248: 110768 DOI:10.1016/j.cbpa.2020.110768 |
PILKIS S J, GRANNER D K. Molecular physiology of the regulation of hepatic gluconeogenesis and glycolysis. Annual Review Physiology, 1992, 54(1): 885-909 DOI:10.1146/annurev.ph.54.030192.004321 |
POLAKOF S, MOMMSEN T P, SOENGAS J L. Glucosensing and glucose homeostasis: From fish to mammals. Comparative Biochemistry and Physiology Part A: Molecular and Integrative Physiology, 2011, 160(4): 123-149 |
QI M, HOU Y L, LIU T, et al. The effect of actue hypoxia stress and re-oxygenation on oxidative stress and energy metabolism of juvenile Cyprinus carpio var qingtianensis. Freshwater Fisheries, 2020, 50(6): 92-98 [齐明, 侯懿玲, 刘韬, 等. 急性低氧胁迫和复氧恢复对青田田鱼幼鱼氧化应激和能量代谢的影响. 淡水渔业, 2020, 50(6): 92-98] |
RACHAEL M, LOUISE T, DANG T, et al. Striped catfish (Pangasianodon hypophthalmus) use air-breathing and aquatic surface respiration when exposed to severe aquatic hypercarbia. Journal of Experimental Zoology: Part A: Ecological and Integrative Physiology, 2021, 335(9/10): 820-830 |
STIERHOFF K L, TARGETT T E, GRECAY P A. Hypoxia tolerance of the mummichog: The role of access to the water surface. Journal of Fish Biology, 2003, 63(3): 580-592 |
SUN J L, ZHAO L L, WU H, et al. Acute hypoxia changes the mode of glucose and lipid utilization in the liver of the largemouth bass (Micropterus salmoides). Science of the Total Environment, 2020, 713: 135157-135203 |
TARGETT T E, DIXON R L, GRECAY P A. Growth of the estuarine fish Fundulus heteroclitus in response to diel-cycling hypoxia and acidification: Interaction with temperature. Canadian Journal of Fisheries and Aquatic Sciences, 2019, 76(8): 1295-1304 |
WANG J Y, ZHU S G, XU C F. Biochemistry. Beijing: Higher Education Press, 2011: 109-110 [王镜岩, 朱圣庚, 徐长法. 生物化学. 北京: 高等教育出版社, 2011: 109-110]
|
WANG L, PAN L Q. A study on penetration physiological adaptation of P. trituberculatus under low salinity. Transactions of Oceanology and Limnology, 2016(3): 106-112 [王林, 潘鲁青. 三疣梭子蟹在低盐胁迫下渗透生理适应性的研究. 海洋湖沼通报, 2016(3): 106-112] |
WANG M, LI B, WANG J, et al. Skin transcriptome and physiological analyses reveal the metabolic and immune responses of yellow catfish (Pelteobagrus fulvidraco) to acute hypoxia. Aquaculture, 2022, 546: 737277 |
WANG P, SHI W J, WAN X H, et al. Effects of hypoxia and reoxygenation on respiratory metabolism enzyme and antioxidant enzyme activities in Exopalaemon carinicauda. Progress in Fishery Sciences, 2021, 42(4): 106-115 [王盼, 史文军, 万夕和, 等. 低氧–复氧对脊尾白虾呼吸代谢和抗氧化酶活力的影响. 渔业科学进展, 2021, 42(4): 106-115] |
WENGER R H. Cellular adaptation to hypoxia: O2-sensing protein hydroxylases, hypoxia-inducible transcription factors, and O2-regulated gene expression. FASEB Journal, 2002, 16(10): 1151-1162 |
XU N, LI D S. Study outlinge on the diel balance of do and the prediction of the lowest diurnal do in mariculture ponds. Journal of Fishery Sciences of China, 1998, 5(1): 84-88 [徐宁, 李德尚. 养殖池塘溶氧平衡与日最低值预报的研究概况. 中国水产科学, 1998, 5(1): 84-88] |
YAN L, PEIJIAN Z, Zhao C, et al. Physiological, biochemical responses and apoptosis-related genes expressions of hypoxia and re-oxygenation stresses in an economically important mariculture fish, the Chinese sea bass (Lateolabrax maculatus). Israeil Journal of Aquaculture-Bamidgeh, 2020, 71: 1-11 |
YANG H, CAO Z D, FU S J. The effects of diel-cycling hypoxia acclimation on the hypoxia tolerance, swimming capacity and growth performance of southern catfish (Silurus meridionalis). Comparative Biochemistry and Physiology Part A: Molecular and Integrative Physiology, 2013, 165(2): 131-138 |
YANG S, WU H, HE K, et al. Response of AMP-activated protein kinase and lactate metabolism of largemouth bass (Micropterus salmoides) under acute hypoxic stress. Science of the Total Environment, 2019, 666: 1071-1079 |



