2. 中国水产科学研究院珠江水产研究所 农业农村部热带亚热带水产资源利用与养殖重点实验室 广东省水产动物免疫技术重点实验室 广东 广州 510380
2. Key Laboratory of Tropical and Subtropical Fishery Resource Application and Cultivation, Ministry of Agriculture and Rural Affairs, Pearl River Fisheries Research Institute, Chinese Academy of Fishery Sciences, Guangdong Key Laboratory of Aquatic Animal Immunity Technology, Guangzhou 510380, China
近年来,中国水产动物蛋白生产增长迅猛,水产品总产量已超过世界总产量的50%以上(罗国芝等, 2018)。养殖过程中大量的残饵及鱼类粪便会导致养殖水体硝酸盐升高,这不仅影响水产品的质量(Davidson et al, 2014),排放后也会破坏周边环境,同时危害人类健康(Li et al, 2016)。目前,异养生物反硝化去除水体硝酸盐是经济环保的方法之一(康传磊等, 2018),其主要机理:反硝化微生物以硝酸盐为终端电子受体,有机物或无机物为电子供体和能源进行反硝化,最终产物为氮气(Ovez et al, 2006)。因此,充足的有机碳是高效去除硝酸盐的关键。
传统的外加碳源多为水溶性低分子有机物液体碳源,如甲醇、乙醇和乙酸等(荆肇乾等, 2015),但这些材料存在成本高、运输和储存复杂等问题。相比之下,固相碳源有相应的优势。一种是以可生物降解聚合物进行反硝化,但其昂贵的成本限制了其在相关领域的推广(Luo et al, 2014)。另一种是利用廉价易得的农业废弃物作为碳源,不仅环保经济,而且具有较大的比表面积,适合微生物的附着生长,是最具潜力的反硝化碳源和生物膜载体(Wang et al, 2016)。水力停留时间(hydraulic retention time, HRT)和进水硝酸盐浓度(influent nitrate concentration, INC)往往对添加农业废弃物的水处理系统的反硝化性能产生显著影响(唐小双等, 2021)。当HRT较短时,单位时间内进入反应器内的氧气量增加,会抑制反硝化的进行,同时,反硝化细菌和水体接触时间不足,造成脱氮不完全(Torno et al, 2018)。随着HRT的增加,脱氮效果通常也会提升,但过长的HRT会降低系统的工作效率(Addy et al, 2016)。因此,有必要对HRT进行优化。Blackmer等(1979)研究表明,INC会影响土壤内的反硝化性能,高浓度的硝酸盐氮(NO33–-N)通过抑制N2的生成,转而生成N2O来影响反硝化。Wang等(2020)研究发现,INC在40~200 mg/L范围内,以石英石为滤料的反硝化柱的ENC峰值和反硝化速率均随INC的增加而增加。这主要是因为高INC提供了更多的电子受体,因此,单位时间内减少的NO3–-N质量也相应增加(Liu et al, 2017),随着NO3–-N去除量的增加,NO3–-N去除率(去除量/初始量)也会发生变化。
香蕉杆(banana stalk, BS)是我国岭南地区常见的一种农业废弃物,其纤维素、半纤维素和木质素的含量分别为30%~50%、11%和25%,是一种广泛使用的可再生能源材料(蔡燕飞等, 2005)。此外,其内部存在密集的薄膜间隔的孔洞结构,是一种良好的微生物载体(Li et al, 2010)。目前,关于香蕉杆作为养殖尾水的反硝化碳源,并探究HRT和INC对其反硝化性能影响的研究少有报道。本研究以香蕉杆为养殖尾水处理系统的外加碳源,探究不同HRT和INC对其反硝化性能的影响。通过单因素方差分析(one-way ANOVA)比较不同条件下反硝化系统对养殖尾水中含氮、磷污染物的去除效果,对其最佳HRT进行优化。同时,引入高通量测序技术分析实验初期和末期反应器内细菌群落结构组成。本研究可为农业废弃物作为水产养殖尾水反硝化碳源的工艺优化提供理论基础。
1 材料与方法 1.1 实验材料和仪器香蕉杆采集于广东省广州市某农村,将香蕉杆剪切为1 cm3左右的小块,超纯水洗涤2遍,60 ℃烘干,放于密封袋中备用。采集中国水产科学研究院珠江水产研究所多年未清理的池塘底泥,用纱布(16目)过滤去除杂质作为反硝化污泥。合成水产养殖尾水(synthetic aquaculture tailwater, SAT)按照Li等(2019)的方法用纯水配制,每升SAT中的氮、磷化合物含量如表 1所示,NO3–-N浓度根据不同实验需求进行调整,亚硝酸盐氮(NO2–-N)为2.5 mg/L,氨氮(NH4+-N)为5.5 mg/L,总磷(TP)为23.88 mg/L,实验所需化学药品(分析纯)购于上海麦克林生化科技有限公司。
|
|
表 1 人工合成养殖尾水组成 Tab.1 Composition of synthetic aquaculture tailwater |
实验仪器:YSI Professional Plus系统(YSI Incorporated,美国),蠕动泵(WT-600CAS/353Y型,北京),COD测定仪(DRB200/DR900,美国),TN测定仪(LH-25A/LH-3BN,北京),酶标仪(Multiskan FC,上海)。
1.2 反应器的建立及运行如图 1所示,以圆柱形有机玻璃容器作为反硝化反应器(denitrification reactor, DR) (直径10 cm,高55 cm),采用底部进水、顶部自动溢出的流水方式,进水口位于底部向上5 cm处,出水口位于顶部向下5 cm处。购买于广州某超市的超细化学纤维材料毛巾(100 cm×40 cm)作为微生物载体,包裹40 g香蕉杆和200 mL反硝化污泥置入反应器内,有效容积为(2 800±100) mL,设置3个重复,用恒流蠕动泵控制进水流量。为确保实验数据的有效性及反应器的规模化运行,本实验在室内进行,温度为(22±2) ℃,光照强度为(355±31) lx。BS-DR0表示香蕉杆反应器未驯化状态,BS-DR14表示反应器在HRT为20 h运行14 d后的状态。
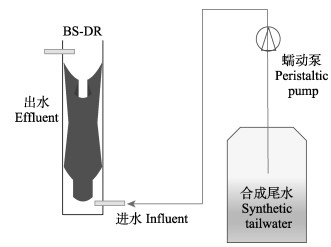
|
图 1 反硝化系统示意图 Fig.1 Schematic diagram of denitrification system |
HRT对反硝化性能的影响:向反应器中加满SAT (NO3–-N=50 mg/L),水体不流动,当NO3–-N完全去除且无NO2–-N积累,认为驯化完成。之后维持INC为50 mg/L,设置HRT为16、20、24和28 h。每个HRT运行14 d,每2 d测定出水的NO3–-N、NO2–-N、NH4+-N、TN、TP、COD、溶解氧(DO)和pH。
INC对反硝化性能的影响:驯化方法同上,在最佳HRT的基础上,设置INC为75、100和125 mg/L,每个INC运行14 d,每2 d测定出水指标(同上)。
香蕉秆表面结构及主要成分分析:收集最佳HRT下反应器内运行初期及末期的香蕉秆,在烘箱中(60 ℃)烘干,利用扫描电子显微镜(SEM)对其进行扫描观察,分析其表面结构变化。此外,分析其纤维素、半纤维素、木质素及碳、氮、磷含量变化。
微生物群落结构分析:HRT实验结束后,收集在最佳HRT下BS-DR0和BS-DR14的污泥样品进行细菌群落多样性分析。提取DNA,以“CCTACGGRRBGCA SCAGKVRVGAAT”为上游引物,“GGACTACNVGG GTWTCTAATCC”为下游引物,扩增原核生物16S rDNA的V3及V4高度可变区。PCR扩增体系包括上下游引物各1 μL、dNTPs 2 μL、TransStart Buffer 2.5 μL、TransStart Taq DNA 0.5 μL和模板DNA 20 ng,ddH2O补至25 μL。高通量测序文库的构建和基于Illumina MiSeq平台的测序由苏州帕诺米克生物公司完成。
1.3 分析方法水样经0.45 μm滤膜(PALL,中国)过滤后测定NO3–-N、NO2–-N和NH4+-N。DO和pH采用YSI Professional Plus系统测定,COD浓度采用重铬酸钾法测定;TN和TP采用过硫酸钾消解法测定;NO3–-N采用麝香草酚分光光度法测定;NO2–-N采用N-(1-萘基)乙二胺光度法测定;NH4+-N采用水杨酸分光光度法测定。
所有水质指标以平均值±标准差(Mean±SD)的形式呈现,使用SPSS 26.0软件对COD、TN、TP和NO3–-N等指标进行单因素方差分析,P < 0.05为差异显著。使用GraphPad棱镜8.0.2和Excel 2010软件绘图。
2 结果 2.1 香蕉秆表面结构及主要成分变化分析从表 2可以看出,香蕉秆的主要成分为纤维素(含量为36.90%),其次为木质素(19.23%)和半纤维素(20.13%)。其中,碳含量为42.62%,氮、磷含量均低于0.4%,表明香蕉秆作为外加碳源不易造成二次污染。经过长期运行后,其木质素相对含量增加,纤维素和半纤维素相对含量均降低,说明二者均发生了水解,为反硝化提供了碳源。此外,香蕉秆在实验后的碳、氮和磷相对含量变化不大。
|
|
表 2 实验前后香蕉秆主要成分分析结果/% Tab.2 Analysis results of main components of BS before and after experiment/% |
图 2是反应器运行前后香蕉秆分别在100倍和500倍下的扫描电镜照片。可以看出,运行前香蕉杆表面为密集的椭圆状坑洼结构。经过长期运行后,其表面结构被水解,显露出足球状的小球堆积的立体结构,且伴随孔洞和缝隙的产生,比表面积和粗糙程度大大增加。从图 2d还可以看出,其表面附着一层生物膜,这些细菌促进了香蕉秆中碳源的释放及反硝化的进行。

|
图 2 实验前后香蕉秆表面结构扫描电镜观察结果 Fig.2 SEM observation results of surface structure of BS before and after the experiment |
整个实验期间,反应器内DO均低于1 mg/L,pH (6.55~7.10)呈弱酸性或偏中性,具备反硝化进行的基础条件。进水NH4+-N始终维持在5.50 mg/L,在整个实验期间,反应器均能够将其完全去除。
INC=50 mg/L时,不同HRT下,出水硝酸盐浓度(effluent nitrate concentration, ENC)均大幅度降低。如图 3a所示,HRT为16 h时,ENC为(6.23±3.98) mg/L,去除率为(87.53±7.95)%。当HRT分别延长至20 h时,ENC降至(1.65±0.68) mg/L,去除率显著升高至(96.71±1.36)% (P=0.021)。继续延长HRT至24 h时,NO3–-N去除率反而降至(94.57±4.73)%,说明NO3–-N去除率并不一定随HRT的延长而增加。之后,当HRT=28 h时,ENC又降至(0.29±0.32) mg/L,去除率达到99%以上。但HRT在20~28 h范围内时,NO3–-N去除率无显著差异(P > 0.05)。考虑到时间成本问题,认为HRT=20 h时,反应器具有较好的NO3–-N去除效果。不同HRT下,出水NO2–-N与ENC均有相近的变化趋势。HRT为16 h时,NO2–-N出现部分积累,为(2.65±1.89) mg/L,说明此时NO3–-N转化为NO2–-N后,部分NO2–-N积累,没有进一步还原为N2。随着HRT增加至20、24和28 h后,NO2–-N浓度出现降低,分别为(0.64±0.54)、(0.70±0.49)和(0.15±0.23) mg/L,均低于1 mg/L。这意味着当HRT≥20 h时,反应器就能实现完全反硝化。如图 3b所示,TN与NO3–-N有相似的变化趋势。HRT为28和24 h时,TN去除率分别为(94.34±2.77)%和(94.48±3.11)%。当HRT缩短为20和16 h时,TN去除率分别降为(93.43±1.93)%和(84.61±5.74)%。但HRT=20 h时的TN去除率显著高于HRT=16 h (P < 0.05),但与HRT为24 h和28 h无显著差异(P > 0.05)。综上分析,香蕉杆反应器的最佳HRT为20 h。
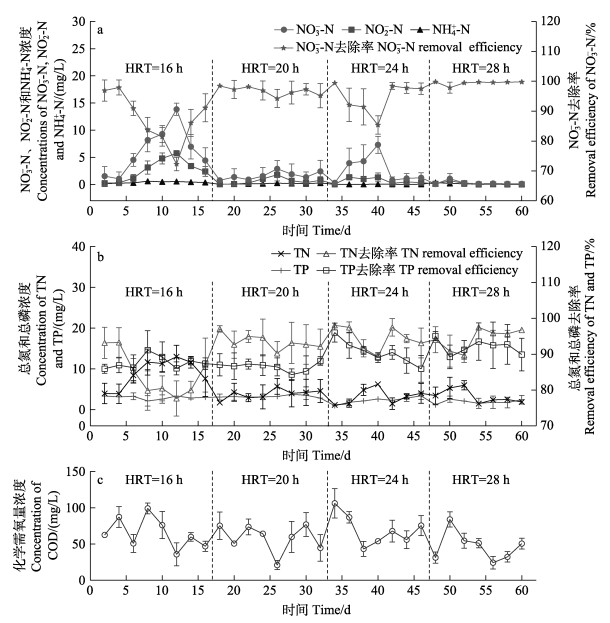
|
图 3 不同HRT下BS-DR对含氮、磷污染物的去除性能 Fig.3 Removal performance of BS-DR for nitrogen and phosphorus pollutants under different HRT |
如图 3b所示,反应器对TP同样具有良好的去除效果,且TP随HRT的延长而降低。HRT为16 h和20 h时,TP去除率分别为(86.49±1.14)%和(87.61± 1.68)%,但无显著差异(P=0.31);HRT延长至24和28 h后,TP去除率显著增加至(90.48±3.26)%和(92.03±1.89)% (P < 0.05),二者之间无显著差异(P=0.19),说明HRT也是影响TP去除效果的主要因素,值得进一步研究。
不同HRT下,出水COD浓度的变化如图 3c所示。HRT在16和20 h时,出水COD分别为(64.96± 19.99)和(58.33±17.86) mg/L。延长HRT至24 h,COD升高至最大值(69.11±20.03) mg/L。继续延长HRT至28 h时,COD又降低至最低值(46.95±19.65) mg/L。但不同HRT下,出水COD并无显著差异(P > 0.05),说明HRT对出水COD影响不明显。
2.3 INC对NO3–-N、NO2–-N、TN、TP和COD的影响在最佳HRT为20 h的条件下,进一步探究不同INC对反硝化性能的影响,NO3–-N的变化曲线如图 4a所示。INC在75~125 mg/L范围内[硝酸盐负荷率nitrate loading rate, NLR为90~150 mg N/(L·d)]时,ENC随INC的增加而增加。当INC为75 mg/L时,ENC为(5.18±4.52) mg/L,NRR为83.78 mg/(L·d)。INC增至100 mg/L时,ENC增加为(10.78±7.09) mg/L,NRR也显著增至(107.06±8.51) mg/(L·d) (P < 0.05)。继续将INC提高至125 mg/L,ENC增至(15.13±2.77) mg/L,NRR继续增至(131.84±4.53) mg/(L·d) (P < 0.05)。然而,在不同INC下,NO3–-N去除率无显著差异(P > 0.05)。以上结果说明,INC是影响ENC和NRR的关键因素,但对NO3–-N去除率影响不大。
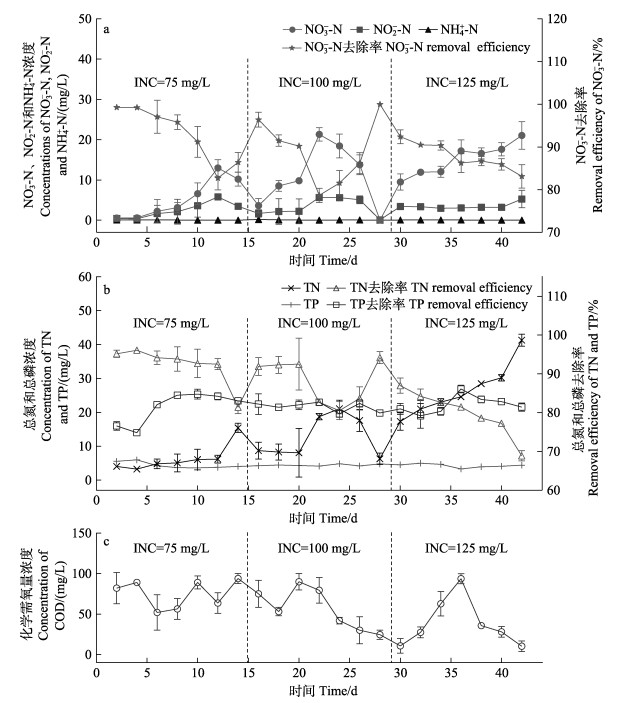
|
图 4 不同INC下BS-DR对含氮、磷污染物的去除性能 Fig.4 Removal performance of BS-DR for nitrogen and phosphorus pollutants under different INC |
如图 4a所示,出水NO2–-N随INC的增加而增加,均出现积累,表明INC在75~125 mg/L范围内时,已经超出反应器的处理能力,不能实现完全反硝化。
如图 4b所示,出水TN的变化曲线与NO3–-N相似,同样随INC的增加而增加。INC为125 mg/L时,TN去除率为(80.02±5.45)%,显著低于INC=75 mg/L组和INC=100 mg/L组(P值为0.007),但INC分别为75和100 mg/L时,TN去除率无显著差异,P值分别为0.097和0.053。结合2.2部分的结果分析,认为在最佳HRT下,INC为50 mg/L时,反应器的硝酸盐处理能力达到饱和状态。
如图 4b所示,不同INC条件下的出水TP去除率均在81%左右,并未随INC的变化而出现显著差异(P值分别为0.38、0.80和0.71),说明INC对TP的去除效果影响不大。
从图 4c可以看出,出水COD随INC的增加而减小,表明COD的消耗量和NRR呈正相关。不同INC条件下,出水COD分别为(75.14±16.07)、(56.29±23.68)和(38.33±27.87) mg/L,它们之间相比具有显著差异(P < 0.05),说明INC是影响出水COD的关键因素。
2.4 微生物群落结构分析 2.4.1 香蕉杆反应器微生物多样性指数变化微生物样本多样性指数如表 3所示。对原始序列进行质控处理,分别获得49 881和53 163个高质量序列,共归入5 202和4 429个OTU (operational taxonomic unit)。所有样本Coverage指数 > 0.98,说明测序序列几乎覆盖所有的细菌,测序结果具有可靠性和代表性。相比初期,反应器经过长期运行后,Observed-species、Chao1、Shannon指数和ACE指数均降低,说明细菌群落多样性和均匀性改变,物种数目、丰富度和均匀度降低,部分细菌被富集。
|
|
表 3 细菌群落α多样性指数 Tab.3 The α diversity index of bacterial community |
所有样品中,共鉴定出103个门、218个纲、524个科和749个属。对OTU的代表序列进行门水平上的分类见图 5a。反应器在初期及末期的优势菌落在结构组成上有一定的相似性,包含变形菌门(Proteobacteria)、盐杆菌门(Halobacterota)、拟杆菌门(Bacteroidetes)、脱硫细菌门(Desulfobacterota)、弯曲杆菌门(Campilobacterota)、厚壁菌门(Firmicutes)、Sva0485、绿弯菌门(Chloroflexi) 和疣微菌门(Verrucomicrobiota)等,但其相对丰度具有差异。实验初期,它们的相对丰度分别为15.53%、14.68%、4.61%、8.35%、0.13%、1.69%、4.99%、4.19%和2.27%;实验后期,变形菌门、拟杆菌门、弯曲杆菌门和厚壁菌门在反应器中相对丰度增至31.20%、6.67%、3.08%和4.26%,相反,盐杆菌门、脱硫细菌门、Sva0485、绿弯菌门和疣微菌门在反应器中减少至10.39%、5.13%、2.82%、2.00%和1.17%。整体来说,香蕉杆的添加及长期硝酸盐注入导致反应器内的部分细菌被富集。
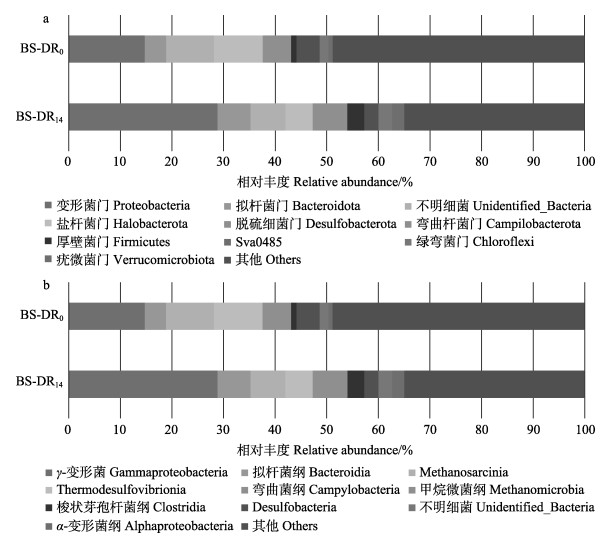
|
图 5 BS-DR0和BS-DR14在门(a)和纲(b)水平上的相对丰度 Fig.5 Relative bacteria abundance of BS-DR0 and BS-DR14 at phylum (a) and class (b) levels |
实验后期,反应器内的优势纲为γ-变形菌纲(Gammaproteobacteria) (28.88%)、拟杆菌纲(Bacteroidia) (6.37%)、Methano-sarcinia (6.75%)、Thermodesulfovibrionia (5.31%)、弯曲菌纲(Campylobacteria) (3.08%)、甲烷微菌纲(Methanomicrobia) (3.64%)、梭状芽孢杆菌纲(Clostridia) (3.28%)、Desulfobacteria (2.76)、α-变形菌纲(Alphaproteobacteria) (2.32%)等(图 5b)。相比实验初期,γ-变形菌纲、拟杆菌纲、弯曲菌纲、梭状芽孢杆菌纲和α-变形菌纲的相对丰度增加,Methanosarcinia、Thermodesulfovibrionia、甲烷微菌纲和Desulfobacteria则降低。
2.4.4 属水平上的微生物群落结构在属水平上进一步对OTU进行分类,可以观察到细菌群落结构更详细的差异(图 6)。实验初期,反应器的优势菌属为Candidatus_competibacter、ADurb.Bin063-1、Geothermobacter、Methanoregula、甲烷鬃菌属(Methanosaeta)、莫拉菌属(Moraxella)、甲烷绳菌属(Methanolinea)、unidentified_Thermodesulfovibrionia、Sva0081_sediment_group和Desulfatiglans。然而,在持续注入硝酸盐后,反应器的优势菌属发生变化,包括Sulfuricella、Pseudarcobacter、硫磺单胞菌属(Sulfurospirillum)、Dechloromonas、Paludibacterium、固氮螺菌属(Azospirillum)、Clostridium sensu stricto1、梳杆菌属(Thiobacillus)、拟杆菌属(Bacteroides)、Dechlorobacter、Sulfurimonas、磁螺菌属(Magnetospirillum)和Dechlorobacter。

|
图 6 基于属水平上BS-DR0和BS-DR14的物种丰度聚类热图 Fig.6 Heatmap of species abundance clustering of BS-DR0 and BS-DR14 based on genus level |
与液体碳源不同,农业废弃物须经降解后才能提供异养细菌可利用的溶解性有机碳,厌氧条件可以促进这一过程的发生(Luo et al, 2014)。此外,DO作为一种能量更高的电子受体,它的存在会与反硝化过程中的电子受体形成竞争,或者通过抑制NO3–-N还原酶来抑制反硝化,因此,反硝化主要发生在厌氧条件下,通常要求DO < 2 mg/L (Waki et al, 2018)。pH主要通过影响酶的活性来影响反硝化过程,高的反硝化性能需要中性或近中性的pH条件,pH值越低,反硝化性能越差(Albina et al, 2019)。在整个实验过程中,反应器内DO均 < 1 mg/L且pH为弱酸性或偏中性,保证了适合反硝化的基础环境条件。
3.2 BS-DR对NH4+-N的去除在HRT和INC实验中,BS-DR均能完全去除NH4+-N。刘倩等(2015)研究发现,养殖尾水固相反硝化系统对NH4+-N也具有很好的去除效果。Li等(2021)在同步硝化反硝化系统中也观察到NH4+-N和NO3–-N均能去除。王振毅等(2021)在厌氧氨氧化耦合反硝化的研究中也有类似发现。根据以往研究分析:一方面可能是反应器发生了同步硝化和反硝化作用。另一方面可能是反硝化过程中会产生大量NO2–-N,能够提供大量的电子受体,在氧气短缺的情况下,发生了厌氧氨氧化作用,导致NH4+-N的完全去除(申慧彦等, 2021)。
3.3 HRT对反硝化性能的影响HRT是影响BS-DR反硝化性能的主要因素之一,当HRT≥20 h时,NO3–-N去除率就不再显著增加。Guo等(2017)等以废活性污泥的热水解液和产酸液为碳源时同样发现,当HRT分别大于12 h和8 h后,两种反硝化系统NO3–-N去除率就不再显著增加。Gao等(2020)也研究发现,当HRT达到6 h后,继续增加HRT并不能提高NO3–-N去除率。这主要是因为当反硝化系统处于较低HRT时,NO3–-N与微生物种群接触时间不足以完成微生物的代谢活动,导致NO3–-N去除率较低(Moussavi et al, 2015)。此外,较小的HRT会导致较大的流速,部分细菌被水流冲走也会影响NO3–-N的去除,导致有机物消耗量减少(Guo et al, 2017)。因此,此时出水COD相对较高。而NO2–-N作为反硝化过程的中间产物,其去除过程受NO3–-N的影响,这是由于NO3–-N还原酶会和NO2−-N还原酶争夺基质电子,且NO3–-N还原酶会抑制NO2–-N还原酶的活性(Ge et al, 2012)。当出水NO3–-N较高时,NO2–-N会积累,不能实现完全反硝化。当HRT延长至20 h后,反硝化细菌有更多时间接触养殖尾水,出水NO3–-N降低,NO2–-N的抑制被解除,进一步还原为N2,几乎无积累。Sage等(2006)以复合材料为碳源的反硝化研究中也有相似的发现,但当HRT过长时,NO3–-N去除率并不显著增加,出现这种现象的原因是NO3–-N的相对流入量减少,抑制了异养菌的生物活性(He et al, 2016)。因此,盲目延长HRT是没有意义的。本研究中,NO3–-N为进水中的主要含氮污染物,实验过程中,NH4+-N被完全去除,且出水NO2–-N较低,因此,TN和NO3–-N的去除过程有相似的趋势,同时也说明香蕉杆自身释氮量较低。
3.4 INC对反硝化性能的影响在最佳HRT下,随着INC的增加,出水NO3–-N和NO2–-N也相应增加。这主要是因为过高的INC超出了反应器的处理能力,因而不能实现完全反硝化。此外,反应器的NRR随INC的增加而增加。同样,Liu等(2017)研究发现,随着河流中NO3–-N浓度的增加,河流潜流带的NRR也会增强。Song等(2020)在海水循环养殖水处理系统中也发现,NRR随INC增加而增加。这主要是因为随着INC的提高,反应器单位体积内电子受体增加,因此,在固定HRT下,有效反硝化的NO3–-N也随之增加,单位时间内减少的NO3–-N也增加,从而导致NRR的提升(Wang et al, 2020)。此外,有机物作为反硝化的电子供体,在NO3–-N去除量增加的同时,COD的消耗量也会增加,因此,反应器的出水COD随INC增加而减少。
3.5 微生物群落结构分析反应器经过长久运行后,细菌群落结构发生改变。Luo等(2020)以猪粪为碳源的反硝化系统也有相同的发现。这是由于碳源的释放及长久NO3–-N注入对细菌具有选择性,从而导致细菌群落结构的改变(Lu et al, 2014)。变形菌门作为第一优势菌门,被大量富集。其多数为反硝化细菌,兼性和专性厌氧,是污泥中普遍存在的反硝化细菌(Meng et al, 2017)。此外,它在不同水体环境中都是促进反硝化作用的优势类群(张健龙等, 2017)。γ-变形菌纲和α-变形菌纲是变形菌门的两个主要类别,包含丰富的硝化细菌、厌氧氨氧化细菌和亚硝酸盐氧化细菌,是污水处理系统脱氮的主要参与者(Kumar et al, 2010),实验期间,反应器对NH4+-N良好的去除作用可能和厌氧氨氧化细菌有关。此外,γ-变形菌纲作为反应器内的第一优势纲,也具有很强的去磷功能,这也是反应器具有良好除磷效果的原因之一(Osaka et al, 2008)。拟杆菌门同样作为反应器内的优势菌门,普遍存在于环境中,在生态系统的氮循环和能量转换中有重要的作用(Zhao et al, 2018),以往发现拟杆菌门存在反硝化系统中的现象有很多(Si et al, 2018)。拟杆菌门中存在可以分解蛋白质、纤维素和脂质等大分子有机物的细菌(Cao et al, 2019),能促进香蕉杆释放有机物,此外,拟杆菌纲属于拟杆菌门,为第二优势纲,也是反硝化的主力军(Zhang et al, 2019)。厚壁菌门中存在参与反硝化和纤维素降解的细菌,对香蕉杆的水解和酸化起着重要作用(Wang et al, 2015)。绿弯菌门在反硝化中的具体作用并没有报道,但亚硝酸盐氧化菌已经从绿弯菌门中分离出来,具有一定参考性(Sorokin et al, 2012)。疣微菌门具有较高的木质素降解能力,存在于循环水养殖系统的生物滤池中(Qu et al, 2021),实验后期,其相对丰度降低,说明其不适合降解香蕉杆。
反应器初期和末期的优势菌属存在明显的差异,周梦娟等(2018)有类似的发现。此外,反应器运行末期的优势菌属多数具有反硝化功能,且在以往反硝化系统中被发现(Chen et al, 2017; Zhou et al, 2019; Wu et al, 2020),说明香蕉杆有利于反硝化细菌的生长,是一种良好的反硝化碳源,同时,这些反硝化细菌也保证了反应器的高效运行。其中,Dechloromonas是目前报道最多的自养型硝酸盐还原硫化物氧化细菌之一(Zhou et al, 2019);拟杆菌属能将纤维素降解为简单有机物且具有反硝化作用,常存在于厌氧反应器内(Wu et al, 2020),是参与香蕉杆水解的主要细菌之一。张欣瑞等(2020)研究发现,Clostridium sensu stricto在低碳源条件下依然能够大量富集,是反应器内主要的反硝化细菌。固氮螺菌属同样具有反硝化功能,在牛粪堆肥中被发现(徐莹莹等, 2015)。硫磺单胞菌属、Sulfurimonas、梳杆菌属是一种以硝酸盐为电子受体将硫化物氧化成硫酸盐的脱氮硫单胞菌,在以往研究中被发现(Chen et al, 2017)。甲烷鬃菌属、甲烷绳菌属和Methanoregula是一种产甲烷古细菌,普遍存在同步反硝化产甲烷系统中(Yi et al, 2016),反应后期,它们在反应器内相对丰度降低。Feng等(2019)有相似的发现,认为有机物浓度的增加可能对它们的生长代谢有抑制作用。
4 结论HRT是影响BS-DR反硝化性能的关键因素,在一定范围内,HRT越长,硝酸盐去除率越高,过长的HRT并不能引起硝酸盐去除率的显著增加。BS-DR的最佳HRT为20 h,对应硝酸盐去除率为(96.71±1.36)%,无亚硝酸盐积累,能实现完全反硝化。
INC也是影响BS-DR硝酸盐去除速率的关键因素。在最佳HRT下,INC在75~125 mg/L范围内时,BS-DR不能实现完全反硝化,它们的ENC和NRR均随INC的增加而增加,硝酸盐去除率随INC的增加而下降,出水COD随INC的增加而降低,认为当INC为50 mg/L时,BS-DR的硝酸盐处理能力达到饱和状态。
经过长期运行后,BS-DR内细菌群落结构发生改变,其中,变形菌门、拟杆菌门、弯曲杆菌门和厚壁菌门被大量富集,它们是反硝化过程的主要参与者,保证了反应器的高效运行。此外,反应器经过长期运行后,优势菌属发生明显改变,这些优势菌属多数具有反硝化功能。
ADDY K, GOLD A J, CHRISTIANSON L E, et al. Denitrifying bioreactors for nitrate removal: A meta-analysis. Journal of Environmental Quality, 2016, 45(3): 873-881 DOI:10.2134/jeq2015.07.0399 |
ALBINA P, DURBAN N, BERTRON A, et al. Influence of hydrogen electron donor, alkaline pH, and high nitrate concentrations on microbial denitrification: A review. International Journal of Molecular Sciences, 2019, 20(20): 5163 DOI:10.3390/ijms20205163 |
BLACKMER A M, BREMNER J M. Stimulatory effect of nitrate on reduction of N2O to N2 by soil microorganisms. Soil Biology and Biochemistry, 1979, 11(3): 313-315 DOI:10.1016/0038-0717(79)90078-6 |
CAI Y F, ZHAO S Q, HE C X, et al. Studies on conversion of banana plant stalk into sugar by cellulose decomposing mixing strains. Modern Chemical Industry, 2005, 25(9): 34-36 [蔡燕飞, 赵肃清, 何成新, 等. 应用纤维素分解菌降解香蕉杆生成可发酵糖的研究. 现代化工, 2005, 25(9): 34-36] |
CAO S B, SUN F Q, LU D, et al. Characterization of the refractory dissolved organic matters (rDOM) in sludge alkaline fermentation liquid driven denitrification: Effect of HRT on their fate and transformation. Water Research, 2019, 159: 135-144 DOI:10.1016/j.watres.2019.04.063 |
CHEN C, XU X J, XIE P, et al. Pyrosequencing reveals microbial community dynamics in integrated simultaneous desulfurization and denitrification process at different influent nitrate concentrations. Chemosphere, 2017, 171: 294-301 DOI:10.1016/j.chemosphere.2016.11.159 |
DAVIDSON J, GOOD C, WELSH C, et al. Comparing the effects of high vs. low nitrate on the health, performance, and welfare of juvenile rainbow trout Oncorhynchus mykiss within water recirculating aquaculture systems. Aquacultural Engineering, 2014, 59: 30-40 |
FENG S H, HONG X J, WANG T, et al. Reutilization of high COD leachate via recirculation strategy for methane production in anaerobic digestion of municipal solid waste: Performance and dynamic of methanogen community. Bioresource Technology, 2019, 288: 121509 DOI:10.1016/j.biortech.2019.121509 |
GAO Y D, GUO L, SHAO M Y, et al. Heterotrophic denitrification strategy for marine recirculating aquaculture wastewater treatment using mariculture solid wastes fermentation liquid as carbon source: Optimization of COD/NO3–-N ratio and hydraulic retention time. Bioresource Technology, 2020, 304: 122982 DOI:10.1016/j.biortech.2020.122982 |
GE S J, PENG Y Z, WANG S Y, et al. Nitrite accumulation under constant temperature in anoxic denitrification process: The effects of carbon sources and COD/NO3–-N. Bioresource Technology, 2012, 114: 137-143 DOI:10.1016/j.biortech.2012.03.016 |
GUO Y D, GUO L, SUN M, et al. Effects of hydraulic retention time (HRT) on denitrification using waste activated sludge thermal hydrolysis liquid and acidogenic liquid as carbon sources. Bioresource Technology, 2017, 224: 147-156 DOI:10.1016/j.biortech.2016.11.056 |
HE Y, WANG Y H, SONG X S. High-effective denitrification of low C/N wastewater by combined constructed wetland and biofilm-electrode reactor (CW-BER). Bioresource Technology, 2016, 203: 245-251 DOI:10.1016/j.biortech.2015.12.060 |
JING Z Q, PENG Y Y, HE R, et al. Types of carbon source for reducing the cost of denitrification. Hubei Agricultural Sciences, 2015, 54(3): 517-520 [荆肇乾, 彭英艳, 何瑞, 等. 降低脱氮成本的新型碳源与工艺研究概况. 湖北农业科学, 2015, 54(3): 517-520] |
KANG C L, LI Q F, ZHANG Y, et al. Purifying effect of three heterotrophic nitrification-aerobic denitrification bacteria strains on the farming water of Verasper variegates. Progress in Fishery Sciences, 2018, 39(2): 42-48 [康传磊, 李秋芬, 张艳, 等. 三株异养硝化–好氧反硝化细菌对圆斑星鲽养殖水质的净化效果. 渔业科学进展, 2018, 39(2): 42-48] |
KUMAR M, LIN J G. Co-existence of anammox and denitrification for simultaneous nitrogen and carbon removal: Strategies and issues. Journal of Hazard Mater, 2010, 178(1/2/3): 1-9 |
LI C W, LI J W, LIU G, et al. Performance and microbial community analysis of combined denitrification and biofloc technology (CDBFT) system treating nitrogen-rich aquaculture wastewater. Bioresource Technology, 2019, 288: 121582 DOI:10.1016/j.biortech.2019.121582 |
LI H, LIU Q S, YANG P, et al. Encapsulation of microorganisms for simultaneous nitrification and denitrification in aerobic reactors. Journal of Environmental Chemical Engineering, 2021, 9(4): 105616 DOI:10.1016/j.jece.2021.105616 |
LI K, FU S, ZHAN H, et al. Analysis of the chemical composition and morphological structure of banana pseudo-stem. BioResources, 2010, 5(2): 576-585 |
LI R, FENG C P, HU W H, et al. Woodchip-sulfur based heterotrophic and autotrophic denitrification (WSHAD) process for nitrate contaminated water remediation. Water Research, 2016, 89: 171-179 DOI:10.1016/j.watres.2015.11.044 |
LIU Q, XU G M, LUO G Z. Study on the effect of hydraulic retention time on aquaculture wastewater treatment in solid-phase denitrification system. Fishery Modernization, 2015, 42(6): 6-10 [刘倩, 徐桂梅, 罗国芝. 水力停留时间对养殖污水固相反硝化处理效果的影响研究. 渔业现代化, 2015, 42(6): 6-10 DOI:10.3969/j.issn.1007-9580.2015.06.002] |
LIU Y Y, LIU C X, NELSON W C, et al. Effect of water chemistry and hydrodynamics on nitrogen transformation activity and microbial community functional potential in hyporheic zone sediment columns. Environmental Science and Technology, 2017, 51(9): 4877-4886 DOI:10.1021/acs.est.6b05018 |
LU H J, CHANDRAN K, STENSEL D. Microbial ecology of denitrification in biological wastewater treatment. Water Research, 2014, 64: 237-254 DOI:10.1016/j.watres.2014.06.042 |
LUO G Z, HOU Z W, GAO J F, et al. Nitrate removal efficiency and microbial community analysis of polycaprolactone-packed bioreactors with PCL as carbon source treating aquaculture water under different hydraulic retention time. Chinese Journal of Environmental Engineering, 2018, 12(2): 572-580 [罗国芝, 侯志伟, 高锦芳, 等. 不同水力停留时间条件下PCL为碳源去除水产养殖水体硝酸盐的效率及微生物群落分析. 环境工程学报, 2018, 12(2): 572-580] |
LUO G Z, LI L, LIU Q, et al. Effect of dissolved oxygen on heterotrophic denitrification using poly (butylene succinate) as the carbon source and biofilm carrier. Bioresource Technology, 2014, 171: 152-158 DOI:10.1016/j.biortech.2014.08.055 |
LUO Z F, WANG D H, YANG J, et al. The effect of using pig manure as an internal carbon source in a traditional piggery wastewater treatment system for biological denitrification. Ecological Engineering, 2020, 143: 105638 DOI:10.1016/j.ecoleng.2019.105638 |
MENG H, WU R, WANG Y F, et al. A comparison of denitrifying bacterial community structures and abundance in acidic soils between natural forest and re-vegetated forest of Nanling Nature Reserve in southern China. Journal of Environmental Management, 2017, 198: 41-49 |
MOUSSAVI G, JAFARI S J, YAGHMAEIAN K. Enhanced biological denitrification in the cyclic rotating bed reactor with catechol as carbon source. Bioresource Technology, 2015, 189: 266-272 DOI:10.1016/j.biortech.2015.04.019 |
OSAKA T, SHIROTANI K, YOSHIE S, et al. Effects of carbon source on denitrification efficiency and microbial community structure in a saline wastewater treatment process. Water Research, 2008, 42(14): 3709-3718 DOI:10.1016/j.watres.2008.06.007 |
OVEZ B, OZGEN S, YUKSEL M. Biological denitrification in drinking water using Glycyrrhiza glabra and Arunda donax as the carbon source. Process Biochemistry, 2006, 41(7): 1539-1544 DOI:10.1016/j.procbio.2006.02.015 |
QU J, YANG H, LIU Y, et al. The study of natural biofilm formation and microbial community structure for recirculating aquaculture system. IOP conference series: Earth Environmental Science, 2021, 742(1): 012018 DOI:10.1088/1755-1315/742/1/012018 |
SAGE M, DAUFIN G, GESAN-GUIZIOU G. Denitrification potential and rates of complex carbon source from dairy effluents in activated sludge system. Water Research, 2006, 40(14): 2747-2755 DOI:10.1016/j.watres.2006.04.005 |
SHEN H Y, WANG H, YAO L, et al. Influence of nitrate (NO3–-N) on nitrite (NO2−-N) accumulation in partial denitrification process. Environmental Science and Technology, 2021, 44(5): 1-7 [申慧彦, 汪河, 姚亮, 等. 硝酸盐对短程反硝化过程中亚硝酸盐积累影响. 环境科学与技术, 2021, 44(5): 1-7] |
SI Z H, SONG X S, WANG Y H, et al. Intensified heterotrophic denitrification in constructed wetlands using four solid carbon sources: Denitrification efficiency and bacterial community structure. Bioresource Technology, 2018, 267: 416-425 DOI:10.1016/j.biortech.2018.07.029 |
SONG X F, YANG X H, HALLERMAN E, et al. Effects of hydraulic retention time and influent nitrate-N concentration on nitrogen removal and the microbial community of an aerobic denitrification reactor treating recirculating marine aquaculture system effluent. Water, 2020, 12(3): 650 DOI:10.3390/w12030650 |
SOROKIN D Y, LUCKER S, VEJMELKOVA D, et al. Nitrification expanded: discovery, physiology and genomics of a nitrite-oxidizing bacterium from the phylum Chloroflexi. ISME Journal, 2012, 6(12): 2245-2256 DOI:10.1038/ismej.2012.70 |
TANG X S, ZHANG K K, JIA J, et al. Purification characteristics of constructed wetland under different hydraulic loads after treatment of marine aquaculture tailwater. Progress in Fishery Sciences, 2021, 42(5): 16-23 [唐小双, 张可可, 贾军, 等. 不同水力负荷下人工湿地对海水养殖尾水污染物的净化特征. 渔业科学进展, 2021, 42(5): 16-23] |
TORNO J, NAAS C, SCHROEDER J P, et al. Impact of hydraulic retention time, backflushing intervals, and C/N ratio on the SID-reactor denitrification performance in marine RAS. Aquaculture, 2018, 496: 112-122 DOI:10.1016/j.aquaculture.2018.07.004 |
WAKI M, YASUDA T, FUKUMOTO Y, et al. Treatment of swine wastewater in continuous activated sludge systems under different dissolved oxygen conditions: Reactor operation and evaluation using modelling. Bioresource Technology, 2018, 250: 574-582 DOI:10.1016/j.biortech.2017.11.078 |
WANG H Y, HE Q L, CHEN D, et al. Microbial community in a hydrogenotrophic denitrification reactor based on pyrosequencing. Applied Microbiology and Biotechnology, 2015, 99(24): 10829-10837 DOI:10.1007/s00253-015-6929-y |
WANG J L, CHU L B. Biological nitrate removal from water and wastewater by solid-phase denitrification process. Biotechnology Advances, 2016, 34(6): 1103-1112 DOI:10.1016/j.biotechadv.2016.07.001 |
WANG J Q, MA R, GUO Z L, et al. Experiment and multicomponent model based analysis on the effect of flow rate and nitrate concentration on denitrification in low-permeability media. Journal of Contaminant Hydrology, 2020, 235: 103727 DOI:10.1016/j.jconhyd.2020.103727 |
WANG Z Y, LI X Y, ZHAO D M, et al. Research progress on reaction mechanism and influencing factors of anaerobic ammonium oxidation coupled denitrification technology. Coal and Chemical Industry, 2021, 44(5): 120-124 [王振毅, 李欣宇, 赵大密, 等. 厌氧氨氧化耦合反硝化技术反应机理及其影响因素研究进展. 煤炭与化工, 2021, 44(5): 120-124] |
WU G M, LI Z J, HUANG Y, et al. Electrochemically assisted sulfate reduction autotrophic denitrification nitrification integrated (e-SANI) process for high-strength ammonium industrial wastewater treatment. Chemical Engineering Journal, 2020, 381: 122707 DOI:10.1016/j.cej.2019.122707 |
XU Y Y, XU X H, REN G M, et al. Effect of microbial inoculum on denitrifying bacterial communities in cow manure compost. Journal of Agro-Environment Science, 2015, 34(3): 570-577 [徐莹莹, 许修宏, 任广明, 等. 接种菌剂对牛粪堆肥反硝化细菌群落的影响. 农业环境科学学报, 2015, 34(3): 570-577] |
YI X H, WAN J Q, MA Y W, et al. Characteristics and dominant microbial community structure of granular sludge under the simultaneous denitrification and methanogenesis process. Biochemical Engineering Journal, 2016, 107: 66-74 |
ZHANG J L, JIANG M, WANG C F, et al. Microbial diversity in bio-filter of the recirculating aquaculture system for Litopenaeus vannamei. Progress in Fishery Sciences, 2017, 38(5): 73-82 [张健龙, 江敏, 王城峰, 等. 凡纳滨对虾(Litopenaeus vannamei)循环水养殖塘挂膜式生物滤器内微生物的多样性. 渔业科学进展, 2017, 38(5): 73-82] |
ZHANG W, BAI Y, RUAN X H, et al. The biological denitrification coupled with chemical reduction for groundwater nitrate remediation via using SCCMs as carbon source. Chemosphere, 2019, 234: 89-97 |
ZHANG X R, CHI Y L, WANG Q, et al. Effects of aeration strategy on denitrifying performance of activated sludge processes in treating low-carbon-source municipal wastewater. Environmental Science, 2020, 41(7): 3356-3364 [张欣瑞, 池玉蕾, 王倩, 等. 低碳源条件下供氧模式对活性污泥系统脱氮性能的影响. 环境科学, 2020, 41(7): 3356-3364] |
ZHAO Y F, CAO X, SONG X S, et al. Montmorillonite supported nanoscale zero-valent iron immobilized in sodium alginate (SA/Mt-NZVI) enhanced the nitrogen removal in vertical flow constructed wetlands (VFCWs). Bioresource Technology, 2018, 267: 608-617 |
ZHOU M J, MIAO H F, LU Z M, et al. The influence of different carbon sources on denitrification rate and community structure of denitrifying bacteria. Research of Environmental Sciences, 2018, 31(12): 2047-2054 [周梦娟, 缪恒锋, 陆震明, 等. 碳源对反硝化细菌的反硝化速率和群落结构的影响. 环境科学研究, 2018, 31(12): 2047-2054] |
ZHOU S L, ZHANG Y R, HUANG T L, et al. Microbial aerobic denitrification dominates nitrogen losses from reservoir ecosystem in the spring of Zhoucun Reservoir. Science of the Total Environment, 2019, 651(1): 998-1010 |



