2. 中国水产科学研究院黄海水产研究所 山东 青岛 266071;
3. 青岛海洋科学与技术国家实验室海洋渔业科学与食物产出过程功能实验室 山东 青岛 266071;
4. 东营市万德海水养殖装备有限公司 山东 东营 257500
2. Key Laboratory of Sustainable and Development of Marine Fisheries, Ministry of Agriculture and Rural Affairs, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China;
3. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071, China;
4. Dongying Wande Marine Aquaculture Equipment Co., Ltd., Dongying 257500, China
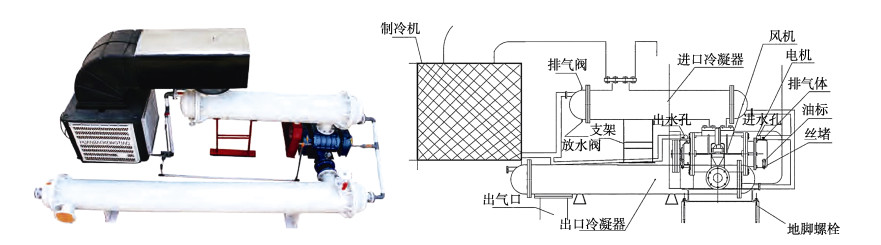
仿刺参(Apostichopus japonicus)又称刺参,具有重要的营养和药用价值,是我国继鱼、虾、贝、藻四次海水养殖浪潮后的第五次海水养殖浪潮的主体品种之一。进入21世纪,刺参养殖产业迅速发展,逐步建立了池塘养殖、围堰养殖、底播养殖、工厂化养殖、浅海网箱养殖、海上吊笼养殖和多物种混养等多元化养殖模式,形成了以山东、辽宁、河北沿海为主产区、并以东参西养、北参南养等形式延伸到黄河三角洲地区和闽浙沿海的增养殖产业群。但自2013年以来,夏季持续的极端高温天气造成我国的刺参大面积死亡,损失严重。从养殖模式上看,池塘养殖是受灾最为严重的养殖形式之一。随着全球气候变化,高温等极端环境正逐渐呈现常态化趋势(Sévellec et al, 2018; Helmuth, 2002),夏季高温已成为制约刺参稳定可持续产出的关键因素。因此,建立一种能够有效减少刺参大面积死亡的安全度夏技术已成为刺参产业可持续发展的重要需求。研究表明,夏季刺参大面积死亡是水体环境、生物体、病原体等多个因素共同作用的结果(霍达等, 2017)。高温条件下,底层水温升高,池塘水体垂直循环受阻,出现温跃层、盐跃层及缺氧层,造成池塘底部缺氧,进而导致池底氨氮、亚硝酸盐等有毒物质累积。此外,环境因子的变化也会影响池底菌群结构的变化,微生物的群落特征能够反映并影响其生存环境的理化性质和健康状况(闫法军, 2013; 丁斯予等, 2019)。为探索建立一种有效的夏季刺参池塘温度及环境调控技术,本团队研发出一款养殖池塘冷能气雾降温设备(图 1)。2019—2020年夏季高温期,应用相关设备在山东省东营市刺参主产区开展了刺参养殖池塘高温防控实验,获得了良好的应用效果,刺参池塘实现了安全度夏。为解析该设备助力池塘养殖刺参安全度夏的机制,本研究在该产区选取2个试验区的8个池塘(安装并使用该设备的5个实验池塘和未采取任何降温措施的3个对照池塘),测定高温期相应池塘的水质和底质环境差异,并利用高通量测序技术分析实验组与对照组池塘沉积物菌群结构差异,以期为解析该设备使用效果提供数据支撑。
|
图 1 冷能气雾降温设备及其工作原理示意图 Fig.1 The schematic diagram and its working principle of the cooling equipment based on cooled atomization air |
本研究的测试池塘位于山东东营垦利刺参池塘养殖主产区的2个区域(区域Ⅰ:37°31ʹN,118°54ʹE;区域Ⅱ:37°36ʹN,118°56ʹE),单个池塘面积为3.67~4.00 hm2,均为刺参单养池塘,刺参的平均规格为(14.59±9.68) g/头,苗种密度为6.0万~10.5万头/hm2。其中5个实验池塘于2020年春季安装养殖池塘冷能气雾降温设备,并自2020年7月1日夏季高温期开始前按照设备使用工艺使用该设备进行度夏,根据相对位置的不同,将5个池塘分为2个实验组,即位于区域Ⅰ的实验组E1的3个池塘(分别标记为E1-1、E1-2和E1-3)和位于区域Ⅱ的实验组E2的2个池塘(分别标记为E2-1和E2-2);此外,每一区域的实验组池塘附近,选取相同养殖背景、但未安装任何度夏措施的池塘作为对照池塘,编号分别为C1、C2和C3,其中,对照池C1和C2位于区域Ⅰ,对照池C3位于区域Ⅱ(具体分布位置见图 2)。

|
图 2 测试池塘的位置及其分组 Fig.2 The location and grouping of the ponds being tested |
在2020年夏季高温末期对相应池塘进行环境因子检测和水样及沉积物样品的采集。每个池塘在3个采样点进行采样,位置为池塘对角线两侧离岸2 m及对角线交点处。将采集的3个样品等量混匀进行实验室测定和送检,每个样品进行3次重复,剔除异常值后最终取3次测定的平均值。采用美国YSI 556便携式水质测定仪现场测定池塘底层水体温度(T)、酸碱度(pH)和溶解氧(DO)。利用采水器采集池塘底层(离池底20 cm处)水样2 L,低温运送到实验室,经0.22 μm醋酸纤维素滤膜抽滤后,利用NH4-3 TC reagent HR Set (德国WTW)试剂盒测定底层水体的离子氨含量;在相应池塘利用柱状采泥器采集池塘表层沉积物样品(0~5 cm),置于无菌自封袋中,并立即放到装满冰块的保温箱中运至实验室。采用纳氏试剂分光光度法(HJ 535-2009)测定沉积物中的氨氮含量,采用分光光度法(GB/T 7493-1987)测定沉积物中亚硝酸氮含量,采用重铬酸盐法(HJ 828-2017-COD)测定沉积物的化学需氧量。用于菌群结构分析的底泥样品在运抵实验室后放入–80 ℃冷冻保存。
1.3 池塘底层沉积物菌群结构分析采用E.Z.N.A.Soil DNA试剂盒(Omega Biotek, 美国)提取沉积物中的基因组DNA,使用16S rDNA V3~V4区特异引物338F (5ʹ-ACTCCTACGGGAGGC AGCA-3ʹ)和806R(5ʹ-GGACTACHVGGGTWTCTAAT-3ʹ)进行PCR扩增,PCR产物回收构建测序文库,利用Illumina HiSeq平台对所构建的文库进行高通量测序。对原始数据进行拼接、过滤、去除嵌合体等多个数据处理过程后最终获得有效序列。
使用Usearch (V10.0)软件,以Reads在97.0%的相似度水平下,对序列进行聚类以获得操作分类单元(OTUs)。采用RDP classifier软件进行物种分类,分类阈值选择0.8,低于该阈值的分类结果划归为unclassified一类。采用Mothur (V1.30)软件对样品序列进行多样性分析。其中,Alpha多样性分析包括ACE指数、Chao1指数、Shannon指数和Simpson指数的分析。Beta多样性分析包括PCoA (principal coordinates analysis)、UPGMA (unweighted pair-group method with arithmetic mean analysis)和Anosim (analysis of similarities)的分析。基于物种分类结果,得到在不同水平上各Rank的丰度值,采用STAMP软件,比较样本或组间丰度差异,进行LefSe (LDA effect size)分析,筛选条件为P < 0.05。采用PICRUSt2软件对实验组和对照组沉积物微生物群落基因功能进行预测和COG (clusters of orthologous groups of proteins)分类,统计实验组与对照组样品间微生物群落的功能基因在代谢途径上的差异和变化。
1.4 池塘底层沉积物菌群结构与环境因子相关性分析基于OTU聚类和环境因子信息,利用R语言的Vegan package进行环境因子相关性分析。根据RDA (redundancy analysis)图中元素点之间距离进行样品组成相近性分析;根据射线间的夹角大小进行环境因子与样品间的相关性分析。用R (https://www.r-project.org/)计算OTU丰度与刺参养殖池塘水体氨氮水平的相关系数。根据Greengenes数据库筛选出皮尔森相关系数(Pearson correlation)绝对值> 0.7、P < 0.05的OTU,确定相应OTU的分类地位并解析其与水体氨氮水平的相关性。
2 结果与分析 2.1 高温期池塘冷能气雾降温设备应用对刺参养殖池塘环境因子的影响对5个实验池和3个对照池底层水体和沉积物的各项环境因子测定数据如表 1所示。结果显示,E1和E2组水温分别为(24.55±0.28)和(24.07±0.24) ℃,对照组水温为(28.81±0.12) ℃,实验组水温均显著低于对照组(P < 0.05),分别比对照组低4.26 ℃和4.74 ℃;E1、E2和对照组水体pH分别为8.39±0.07、8.42±0.03、8.23±0.16,3组间无显著差异(P > 0.05);E1和E2水体溶解氧含量分别为(5.92±0.29)和(6.09±0.45) mg/L,均显著高于对照组的溶解氧含量(4.93±0.15) mg/L (P < 0.05)。此外,实验组水体底层氨氮含量均 < 0.01 mg/L,显著低于对照组氨氮含量(0.29±0.02) mg/L (P < 0.05)。对各池塘沉积物的测定结果显示,E1组沉积物中氨氮以及亚硝酸氮含量分别为(0.13±0.02)和(0.04± 0.03) mg/L,E2组沉积物中氨氮和亚硝酸氮含量分别为(0.12±0.00)和(0.04±0.03) mg/L,2个实验组沉积物中氨氮和亚硝酸氮含量均显著低于对照组(P < 0.05)。E1、E2和对照组的化学需氧量分别为(3.28±0.20)、(3.15±0.23)和(6.07±1.50) mg/L,对照组化学需氧量显著高于实验组(P < 0.05)。
|
|
表 1 高温期池塘冷能气雾降温设备应用对刺参养殖池塘环境因子的影响 Tab.1 Effects of the cooling equipment application based on cooled atomization air on environmental factors in A. japonicus culture ponds during high temperature period in summer |
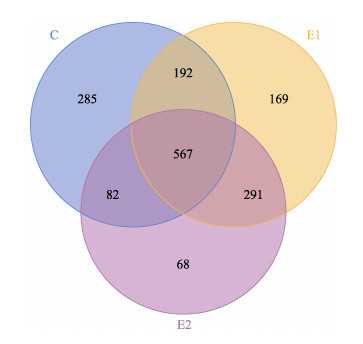
所有沉积物样品经高通量测序后所得原始测序序列为79 800~80 282条,经质量控制、嵌合体和非靶区域序列去除后,8个样品所得有效序列为73 061~75 298条,有效序列占比为91.01%~94.22%,分别获得707~880个OTUs (表 2)。构建的3个组的OTU Venn图显示(图 3),实验组和对照组池塘独有OTU数目分别为E1组169个,E2组68个,C组285个;2个实验组间共有OTU数最多为291个,说明2个实验组间微生物群落种类相似,并与对照组存在差异。对不同分组α多样性指数统计结果见表 2,2个实验组和对照组的ACE和Chao1指数平均值分别为1165.00和1126.90 (E1),1400.21和1119.90 (E2),1070.40和1022.43 (C),其中E2的ACE指数显著高于对照组(P < 0.05),3组间Chao1指数无显著差别(P > 0.05)。E1和E2的Simpson指数均为0.99,Shannon指数均 > 7.00,而对照组分别为0.82和4.45;实验组Simpson指数和Shannon指数均显著高于对照组(P < 0.05),说明实验组的菌群多样性及丰度整体高于对照组。
|
|
表 2 各组池塘池底沉积物菌群多样性 Tab.2 Alpha diversity analysis of sedimental microbial community in the tested ponds |
|
图 3 实验组和对照组沉积物样品Venn图 Fig.3 Venn diagram of sediment in experimental groups and control group |
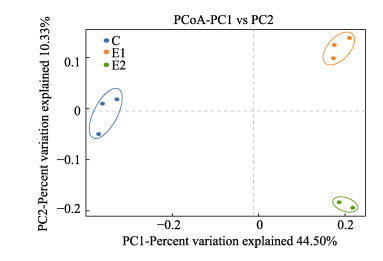
为进一步探究8个池塘沉积物样本间微生物群落相似性,本研究基于Bray-Curtis算法在OTU水平上对8个测试池塘的沉积物样品进行PCoA分析结果见图 4,PCoA1的贡献率为44.50%,PCoA2的贡献率为10.33%,总贡献率为54.83%。各组内样品均聚集在一起,显示出较好的生物学重复性,2个实验组与对照组间样品间距较远,说明实验组与对照组沉积物样品的菌群结构差异较大。以weighted unifrac算法为基础进行UPGMA分析,得到样品间距离矩阵图(图 5),进行Anosim分析,得到组间unifrac距离箱线图(图 6),可以看出,实验组5个样本间微生物群落结构相似性较高,实验组与对照组物种组成相似性较低,组间差异显著大于组内差异(R=1, P=0.012)。
|
图 4 实验组和对照组池塘沉积物菌群的PCoA分析 Fig.4 PCoA of sedimental microbial community in experimental groups and control group E1为第1个区域实验组,E2为第2个区域实验组,C为未安装该设备的对照组。 E1: Experimental group in the first area; E2: Experimental group in the second area; C: Negative control group. |

|
图 5 基于微生物群落结构的实验组与对照组池塘聚类分析 Fig.5 Cluster analysis of the tested ponds based on microbial communities in experimental groups and control group |

|
图 6 实验组和对照组的沉积物样品的Anosim分析距离箱线图 Fig.6 The distance box diagram based on the Anosim analysis in experimental groups and control group |
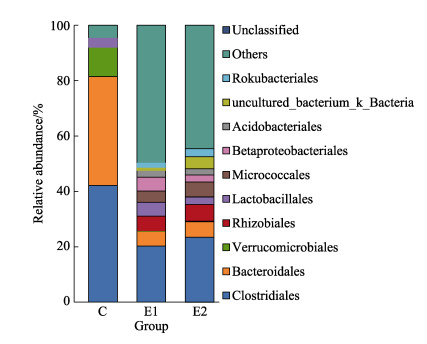
对实验组和对照组沉积物样本进行菌群结构的特征分析发现,8个样品检测到的细菌归属于27门、72纲、176目、325科、639属。在目水平上(图 7),实验组E1、E2沉积物样本中位于前三的优势菌目依次均为梭菌目(Clostridiales)、根瘤菌目(Rhizobiales)和拟杆菌目(Bacteroidales),相对丰度依次为E1 (20.23%、5.34%和5.02%),E2 (23.48%、5.97%和5.54%)。对照组中位于前三的优势菌目依次为梭菌目、拟杆菌目和疣微菌目(Verrucomicrobiales),相对丰度分别为42.15%、39.26%和10.99%。实验组中根瘤菌目、乳杆菌目(Lactobacillales)和微球菌目(Micrococcales)相对丰度显著高于对照组,而拟杆菌目和疣微菌目的相对丰度显著低于对照组(P < 0.05)。
|
图 7 基于目水平的实验组和对照组池塘沉积物菌群相对丰度统计(> 1%) Fig.7 Relative abundance of the experimental groups and control group ponds based on Order level (> 1%) |
基于样本目水平菌群结构的特征分析发现,实验组E1和E2沉积物样本中优势菌群一致,与对照组优势菌群的结构差异明显,且实验组菌群组成较对照组更为丰富。
2.4 实验组和对照组差异菌群结构特征分析基于物种分类结果对实验组和对照组进行LefSe分析,并构建差异菌群物种信息树状图(图 8a),并筛选在不同组中存在显著差异(P < 0.05)的菌群(图 8b)。结果显示,共有不同分类水平的13个菌群在3组间存在显著差异。放线菌门在实验组E1和E2中均存在差异菌群,其中微球菌目为E2组代表性差异菌群;此外,酸杆菌门(Acidobacteria)和变形菌门(Proteobacteria)只在E1组中存在差异菌群,其中,变形菌门代表性差异菌群为β变形菌目(Beta-proteobacteriales)和伯克氏菌科(Burkholderiaceae);而对照组沉积物差异菌门主要隶属于厚壁菌门(Firmicutes),其代表性差异菌科为瘤胃菌科(Ruminococcaceae)。
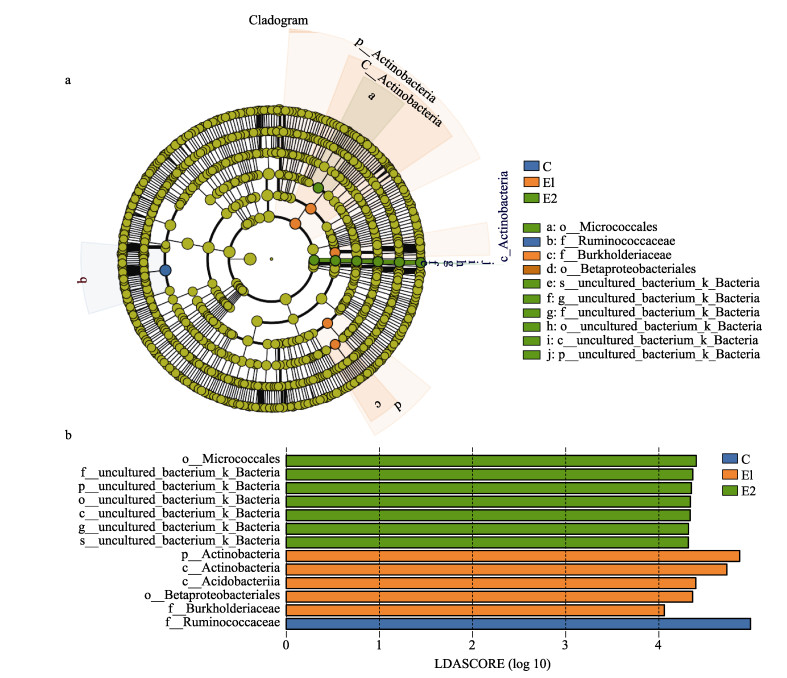
|
图 8 实验组和对照组池塘沉积物菌群LEfSe分析环形树状图(a)和柱状图(b) Fig.8 LEfSe analysis annular tree diagram (a) and histogram (b) of sediment bacterial community in experimental groups and control group |
所选实验区域刺参养殖池塘沉积物菌群与环境因子RDA分析结果显示(图 9a),实验组样本处于第一、第四象限,对照组样本处于第二象限,实验组与对照组样本分布区域无重叠。表明影响2组沉积物菌群结构的主要环境因子不同。根据环境因子与原点连线的长度可知,T (底层水温)、NH4+-N-1 (底层水体氨氮)、NH4+-N-2 (沉积物中氨氮)、NO2–-N (沉积物中亚硝酸盐)、COD (沉积物化学需氧量) 等是影响沉积物菌群的主导环境因子。所有环境因子中,NH4+-N-1、NH4+-N-2、NO2–-N和COD与对照池沉积物菌群相对丰度呈正相关,与实验池沉积物菌群相对丰度呈负相关;DO和pH与实验池菌群相对丰度呈正相关,与对照池菌群相对丰度呈负相关。

|
图 9 基于RDA的实验组和对照组池塘沉积物样品与环境因子(a)以及菌群与环境因子间(b)关系分布图 Fig.9 The distribution diagram of the relationship between pond sediment samples and environmental factors (a) and between bacterial community and environmental factors (b) in experimental groups and control group based on the RDA |
通过对RDA结果中环境因子与样本优势菌目的分布关系(图 9b)进行分析发现,实验组中的优势菌目:酸杆菌目、β变形菌目、微球菌目、根瘤菌目和乳杆菌目等的分布与环境因子中的pH和DO呈正相关,与T、NH4+-1、NH4+-2、NO2–-N、COD等呈负相关;对照组中的优势菌目疣微菌目、拟杆菌目的分布与T、NH4+-1、NH4+-2、NO2–-N、COD等环境因子呈正相关,与pH和DO呈负相关。
2.5.2 OTUs相对丰度与氨氮水平关联性分析根据OTUs在实验组与对照组的相对丰度和刺参养殖池塘水体氨氮水平变化趋势之间的相关系数,筛选P < 0.05和Pearson correlation的绝对值> 0.7的OTU,并对筛选获得的OTU进行注释(表 3),Pearson correlation为正值的为正相关,若为负值则为负相关,变化趋势如图 10所示。OTU7、OTU29以及OTU108均与水体中氨氮含量呈显著负相关(P < 0.05),Pearson correlation分别为–0.74、–0.88和–0.82。OTU7、OTU29及OTU108分别注释为苍白杆菌属(Ochrobactrum)、埃希氏菌属(Escherichia-Shigella)及芽孢杆菌属(Bacillus)。
|
|
表 3 水体氨氮水平及与其相关OTU的筛选及注释结果 Tab.3 The ammonia nitrogen in the bottom water and its associated OTU screening and annotation results |
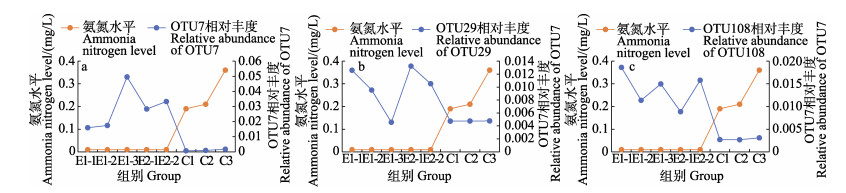
|
图 10 水体氨氮水平与筛选OTU7 (a)、OTU29 (b)、OTU108 (c)相对丰度的变化趋势 Fig.10 The variation trend of ammonia nitrogen level in the bottom water and OTU7 (a), OTU29 (b), and OTU108 (c) relative abundance |
利用PICRUSt2软件对实验组和对照组沉积物微生物群落进行基因功能预测和COG分类统计,在所预测到的25个原核生物COG代谢途径中,实验组和对照组在18个代谢途径上存在显著差异(P < 0.05)(图 11)。其中,代谢方面的氨基酸的运输和代谢、辅酶的运输和代谢、脂质的运输和代谢、能源生产与转换等在实验组的相对丰度显著高于对照组;而碳水化合物的运输和代谢、翻译后修饰、蛋白质转换以及伴侣蛋白等在对照组中相对丰度显著高于实验组(P < 0.05)。在细胞过程与信号传导方面,细胞运动性、细胞内运输、分泌和囊泡运输、复制、重组和修复等在实验组的相对丰度显著高于对照组;细胞周期控制、细胞分裂、染色体分裂,防御机理、转录以及细胞外结构等在对照组中相对丰度显著高于实验组(P < 0.05)。在信息存储与处理方面,染色质结构和动力学、次生代谢物的生物合成、运输和分解代谢等在实验组的相对丰度显著高于对照组;RNA加工和修饰、翻译、核糖体结构和生物发生等在对照组中相对丰度显著高于实验组(P < 0.05)。
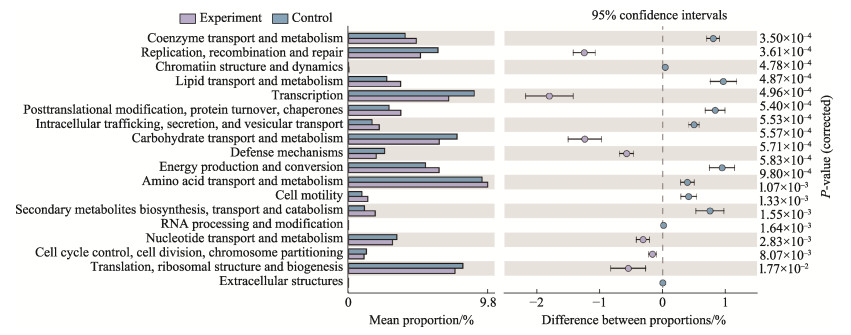
|
图 11 基于COG分类的实验组与对照组沉积物菌群的功能分类统计图 Fig.11 The statistical chart of functional categories based on the analysis of the COG of all the bottom sediments samples in experimental groups and control group |
霍达等(2017)和王印庚等(2014)研究表明,夏季刺参大面积死亡是水体环境、生物体、病原体等多个因素共同作用的结果,其中,影响较为显著的环境因子有高温、低氧、低盐和高氨氮水平等。本设备的工作原理是将降温后的低温空气通过纳米微气泡的形式输入到底层水体,由于纳米级微气泡具有上升速度慢且在水体中存留时间长的特点,留存在池水里的微气泡可以在白天反射太阳光,减少阳光照射造成的池水温度快速升高。本研究结果表明,应用该设备既可以显著降低池塘底部水温,又可以有效提高池水的溶解氧并降低池水和池底氨氮和亚硝酸盐的浓度。这可能是由于设备使用可有效往池塘中输送冷能气雾,打破高温期池水的温跃层,在给池水降温的同时,氧气被高效地送到池底,增加了池水的溶解氧,溶解氧的增高可有效氧化氨氮和亚硝酸盐等对刺参有害的物质,为刺参提供更优良的栖息环境,有效避免了高温期池底高水温、低溶氧造成的海参逆境胁迫,并降低了氨氮和亚硝酸盐对刺参的毒性作用,达到池塘养殖条件下刺参安全度夏的目的。
3.2 应用高温期池塘冷能气雾降温设备对养殖池塘沉积物菌群多样性的影响微生态学研究结果表明,菌群物种丰度和多样性受多种环境因子的共同调控,温度和溶解氧既会影响微生物的代谢和增殖活性,还会间接影响氨氮、亚硝酸盐等环境因子,进而影响微生物群落结构(Bell et al, 2013; Nishiyama et al, 2018; 裴泓霖等, 2021; 谭八梅等, 2021)。水温为26 ℃条件下的拟穴青蟹(Scylla paramamosain)养殖系统中细菌群落多样性指数和物种丰度均高于30 ℃(罗金飞等, 2020)。王玉龙等(2021)研究发现,与自然纳潮的刺参养殖池塘相比,应用养水机的刺参养殖池塘水体中溶解氧含量明显增加,细菌群落多样性较高且二者间菌群结构差异大。本研究结果显示,应用冷能气雾降温设备的实验组池塘(平均水温为24~25 ℃,平均溶解氧为6 mg/L)沉积物菌群丰度和多样性整体显著高于未安装任何度夏措施的对照组池塘(平均水温为28~29 ℃,平均溶解氧为5 mg/L)。本结果与以上结果相似,推测高温、低氧条件下微生物的种类和丰度可能受到影响,进而造成菌群多样性较低。此外,基于微生物群落结构对2个实验区域的实验组和对照组池塘的PCoA和聚类分析结果均显示,2个实验区域的5个实验池塘菌群结构相似性较高,而与对照组差异较大,可以推测设备使用是影响夏季池塘沉积物菌群结构变化的主要因素。
3.3 池塘沉积物菌群结构与环境因子的相关性氮富集是导致我国水体污染的主要原因之一,养殖环境中过高的氨氮与亚硝酸氮浓度会降低刺参机体免疫能力,对其生长造成负面影响,更易受病原微生物侵染,最终导致刺参死亡(刘洪展, 2013; 徐松涛等, 2017; 姚雪梅等, 2007)。沉积物表层是池塘氮循环发生的主要场所(方秀珍等, 1999; 谢骏等, 2002)。本研究结果表明,实验池塘沉积物的氨氮和亚硝酸氮含量均显著低于对照池塘,因此,参与氮循环过程的微生物种类丰度变化与氨氮和亚硝酸氮含量等环境因子密切相关。基于目水平的实验组和对照组的菌群相对丰度可以看出,实验组中根瘤菌目、乳杆菌目和微球菌目相对丰度显著高于对照组,而拟杆菌目和疣微菌目的相对丰度显著低于对照组。对3组池塘沉积物特异性菌群分析,筛选到2个实验组中具有代表性的差异菌类有放线菌门、酸杆菌纲、微球菌目、β-变形菌目、伯克氏菌科的相应菌株。根瘤菌目分类下的多种细菌多为池塘底栖环境中常见的固氮菌,均具有高水平的固氮作用(Hunter et al, 2006),可有效去除沉积物中多余的氮,减少水体富营养化(龚骏等, 2013)。乳杆菌目与沉积物中亚硝酸氮含量呈负相关,其分支下的乳杆菌科,主要包括乳杆菌(Lactobacillus)等多种细菌,具有抑制致病菌、增强机体免疫力以及降解亚硝酸盐的功能(Wang et al, 2015; Rauch et al, 2012)。本研究结果表明,β-变形菌目和微球菌目的菌株是实验组中具有代表性的差异菌,β-变形菌目的种类是变形菌门中主要参与沉积物中NH4+氧化过程以及硫循环中硫氧化和硫还原的细菌(李金业等, 2021; Freitag et al, 2003; McCaig et al, 1999),同时也是底栖环境中常见的固氮菌。此外,β-变形菌目细菌在环境中的占比可作为环境质量监测与评价的生态指标之一,在池塘养殖生态系统中占据重要的生态学地位(龚骏等, 2013; 白洁等, 2009)。谢骏等(2002)研究发现,高溶氧水平会提高氨化反应效率,微球菌目作为氨化细菌,与水体中溶解氧水平呈正相关(李辉等, 2008),在一定条件下还表现出强硝化和反硝化作用(陈威等, 2010; Kim et al, 2014),说明应用设备后显著的增氧效果可以更好达到去除氮素污染的目的。养殖池塘沉积物中的放线菌具有分解纤维素、芳香族化合物、蛋白质和淀粉等大分子物质、净化水质(傅丽君等, 2010)和修复水体环境(宫兴文等, 2000)的能力,同时可以合成多种次生代谢产物,产生能抑制其他革兰氏阳性细菌的抗菌类物质,有望成为益生菌的重要微生物类别(李文均等, 2002)。本研究进一步筛选到与水体氨氮呈显著负相关的3个OTUs,分别注释到苍白杆菌属、埃希氏菌属以及芽孢杆菌属。芽孢杆菌属是一种多功能菌属,可有效分解有机氮化物并将其矿化为氨,还具有硝化与反硝化功能,对沉积物内源氮素的固定与释放具有重要意义(梁秀莲, 2021; Zheng et al, 2008),同时,芽孢杆菌属对病原微生物具有强拮抗作用,可以产生抑制毒性基因表达的抗生素等活性物质(苏艳莉等, 2016; 林亮, 2005)。埃希氏菌属参与反硝化过程,可有效防止环境中的氮素过分损失,使氮素能被贮藏,有利于维持池塘沉积物微生态环境的稳定。苍白杆菌属参与氮循环中的固氮、硝化和反硝化反应,对于水体自净和改善环境具有重要意义(李思亮等, 2002)。由此可以推测,实验组刺参养殖池塘反硝化过程活跃,有利于氮循环的稳定进行,降低沉积物中有害有机物的水平,这也与本研究中实验池塘亚硝酸盐和氨氮含量显著低于对照池塘的结果一致。
4 结论本研究表明,在高温期运用冷能气雾降温设备的实验组刺参养殖池塘底层水体温度、水体氨氮、沉积物氨氮、沉积物亚硝酸氮和化学需氧量均显著低于未安装任何度夏措施的对照组池塘,底层水体的溶解氧含量显著高于对照池塘。对相应池塘的沉积物微生物群落结构测定结果表明,实验组池塘的沉积物的菌群丰度和多样性均显著高于对照池,实验组中参与氮循环过程的微生物种类丰度显著高于对照组。相关研究结果为池塘冷能气雾降温设备保障刺参安全度夏的机制解析提供了数据支撑。
BAI J, LI H Y, ZHANG J, et al. Diversity of bacterial community in the sediments of the Northern Yellow Sea China. Environmental Science, 2009, 29(12): 1277-1284 [白洁, 李海艳, 张健, 等. 黄海西北部沉积物中细菌群落16S rDNA多样性解析. 中国环境科学, 2009, 29(12): 1277-1284] |
BELL T H, YERGEAU E, MAYNARD C, et al. Predictable bacterial composition and hydrocarbon degradation in Arctic soils following diesel and nutrient disturbance. ISME Journal, 2013, 10(1): 1-13 |
CHEN W, WANG Z Y, ZHAO G F, et al. Isolation and performance evaluation of a heterotrophic nitrobacterium Micrococcus sp. Chinese Journal of Ecology, 2010, 29(8): 1629-1633 [陈威, 王振宇, 赵更峰, 等. 异养硝化微球菌的分离及性能评价. 生态学杂志, 2010, 29(8): 1629-1633] |
DING S Y, WANG L, XU H C, et al. Bacterial community structure and function in the intestinal tracts and culture environment of sea cucumber (Apostichopus japonicus). Chinese Journal of Ecology, 2019, 38(1): 210-220 [丁斯予, 王荦, 徐瀚晨, 等. 刺参肠道及养殖环境菌群结构与功能. 生态学杂志, 2019, 38(1): 210-220] |
FANG X Z, XIE J, GUO X Z, et al. Study on the conversion efficiency of nitrogenous matter by the bacteria in pond silt. Journal of Dalian Ocean University, 1999, 14(1): 70-74 [方秀珍, 谢骏, 郭贤桢, 等. 池塘淤泥中细菌对含氮物质转化效率的研究. 大连水产学院学报, 1999, 14(1): 70-74] |
FREITAG T E, PROSSER J I. Community structure of ammonia-oxidizing bacteria within anoxic marine sediments. Applied and Environmental Microbiology, 2003, 69(3): 1359-1371 DOI:10.1128/AEM.69.3.1359-1371.2003 |
FU L J, AN X L, ZHENG T L. Advances in algicidal substances produced by algae-lysing Actinomycetes. Advances in Earth Science, 2010, 25(9): 960-965 [傅丽君, 安新丽, 郑天凌. 环境中放线菌及其抑藻活性物质研究的若干进展. 地球科学进展, 2010, 25(9): 960-965] |
GONG J, SONG Y J, ZHANG X L. Phylogenetic and functional diversity of nitrogen cycling microbes in coastal sediments. Biodiversity Science, 2013, 21(4): 434-445 [龚骏, 宋延静, 张晓黎. 海岸带沉积物中氮循环功能微生物多样性. 生物多样性, 2013, 21(4): 434-445] |
GONG X W, CAI W Q, MA J Y. A study on improvement of S30 and PSB in water quality for Trionyx sinensis in greenhouse. Journal of Fishery Sciences of China, 2000, 7(2): 116-118 [宫兴文, 蔡完其, 马江耀. 玉垒菌(S30)和光合细菌(PSB)对温室养鳖池水质改良作用的研究. 中国水产科学, 2000, 7(2): 116-118] |
HELMUTH B. Climate change and latitudinal patterns of intertidal thermal stress. Science, 2002, 298(5595): 1015-1017 DOI:10.1126/science.1076814 |
HUO D, LIU S L, YANG H S. Analysis of causes and corresponding strategies for summer massive mortalities of sea cucumber. Studia Marina Sinica, 2017, 52: 47-58 [霍达, 刘石林, 杨红生. 夏季养殖刺参(Apostichopus japonicus)大面积死亡的原因分析与应对措施. 海洋科学集刊, 2017, 52: 47-58] |
HUNTER E M, MILLS H J, KOSTKA J E. Microbial community diversity associated with carbon and nitrogen cycling in permeable shelf sediments. Applied and Environmental Microbiology, 2006, 72(9): 5689-5701 DOI:10.1128/AEM.03007-05 |
KIM Y E, YOON H, YOU Y H, et al. Diversity and characteristics of rhizosphere microorganisms isolated from the soil around the roots of three plants native to the Dokdo Islands. Journal of Life Science, 2014, 24(4): 461-466 |
LI H, XU X Y, LI P J, et al. Research on ammonibacteria removing organic nitrogen in construction wetland. Chinese Journal of Environmental Engineering, 2008, 2(8): 1044-1047 [李辉, 徐新阳, 李培军, 等. 人工湿地中氨化细菌去除有机氮的效果. 环境工程学报, 2008, 2(8): 1044-1047] |
LI J Y, CHEN Q F, LI Q, et al. Analysis of microbial diversity and driving factors in coastal wetlands of the Yellow River Delta. Acta Ecologica Sinica, 2021, 41(15): 1-13 [李金业, 陈庆锋, 李青, 等. 黄河三角洲滨海湿地微生物多样性及其驱动因子. 生态学报, 2021, 41(15): 1-13] |
LI S L, LIU C Q, XIAO H Y. Microbial effect on nitrogen cycle and nitrogen isotope fractionation on the earth's surface: A review. Geology-Geochemistry, 2002, 30(4): 40-45 [李思亮, 刘丛强, 肖化云. 地表环境氮循环过程中微生物作用及同位素分馏研究综述. 地质地球化学, 2002, 30(4): 40-45] |
LI W J, ZHANG Z Z, JIANG C L. The advance on taxonomic of genus Thermoactinomyces. Acta Microbiologica Sinica, 2002, 42(6): 759-763 [李文均, 张忠泽, 姜成林. 高温放线菌属分类研究进展. 微生物学报, 2002, 42(6): 759-763] |
LIANG X L. Study on the distribution characteristics of nitrogen forms and microbial community structure in the sediments of Xiangjiaba reservoir. Master´s Thesis of the Hebei University of Engineering, 2021 [梁秀莲. 向家坝库区底泥氮形态分布特征及微生物群落结构研究. 河北工程大学硕士研究生学位论文, 2021]
|
LIN L. The effect of Bacillus probiotics on microbial communities and shrimp intestinal microflora. Master´s Thesis of the Jinan University, 2005 [林亮. 芽孢杆菌制剂对虾池微生物群落以及对虾肠道菌群的影响. 暨南大学硕士研究生学位论文, 2005]
|
LIU H Z. The immunoresponse characteristics and molecularly resistant mechanism of Apostichopus japonicus subjected to the marine environment and pathogens. Doctoral Dissertation of the Ocean University of China, 2013 [刘洪展. 养殖仿刺参对环境因子和病原的免疫应答及抗病分子机理. 中国海洋大学博士研究生学位论文, 2013]
|
LUO J F, LIAO Y Y, LI S D, et al. Influence of temperature on microbial community structure in a Scylla paramamosain recirculating aquaculture system. Journal of Fishery Sciences of China, 2020, 27(4): 393-405 [罗金飞, 廖永岩, 李书迪, 等. 温度对拟穴青蟹循环水养殖系统微生物群落结构的影响. 中国水产科学, 2020, 27(4): 393-405] |
MCCAIG A E, PHILLIPS C J, STEPHEN J R, et al. Nitrogen cycling and community structure of proteobacterial β-subgroup ammonia-oxidizing bacteria within polluted marine fish farm sediments. Applied and Environmental Microbiology, 1999, 65(1): 213-220 |
NISHIYAMA E, HIGASHI K, MORI H, et al. The relationship between microbial community structures and environmental parameters revealed by metagenomic analysis of hot spring water in the Kirishima area, Japan. Frontiers in Bioengineering and Biotechnology, 2018, 20(6): 202-217 |
PEI H L, WANG L, TAN B M, et al. Environmental factors influence the seasonal characteristics of bacterial community in the sediment of Apostichopus japonicus culture ponds. Progress in Fishery Sciences, 2021, 42(3): 89-99 [裴泓霖, 王荦, 谭八梅, 等. 不同季节刺参养殖池塘沉积物菌群结构及其影响因素. 渔业科学进展, 2021, 42(3): 89-99] |
RAUCH M, LYNCH S V. The potential for probiotic manipulation of the gastrointestinal microbiome. Current Opinion in Biotechnology, 2012, 23(2): 192-201 |
SÉVELLEC F, DRIJFHOUT S S. A novel probabilistic forecast system predicting anomalously warm 2018–2022 reinforcing the long-term global warming trend. Nature Communications, 2018, 9(1): 1-12 |
SU Y L, SUN S M, ZHU J, et al. Advances of Bacillus subtilis application in aquaculture. Chinese Fishery Quality and Standards, 2016, 6(6): 32-39 [苏艳莉, 孙盛明, 朱健, 等. 枯草芽孢杆菌在水产养殖中的研究进展. 中国渔业质量与标准, 2016, 6(6): 32-39] |
TAN B M, WANG L, PEI H L, et al. The seasonal structural and functional characteristics of bacterial community in Apostichopus japonicus culture pond water. Progress in Fishery Sciences, 2021, 42(3): 77-88 [谭八梅, 王荦, 裴泓霖, 等. 不同季节刺参养殖池塘水体菌群结构与功能特征研究. 渔业科学进展, 2021, 42(3): 77-88] |
WANG J, TANG H, ZHANG C, et al. Modulation of gut microbiota during probiotic-mediated attenuation of metabolic syndrome in high fat diet-fed mice. ISME Journal, 2015, 9(1): 1-15 |
WANG Y L, LIN Q, SUN Y H, et al. Bacterial flora in sea cucumber culture ponds under different administration methods in autumn. Chinese Journal of Fisheries, 2021, 8(1): 1-7 [王玉龙, 林青, 孙亚慧, 等. 不同管理方式下秋季刺参养殖环境中菌群结构分析. 水产学杂志, 2021, 8(1): 1-7] |
WANG Y G, RONG X J, LIAO M J, et al. Sea cucumber culture and disease control technology. Beijing: China Agriculture Press, 2014: 1-127 [王印庚, 荣小军, 廖梅杰, 等. 刺参健康养殖与病害防控技术丛书. 北京: 中国农业出版社, 2014: 1-127]
|
XIE J, FANG X Z, YU T B. Studies on the correlation among various bacteria and physicochemical factors in the nitrogen cycle in fishpond. Acta Hydrobiologica Sinica, 2002, 26(2): 180-187 [谢骏, 方秀珍, 郁桐炳. 池塘氮循环中各种细菌与理化因子的相关性研究. 水生生物学报, 2002, 26(2): 180-187] |
XU S T, ZHAO B, LI C L, et al. Effects of ammonia nitrogen stress on the survival and activities of non-specific immune enzymes of different-sized sea cucumber (Apostichopus japonicus). Progress in Fishery Sciences, 2017, 38(3): 172-179 [徐松涛, 赵斌, 李成林, 等. 氨氮胁迫对不同规格刺参(Apostichopus japonicus)存活及非特异性免疫酶活性的影响. 渔业科学进展, 2017, 38(3): 172-179] |
YAN F J. Study on microbial community structure and functional diversity from sea cucumber (Apostichopus japonicus Selenka) culture ponds. Doctoral Dissertation of the Ocean University of China, 2013 [闫法军. 刺参(Apostichopus japonicus Selenka)养殖池塘生态系统微生物结构与功能研究. 中国海洋大学博士研究生学位论文, 2013]
|
YAO X M, WANG H Y, XING S L, et al. The effects of temperature and water quality on feeding and growth of Hobthuria scabra. Fisheries Science, 2007, 26(5): 292-295 [姚雪梅, 王红勇, 邢少雷, 等. 不同水温和水质理化因子对糙海参摄食、生长影响研究. 水产科学, 2007, 26(5): 292-295] |
ZHENG Y G, CHEN J, LIU Z Q, et al. Isolation, identification and characterization of Bacillus subtilis ZJB-063, a versatile nitrile-converting bacterium. Applied Microbiology and Biotechnology, 2008, 77(5): 985-993 |



