2. 烟台市芝罘区现代海洋产业发展促进中心 山东 烟台 264006;
3. 烟台市海洋经济研究院 山东 烟台 264003
2. Modern Marine Industry Development Promotion Center Zhifu District Yantai City, Yantai 264006, China;
3. Yantai Marine Economic Research Institute, Yantai 264003, China
盐度作为海水养殖业中重要的环境因子之一,能够直接影响鱼类的生长、存活、繁育和免疫等一系列生理活动(Mylonas et al, 2009; Xu et al, 2020)。近年来,有关盐度对鱼类生长性能影响的研究较多,一系列研究结果证实,适宜盐度可以保障鱼类的健康生长,而盐度过高或过低时,鱼类生长会受到不同程度的抑制(Tsuzuki et al, 2007; 王素久等, 2011; Árnason et al, 2013)。同时,消化能力的高低是决定鱼体生长性能的重要因素,其中,消化酶活性是影响消化水平的关键因子。研究表明,盐度对消化酶活性有着不同程度的影响,主要表现为激活、抑制或无影响(李希国等, 2006; 欧志联, 2018; 温久福等, 2019)。另外,盐度的变化往往会引起鱼体的应激反应,产生较多的活性氧自由基,从而可能会激活鱼体的抗氧化系统,保护机体免受氧化损伤(Saoud et al, 2007)。鱼体的抗氧化系统主要是由酶类和非酶类的抗氧化物质构成,其中,酶类中的抗氧化酶主要包括超氧化物歧化酶(SOD)和过氧化氢酶(CAT)等,这一系列抗氧化酶具有清除机体活性氧自由基的功能,增强机体的免疫能力。针对点篮子鱼(Siganus guttatus) (庄平等, 2011)、日本黄姑鱼(Argyrosomus japonicus) (王跃斌等, 2015)和点带石斑鱼(Epinephelus coioiaes) (余燕等, 2009)的研究均表明,当盐度变化超出鱼类的最适范围时,鱼体的抗氧化酶(SOD和CAT等)活性会发生适应性变化,其活性会显著升高,用于清除体内产生的过多的活性氧自由基,减少鱼体受到氧化损伤。
珍珠龙胆石斑鱼(Epinephelus fuscoguttatus♀×E. lanceolatus♂)生长迅速、肉质鲜美,具有较高的市场价值。但近年来珍珠龙胆石斑鱼疾病频发,导致养殖产业损失严重,其中,水环境因子的突变(如盐度、温度等)是其重要原因之一。因此,在养殖过程中控制好环境因子是确保养殖顺利的关键之一。林国文(2020)采用渐变式方法进行实验,结果显示,珍珠龙胆石斑鱼(121.4 g)的适宜盐度为11.0~40.0。刘龙龙等(2019)在周期为30 d的幼鱼(26.05 g)实验中,在生长性能方面显示,盐度6~12最适合珍珠龙胆石斑鱼幼鱼生长。从而可以看出,先前的相关研究仅从生长性能和存活率等方面,推出鱼体适应的盐度范围,并未对鱼体的最适盐度进行回归分析,去获得鱼体生长所需的精准盐度。鉴于此,本研究从生长性能、机体化学组成、消化能力和抗氧化等非特异免疫能力方面展开,较为系统地研究不同盐度对珍珠龙胆石斑鱼幼鱼生长及生理变化的影响,同时,通过回归分析得出珍珠龙胆石斑鱼幼鱼生长的最适盐度范围。初步揭示不同盐度对珍珠龙胆石斑鱼幼鱼生长及生理生化的影响,以期为珍珠龙胆石斑鱼的养殖提供基础数据和理论依据。
1 材料与方法 1.1 实验用鱼及养殖管理养殖实验在山东省海洋资源与环境研究院东营实验基地室内养殖实验室进行,实验用水以比重为1.020 (25 ℃)的自然海水为基础,盐度调节用海水晶和自来水(比重1.000),配制盐度分别为10、15、20、25、30和35的6种实验海水,分别命名为S1、S2、S3、S4、S5和S6。实验期间,水温保持在25~28 ℃,DO≥6 mg/L,pH 8~9,氨氮和亚硝酸氮含量均 < 0.1 mg/L。
实验用鱼取自该基地当年繁育的同一批珍珠龙胆石斑鱼幼鱼,先将幼鱼放置于养殖桶中,暂养7 d,使其适应养殖环境。实验正式开始前,实验鱼饥饿24 h,选取规格均匀且健康的珍珠龙胆石斑鱼幼鱼[平均体重为(29.99±2.60) g],随机放置于18个养殖桶(200 L)内。每个桶内放置20尾幼鱼,每个实验组设置3个重复。实验用饲料为山东升索饲料科技有限公司海水鱼精制饲料(型号P3,粗蛋白51%,粗脂肪10%),每天08:00和17:00饱食投喂2次,投喂30 min后,排出残饵,并记录残饵量,每天换水100 L,实验桶每天吸污1次,实验周期28 d。
1.2 实验样品采集实验结束,将实验鱼禁食24 h,记录总数和总重。从每个养殖桶中随机取出8尾鱼,其中3尾用于全鱼体成分分析,放置于–20 ℃冰柜保存,另外5尾采用尾部静脉取血法取血,4 ℃静置4 h,离心得到血清,将其放入液氮中速冻。之后,将采完血的实验鱼进行解剖取样,分别分离出肝脏、肠道和肌肉组织,液氮速冻后转移至–80 ℃超低温冰箱中保存,用于后期实验分析。
1.3 测定指标及方法 1.3.1 生长指标存活率(survival rate, SR, %)=100×Nt/N0;
增重率(weight gain rate, WGR, %)=100×(Wt–W0)/W0;
特定生长率(specific growth rate, SGR, %/d)=(lnWt–lnW0)/t×100%
饲料效率(feeding efficiency, FE)=(Wt–W0)/F;
式中,Nt是实验鱼终末数量,N0是实验鱼初始数量,Wt是实验鱼终末体重(g),W0是实验鱼初始体重(g),t是实验鱼养殖时间,F是干饲料重量(g)。
1.3.2 实验样品常规营养指标分析实验样品水分测定采用105 ℃烘干恒重法测定(GB/T6435-2006),粗蛋白采用凯氏定氮法测定(GB/T6432-2006),粗脂肪采用索氏抽提法测定(GB/T6433-2006),粗灰分采用马弗炉550 ℃失重法测定(GB/T 6438-2007)。
1.3.3 生理生化指标分析肝脏超氧化物歧化酶(superoxide dismutase, SOD)、总抗氧化能力(total antioxidant capacity, T-AOC)、过氧化氢酶(catalase, CAT)、丙二醛(malondialdehyde, MDA),肠道中胰蛋白酶(trypsin)、脂肪酶(lipase)和淀粉酶(amylase)均利用南京建成生物工程研究所生产的相应试剂盒测得。血清谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)、碱性磷酸酶(alkaline phosphatase, AKP)、乳酸脱氢酶(lactate dehydrogenase, LDH)活性均采用日立自动生化分析仪(7020型, 日立, 日本)测定。
1.4 数据统计分析用SPSS 19.0分析软件对实验数据进行单因素方差分析(one-way ANOVA),所有实验数据用平均值±标准误(Mean±SE)来表示。同时,用Duncan´s检验方法对实验数据(生长数据、体成分数据、消化酶数据、非特异性免疫数据)进行多重比较,P < 0.05表示具有显著性差异。采用二次回归模型分析,确定珍珠龙胆石斑鱼的最适盐度范围。
2 结果 2.1 不同盐度对珍珠龙胆石斑鱼幼鱼生长性能及饲料利用的影响不同盐度对幼鱼的生长性能会产生不同的影响(P < 0.05)(表 1)。随着盐度的升高,珍珠龙胆石斑鱼幼鱼的WGR和SGR均呈先上升后降低的趋势,S4组达到最大值,与S3组无显著性差异(P > 0.05),显著高于其他实验组(P < 0.05)。各实验组幼鱼的存活率均在90.00%~95.00%之间,无显著性差异(P > 0.05)。在饲料利用方面,幼鱼的饲料效率在S4组达到最大值,显著高于S1、S2、S5和S6组(P < 0.05),与S3组无显著性差异(P > 0.05)。
|
|
表 1 不同盐度对珍珠龙胆石斑鱼幼鱼生长性能及饲料利用的影响 Tab.1 Effects of different salinities on growth performance and feed utilization of juvenile hybrid grouper |
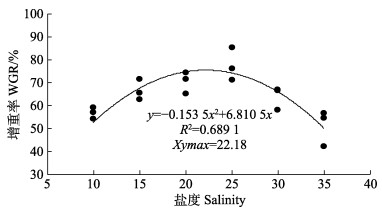
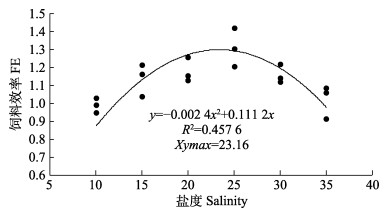
根据二次回归模型分析(图 1、图 2),在本研究条件下,盐度为22.18时,珍珠龙胆石斑鱼幼鱼的增重率最大;盐度为23.16时,饲料效率达到最大值。
|
图 1 珍珠龙胆石斑鱼幼鱼增重率与盐度的二次回归模型 Fig.1 Quadratic regression analysis of salinity and weight gain rate of juvenile hybrid grouper |
|
图 2 珍珠龙胆石斑鱼幼鱼饲料效率与盐度的二次回归模型 Fig.2 Quadratic regression analysis of salinity and feeding efficiency of juvenile hybrid grouper |
不同盐度对珍珠龙胆石斑鱼幼鱼鱼体和肌肉化学组成的影响见表 2。随着盐度的升高,鱼体粗蛋白在S3组达最大值(65.24%),显著高于S5组(63.74%) (P < 0.05),与其他处理组无显著性差异(P > 0.05);鱼体粗脂肪含量呈先升高后降低的趋势,当盐度为25 (S4组)时,鱼体粗脂肪含量最高(10.86%),与S5组(10.17%)无显著性差异(P > 0.05),而显著高于其他实验组(9.22%~9.79%)(P < 0.05)。鱼体的水分(70.41%~ 71.01%)和灰分(19.66%~19.96%)含量在不同实验组间均无显著性差异(P > 0.05)。
|
|
表 2 不同盐度对珍珠龙胆石斑鱼幼鱼鱼体化学组成的影响(%干重) Tab.2 Effects of different salinities on body chemical composition of juvenile hybrid grouper (% dry weight) |
随盐度的变化,肌肉粗脂肪含量与全鱼粗脂肪含量呈现相同的变化趋势,S4组肌肉粗脂肪含量达最大值(2.95%),显著高于S1、S2、S5和S6组(P < 0.05),与S3组无显著性差异(P > 0.05)。另外,结果显示,肌肉中粗蛋白、水分和灰分含量在各处理组间无显著性差异(P > 0.05)。
2.3 不同盐度对珍珠龙胆石斑鱼幼鱼肠道消化酶活性的影响各实验组幼鱼肠道淀粉酶活性并未随着盐度的改变而发生显著变化(P > 0.05)。随盐度的升高,肠道脂肪酶活性在S3和S4组处于较高水平,显著高于其他4组(P < 0.05),但2组间无显著性差异(P > 0.05)。肠道胰蛋白酶活性与脂肪酶活性呈现相似的变化趋势,在S3组活性最高,显著高于S1组(P < 0.05)(表 3)。
|
|
表 3 不同盐度对珍珠龙胆石斑鱼幼鱼肠道消化酶活性的影响 Tab.3 Effects of different salinities on digestive enzyme activities in intestinal tract of juvenile hybrid grouper |
盐度变化会对珍珠龙胆石斑鱼幼鱼肝脏的抗氧化能力产生较大影响(表 4)。随着盐度的升高,肝脏的SOD、CAT活性和T-AOC均呈先下降后升高的趋势,在S1和S6组表现出较高活性,显著高于其他4个实验组(P < 0.05),而S1和S6组之间无显著性差异(P > 0.05)。同时,值得注意的是,S3和S4组的SOD、CAT活性和T-AOC均处于较低水平。另外,肝脏中的MDA含量与SOD活性呈现相似的变化趋势,其中,S1组的MDA含量最高,显著高于其他各实验组(P < 0.05)。
|
|
表 4 不同盐度对珍珠龙胆石斑鱼幼鱼肝脏抗氧化能力的影响 Tab.4 Effects of different salinities on antioxidant capacity in liver of juvenile hybrid grouper |
不同盐度对幼鱼血清中的ALT、AST、AKP和LDH活性产生不同程度的影响(表 5)。ALT和AST活性均在S3组处于最低水平,与S4组无显著性差异(P > 0.05),但显著低于其他4个实验组(P < 0.05)。S6组的ALT活性显著低于S1组(P < 0.05),而AST活性与S1组无显著性差异(P > 0.05)。AKP和LDH活性在S3和S4组也处于较低水平,均显著低于S1、S2、S5和S6组(P < 0.05),而S6组的AKP和LDH活性与S1组均无显著性差异(P > 0.05)。
|
|
表 5 不同盐度对珍珠龙胆石斑鱼幼鱼血清部分生化指标的影响 Tab.5 Effects of different salinities on activity of ALT, AST, AKP and LDH in serum of juvenile hybrid grouper/(U/L) |
水体盐度是影响鱼类生存的重要环境因子,当外界水环境盐度发生改变,鱼类的存活、生长、繁殖、消化吸收和免疫等生理活动均会受到影响(Imsland et al, 2008)。一系列研究表明,不同鱼类对盐度的适应范围不同,盐度条件为8.0时,星斑川鲽(Platichthys stellatus)幼鱼获得最佳的特定生长率和增重率(冯新等, 2008);斜带石斑鱼(Epinephelus coioides)的生长适宜盐度范围为20~30,最适盐度为25 (成永洲, 2015);大黄鱼(Pseudosciaena crocea)在盐度为13.6~14.1时,获得较高的生长速率和较低的饲料系数(陈佳等, 2013);云纹石斑鱼(Epinehelus moara)幼鱼的最适生长盐度范围为14~19 (刘银华等, 2014)。本研究也表明,当盐度范围为20~25时,珍珠龙胆石斑鱼幼鱼获得较佳的WGR和SGR,以SGR为评定指标,经二次回归模型拟合表明,最适盐度为22.18。当盐度过高(30)或过低(10)时,幼鱼的生长均受到较大影响,与Mookkan等(2014)在金钱鱼(Scatophagus argus)幼鱼和王素久等(2011)在斜带石斑鱼幼鱼等的研究结果相一致。这主要是因为当水环境盐度发生较大变化时,为维持机体内环境的稳定,鱼体需要消耗大量的能量进行渗透压调节,进而用于生长的能量将会减少。而鱼类处于适宜盐度条件时,用于维持内环境稳态的能量消耗较低,更多的能量则用于生长(Duston, 1994)。这进一步说明,在适宜盐度条件下,鱼体的生长性能会达到最佳状态。然而,本研究结果与林国文(2020)和刘龙龙等(2019)在珍珠龙胆石斑鱼有关适宜盐度的研究结果不一致,可能与实验鱼的苗种来源、规格、实验周期和养殖环境等因素有关。
本研究中,珍珠龙胆石斑鱼幼鱼的存活率维持在90.00%~95.00%之间,各处理组间并无显著性差异(P > 0.05),说明,其在10~35的盐度范围内均可存活,可能主要是因为石斑鱼属于广盐性鱼类,对盐度具有较强的适应性。本研究结果与在其他广盐性鱼类,如花鲈(Lateolabrax maculatus) (王勇等, 2015)、金钱鱼(孙雪娜, 2021)和斜带石斑鱼(张海发等, 2006)的研究结果一致。
3.2 不同盐度对珍珠龙胆石斑鱼幼鱼鱼体和肌肉化学组成的影响Árnason等(2013)研究表明,鱼体和肌肉的化学组成受多重因素的影响,比如养殖品种、规格、营养、养殖模式及养殖环境等,其中盐度也是影响其组成的重要环境因子。成永洲(2015)在斜带石斑鱼的研究中表明,不同盐度对幼鱼肌肉中粗脂肪含量影响显著,且生长最佳组(盐度为25)粗脂肪含量最高,而对粗蛋白、灰分和水分含量无影响。在褐牙鲆(Paralichthys olivaceus)的实验中也发现,不同盐度(12~40)对褐牙鲆鱼体粗脂肪含量有一定的影响,而对粗蛋白和水分并无显著影响(P < 0.05)(张国政等, 2008)。
本研究表明,盐度对鱼体和肌肉化学组成的影响主要是粗脂肪含量,且在生长较佳的S3(盐度20)和S4组(盐度25)鱼体和肌肉的粗脂肪含量显著高于S1 (盐度10)和S6组(盐度35),与先前的研究结果相一致。推测其主要是因为珍珠龙胆石斑鱼在盐度不适宜的条件下,需要消耗大量的能量来维持渗透压平衡,保持内环境稳态,而这一能量的来源主要靠消耗脂肪提供,而饲料中的蛋白质和糖类等主要用于生长和发育(李晓勤等, 2008),具体代谢机理还有待进一步研究。而对条石鲷(Oplegnathus fasciatus)(柳敏海等, 2012)和星斑川鲽(冯新等, 2008; 尤宏争等, 2009)的研究却表明,不同盐度对实验鱼肌肉的常规化学指标(水分、粗蛋白和粗脂肪)均无显著性影响,与本研究结果不同,可能与实验对象的种类、规格以及对盐度耐受性不同等因素有关。
3.3 不同盐度对珍珠龙胆石斑鱼幼鱼肠道消化酶的影响鱼类的消化酶可以将摄入的营养物质进行消化,保障机体的正常机能,其活性的高低直接反映了机体的消化能力。盐度的变化不仅会影响鱼体渗透压的调节,还能激活或抑制机体消化酶的活性,从而影响机体对营养物质的吸收转化(王云峰等, 2002)。研究表明,黄鳍鲷(Sparus latus)幼鱼的蛋白酶、淀粉酶和脂肪酶活性在盐度20~30时显著高于盐度5~15 (李希国等, 2006);康自强(2014)研究设置了0、5、10、15和20 5个盐度梯度,结果显示,星洲红鱼(Oreochromis mossambicus♀×Oreochromis niloticus♂)肠道中蛋白酶、脂肪酶和淀粉酶活性差异明显(P < 0.05);罗鸣钟等(2015)研究表明,盐度升高能够抑制花鳗鲡(Anguilla marmorata)胃、肠道和肝脏中的淀粉酶和脂肪酶的活性,却对太平洋双色鳗鲡(A. bicolor pacifica)蛋白酶的活性有一定激活作用。本研究也表明,当盐度为20和25时,珍珠龙胆石斑鱼幼鱼肠道的脂肪酶和胰蛋白酶活性显著高于盐度为10和35时的活性。这一系列研究结果表明,盐度对不同鱼类的消化能力有一定影响,适宜盐度是保障鱼体较好发挥消化功能的重要因子。另外,也有研究表明,盐度变化对消化酶活性无显著影响,这也可能是不同鱼类对盐度的适应能力不同所造成的(Moutou et al, 2004)。
3.4 不同盐度对珍珠龙胆石斑鱼幼鱼非特异性免疫的影响由于鱼类的特异性免疫系统不发达,当受到外界环境干扰时,主要依靠非特异性免疫系统发挥作用,相关调节因子主要包括:抗氧化酶、免疫因子、补体、溶菌酶和碱(酸)性磷酸酶等。其中,SOD、T-AOC和CAT是反映机体抗氧化系统功能综合水平的主要指标,可以有效清除氧化胁迫过程中产生的活性氧自由基,以保护机体组织免受损伤(张海恩等, 2020)。另外,MDA作为脂肪氧化的终产物之一,是反映机体细胞受自由基攻击严重程度的主要指标。
本研究结果显示,在盐度为10和35时,幼鱼肝脏中的SOD、CAT活性和T-AOC显著高于其他各组,同时,MDA含量也处于较高水平,说明,不同盐度会对珍珠龙胆石斑鱼幼鱼的抗氧化系统产生明显影响,盐度过高或过低都会给肝脏带来较大的氧化应激压力。另外,对云纹石斑鱼(廖雅丽等, 2016)、鲈鱼(Lateolabrax japonicus) (温久福等, 2019)和金钱鱼(刘永士等, 2020)幼鱼的研究也均表明,当盐度高于或是低于鱼体的最适范围时,鱼体体内的抗氧化酶(如SOD和CAT等)活性会明显提高。可能是因为,当盐度过低或过高时,鱼体需要消耗能量来维持渗透压平衡,加快了机体的新陈代谢,体内的活性氧自由基增加,在一定程度上激活了的抗氧化系统,从而提高鱼体的抗氧化能力以抵御盐度胁迫,减轻机体受到的氧化损伤(Saoud et al, 2007; 张宇婷等, 2021)。也有研究表明,在低盐或高盐胁迫一段时间后,有些鱼类的部分抗氧化酶类指标可以恢复正常,与最适盐度组无显著性差异(朱友芳等, 2013; 王跃斌等, 2015),这可能与鱼类的品种、规格、养殖周期和盐度范围等因素有关。
ALT和AST是氨基酸代谢过程中2个重要的转氨酶,主要存在于肝脏中。正常情况下,血清中的转氨酶活性较低,只有当肝脏受到损伤后,才会释放大量的转氨酶进入血液中。因此,血清中ALT和AST活性的高低在一定程度上可以判断肝脏的损伤程度(Samsonova et al, 2003)。本研究结果显示,在盐度为20和25时,血清中的ALT和AST活性处于较低水平,而盐度为10和35时,二者的活性明显升高。而这也说明,盐度不适会对幼鱼的肝脏健康产生一定的影响,机体健康受到损伤,不利于幼鱼生长发育,与生长部分的结果相呼应。
4 结论综上所述,在本研究条件下,适宜水平(20~25)的盐度能使珍珠龙胆石斑鱼幼鱼获得较佳的生长性能,同时具有较强的消化能力、抗氧化及非特异性免疫能力,保障鱼体的健康。与此同时,以WGR与FE作为评价指标,经二次回归模型分析得出,珍珠龙胆石斑鱼幼鱼生长所需的最适盐度范围为22.18~23.16。
ÁRNASON T, MAGNADÓTTIR B, BJÖRNSSON B, et al. Effects of salinity and temperature on growth, plasma ions, cortisol and immune parameters of juvenile Atlantic cod (Gadus morhua). Aquaculture, 2015, 380/381/382/383: 70–79-70–79 [成永洲. 海水盐度对斜带石斑鱼幼鱼生长及生理生化的影响. 南京农业大学硕士研究生学位论文, 2015, 380/381/382/383: 17-20] |
CHENG Y Z. Effect of salinity on growth and physiolgy, biochemical of juvenile Epinephelus coiodies reared in the seawater. Master´s Thesis of Nanjing Agricultural University, 2015, 17-20 [成永洲. 海水盐度对斜带石斑鱼幼鱼生长及生理生化的影响. 南京农业大学硕士研究生学位论文, 2015, 17-20] |
CHEN J, YUAN C G, RUAN C X. Combined effect of temperature and salinity on the growth of Pseudosciaena crocea. Journal of Guangzhou University (Natural Science Edition), 2013, 12(5): 35-39 [陈佳, 袁重桂, 阮成旭. 温度和盐度对大黄鱼生长性能的联合效应. 广州大学学报(自然科学版), 2013, 12(5): 35-39] |
DUSTON I. Effect of salinity on survival and growth of Atlantic salmon (Salmo salar) parr and smolts. Aquaculture, 1994, 121(1/2/3): 115-124 |
FENG X, LIU J L, DONG Y B, et al. Effect of different salinity on food intake and growth for Platichthys stellatus juveniles. Feed Industry, 2008, 29(24): 22-25 [冯新, 刘建立, 董玉波, 等. 不同盐度对星斑川鲽(Platichthys stellatus)幼鱼摄食生长的影响. 饲料工业, 2008, 29(24): 22-25 DOI:10.3969/j.issn.1001-991X.2008.24.007] |
IMSLAND A K, GÚSTAVSSON A, GUNNARSSON S, et al. Effects of reduced salinities on growth, feed conversion efficiency and blood physiology of juvenile Atlantic halibut (Hippoglossus hippoglossus L.). Aquaculture, 2008, 274(2/3/4): 254-259 |
KANG Z Q. Study on the influences of salinity on growth, digestive enzyme and immune factor activities and muscle quality of red tilapia. Master´s Thesis of Jimei University, 2014, 22-23 [康自强. 盐度胁迫对星洲红鱼生长、消化酶和免疫因子活性及肌肉品质的影响. 集美大学硕士研究生学位论文, 2014, 22-23] |
LI X G, LI J E, QU Y J. Effects of salinity on digestive enzyme activity and diurnal variation of digestive enzyme activity of young Yellowfin black porgy Sparus latus. Marine Fisheries Research, 2006, 27(1): 40-45 [李希国, 李加儿, 区又君. 盐度对黄鳍鲷幼鱼消化酶活性的影响及消化酶活性的昼夜变化. 海洋水产研究, 2006, 27(1): 40-45] |
LI X Q, LIU X M, LENG X J, et al. Effect of salinity on growth and flesh quality of snakehead Channa argus. Oceanologia et Limnologia Sinica, 2008, 39(5): 505-510 [李晓勤, 刘贤敏, 冷向军, 等. 盐度对乌鳢(Channa argus)生长和肌肉品质的影响. 海洋与湖沼, 2008, 39(5): 505-510 DOI:10.3321/j.issn:0029-814X.2008.05.012] |
LIAO Y L, ZHANG C J, PENG S M, et al. Effects of salinity on the activities of liver antioxidant enzymes and plasma lysozyme of Epinephelus moara. Journal of Shanghai Ocean University, 2016, 25(2): 169-176 [廖雅丽, 张晨捷, 彭士明, 等. 盐度对云纹石斑鱼抗氧化酶及溶菌酶活性的影响. 上海海洋大学学报, 2016, 25(2): 169-176] |
LIN G W. Tolerance study on the water temperature, salinity and dissolved oxygen changes of pearl gentian grouper (Epinephelus fuscoguttatus♀×E. lanceolatus♂). Journal of Fisheries Research, 2020, 42(5): 481-485 [林国文. 珍珠龙胆石斑鱼对水温、盐度和低溶解氧耐受能力的初步研究. 渔业研究, 2020, 42(5): 481-485] |
LIU M H, PENG Z L, ZHANG F P, et al. Effects of salinity on feeding, growth and muscular biochemical composition in striped knifejaw Oplegnathus fasciatus. Journal of Dalian Ocean University, 2012, 27(5): 392-397 [柳敏海, 彭志兰, 张凤萍, 等. 盐度对条石鲷摄食、生长和肌肉生化组成的影响. 大连海洋大学学报, 2012, 27(5): 392-397] |
LIU L L, LUO M, CHEN F X, et al. Effects of salinity on growth, and gill and kidney histological structures of juvenile pearl gentian grouper. Journal of Dalian Ocean University, 2019, 34(4): 505-510 [刘龙龙, 罗明, 陈傅晓, 等. 盐度对珍珠龙胆石斑鱼幼鱼生长及鳃肾组织学结构的影响. 大连海洋大学学报, 2019, 34(4): 505-510] |
LIU Y H, ZHONG Y P, ZENG Q M, et al. Effects of temperature and salinity on the growth and survivability of young Epinephelus moara. Journal of Jimei University (Natural Science), 2014, 19(4): 241-246 [刘银华, 钟幼平, 曾庆民, 等. 温度和盐度对云纹石斑鱼早期幼鱼生长和存活的影响. 集美大学学报(自然科学版), 2014, 19(4): 241-246] |
LIU Y S, XU J B, SHI Y H, et al. Effects of salinity on digestive enzymes and antioxidant indices of juvenile Scatophagus argus. Fisheries Science and Technology Information, 2020, 47(4): 181-185 [刘永士, 徐嘉波, 施永海, 等. 盐度对金钱鱼幼鱼消化酶和抗氧化酶活性的影响. 水产科技情报, 2020, 47(4): 181-185] |
LUO M Z, GUAN R Z, JIN H. Effects of the salinity on the growth performance and digestive enzyme activities of Anguilla marmorata elver and A. bicolor Pacifica elver. Acta Hydrobiologica Sinica, 2015, 39(4): 653-660 [罗鸣钟, 关瑞章, 靳恒. 盐度对花鳗鲡和太平洋双色鳗鲡幼鳗生长性能及消化酶活力的影响. 水生生物学报, 2015, 39(4): 653-660] |
MOOKKAN M, MUNIYANDI K, RENGASAMY T A, et al. Influence of salinity on survival and growth of early juveniles of spotted scat Scatophagus argus (Linnaeus, 1766). Indian Journal of Innovations and Developments, 2014, 3(2): 23-29 |
MOUTOU K A, PANAGIOTAKI P, MAMURIS Z. Effects of salinity on digestive protease activity in the euryhaline sparid Sparus aurata L.: A preliminary study. Aquaculture Research, 2004, 35: 912-914 |
MYLONAS C C, PAVLIDIS M, PAPANDROULAKIS N, et al. Growth performance and osmoregulation in the shi drum (Umbrina cirrosa) adapted to different environmental salinities. Aquaculture, 2009, 287(1/2): 203-210 |
OU Z L. Study on digestive enzymes of fish and its application in aquaculture. Jiangxi Fishery Science and Technology, 2018, 25(3): 27-28 [欧志联. 鱼类消化酶研究及其在水产养殖中的应用. 江西水产科技, 2018, 25(3): 27-28] |
SAMSONOVA M V, MIN´KOVA N O, LAPTEVA T I, et al. Aspartate and alanine aminotransferases in early development of the keta. Russian Journal of Developmental Biology, 2003, 34(1): 14-18 |
SAOUD I P, KREYDIYYEH S, CHALFOUN A, et al. Influence of salinity on survival, growth, plasma osmolality and gill Na+-K+-ATPase activity in the rabbitfish Siganus rivulatus. Journal of Experimental Marine Biology and Ecology, 2007, 348(1/2): 183-190 |
SUN X N. Effects of salinity on growth and antioxidant system of juvenile Scatophagus argus. Master´s Thesis of Shanghai Ocean University, 2021, 7-9 [孙雪娜. 盐度对金钱鱼幼鱼生长和抗氧化系统的影响研究. 上海海洋大学硕士研究生学位论文, 2021, 7-9] |
TSUZUKI M Y, SUGAI J K, MACIEL J C, et al. Survival, growth and digestive enzyme activity of juveniles of the fat snook (Centropomus parallelus) reared at different salinities. Aquaculture, 2007, 271(1/2/3/4): 319-325 |
WANG S J, ZHANG H F, ZHAO J, et al. Effects of different salinities on growth and physiology of orange-spotted grouper, Epinephelus coioides. Journal of Guangdong Ocean University, 2011, 31(6): 39-44 [王素久, 张海发, 赵俊, 等. 不同盐度对斜带石斑鱼幼鱼生长和生理的影响. 广东海洋大学学报, 2011, 31(6): 39-44] |
WANG Y, WU B. Technology of large-scale intensive freshwater farming for Lateolabrax japonicus. Fujian Agriculture, 2015(3): 87 [王勇, 吴宾. 花鲈淡水大规模集约化养殖技术. 福建农业, 2015(3): 87] |
WANG Y B, HU Z H, ZHU Y H, et al. Effects of salinity on growth and non-specific immunity of Nibea japonica. Journal of Zhejiang Ocean University (Natural Science), 2015, 34(1): 26-31 [王跃斌, 胡则辉, 朱云海, 等. 盐度对日本黄姑鱼生长及非特异性免疫的影响. 浙江海洋学院学报(自然科学版), 2015, 34(1): 26-31] |
WANG Y F, ZHU X H. A review on impact of salinity on patterns of fish ecophysiology. Studia Marina Sinica, 2002(1): 151-158 [王云峰, 朱鑫华. 盐度对鱼类生态生理学特征的影响. 海洋科学集刊, 2002(1): 151-158] |
WEN J F, LAN J N, ZHOU H, et al. Effects of salinity on digestive enzymes and antioxidant system of juvenile Lateolabrax maculatus. Chinese Journal of Zoology, 2019, 54(5): 719-726 [温久福, 蓝军南, 周慧, 等. 盐度对花鲈幼鱼消化酶和抗氧化系统的影响. 动物学杂志, 2019, 54(5): 719-726] |
XU J B, SHUI C, SHI Y H, et al. Effect of salinity on survival, growth, body composition, oxygen consumption and ammonia excretion of juvenile spotted scat, Scatophagus argus. North American Journal of Aquaculture, 2020, 82(1): 54-62 |
YOU H Z, YANG Z Q, GE S S, et al. Effect of different salinity on biochemical composition and energy budget for Platichthys stellatus juveniles. Hebei Fisheries, 2009(5): 16-19 [尤宏争, 杨增强, 葛珊珊, 等. 盐度对星斑川鲽幼鱼肌肉生化组成及能量收支的影响. 河北渔业, 2009(5): 16-19] |
YU Y, XU W N, LIU Z P, et al. Effect of low salinity stress on activities of digestive and anti-stress enzymes, and survival rate of juvenile Epinephelus malabaricus. Progress in Fishery Sciences, 2009, 30(4): 21-26 [余燕, 徐维娜, 刘兆普, 等. 低盐度胁迫对点带石斑鱼幼鱼消化酶、抗应激酶和存活率的影响. 渔业科学进展, 2009, 30(4): 21-26] |
ZHANG G Z, HUANG G Q, TIAN S J, et al. Effect of salinity stress and following recovery on the growth, energy allocation and composition of juvenile Paralichthys olivaceus. Journal of Fisheries of China, 2008, 32(3): 402-410 [张国政, 黄国强, 田思娟, 等. 盐度胁迫及恢复对褐牙鲆幼鱼生长、能量分配和身体成分的影响. 水产学报, 2008, 32(3): 402-410] |
ZHANG H E, HE Y Y, LI J, et al. Effects of stocking density on growth, water quality, and antioxidant system of juvenile Fenneropenaeus chinensis. Progress in Fishery Sciences, 2020, 41(2): 140-149 [张海恩, 何玉英, 李健, 等. 密度胁迫对中国对虾幼虾生长、抗氧化系统功能及水质指标的影响. 渔业科学进展, 2020, 41(2): 140-149] |
ZHANG H F, LIU X C, WANG Y X, et al. Effects of temperature, salinity and pH on hatch and larval activity of Epinephelus coioides. Journal of Tropical Oceanography, 2006, 25(2): 31-36 [张海发, 刘晓春, 王云新, 等. 温度、盐度及pH对斜带石斑鱼受精卵孵化和仔鱼活力的影响. 热带海洋学报, 2006, 25(2): 31-36] |
ZHANG Y T, YANG J, GENG L W, et al. Effects of salinity stress on antioxidant enzymes and serum cortisol in Luciobarbus capito. Progress in Fishery Sciences, 2021, 42(1): 56-62 [张宇婷, 杨建, 耿龙武, 等. 盐度胁迫对大鳞鲃抗氧化酶和血清皮质醇的影响. 渔业科学进展, 2021, 42(1): 56-62] |
ZHU Y F, XIAO Y Z, LI W H, et al. Effects of low salinity stress on survival rate, gill APTase and liver antioxidant enzymes in the young yellowfin porgy Acanthopagrus latus. Journal of Xiamen University (Natural Science), 2013, 52(3): 414-420 [朱友芳, 肖懿哲, 李文辉, 等. 低盐胁迫对黄鳍棘鲷幼鱼存活率、鳃ATP酶和肝脏抗氧化酶的影响. 厦门大学学报(自然科学版), 2013, 52(3): 414-420] |
ZHUANG P, WANG Y, ZHANG L Z, et al. The effects of ambient salinity decrement on survival and the activity of antioxidant enzymes in livers of Siganus guttatus. Journal of Fudan University (Natural Science), 2011, 50(3): 366-372 [庄平, 王妤, 章龙珍, 等. 盐度骤降对点篮子鱼存活率及肝脏抗氧化酶活性的影响. 复旦学报(自然科学版), 2011, 50(3): 366-372] |



