2. 上海市水产动物良种创制与绿色养殖协同创新中心 上海 201306;
3. 南方海洋科学与工程广东省实验室 广东 广州 511458
2. Shanghai Collaborative Innovation Center for Cultivating Elite Breeds and Green-Culture of Aquatic Animals, Shanghai 201306, China;
3. Southern Marine Science and Engineering Guangdong Laboratory, Guangzhou 511458, China
在海洋环境中,细菌主要以生物被膜形式存在,生物被膜形成过程分为5个阶段:可逆附着、不可逆黏附、早期发展、成熟期和分散期(Costerton et al, 1987; Rumbaugh et al, 2020)。可逆附着是指细菌通过鞭毛等运动器官附着在载体表面,这个过程是可逆的;不可逆黏附是指分泌一些胞外多聚物,增强细菌与载体的黏附;早期发展是指细菌不断繁殖形成菌落,胞外聚合物含量也不断增加;成熟期是指形成具有三维结构的成熟生物被膜;分散期是指细菌开始脱落(Renner et al, 2011)。生物被膜的构成主要由细菌和胞外基质组成。胞外基质主要包括多糖、蛋白质、脂质、胞外DNA和胞外囊泡,可以维持生物被膜稳定性,可使生物被膜中的微生物凝集成堆,最终形成一定的附着力,且胞外产物中的大分子增强了其附着力(Flemming et al, 2010)。生物被膜的形成受到细菌运动性的影响,细菌的生长或附着会促进细菌的流动性,而由于饥饿、捕食或寄生而导致的细菌种群大小的减少会减少细菌的趋化作用(Cannon et al, 1991)。
许多细菌具有运动性,而细菌运动的方式有很多。细菌的运动主要受鞭毛和菌毛影响,运动方式主要有游动、涌动、蹭行和滑行(Klausen et al, 2003; Murray et al, 2008)。细菌趋化性是细菌为了增强对环境的适应性而产生的运动行为,运动细菌会选择向有利的化学物质移动或者规避不利的化学物质(Stocker et al, 2012)。例如,大肠杆菌(Escherichia coli)对氨基酸及糖的趋化性研究发现,细胞表面的受体蛋白发挥关键作用(Baker et al, 2006; Alder et al, 1960)。许多研究表明,细菌的运动性降低可以促进细菌生物被膜的形成。空肠弯曲菌(Campylobacter jejuni)中的多配体结合化学受体Cj1564 (Tlp3)同基因突变体通过降低细菌趋化运动性促进生物被膜的形成(Rahman et al, 2014)。茄青枯菌(Ralstonia solanacearum)中aer1/aer2双突变菌株在番茄根部的趋化性明显降低,但其生物被膜厚度明显增强(Yao et al, 2007)。
生物被膜不仅对微生物种群的生存与繁衍及群落自我重建有重要作用,对海洋无脊椎动物的附着变态过程也具有重要意义(杨金龙等, 2012、2021)。研究表明,生物被膜可以促进贻贝、海胆幼虫附着变态(Rahim et al, 2004; Bao et al, 2007),同时能抑制多毛类、藤壶、海鞘幼虫附着(Maki et al, 1988; Holmström et al, 1992; Dobretsov et al, 2004)。在贻贝中,海洋假交替单胞菌(Pseudoalteromonas marina)(Peng et al, 2018)鞭毛蛋白合成基因敲除后,生物被膜形成能力增强,伴随着运动性的丧失,生物被膜上胞外产物的变化抑制了幼虫的附着变态(Liang et al, 2020);脂肪酸合成基因敲除后,生物被膜形成能力增强,伴随着运动性降低,生物被膜上的脂类减少抑制了幼虫的附着变态(Hu et al, 2021)。生物被膜的形成是一个随时变化、不断演替的过程。研究发现,细菌可以促进生物被膜形成的动态演替且对经济贝类的附着产生影响,例如,不同弧菌菌株被膜在动态演替过程中,其细菌密度、膜厚度、细菌聚集以及胞外产物情况的变化均不同程度地影响了贻贝的附着(梁箫等, 2020a)。
厚壳贻贝(Mytilus coruscus)是我国重要的海洋经济贝类,分布于我国黄渤海和东海海岸,其中,舟山嵊泗县是厚壳贻贝的主要产区(周轩等, 2015; 梁箫等, 2019、2020b)。在厚壳贻贝生活史中主要分为浮游和底栖附着2个阶段(Yang et al, 2014a、b)。在稚贝之前主要以浮游生活为主,幼虫经过附着变态成为稚贝,转变为底栖附着生活(杨金龙等, 2015);稚贝在周围生活环境发生变化时会自动切断足丝,寻找新的生态位完成附着,称为“二次附着”(Carl et al, 2011; Yang et al, 2014b)。稚贝二次附着直接影响稚贝中间培育过程中的保苗和附苗环节。此外,在海洋牧场等人工生态系统构建中,附着生物群落和生物量直接影响生物资源养护以及投礁效果(郭彪等, 2020)。因此,探究厚壳贻贝附着的调控机制,对于海水养殖产业及海洋牧场等底栖生境营造技术研发都具有重要意义。
运动性会对生物被膜产生影响(Todhanakasem, 2008; Kobayashi, 2008),而生物被膜可以影响海洋贝类的附着,但海洋假交替单胞菌趋化性相关基因cheW缺失后,运动性是如何变化且如何影响生物被膜的动态演替并影响经济贝类附着尚未有报道。本文选取厚壳贻贝为研究对象,通过基因敲除技术获得海洋假交替单胞菌趋化性相关基因cheW缺失菌株,探究运动性不同的野生型菌株与ΔcheW菌株在不同时间段如何影响生物被膜的形成,以及在运动性的影响下,生物被膜如何影响厚壳贻贝附着,旨在为开展细菌运动性、生物被膜形成和厚壳贻贝互作机制研究奠定基础,以及为该稚贝中间培育和海洋牧场底栖生境营造技术提供支撑。
1 材料与方法 1.1 实验菌株本研究所用菌种为自然微生物被膜通过分离得到的海洋假交替单胞菌,保藏号为MCCC 1K03544,保存于–80℃。通过海洋假交替单胞菌构建了基因敲除菌株ΔcheW。
1.2 实验材料本研究所用的厚壳贻贝稚贝均来自于浙江舟山市嵊泗县(122°77′E; 30°72′N)。
1.2.1 细菌运动性测定在2216E液体培养基中分别培养野生型菌株和ΔcheW菌株至同一OD值,在同一运动性平板上分别垂直滴1 µL菌液,在不同时间(6、12、24、48、72和96 h)分别测量菌圈半径并拍照。
1.2.2 生物被膜的制备参考杨金龙等(2013)的方法,将细菌进行分离、纯化、扩培,3 500 r/min离心收集菌体,加入灭菌海水混匀,0.22 µm滤膜过滤,0.1%吖啶橙染色后进行细菌计数,确定细胞密度。将相应量菌液加入装有无菌载玻片的无菌培养皿(64 mm×19 mm),培养不同时间的生物被膜(6、12、24、48、72和96 h)。
1.2.3 厚壳贻贝稚贝的附着将不同培养时间(6、12、24、48、72和96 h)形成的生物被膜分别放入干净的灭菌培养皿中,加入20 mL灭菌过滤海水(autoclaved filtered sea water, AFSW)。用移液管吸取10只稚贝加入其中,空白对照为放有干净灭菌载玻片的培养皿,并记录稚贝附着率。设置9个平行组。
1.2.4 生物被膜细菌密度计数生物被膜培养中收集不同时间段(6、12、24、48、72和96 h)的生物被膜,按照生物被膜细菌密度计数原则计数,设置3个平行。
1.2.5 胞外产物染色生物被膜采用Peng等(2020)的方法进行染色,染料信息见表 1。实验中每片生物被膜分别滴加50 µL染料,避光染色20 min,使用0.9%生理盐水洗去多余染料,风干后使用徕卡共聚焦显微镜扫描拍摄,像素1024×1024,每层扫描的厚度为0.2 µm。并采Image J软件计算其生物量,并进行数据统计分析。
|
|
表 1 胞外基质荧光染料信息 Tab.1 Dye information of biofilm matrix |
使用共聚焦显微镜(徕卡TCS SP8)与LAS X软件拍摄海洋假交替单胞菌被膜。每片样品随机选取3个分布均匀的视野拍摄,每组设置3个平行。
1.2.7 数据分析实验结果使用软件JMP 10.0.0统计分析和相关性检验。幼虫附着变态率与细菌被膜生物量和胞外基质含量的相关性检验使用多元分析方法,相关系数为r,P < 0.05时差异显著。
2 结果 2.1 不同时间细菌运动性的差异比较由图 1可见,野生型菌株和ΔcheW菌株在6、12、24、48、72和96 h的运动性差异明显。野生型菌株在不同时间段形成的菌圈均大于ΔcheW菌株,同时,2株菌株菌圈的半径随时间不断增加,均在96 h达到最大,野生型半径为32.97 mm,ΔcheW菌株半径为2.62 mm (图 1A)。6 h时,2株菌株无显著差异(P > 0.05);12 h时,2株菌株开始具有差异性,野生型菌株的菌圈大于ΔcheW菌株的菌圈(P < 0.05);24 h开始,2株菌株的菌圈半径差异性增大,野生型菌株的菌圈增长较快,ΔcheW菌株的菌圈增长较慢,野生型菌株的菌圈是ΔcheW菌株的4.9倍;2株菌株菌圈半径均在96 h时达到最高(图 1B)。
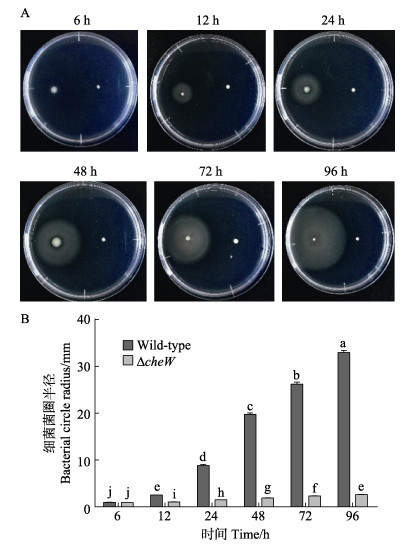
|
图 1 2株菌株在不同时间段的运动性的差异比较 Fig.1 Comparison of swimming motility between two strains at different periods 不同字母表示差异显著(P < 0.05)。下同。 Different letters show significant difference (P < 0.05). The same as below. |
由图 2A可见,野生型菌株和ΔcheW菌株的初始细菌密度均为5×108 cells/mL,野生型菌株和ΔcheW菌株在不同时间段所形成的生物被膜的细菌密度具有显著差异(P < 0.05),ΔcheW菌株在不同时间段形成的生物被膜的细菌密度均大于野生型菌株,且2株菌株形成的生物被膜的细菌密度随时间呈先增加再趋于平缓最后降低的趋势。在野生型菌株和ΔcheW菌株形成生物被膜的动态演替过程中,细菌密度在0~48 h呈现上升的趋势,48 h野生型菌株细菌密度为1.95×107 cells/mL,ΔcheW菌株为2.93×107 cells/mL;48~72 h趋于平缓,无显著差异性,野生型菌株细菌密度在1.90×107~1.95×107 cells/mL之间,ΔcheW菌株在2.93×107~2.97×107 cells/mL之间;72~96 h细菌密度呈下降趋势,野生型菌株为1.61×107 cells/mL,ΔcheW菌株为2.40×107 cells/mL。总体趋势为先上升后下降。

|
图 2 2株菌株在不同时间的生物被膜细菌密度比较(A);2株菌株培养48 h生物被膜在灭菌过滤海水至96 h水体中的细菌密度比较(B) Fig.2 Comparison of biofilm bacterial density of two strains during different periods (A), bacterial density in AFSW after 48 h and 96 h of two bacterial biofilms (B) |
由图 2B可见,2株菌株培养至成熟期48 h放入灭菌过滤海水时,水体细菌密度为0;培养至96 h时,野生型菌株水体中的细菌密度显著大于ΔcheW菌株(P < 0.05)。
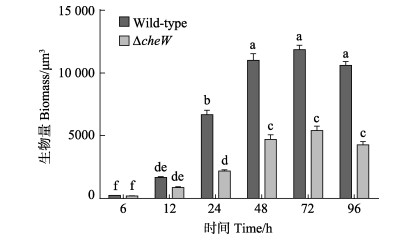
2.3 不同时间段的生物被膜膜厚的差异比较图 3为野生型菌株和ΔcheW菌株在不同时间段形成生物被膜膜厚的共聚焦图像以及生物量的比较。野生型菌株和ΔcheW菌株在6~96 h不同时间段所形成的生物被膜的细菌聚集程度及膜厚具有显著差异(P < 0.05)。ΔcheW菌株在不同时间段形成的生物被膜厚度均大于野生型菌株,野生型菌株形成的生物被膜厚度随时间的变化呈先增加再趋于平缓最后降低的趋势,在0~48 h呈上升趋势,48~72 h趋于平缓,无差异性,72~96 h呈下降趋势,总体趋势为先上升后下降。ΔcheW菌株形成的生物被膜的膜厚随着时间的变化呈先增加后稳定的趋势,在0~48 h呈上升趋势,在48 h达到最大值,48~96 h趋于平缓,无差异性,总体趋势为先上升后趋于平缓。

|
图 3 2株菌株在不同时间阶段形成生物被膜的共聚焦显微镜图像(A)和生物被膜膜厚(B) Fig.3 CLSM images (A) and biomass of biofilms thickness (B) of two strains during different periods |
图 4为野生型菌株和ΔcheW菌株在不同时间段形成生物被膜上胞外产物的生物量的比较。野生型菌株和ΔcheW菌株在6~96 h的不同时间段所形成生物被膜上胞外产物差异显著(P < 0.05),2株菌株形成的生物被膜上的胞外产物总量随时间的变化呈先增加再趋于平缓的趋势,在0~48 h呈上升趋势,48~96 h趋于平缓,没有差异性。2株菌株在6 h和12 h时间段形成生物被膜的胞外产物总量无显著差异(P > 0.05),在48、72、96 h时,野生型菌株形成生物被膜上胞外产物总量均大于ΔcheW菌株在不同时间段形成生物被膜上胞外产物的总量。野生型菌株和ΔcheW菌株形成被膜胞外基质的总量与细菌运行性显著相关(表 2) (P < 0.001)。
|
图 4 2株菌株在不同时间段胞外产物的生物量比较(P < 0.05, n=9) Fig.4 Comparison of biomass of extracellular products formed by two strains during different periods (P < 0.05, n=9) |
|
|
表 2 胞外产物与细菌运动性的相关性分析 Tab.2 Correlation analysis between extracellular products and bacterial motility |
由图 5可见,野生型菌株和ΔcheW菌株在6~96 h不同时间段所形成的细菌被膜对厚壳贻贝稚贝附着影响差异显著(P < 0.05)。整体上,野生型菌株在不同时间段形成的生物被膜对稚贝的附着均大于ΔcheW菌株,且2株菌株形成的细菌被膜对稚贝附着率随时间的增加呈先增加再趋于平缓最后降低的趋势。6 h时,2株菌株具有差异性,野生型菌株稚贝的平均附着率为13.33%,ΔcheW菌株稚贝的平均附着率为8.89%;12 h时,2株菌株具有差异性,野生型菌株稚贝的平均附着率为18.89%,ΔcheW菌株稚贝的平均附着率为12.22%;24 h时,2株菌株具有差异性,野生型菌株稚贝的平均附着率为30.00%,ΔcheW菌株稚贝的平均附着率为17.78%;48 h时,2株菌株具有差异性,野生型菌株贝的平均附着率为38.89%,ΔcheW菌株稚贝的平均附着率为23.33%;72 h时,2株菌株具有差异性,野生型菌株稚贝的平均附着率为37.78%,ΔcheW菌株稚贝的平均附着率为23.33%;96 h时,2株菌株具有差异性,野生型菌株稚贝的平均附着率为35.56%,ΔcheW菌株稚贝的平均附着率为20%。对于野生型菌株和ΔcheW菌株形成生物被膜对稚贝附着的影响效应,在动态演替过程中,0~48 h呈上升趋势,48 h达到最大值,48~72 h趋于平缓,72~96 h呈下降趋势,总体趋势是先上升后下降。2个菌株形成细菌被膜的胞外基质与稚贝附着呈显著相关(表 3) (P < 0.001)。
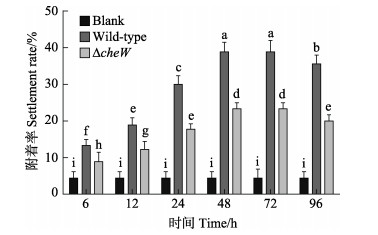
|
图 5 2株菌株在不同时间阶段的生物被膜对厚壳贻贝附着率的差异比较(P < 0.05, n=9) Fig.5 Comparison of biofilms formed by two strains during different periods (P < 0.05, n=9) on settlement of M. coruscus |
|
|
表 3 胞外产物与厚壳贻贝附着率的相关性分析 Tab.3 Correlation analyses between extracellular products and settlement of the mussel M. coruscus |
本研究对野生菌和趋化性基因缺失菌株ΔcheW进行了不同时间点的运动性实验,结果表明,野生型菌株的运动性明显大于ΔcheW菌株。细菌的运动性不仅为细菌的生长提供了生存优势,而且会影响生物被膜的形成。在许多具有趋化性的细菌种类中,细菌趋化能力的减弱伴随着生物被膜形成能力的增强,细菌运动性的减弱可以促进细菌被膜的形成(Rahman et al, 2014; Yao et al, 2007)。细菌被膜形成过程中分泌信号分子来检测周边细菌密度,可以通过调控细菌密度来适应环境变化(Hammer et al, 2003; Miller et al, 2001)。本研究结果表明,ΔcheW菌株运动性降低,导致细菌的游动能力降低、聚集能力增强,细菌密度测定显示,ΔcheW菌株的细菌密度明显高于野生型菌株。结果显示,运动性小的ΔcheW菌株的细菌聚集及累积能力较强,共聚焦拍摄结果及膜厚测定发现,运动性弱的ΔcheW菌株膜厚比运动性强的野生型菌株大。
研究表明,大肠杆菌生物被膜在6 h时形成可逆附着,24 h开始大量附着增长,48 h达到最大值,48~72 h为成熟期,72 h后开始脱落(欧阳凤菊等, 2010)。根据本实验结果推测,2株菌株在生物被膜形成过程中,6 h开始可逆黏附,6~48 h发生不可逆黏附及早期发展,在48 h达到最大值,48~72 h是生物被膜形成过程中的成熟期,72 h后开始分散期,生物被膜上的细菌开始脱落,细菌密度开始降低。本研究选取48 h生物被膜放到灭菌过滤海水至96 h,发现水体中运动性大的野生型菌株的细菌密度明显大于运动性小的ΔcheW菌株,说明运动性小的菌株扩散能力较差,同时解释了成膜后ΔcheW菌株扩散的能力较慢、较差,因此,96 h膜厚与成熟期没有明显差异。本研究中,随着时间的变化,细菌被膜的细胞密度和膜厚等呈先上升再下降的趋势,符合生物被膜发展的5个阶段。
3.2 运动性介导下生物被膜动态演替对厚壳贻贝附着的影响细菌生物被膜主要是由细菌和多糖、蛋白、脂类等胞外基质组成(Flemming et al, 2010)。以往研究发现,海洋弧菌生物被膜在动态演替过程中,其分泌的胞外多糖随着时间增加呈先增多后下降的趋势,细菌被膜诱导厚壳贻贝附着活性也呈现同样趋势(梁箫等, 2020)。然而,细菌运动性与被膜动态演替以及贻贝附着的关系尚未知。研究表明,假交替单胞菌属细菌一旦与细胞双组份信号传导系统wsp中的关键调控基因wspF高度相似的AT00_08765基因被敲除,细菌的运动性丧失,其分泌的胞外多糖纤维素过量产生,同时,Δ08765突变菌形成生物被膜,对厚壳贻贝幼虫附着变态诱导活性显著下调(Zeng et al, 2015)。同时,海洋假交替单胞菌属细菌的鞭毛消失,其运动能力丧失,细菌形成生物被膜能力增强,被膜厚度增加超过1倍,其β-胞外多糖分泌显著减少,鞭毛蛋白明显消失,细菌被膜对幼虫附着诱导能力明显下降(Liang et al, 2020)。
本研究通过共聚焦图像以及生物量分析发现,随着时间的推移,2株菌的胞外产物均发生了变化,表明生物被膜从成熟到分散的过程导致细菌分散及生物被膜上胞外产物减少;同时,厚壳贻贝在2株菌形成生物被膜上的附着也呈先增加后下降的趋势;相关性分析显示,厚壳贻贝附着与生物被膜胞外产物分泌相关,胞外产物分泌与细菌运动能力显著相关。因此,细菌运动性通过影响生物被膜的形成、胞外产物的分泌,从而介导厚壳贻贝附着效应。
综上所述,与运动性强的野生型菌株相比,运动性弱的ΔcheW菌株细菌聚集能力增强,从而形成生物被膜的能力增强,膜厚、细菌密度增加,运动性弱的ΔcheW菌株细菌分散能力减弱,因此,在生物被膜形成过程的分散期,细菌脱落的速度较慢,细菌的运动性影响了生物被膜形成过程,从而影响了厚壳贻贝稚贝附着。本研究为后续开展细菌运动性、生物被膜形成和厚壳贻贝互作机制研究奠定了基础,对开展海洋牧场等人工生态系统底栖生境营造技术研发具有重要的潜在价值。
ALDER B J, WAINWRIGHT T E. Studies in molecular dynamics. II. Behavior of a small number of elastic spheres. Journal of Chemical Physics, 1960, 33(5): 1349-1451 DOI:10.1063/1.1731411 |
BAKER M D, WOLANIN P M, STOCK J B. Signal transduction in bacterial chemotaxis. BioEssays, 2006, 28(1): 9-22 DOI:10.1002/bies.20343 |
BAO W Y, SATUITO C G, YANG J L, et al. Larval settlement and metamorphosis of the mussel Mytilus galloprovincialis in response to biofilms. Marine Biology, 2007, 150: 565-574 |
CANNON J T, MANILAL V B, ALEXANDER M. Relationship between cell surface properties and transport of bacteria through soil. Applied and Environmental Microbiology, 1991, 57(1): 190-193 DOI:10.1128/aem.57.1.190-193.1991 |
CARL C, POOLE AJ, VUCKO M J, et al. Optimising settlement assays of pediveligers and plantigrades of Mytilus galloprovincialis. Biofouling, 2011, 27: 859-868 DOI:10.1080/08927014.2011.605943 |
COSTERTON W, CHENG K J, GEESEY G G, et al. Bacterial biofilms in nature and disease. Annual Review of Microbiology, 1987, 41: 435-46 DOI:10.1146/annurev.mi.41.100187.002251 |
DOBRETSOV S, QIAN P Y. The role of epibotic bacteria from the surface of the soft coral Dendronephthya sp. in the inhibition of larval settlement. Journal of Experimental Marine Biology and Ecology, 2004, 299: 50-55 |
FLEMMING H C, WINGENDER J. The biofilm matrix. Nature Reviews Microbiology, 2010, 8(9): 623-633 DOI:10.1038/nrmicro2415 |
GUO B, CHEN W, GAO Y, et al. Community characteristics of attaching organisms on the artificial reefs built in different years in Dashentang, Tianjin. Progress in Fishery Sciences, 2020, 41(6): 12-18 [郭彪, 陈卫, 高燕, 等. 天津大神堂海域不同时间序列礁体附着生物群落特征变化. 渔业科学进展, 2020, 41(6): 12-18 DOI:10.19663/j.issn2095-9869.20190918002] |
HAMMER B K, BASSLER B L. Quorum sensing controls biofilm formation in Vibrio cholerae. Molecular Microbiology, 2003, 50(1): 101-114 DOI:10.1046/j.1365-2958.2003.03688.x |
HOLMSTRÖM C, RITTSCHOF D, KJELLEBERG S. Inhibition of settlement by larvae of Balanusamphitrite and Ciona intestinalis by a surface-colonizing marine bacterium. Applied and Environmental Microbiology, 1992, 58(7): 2111-2115 DOI:10.1128/aem.58.7.2111-2115.1992 |
HU X M, ZHANG J B, DING W Y, et al. Reduction of mussel metamorphosis by inactivation of the bacterial thioesterase gene via alteration of the fatty acid composition. Biofouling, 2021, 37(8): 911-921 DOI:10.1080/08927014.2021.1981882 |
KLAUSEN M, HEYDORN A, RAGAS P, et al. Biofilm formation by Pseudomonas aeruginosa wild type, flagella and type Ⅳ pili mutants. Molecular Microbiology, 2003, 48(6): 1511-1524 DOI:10.1046/j.1365-2958.2003.03525.x |
KOBAYASHI K. SlrR/SlrA controls the initiation of biofilm formation in Bacillus subtilis. Molecular Microbiology, 2008, 69(6): 1399-1410 DOI:10.1111/j.1365-2958.2008.06369.x |
LIANG X, LIU H Y, YANG L T, et al. Effects of dynamic succession of Vibrio biofilms on settlement of the mussel Mytilus coruscus. Journal of Fisheries of China, 2020a, 44(1): 118-129 [梁箫, 刘红雨, 杨丽婷, 等. 弧菌生物被膜的动态演替对厚壳贻贝附着的影响. 水产学报, 2020a, 44(1): 118-129] |
LIANG X, LIU Y Z, CHEN K, et al. Identification of MyD88-4 in Mytilus coruscus and expression changes in response to Vibrio chagasii challenge. Journal of Fisheries of China, 2019, 43(11): 1910-1921 [梁箫, 刘钰珠, 陈珂, 等. 厚壳贻贝MyD88-4基因的生物学特性及其对沙氏弧菌的免疫应答. 水产学报, 2019, 43(11): 1910-1921] |
LIANG X, YANG L T, PENG L H, et al. Effects of biofilms of deep-sea bacteria at varying temperatures on larval metamorphosis of Mytilus coruscus. Journal of Fisheries of China, 2020b, 44(10): 1728 [梁箫, 杨丽婷, 彭莉华, 等. 不同温度下形成的深海菌膜对厚壳贻贝幼虫变态的影响. 水产学报, 2020b, 44(10): 1728] |
LIANG X, ZHANG X K, PENG L H, et al. The flagellar gene regulates biofilms formation and mussel larval settlement and metamorphosis. International Journal of Molecular Sciences, 2020, 21(3): 710 DOI:10.3390/ijms21030710 |
MAKI J S, RITTSCHOF D, COSTLOW J D, et al. Inhibition of attachment of larval barnacles, Balanus amphitrite, by bacterial surface films. Marine Biology Research, 1988, 97: 199-206 DOI:10.1007/BF00391303 |
MILLER M B, BASSLER B L. Quorum sensing in bacteria. Annual Review of Microbiology, 2001, 55(1): 165-199 DOI:10.1146/annurev.micro.55.1.165 |
MURRAY T S, KAZMIERCZAK B I. Pseudomonas aeruginosa exhibits sliding motility in the absence of type IV pili and flagella. Journal of Bacteriology, 2008, 190(8): 2700-2708 DOI:10.1128/JB.01620-07 |
OUYANG F J, LI Z L, HE M L, et al. The biofilm formation of avian pathogenic Escherichia coli in vitro. Chinese Journal of Preventive Veterinary Medicine, 2010, 32(9): 672-676 [欧阳凤菊, 李兆利, 赫明雷, 等. 禽致病性大肠杆菌生物被膜的形成及其影响因素. 中国预防兽医学报, 2010, 32(9): 672-676] |
PENG L H, LIANG X, CHANG R H, et al. A bacterial polysaccharide biosynthesis-related gene inversely regulates larval settlement and metamorphosis of Mytilus coruscus. Biofouling, 2020, 36(7): 753-765 DOI:10.1080/08927014.2020.1807520 |
PENG L H, LIANG X, GUO X P, et al. Complete genome of Pseudoalteromonas marina ECSMB14103, a mussel settlement-inducing bacterium isolated from the East China Sea. Marine Genomics, 2018, 41: 46-49 DOI:10.1016/j.margen.2018.04.001 |
RAHIM S A K A, LI J Y, KITAMURA H. Larval metamorphosis of the sea urchins, Pseudocentrotus depressus and Anthocidaris crassispina in response to microbial film. Marine Biology, 2004, 144: 71-78 |
RAHMAN H, KING R M, SHEWELL L K, et al. Characterisation of a multi-ligand binding chemoreceptor CcmL (Tlp3) of Campylobacter jejuni. PLoS Pathogens, 2014, 10(1): e1003822 |
RENNER L D, WEIBEL D B. Physicochemical regulation of biofilm formation. Materials Research Society Bulletin, 2011, 36(5): 347-355 |
RUMBAUGH K P, SAUER K. Biofilm dispersion. Nature Reviews Microbiology, 2020, 18(10): 571-586 |
STOCKER R, SEYMOUR J R. Ecology and physics of bacterial chemotaxis in the ocean. Microbiology and Molecular Biology Reviews, 2012, 76(4): 792-812 |
TODHANAKASEM T, YOUNG G M. Loss of flagellum-based motility by Listeria monocytogenes results in formation of hyperbiofilms. Journal of Bacteriology, 2008, 190(17): 6030-6034 |
YANG J L, DUAN Z H, DING W Y, et al. Effects of VB7 and VB12 on biofilm formation and larval metamorphosis of the mussel Mytilus coruscus. Progress in Fishery Sciences, 2021, 42(5): 113-123 [杨金龙, 段志鸿, 丁文扬, 等. 维生素B7和B12对细菌生物被膜形成及厚壳贻贝幼虫变态的影响. 渔业科学进展, 2021, 42(5): 113-123] |
YANG J L, GUO X P, CHEN Y R, et al. Effects of bacterial biofilms formed on middle wettability surfaces on settlement of plantigrades of the mussel Mytilus coruscus. Journal of Fisheries of China, 2015, 39(3): 421-428 [杨金龙, 郭行磐, 陈芋如, 等. 中湿度表面的海洋细菌对厚壳贻贝稚贝附着的影响. 水产学报, 2015, 39(3): 421-428] |
YANG J L, LI WS, LIANG X, et al. Effects of adrenoceptor compounds on larval metamorphosis of the mussel Mytilus coruscus. Aquaculture, 2014a, 426/427: 282-287 |
YANG J L, LI X, LIANG X, et al. Effects of natural biofilms on settlement of plantigrades of the mussel Mytilus coruscus. Aquaculture, 2014b, 424/425: 228-233 |
YANG J L, SHEN P J, LIANG X, et al. Larval settlement and metamorphosis of the mussel Mytilus coruscus in response to monospecific bacterial biofilms. Biofouling, 2013, 29(3): 247-259 |
YANG J L, SHEN P J, WANG C, et al. Effects of biofilms on settlement of plantigrades of the mussel Mytilus coruscus. Journal of Fisheries of China, 2013, 37(6): 904-909 [杨金龙, 慎佩晶, 王冲, 等. 微生物膜对厚壳贻贝稚贝附着的影响. 水产学报, 2013, 37(6): 904-909] |
YANG J L, WANG C, GU Z Q, et al. A review on the role of marine biofilms on larval settlement and metamorphosis of marine invertebrates. Marine Sciences, 2012, 36(8): 116-121 [杨金龙, 王冲, 顾忠旗, 等. 微生物膜对海洋无脊椎动物幼体附着变态的影响研究. 海洋科学, 2012, 36(8): 116-121] |
YAO J, ALLEN C. The plant pathogen Ralstonia solanacearum needs aerotaxis for normal biofilm formation and interactions with its tomato host. Journal of Bacteriology, 2007, 189(17): 6415-6424 |
ZENG Z, GUO XP, LI B, et al. Characterization of self-generated variants in Pseudoalteromonas lipolytica biofilm with increased antifouling activities. Applied Microbiology and Biotechnology, 2015, 99: 10127-10139 |
ZHOU X, GUO X P, CHEN Y R, et al. Effects of bacterial biofilms formed on low surface wettability on settlement of plantigrades of the mussel Mytilus coruscus. Journal of Dalian Ocean University, 2015, 30(1): 30-35 [周轩, 郭行磐, 陈芋如, 等. 低湿度表面的海洋附着细菌对厚壳贻贝附着的影响. 大连海洋大学学报, 2015, 30(1): 30-35] |



