2. 中国水产科学研究院黄海水产研究所 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 农业农村部海洋渔业可持续发展 重点实验室 山东 青岛 266071;
3. 中国水产科学研究院东海水产研究所 上海 200093
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences; Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071, China;
3. East China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Shanghai 200093, China
镉(Cd)是一种具有延展性、蓄积性的银白色有光泽的重金属元素,其毒性持久,摄入过量Cd会对生物肝脏、肾脏等器官造成极其严重的危害(杜丽娜等, 2013)。随着工农业的迅速发展,工业排放废水、电镀冶炼、农用化学品、交通、家庭等污染物,未经适当处理或不处理而不加区别地排放到环境中(Sfakianakis et al, 2015),导致水体污染日益严重,河流、湖泊、海洋等区域水环境遭到不同程度地重金属污染。水环境Cd的来源主要有以Cd为原料的杀虫剂、油漆、颜料、杀菌剂和合成橡胶等排放入水(王志芳等, 2019);硫锌矿冶炼、燃烧的副产品进入水体;硫铁矿石、磷矿石制取H2SO4、磷肥排放的废水以及城市用水系统管道及水容器污染(田鹏, 2013)。目前,Cd污染状况越来越受到人们的关注,已经成为全球性威胁。
水体中重金属污染对鱼类繁殖、发育等各种生理过程有重要的影响。尤其是处于早期生活阶段的鱼类,对水环境中重金属含量尤其敏感。Cd2+对水体中有毒物质的降解会产生抑制作用,并且会降低水体溶氧量(白秀娟等, 2013)。重金属Cd主要通过鳃呼吸作用及摄食2种方式进入鱼体内,通过循环系统、消化系统进入鱼体组织器官(刘阳等, 2019),此外,水体与体表的渗透交换作用也可能使少量Cd进入体内(刘长发等, 1999)。当水环境中Cd2+浓度超过鱼类所处生长阶段的安全浓度时,就会对该鱼类产生毒害作用,影响其繁殖及生长发育过程,严重的甚至导致畸形和死亡。杨志艳等(2021)研究发现,在重金属处理组中,胚胎孵化的畸形率显著提高,造成卵黄囊畸形、脊柱弯曲、色素沉着异常等畸形状态。任洪涛等(2016)研究发现,Cd2+会在草鱼(Ctenopharyngodon idellus)体内蓄积,积累到一定程度就会对鱼体内氧化还原过程产生干扰,显著降低超氧化物歧化酶(SOD)活性,此外,还会造成肝脏、鳃等组织病理变化,如肝脏组织坏死、鳃上皮细胞增生等。
绿鳍马面鲀(Thamnaconus septentrionalis)其因蛋白质含量高,整体利用率高,成为优良养殖品种(詹秉义等, 1986),而重金属对绿鳍马面鲀毒性作用还未见详细研究。本研究先测定Cd2+对绿鳍马面鲀幼鱼的急性毒性效应,然后,在此基础上测定不同浓度的Cd2+环境中,绿鳍马面鲀幼鱼肝脏抗氧化酶活性变化及肝脏、鳃组织结构变化,探讨Cd2+对绿鳍马面鲀幼鱼的致毒机理,以及鱼体内抗氧化酶防御系统对Cd2+污染胁迫的应对机制。
1 材料与方法 1.1 实验材料与条件实验用绿鳍马面鲀幼鱼取自中国水产科学研究院东海水产研究所赣榆研究中心,同一批孵化的健康个体,幼鱼体长为(6.53±0.51) cm、体重为(3.11±0.52) g,饲养于120 L的水箱。饲养水温为(21.5±1.0) ℃,盐度为29,pH为(7.5±0.1),溶解氧(DO)为(7.5±1.0) mg/L,实验前1 d停止喂食。
试剂:总蛋白(TP)含量、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-PX)、总超氧化物歧化酶(T-SOD)活性、丙二醛(MDA)含量测定试剂盒(购自南京建成科技有限公司)、CdCl2(分析纯)。组织切片机为Leica RM 2016轮转式切片机。
1.2 实验方法 1.2.1 预实验参照相关鱼类研究结果,预实验按照等比间距法预估设计浓度梯度为2、4、8、16 mg/L,每组放入10尾幼鱼,每隔6 h记录1次各桶内幼鱼死亡数,及时取出死鱼以防止污染水质。实验组各浓度设置3个平行,测定幼鱼24 h全存活最高浓度和96 h全致死最低浓度,观察并记录Cd2+胁迫时幼鱼的中毒反应。
1.2.2 高浓度Cd2+毒性实验根据预实验结果选择等对数间距法设定8.19、9.18、10.30、11.56 mg/L共4个Cd2+浓度梯度实验组和1个空白对照组,每组设3个平行,每个平行放入30尾幼鱼,饲养于100 L实验液中。实验期间,不投饵,保持持续充气。观察记录幼鱼在24、48、72和96 h的活动状况和存活个体数,及时清除死亡幼鱼,计算存活率、死亡率、各时间点半致死浓度(LC50)、安全浓度。
1.2.3 低浓度Cd2+毒性试实验根据Cd2+对绿鳍马面鲀幼鱼的急性毒性实验结果,以安全浓度倍数设定实验浓度梯度为1.84、2.76、3.68和4.60 mg/L,每组设3个平行,每个平行放入30尾幼鱼,实验水体为100 L。实验期间,不投饵,保持持续充气。在6、12、24、48、72和96 h时,每个平行取3尾幼鱼进行解剖,取出肝脏组织,放入5 mL塑料离心管中,置于–20 ℃冰箱保存用于酶活性测定,在24、48、72和96 h时,对幼鱼肝脏、鳃分别取样,放入波恩氏液固定保存,用于组织切片观察。
1.3 组织匀浆制备和酶活性测定肝脏组织样品使用4 ℃预冷的生理盐水清洗干净,再用吸水纸吸去表面水分,称取适量样品,按1∶9的比例加入4 ℃的生理盐水,用组织捣碎机10 000~ 15 000 r/min进行匀浆,匀浆液在4 ℃,2 000 r/min离心10 min,取上清液备用。
上清液采用BCA微板法测定蛋白含量,黄嘌呤氧化法测定SOD活性,TBA(2-硫代巴比妥酸)法测定MDA含量,钼酸铵法测定CAT活性,DTNB(5, 5′-二硫代硝基苯甲酸)比色法测定GSH-PX活性,具体操作参照试剂盒说明进行。
1.4 组织切片制备将鳃、肝脏组织使用0.86%生理盐水冲洗后放入波恩氏液中固定,各组织分别采用70%、80%、90%和100%酒精进行梯度脱水,每个梯度脱水40 min,脱水后进行透明浸蜡,石蜡包埋。切片(厚度5 μm)经展片、苏木精–伊红(HE)染色后使用中性树胶封片、晾干和保存。
1.5 数据处理采用SPSS20.0软件检验分析重金属Cd不同时间的急性毒性,计算24、48、72和96 h的LC50,安全浓度(SC)=96 h LC50×0.1。采用单因素方差分析(one-way ANOVA)和Duncan´s多重比较法对SOD、CAT、GSH-PX活性和MDA含量进行分析,分析各浓度处理组与对照组的差异显著性,P < 0.05为差异显著。
2 结果与分析 2.1 高浓度Cd2+毒性实验 2.1.1 绿鳍马面鲀幼鱼的中毒症状8.19 mg/L实验组在0—24 h时,绿鳍马面鲀幼鱼活动状态与对照组相比无明显差异,呈集群式快速游动,反应灵敏;8.19 mg/L组在48—96 h、9.18 mg/L组在24—72 h时,中毒幼鱼反应迟钝,呼吸缓慢,平衡游泳能力受损。10.30和11.56 mg/L组幼鱼一进入水体即躁动不安,无规律快速游动;24—48 h时,鱼体平衡能力失调,呼吸紊乱,部分个体在水中出现间歇性转圈、上下浮动、沿桶壁急速游动等现象;9.18 mg/L组在72—96 h、10.30和11.56 mg/L组在48—72 h时,幼鱼体表颜色明显加深,鳃盖及体表黏液分泌增多,丧失运动能力沉于桶底;10.30 mg/L组在72—96 h时,未死亡个体鳃盖充血,解剖后发现肝脏肿大发白,胆囊肿大。
2.1.2 Cd2+对绿鳍马面鲀幼鱼的急性毒性实验不同浓度Cd2+对绿鳍马面鲀幼鱼毒性情况见表 1。从表 1可以看出,8.19 mg/L组在48 h开始出现死亡,9.18、10.30和11.56 mg/L组在24 h开始出现死亡,11.56 mg/L组在96 h全部死亡。
|
|
表 1 绿鳍马面鲀幼鱼在不同Cd2+浓度及作用时间下的死亡率 Tab.1 Mortality of juvenile T. septentrionalis at different Cd2+ concentration and duration |
Cd2+对绿鳍马面鲀幼鱼毒性的线性回归方程、LC50及安全浓度见表 2。从表 2可以看出,Cd2+对绿鳍马面鲀幼鱼的安全浓度为0.92 mg/L。
|
|
表 2 Cd2+对绿鳍马面鲀幼鱼毒性的线性回归方程、LC50及安全浓度 Tab.2 Linear regression, LC50 and safe concentration of Cd2+ on juvenile T. septentrionalis |
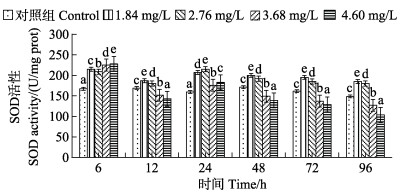
不同浓度Cd2+对肝脏SOD活性的影响见图 1。从图 1可以看出,6 h时,与对照组酶活性167.24 U/mg prot相比,各处理组肝组织SOD活性均有显著上升,分别上升到214.62、208.52、224.85和227.69 U/mg prot;6—24 h内SOD活性呈先下降后上升的趋势;24—96 h,各浓度组SOD活性均呈下降趋势。1.84和2.76 mg/L组SOD活性在96 h内始终高于对照组;3.68和4.60 mg/L组在6— 12 h时,SOD活性低于对照组,在24 h时,SOD活性升高,之后一直处于下降趋势且均低于对照组;4.60 mg/L组SOD活性在96 h降到最低,为103.61 U/mg prot,抑制作用显著。
|
图 1 绿鳍马面鲀幼鱼肝脏SOD活性随Cd2+处理时间的变化 Fig.1 Changes of SOD activity in liver of juvenile T. septentrionalis under different Cd2+treatment time 不同小写字母表示同一时间点不同处理组与对照组差异显著(P < 0.05)。下同。 Different lowercase letters in the figure indicate significant difference between different treatment groups and control group at the same time point (P < 0.05). The same as below. |
不同浓度Cd2+对肝脏MDA含量的影响见图 2。从图 2可以看出,6—12 h时,MDA含量呈先下降后升高的趋势,且6 h时,MAD含量均低于对照组;12 h时,MAD含量有显著升高;24 h各处理组MDA含量有所下降,但仍高于对照组,与对照组(3.73 nmol/mg prot)相比差异显著(P < 0.05)。12—48 h,1.84和2.76 mg/L组MDA含量呈先下降后上升的趋势;24—96 h内,3.68和4.60 mg/L组一直保持增长趋势,显著高于对照组,且在96 h时,MDA含量达到峰值,分别为6.98和8.36 nmol/mg prot。

|
图 2 绿鳍马面鲀幼鱼肝脏MDA含量随Cd2+处理时间的变化 Fig.2 Changes of MDA content in liver of juvenile T. septentrionalis under different Cd2+ treatment time |
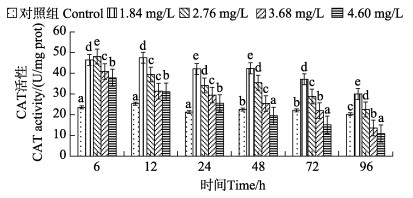
不同浓度Cd2+对肝脏CAT活性影响见图 3。从图 3可以看出,在6 h时,与对照组相比,各处理组CAT活性均有显著上升,2.76 mg/L组CAT活性达到最大值,为48.11 U/mg prot;12 h时,1.84 mg/L组CAT活性达到最大值,为47.54 U/mg prot;12—96 h时,各处理组整体呈下降趋势;24—48 h时,1.8和2.76 mg/L组CAT活性相比差异不显著(P > 0.05)。与对照组相比,3.68和4.60 mg/L组在96 h时,CAT活性达到最低,分别为13.58和10.84 U/mg prot,其中,4.60 mg/L组在48 h时,CAT活性低于对照组。
|
图 3 绿鳍马面鲀幼鱼肝脏CAT活性随Cd2+处理时间的变化 Fig.3 Changes of CAT activity in liver of juvenile T. septentrionalis under different Cd2+treatment time |
不同浓度Cd2+对肝脏GSH-PX活性影响见图 4。从图 4可以看出,各处理组在6—96 h内,GSH-PX活性呈先下降再上升后下降的趋势。1.84 mg/L组GSH-PX活性在6—48 h显著升高,48—96 h时GSH-PX活性降低,但活性水平均高于对照组。与对照组相比,2.76和3.68 mg/L组在0—6 h被轻微抑制,6—24 h时,GSH-PX活性升高,24—96 h时,GSH-PX活性降低,且胁迫时间越长活性越低;4.60 mg/L组中,GSH-PX活性呈先增加后降低的趋势,且在96 h时,GSH-PX活性降到最低,为300.12 U/mg prot,与对照组相比差异显著(P < 0.05)。

|
图 4 绿鳍马面鲀幼鱼肝脏GPX-PX活性随Cd2+处理时间的变化 Fig.4 Changes of GPX-PX activity in liver of juvenile T. septentrionalis under different Cd2+ treatment time |
绿鳍马面鲀幼鱼对照组肝脏细胞完整,排列紧密,分布均匀,细胞核明显(图 5A)。1.84 mg/L组72 h内肝脏组织无明显变化,1.84 mg/L组96 h、2.76 mg/L组24 h时,肝脏细胞损伤情况相似,均出现轻微增大且形状不规则,部分细胞膜边界模糊(图 5B);2.76 mg/L组48— 96 h、3.68和4.60 mg/L组24—48 h时,肝细胞均表现出无序离散,细胞结构多不完整(图 5C);3.68 mg/L组72—96 h、4.60 mg/L组72 h时,肝细胞异常情况明显加重,细胞肥大,出现大面积解体现象,胞浆溢出,细胞空化(图 5D);4.60 mg/L组96 h时,细胞核缩小,胞内物质聚集,出现大块不规则空白(图 5E)。
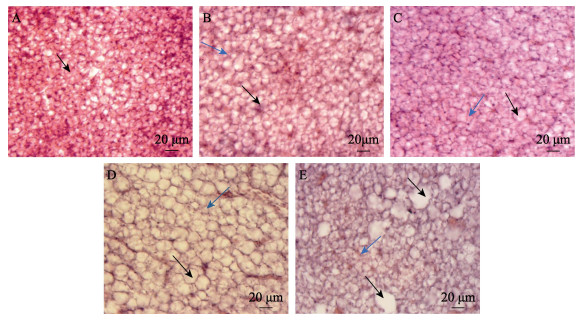
|
图 5 Cd2+各浓度绿鳍马面鲀幼鱼肝脏结构 Fig.5 Liver structure of juvenile T. septentrionalis under different concentrations of Cd2+ A:对照组肝脏结构,黑箭头:细胞核;B:1.84 mg/L Cd2+处理96 h,黑箭头:细胞形状各异且增大,蓝箭头:细胞膜边界模糊;C:2.76 mg/L Cd2+处理48—96 h,黑箭头:肝细胞无序离散,蓝箭头:结构不完整;D:3.68 mg/L Cd2+处理72—96 h,黑箭头:肝细胞肥大,空泡化,蓝箭头:胞浆溢出聚集;E:4.60 mg/L Cd2+处理96 h,黑箭头:由于胞内物质聚集出现的大块空白,蓝箭头:细胞核缩小。 A: Liver structure of control group, the black arrow: Nucleus; B: 1.84 mg/L Cd2+ treatment for 96 h, the black arrow: Different and enlarged cells, the blue arrow: Blurred cell membrane boundary; C: 2.76 mg/L Cd2+ treatment for 48–96 h, the black arrow: Disordered dispersion of liver cells, the blue arrow: Incomplete structure; D: 3.68 mg/L Cd2+ treatment for 72–96 h, the black arrow: Hypertrophy and vacuolation of hepatocytes, the blue arrow: Cytoplasm overflow and aggregation; E: 4.60 mg/L Cd2+ treatment for 96 h, the black arrow: Large blank due to intracellular material aggregation, the blue arrow: Nuclear shrinkage. |
正常的绿鳍马面鲀幼鱼的鳃呈梳状对称排列,鳃丝上皮细胞结构完整,鳃小片平滑舒展且分布均匀,各部位细胞均无异常现象(图 6A)。1.84 mg/L组72 h、2.76 mg/L组24 h内鳃组织结构无显著变化;低浓度组长时间与高浓度组短时间对鳃组织结构损伤情况具有一定相似性,如1.84 mg/L组96 h、2.76 mg/L组48 h、4.60 mg/L组24 h时,鳃小片弯曲,顶端呈棒状,周围分泌出黏液,上皮细胞水肿膨大,出现部分增生,相邻鳃小片间距变小(图 6B);2.76 mg/L组72 h、3.68和4.60 mg/L组24—48 h时,小部分相邻鳃小片之间会出现融合,形成小块上皮细胞板,周围出现大量黏液,鳃小片长度明显缩短(图 6C);2.76 mg/L组96 h、3.68 mg/L组72 h时,绝大部分鳃小片基部融合在一起,鳃小片上皮细胞增生肿胀严重,且周围散布脱落的上皮细胞(图 6D);3.68 mg/L组96 h、4.60 mg/L组72—96 h时,相邻鳃小片相互黏连融合,无游离端,细胞大量坏死脱落(图 6E)。

|
图 6 Cd2+各浓度绿鳍马面鲀幼鱼鳃组织结构 Fig.6 Gill tissue structure of juvenile T. septentrionalis under different concentrations of Cd2+ A:对照组鳃结构,图中区域为鳃丝结构,黑箭头:鳃小片;B:1.84 mg/L Cd2+处理96 h,黑箭头:鳃小片间距,蓝箭头:鳃小片;C:2.76 mg/L Cd2+处理72 h,黑箭头:上皮细胞板;D:2.76 mg/L Cd2+处理96 h,黑箭头:鳃小片上皮细胞;E:3.68 mg/L Cd2+处理96 h。 A: The gill filament structure in control group. The black arrow: Gill filaments; B: 1.84 mg/L Cd2+ treatment for 96 h, the black arrow: Distance between gill segments, the blue arrow: Gill segments; C: 2.76 mg/L Cd2+ treatment for 72 h, the black arrow: Epithelial cell plate; D: 2.76 mg/L Cd2+ treatment for 96 h, the black arrow: Epithelial cells; E: 3.68 mg/L Cd2+ treatment for 96 h. |
绿鳍马面鲀幼鱼Cd2+中毒症状表现为间歇性打转、上下浮动、平衡能力受损,呼吸紊乱, 体表和鳃分泌黏液增多等。这与澳洲龙纹斑(Maccullochella peelii peelii)幼鱼(罗土炎等, 2017)、刀鲚(Coilia nasus)(聂志娟等, 2014)幼鱼、褐牙鲆(Paralichthys olivaceus)(秦华伟等, 2015)的Cd2+中毒症状相似。在同一时间段内,Cd2+浓度越高,绿鳍马面鲀幼鱼死亡率越高;在同一浓度时,时间越长,死亡率越高,说明Cd2+与绿鳍马面鲀幼鱼之间存在明显的剂量及时间效应关系。24 h LC50>48 h LC50>72 h LC50>96 h LC50说明随着胁迫时间增加,绿鳍马面鲀幼鱼对Cd2+敏感性增加,这与褐牙鲆(曹亮, 2010)、草鱼(任洪涛等, 2016)、尼罗罗非鱼(Oreochromis niloticus)(王小娇等, 2016) Cd2+中毒研究结果相一致。Cd2+胁迫下,绿鳍马面鲀幼鱼96 h LC50为9.19 mg/L,同样是海水鱼幼鱼时期,绿鳍马面鲀幼鱼96 h LC50 (9.19 mg/L)低于褐牙鲆幼鱼(17.27 mg/L) 的96 h LC50 (曹亮, 2010),根据鱼类急性中毒实验96 h LC50的4级毒性标准(张志杰等, 1991),Cd2+对于绿鳍马面鲀幼鱼而言属于中度毒性物质,对于褐牙鲆幼鱼而言属于低度毒性物质,说明绿鳍马面鲀幼鱼对Cd2+的耐受力相对较低,其敏感性更强。本研究结果表明,Cd2+浓度为0.92 mg/L是绿鳍马面鲀幼鱼的安全浓度,在此浓度内幼鱼可以正常生长。
3.2 Cd2+对绿鳍马面鲀幼鱼肝脏抗氧化酶的影响SOD、CAT和GSH-PX等组成的抗氧化酶系统在正常情况下,可以有效地清除生物体各项代谢活动产生的活性氧(姚志峰等, 2010)。在重金属浓度超过安全浓度情况下,机体会产生超出抗氧化酶系统清理能力的活性氧,从而对机体产生毒害作用(赖廷和等, 2011)。
绿鳍马面鲀幼鱼在Cd2+胁迫6 h内,各浓度梯度幼鱼肝脏SOD活性均显著上升,且4.60 mg/L组在此时达到峰值,说明鱼体在此时产生“毒物兴奋效应”(Stebbing, 1982)并做出应激反应。24—96 h内,各实验组SOD活性呈下降趋势,1.84和2.76 mg/L组SOD活性始终高于对照组,3.68和4.60 mg/L组在48 h开始低于对照组,说明此时Cd2+导致机体产生过量自由基,鱼体内抗氧化系统受损。Hg2+胁迫下红鳍笛鲷(Lutjanus erythopterus)(王学峰等, 2010)肝脏SOD活性也出现类似变化,短时间内SOD活性显著升高,随着胁迫时间的增加,高浓度组SOD活性被抑制。本研究中,绿鳍马面鲀幼鱼在不同Cd2+浓度条件下,CAT和GSH-PX活性在不同作用时间具体表现不同,但整体趋势均呈先升高后降低的趋势,且变化幅度与Cd2+浓度呈正相关。在Cd2+胁迫下,鲫鱼(Carassius auratus)肝脏SOD活性也有类似变化,开始被诱导升高,随时间延长活性被显著抑制,肝脏CAT活性在48 h内被显著诱导,之后随时间延长表现出明显抑制效应(胡蓉等, 2011)。长时间重金属胁迫环境也会造成尼罗罗非鱼肝脏中CAT活性被抑制(Atli et al, 2006)。Cr6+胁迫下,草鱼肝胰脏SOD、CAT和GSH-PX活性整体上均呈先升高后下降的趋势(郭婷等, 2012),表明重金属对抗氧化酶在短时间内表现为诱导作用,而长时间作用会影响正常代谢活动对肝脏造成损伤,表现为抗氧化酶活性被抑制。由此可以看出, 抗氧化酶SOD、CAT和GSH-PX活性的变化情况反映了绿鳍马面鲀幼鱼肝脏受损伤程度。
3.3 Cd2+对绿鳍马面鲀幼鱼肝脏MDA含量的影响MDA是生物体内脂质过氧化作用的最终分解产物,具有细胞毒性,可导致生物大分子的损伤和细胞膜生物功能的异常(Atli et al, 2006)。因而MDA含量可反映机体脂质过氧化的程度,间接的反应出细胞受损伤程度。
不同Cd2+浓度条件下,绿鳍马面鲀幼鱼肝脏中MDA含量与对照组相比,在6 h内减少,12 h时显著增加且均高于对照组,24 h时,1.84、2.76和3.68 mg/L组与12 h相比MDA含量减少,4.60 mg/L组含量增加,说明Cd2+在短时间内会造成肝脏抗氧化系统紊乱,产生自由基量有浮动,从而影响脂质过氧化作用。24—96 h内,1.84和2.76 mg/L组呈先下降后上升的趋势,说明低浓度Cd2+在24—96 h使肝脏抗氧化系统发生紊乱,从而影响脂质过氧化及其他代谢活动;3.68和4.60 mg/L组MDA含量一直呈上升趋势,说明高浓度Cd2+胁迫下,随着时间的延长,脂质过氧化程度增大,即细胞受损伤程度增加。Cr6+胁迫下,草鱼肝胰脏中MDA含量随时间延长不断增加,且与Cr6+浓度呈正相关(郭婷等, 2012)。斑马鱼(Danio rerio)在Cu胁迫下,不同浓度组中鳃的MDA含量随时间变化表现出不同程度的上升趋势,其中,高浓度组含量显著高于对照组(赵巧雅, 2017)。吉富罗非鱼(Oreochromis niloticus)在重金属Cu胁迫下,随浓度的增加,肝脏内MDA含量呈先降低后上升的变化趋势(单丹等, 2016)。说明高浓度重金属胁迫抑制了机体抗氧化酶活性,使清除自由基能力下降,加剧脂质过氧化作用,引起氧化损伤。
3.4 Cd2+对绿鳍马面鲀幼鱼肝脏和鳃组织结构的影响鱼体长时间处于过量重金属水环境中,必将影响肝脏组织细胞代谢,从而造成肝细胞结构的破坏,主要表现为肝细胞超微结构的改变,如产生大量溶酶体,内质网扩张,线粒体受损等(Giari et al, 2007)。肝细胞破坏程度与胁迫时间和Cd2+浓度呈正相关,在高浓度Cd2+作用下,绿鳍马面鲀幼鱼肝脏组织细胞无序离散,细胞体积明显增大,出现空泡化,细胞膜破裂,胞内物质展出并出现聚集现象。Zn2+胁迫下草鱼(任洪涛等, 2017)、Pb2+胁迫下泥蚶(Tegillarca granosa) (陈彩芳等, 2014)以及Cr6+胁迫下翠鳢(Channa punctatus)(Mishra et al, 2008)肝脏组织结构的急性中毒症状均出现空泡化等类似病变现象。
鳃是鱼类进行滤食、水交换和气体交换的重要场所。其由磷脂组成的鳃膜能直接吸附游离的金属离子, 若吸附过量的重金属离子将使鳃组织结构发生病理变化。重金属对鱼鳃的损伤类型一般分为2种:一种是防御损伤,具体表现为鳃丝上皮细胞增生,鳃小片上皮细胞肿胀,分泌大量黏液等;另一种是直接损伤,表现为上皮细胞坏死和直接脱落。重金属胁迫会使中央静脉窦周围出现大量含吞噬小泡的形状不规则的嗜酸性粒细胞,且有大量的高电子密度的异染色质分布在核周缘及细胞核内部,表明重金属可加速嗜酸性粒细胞老化(赵巧雅, 2017)。重金属胁迫还会使黏液细胞分泌活动旺盛,产生过量黏液阻碍鳃丝与水进行气体交换,从而造成鱼体缺氧(Carmona et al, 2010)。鳃丝上皮细胞增生及鳃叶变宽、鳃小片顶端膨大等现象均为增大相对面积,从而利于气体交换。24 h内,1.84和2.76 mg/L组的Cd2+胁迫对绿鳍马面鲀幼鱼鳃的损伤以第1类为主,主要表现为鳃小片弯曲,长度明显缩短,上皮细胞肿胀、增生,鳃丝呈棒状,周围分泌出黏液,相邻鳃小片间距变小,这些表现是为了阻止重金属进入体内,保护机体免受重金属侵害。3.68和4.60 mg/L的高浓度Cd2+则会对鱼鳃造成直接损伤,使鳃小片上皮细胞脱落、坏死,直接影响鳃组织正常生理功能。短时间内,低浓度Cd2胁迫不会对鲤鱼(Cyprinus carpio)(关海红等, 2004)鳃组织造成损伤,而高浓度Cd2+胁迫会使鳃组织出现黏液增多,鳃小片弯曲,水肿等现象,其他重金属离子,如Hg、Cu和Zn均会对鳃组织结构造成类似影响。在Cu胁迫条件下,塞内加尔鳎(Prochilodus scrofa)(Cerqueira et al, 2002)鳃组织发生细胞增生,鳃小片融合等病理变化。急性Cd2胁迫下,溪蟹(Sinopotamon henanense)鳃组织也会出现鳃叶变宽,末端膨大等现象(轩瑞晶等, 2013),说明不同重金属胁迫对不同水生生物鳃组织结构毒性效应大致相似。由此可见,SOD、CAT和GSH-PX活性及MDA含量变化,肝脏及鳃组织结构病理损伤情况均能够反映绿鳍马面鲀幼鱼受重金属毒性影响程度,可作为安全性风险评价的依据,在实际生产应用中,水体Cd2+浓度应控制在安全浓度(0.92 mg/L)以下。
BAI X J, LU H S, FENG B. Acute toxicity of three heavy metal ions on larva of Branchiostoma belcheri. Journal of Hydroecology, 2013, 34(3): 81-84 [白秀娟, 卢伙胜, 冯波. 3种重金属离子对文昌鱼幼体的急性毒性. 水生态学杂志, 2013, 34(3): 81-84 DOI:10.3969/j.issn.1674-3075.2013.03.013] |
CAO L. Toxic effects of cadmium and copper to early life stages of flounder (Paralichthys olivaceus). Master´s Thesis of Graduate University of the Chinese Academy of Sciences (Oceanographic Institute), 2010 [曹亮. 铜、镉对褐牙鲆(Paralichthys olivaceus)早期发育阶段的毒理效应研究. 中国科学院研究生院(海洋研究所)硕士研究生学位论文, 2010]
|
CARMONA R, GARCÍA‐GALLEGO M, SANZ A, et al. Chloride cells and pavement cells in gill epithelia of Acipenser naccarii: Ultrastructural modifications in seawater-acclimated specimens. Journal of Fish Biology, 2010, 64 |
CERQUEIRA C, FERNANDES M. Gill tissue recovery after copper exposure and blood parameter responses in the tropical fish prochilodus scrofa. Ecotoxicol Environ Safety, 2002, 52(2): 83-91 DOI:10.1006/eesa.2002.2164 |
CHEN C F, SHEN W L, SHENTU J K, et al. Effect of Pb2+ on the microstructure and ultrastructure of gill and hepatopancreas in Tegillarca granosa. Journal of Fisheries of China, 2014, 38(7): 56-63 [陈彩芳, 沈伟良, 申屠基康, 等. Pb2+对泥蚶鳃、肝脏等组织结构的影响. 水产学报, 2014, 38(7): 56-63] |
DU L N, YU R Z, WANG H Y, et al. Pollution and toxicity of cadmium: A review of recent studies. Journal of Environment and Health, 2013, 30(2): 77-84 [杜丽娜, 余若祯, 王海燕, 等. 重金属镉污染及其毒性研究进展. 环境与健康杂志, 2013, 30(2): 77-84] |
GIARI L, MANERA M, SIMONI E, et al. Cellular alterations in different organs of European sea bass Dicentrarchus labrax (L.) exposed to cadmium. Chemosphere, 2007, 67(6): 1171-1181 DOI:10.1016/j.chemosphere.2006.10.061 |
GUAN H H, LIN Y H. Constitution and the tolerance of several heavy metals on the gill tissue of carp. Journal of Fisheries, 2004, 17(1): 69-73 [关海红, 蔺玉华. 鲤鱼鳃组织结构及鳃对重金属离子的耐受性. 水产学杂志, 2004, 17(1): 69-73] |
GUO T, MA Y Y, TIAN P, et al. Effect of chromium on oxidative damage and antioxidant capacity of Ctenopharyngodon idellus. Journal of Anhui Agricultural Sciences, 2012, 40(28): 160-162 [郭婷, 马园园, 田鹏, 等. 铬暴露对草鱼的氧化损伤及抗氧化能力的影响. 安徽农业科学, 2012, 40(28): 160-162] |
HU R, TANG Z Y. Effect of cadmium on activities of catalase and superoxide dismutase from hepatopancreas of Carassius auratus. Journal of Southwest University (Natural Science), 2011, 33(8): 100-104 [胡蓉, 唐正义. 镉对鲫鱼肝胰脏CAT和SOD活性的影响. 西南大学学报(自然科学版), 2011, 33(8): 100-104] |
LAI T H, HE B Y, FAN H Q, et al. Effects of cadmium stress on the activities of antioxidant enzymes, digestive enzymes and the membrane lipid peroxidation of the mangrove mud clam Geloina coaxans (Gmelin). Acta Ecologica Sinica, 2011, 31(11): 92-101 [赖廷和, 何斌源, 范航清, 等. 重金属Cd胁迫对红树蚬的抗氧化酶、消化酶活性和MDA含量的影响. 生态学报, 2011, 31(11): 92-101] |
LIU C F, LI H, TAO S, et al. Uptake and accumulation of free lead by goldfish (Carassius auratus L.) and effect of gill mucus on the processes. Journal of Environmental Science, 1999, 19(4): 438-442 [刘长发, 李杭, 陶澍, 等. 金鱼(Carassius auratus L.)对水中游离态铅的吸收积累及鳃分泌粘液的自身保护作用. 环境科学学报, 1999, 19(4): 438-442] |
LIU Y, ZHANG L, QIN J H. Effects of cadmium on gene expression in liver of mosquitofish Gambusia affinis. Fisheries Science, 2019, 38(5): 132-137 [刘阳, 张力, 覃剑晖. 镉胁迫对食蚊鱼肝组织基因表达的影响. 水产科学, 2019, 38(5): 132-137] |
LUO T Y, LUO Q, RAO Q H, et al. Acute toxicities of disinfectants and metal ions on juvenile murray cod, maccullochella peelii peellii. Fujian Journal of Agricultural Sciences, 2017, 32(7): 691-696 [罗土炎, 罗钦, 饶秋华, 等. 重金属离子与消毒药物对澳洲龙纹斑幼鱼的急性毒性. 福建农业学报, 2017, 32(7): 691-696] |
MISHRA A K, MOHANTY B. Acute toxicity impacts of hexavalent chromium on behavior and histopathology of gill, kidney and liver of the freshwater fish, Channa punctatus (Bloch). Environmental Toxicology and Pharmacology, 2008, 26(2): 136-141 |
NIE Z J, XU G C, ZHANG S L, et al. Acute effects of copper on survival of fingerlings, antioxidant enzyme activities in liver and structure of gill and liver of Coilia nasus. Fishery Sciences of China, 2014, 21(1): 163-170 [聂志娟, 徐钢春, 张守领, 等. 铜对刀鲚幼鱼的急性毒性及对肝抗氧化酶活性与组织结构的影响. 中国水产科学, 2014, 21(1): 163-170] |
QIN H W, LIU A Y, GU W L, et al. Acute toxicity of six heavy metals on three aquaculture organisms. Journal of Ecotoxicology, 2015, 10(6): 287-296 [秦华伟, 刘爱英, 谷伟丽, 等. 6种重金属对3种海水养殖生物的急性毒性效应. 生态毒理学报, 2015, 10(6): 287-296] |
REN H T, LIN L. Effects of different concentrations of Cd2+ on tissue and organs and SOD activity of antioxidant enzyme of Ctenopharyngodon idellus. Jiangsu Agricultural Sciences, 2016(11): 272-274 [任洪涛, 林霖. 不同浓度Cd2+对草鱼组织器官及抗氧化酶SOD活性的影响. 江苏农业科学, 2016(11): 272-274] |
REN H T. Effects of different concentrations of zinc ion on histological structure of brain and hepatopancreas and hepatopancreatic SOD activity in grass carp Ctenopharyngodon idellus. Fisheries Science, 2016, 35(4): 106-110 [任洪涛. 不同质量浓度Zn2+对草鱼脑、肝胰脏组织结构及肝胰脏中超氧化物歧化酶活性的影响. 水产科学, 2016, 35(4): 106-110] |
SFAKIANAKIS D G, RENIERI E, KENTOURI M, et al. Effect of heavy metals on fish larvae deformities: A review. Environmental Research, 2015, 137: 246-255 |
SHAN D, ZHONG H, GUO Z B, et al. Antioxidant enzyme activity and tissue residue of GIFT tilapia after copper exposure. Journal of Southern Agriculture, 2016, 47(10): 156-161 [单丹, 钟欢, 郭忠宝, 等. 重金属铜暴露对吉富罗非鱼组织残留及抗氧化酶活性的影响. 南方农业学报, 2016, 47(10): 156-161] |
STEBBING A. Hormesis-the stimulation of growth by low levels of inhibitors. Science of the Total Environment, 1982, 22(3): 213-234 |
TIAN P. Study on the oxidative stress of the grass carp (Ctenopharyngodon idellus) after exposure to the water-borne cadmium (Cd). Master´s Thesis of Southwest University, 2013 [田鹏. 水体中镉暴露对草鱼的氧化胁迫研究. 西南大学硕士研究生学位论文, 2013]
|
WANG X F, CHEN H G, CAI W G, et al. Effects of mercury exposure on the antioxidant enzymes and acetylcholinesterase activities in the young crimson snapper (Lutjanus erythropterus). Journal of Fisheries of China, 2010, 34(12): 1829-1836 [王学锋, 陈海刚, 蔡文贵, 等. 汞离子胁迫对红鳍笛鲷抗氧化酶及乙酰胆碱酯酶活性的影响. 水产学报, 2010, 34(12): 1829-1836] |
WANG X J, HU G C, ZHANG L J, et al. Influence of cadmium on antioxidant defense system in juvenile of Orechromis niloticus. Marine Environmental Science, 2016, 35(5): 10–14, 20 [王小娇, 胡国成, 张丽娟, 等. 重金属镉胁迫对尼罗罗非鱼抗氧化酶系统的影响. 海洋环境科学, 2016, 35(5): 10–14, 20] |
WANG Z F, XIAO J, LUO Y J. A review of the effects of cadmium on aquaculture. Journal of Guangxi Academy of Sciences, 2019, 35(3): 12-17 [王志芳, 肖俊, 罗永巨. 水环境镉污染对养殖鱼类的影响研究进展. 广西科学院学报, 2019, 35(3): 12-17] |
XUAN R J, WU H, LI Y J, et al. Comparison study on gills of freshwater crab Sinopotamon henanense exposed to acute and subchronic cadmium. Guangdong Agricultural Sciences, 2013, 40(7): 123-126 [轩瑞晶, 吴昊, 李颖君, 等. 急性和亚慢性镉处理对溪蟹鳃组织影响的比较. 广东农业科学, 2013, 40(7): 123-126] |
YANG Z Y, XUE Y F, XU Y J. Effects of four heavy metal ions on embryonic development and larval growth of Oryzias melastigma. Journal of Ningbo University (Science and Technology edition), 2021, 34(5): 9-15 [杨志艳, 薛雅芳, 徐永健. 4种重金属离子对海水青鳉胚胎发育及仔鱼的急性毒性研究. 宁波大学学报(理工版), 2021, 34(5): 9-15] |
YAO Z F, ZHANG L Z, ZHUANG P, et al. Effects of antioxidant enzyme in liver and acute toxicity of Cu2+ on juvenile Chinese sturgeon. Fishery Sciences of China, 2010, 17(4): 115-122 [姚志峰, 章龙珍, 庄平, 等. 铜对中华鲟幼鱼的急性毒性及对肝脏抗氧化酶活性的影响. 中国水产科学, 2010, 17(4): 115-122] |
ZHAN B Y, LOU D C, ZHONG J S. An assessment of the filefish population and rational exploitation of the resource. Journal of Fisheries of China, 1986, 10(4): 70-79 [詹秉义, 楼冬春, 钟俊生. 绿鳍马面鲀资源评析与合理利用. 水产学报, 1986, 10(4): 70-79] |
ZHANG Z J, ZHANG W P. Biological monitoring and evaluation of environmental pollution. Beijing: China Environmental Science Press, 1991: 69 [张志杰, 张维平. 环境污染生物监测与评价. 北京: 中国环境科学出版社, 1991: 69]
|
ZHAO Q Y. Study on the toxic effects of heavy metal copper on gill of zebrafish (Danio rerio). Master´s Thesis of Nanjing Agricultural University, 2017 [赵巧雅. 重金属铜对斑马鱼鳃的毒性作用研究. 南京农业大学硕士研究生学位论文, 2017]
|



