2. 辽宁省海洋水产科学研究院 辽宁 大连 116023
2. Liaoning Ocean and Fisheries Science Research Institute, Dalian 116023, China
海草床是滨海三大典型生态系统之一,不仅可以吸收营养盐、改善水质,还能固定底质、抵抗风浪、保护海岸,亦可为许多动物提供栖息地、繁育场所和食物来源,对浅海海岸和河口生态系统具有极其重要的意义(Fonseca et al, 1992; Edgar et al, 1994; Moore, 2004; Unsworth et al, 2019)。浮游生物作为水域生态系统重要的生物组分,是鱼类等水生动物的天然饵料,也是水体营养物质生产和传输的重要环节,对维持食物网的复杂性和稳定性具有重要作用(Tang et al, 2019)。海草床作为重要的育幼场所,为多种海洋生物提供丰富的食物来源,主要包括以浮游植物为代表的初级生产者和以初级生产者为食的浮游动物(Nakamura et al, 2005; Lugendo et al, 2006; Gullström et al, 2011; Park et al, 2013)。
研究发现,海草床显著影响浮游生物的群落结构。如,Ambo-Rappe (2011)研究表明,印度尼西亚Barrang Lompo岛附近海菖蒲(Enhalus acoroides)海草床和卵叶喜盐草(Halophila ovalis)海草床的浮游植物多样性指数是邻近裸沙区的1.7倍;Lo等(2020)研究发现,马来西亚Limau-limauan海域海菖蒲海草床的浮游动物丰度是邻近裸沙区的1.5倍以上。海草叶片是大量附生植物的优良附着基,这些附生植物是端目类和桡足类等众多浮游动物的重要食物来源,而浮游动物又被海草床的鱼类等更高营养级动物所捕食(Jernakoff et al, 1998; Beck et al, 2001; Heck et al, 2003; Blandon et al, 2014)。因此,海草床的植株密度和生物量等生态特征决定了海草生境结构的复杂性,也显著影响浮游生物的群落结构(Azmi et al, 2016; Metillo et al, 2019)。目前为止,相关研究大多集中于热带海草床生境,以温带海草床生境为研究区域的报道还很少。
为查明温带海草床及其邻近裸沙区浮游生物群落结构的时空变化特征,本研究选取荣成天鹅湖鳗草(Zostera marina)海草床及其邻近裸沙区,通过对浮游生物群落结构、鳗草生物量和植株密度以及关键环境因子的周年调查,对比分析海草床及其邻近裸沙区浮游生物群落结构的时空分布差异,探讨浮游生物群落与鳗草海草床生态学特征及关键环境因子的相关性,以期为深入了解海草床的生态功能、实现海草生境的科学保护提供理论支持。
1 材料与方法 1.1 研究区域与站位布设天鹅湖(37.34°~37.36°N,122.56°~122.58°E)位于山东半岛最东端,面积约为4.8 km2,是一个半封闭的海湾泻湖,湖东南部的狭长潮汐汊道与外海相通,湖区平均水深小于2 m (帅莉等, 2003; Zhang et al, 2015)。湖内分布有鳗草和日本鳗草(Zostera japonica) 2种海草,其中鳗草为优势种,主要分布于天鹅湖中央部分的潮下带和潮间带区域,形成大面积海草床(刘建影等, 2017)。
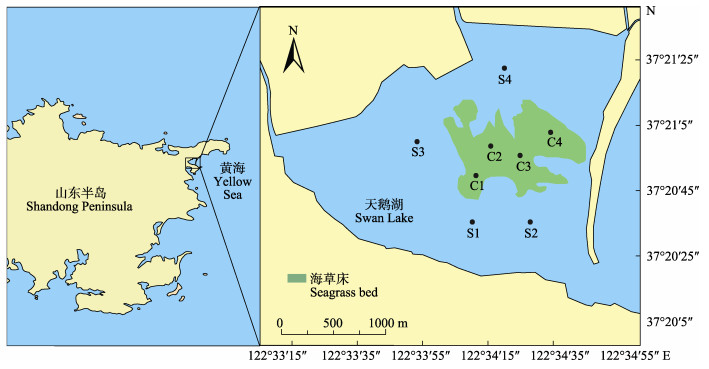
2019年2月、5月、8月和11月,对天鹅湖海草床及其邻近裸沙区的浮游生物、关键环境因子和海草床生态特征进行了调查。根据天鹅湖生境类型,共设置8个站位,其中,C1、C2、C3和C4位于鳗草海草床,S1、S2、S3和S4位于邻近裸沙区(图 1)。
|
图 1 调查站位设置 Fig.1 Setting of survey stations |
浮游生物的采集按照《海洋调查规范》(GB/T12763-2007)进行,其中,浮游植物使用浅水Ⅲ型浮游生物网(网口面积0.1 m2,筛孔77 μm)由底至表进行垂直拖网,样品用鲁哥氏液现场固定;浮游动物使用浅水Ⅰ型浮游生物网(网口面积0.2 m2,孔径0.5 mm)由底至表垂直拖网,样品使用5%甲醛溶液现场固定保存。固定好的样品带回实验室进行种类鉴定和数量统计。
1.2.2 环境指标在各站位,采用Professional Plus多功能水质仪(美国YSI公司)现场测定海水的pH值、水温(WT)、溶解氧含量(DO),用盐度计测定海水盐度;用采水器于水下0.5 m处采集水样,按照《海洋监测规范》(GB/T17378.4-2007)的方法进行海水化学需氧量(COD)、生化需氧量(BOD5)、氨氮(NH4+-N)和磷酸盐(PO43–-P)的测定。
1.2.3 海草床生态学特征在海草床的各站位,使用0.5 m×0.5 m的采样框进行海草植株取样,潜水挖掘采样框内鳗草植株,并确保植株的完整性,每站位重复取样3次。用海水将植株彻底冲洗干净后放到聚乙烯封口袋中,加冰低温运回实验室。先计数每个采样框的植株数量以计算植株密度(shoots/m2),再将样品用去离子水进行漂洗,并在60 ℃烘干至恒重,测量植株生物量(g DW/m2)。
1.3 数据处理与分析浮游生物的丰度根据采样时的滤水体积,以每立方米水体中细胞数或个体数(cells/m3, ind./m3)表示。
优势种使用浮游生物优势度(Y)表示,生物多样性采用香农–威纳指数(Shannon-Weaner index) (H׳)、均匀度指数(Pielou index)(J)和Margalef丰富度指数(D)进行分析(张雪等, 2018),计算公式为:
| $ Y = ({n_i}/N) \times {f_i} $ | (1) |
| $ H' = - \mathop \sum \limits_{i = 1}^s {P_i}{\log _2}{P_i} $ | (2) |
| $ J = H'/{\log _2}S $ | (3) |
| $ D = (S - 1)/{\log _2}N $ | (4) |
式中,
对各环境指标和浮游生物丰度的时间变化进行单因素方差分析(one-way ANOVA),结果用平均值±标准差(Mean±SD)表示,差异显著时使用Duncan多重比较;对同月份海草床和裸沙区的环境指标、浮游生物群落多样性指数进行独立样本T检验;显著性水平设置为P≤0.05。
运用Canoco 5.0软件分析浮游生物群落结构和环境因子之间的关系。对优势种的丰度/生物量数据进行去趋势对应分析(DCA)。如果最大梯度长度(length of gradient) > 4.0,进行典范对应分析(CCA);如果在3.0~4.0之间,冗余分析(RDA)和CCA均可;如果 < 3.0,进行RDA分析。排序结果用物种–环境因子关系双序图表示。
2 结果与分析 2.1 关键环境因子调查结果显示(表 1),海草床与裸沙区的关键环境因子呈现显著的季节变化,且两区之间存在一定的差异。多数环境因子在冬季和春季达到最大值,水温和pH值在夏季达到最大值,而盐度在秋季达到最大值。尽管各环境因子的平均值在海草床与裸沙区之间无明显不同,但一些环境因子于某些季节在两区之间存在显著差异(P < 0.05)。如,裸沙区海水COD含量在春、夏季显著高于海草床,平均为海草床的1.3倍;裸沙区海水BOD5含量在秋季显著高于海草床,是其1.4倍;海草床海水NH4+-N含量在冬季和春季显著高于裸沙区,为裸沙区的1.7倍,夏季则正相反,海草床海水NH4+-N含量仅为裸沙区NH4+-N含量的40%。
|
|
表 1 天鹅湖海草床及其邻近裸沙区环境因子的时空变化 Tab.1 Spatial-temporal variation of environmental factors in seagrass bed and its adjacent bare sand area of Swan Lake |
鳗草植株的生长表现出明显的季节变化,植株密度和生物量均于8月达到最大值,分别为(1 472.0± 33.8) shoots/m2和(800.3±40.2) g DW/m2,是2月植株密度和生物量的1.7倍和16.7倍(P < 0.05) (表 2)。
|
|
表 2 天鹅湖海草床生态学特征的季节变化 Tab.2 Seasonal variation of ecological characteristics in seagrass bed of Swan Lake |
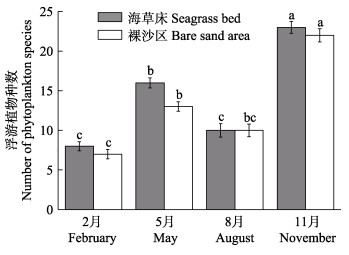
调查期间,共发现浮游植物38种,隶属于3门25属,如表 3所示。其中,硅藻门(Bacilariophyta)最多,共16科21属34种,占总种数的89.4%;甲藻门(Dinophyta)次之,共3科3属3种,占总种数的7.8%;金藻门(Chrysophyta)最少,仅1科1属1种。浮游植物种类数呈现明显的季节变化,海草床和裸沙区均在11月达到最大值,显著高于其他月份(P < 0.05),相同月份海草床和裸沙区的浮游植物种类数差异不显著(P > 0.05) (图 2)。
|
|
表 3 天鹅湖海草床及其邻近裸沙区浮游植物物种名录 Tab.3 List of phytoplankton species in seagrass bed and its adjacent bare sand area of Swan Lake |
|
图 2 天鹅湖海草床及其邻近裸沙区 Fig.2 Spatial-temporal variation of phytoplankton species in seagrass bed and its adjacent bare sand area of Swan Lake 浮游植物种类数的时空变化 |
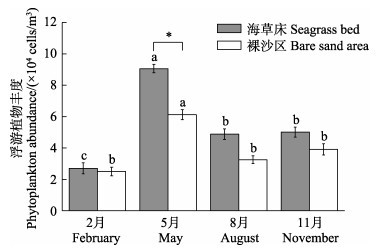
调查结果显示,海草床与裸沙区的浮游植物丰度呈现明显的季节变化,且两区之间存在一定的差异(图 3)。海草床与裸沙区浮游植物丰度均在5月显著高于其他月份(P < 0.05),分别为9.06×104 cells/m3和6.12×104 cells/m3,为2月浮游植物丰度的3.4倍和2.4倍。5月时,海草床浮游植物丰度显著高于裸沙区(P < 0.05),是裸沙区的1.5倍;其余调查月份,海草床浮游植物丰度亦高于裸沙区浮游植物丰度,但二者差异不显著(P > 0.05)。
|
图 3 天鹅湖海草床及其邻近裸沙区 Fig.3 Spatial-temporal variation of phytoplankton abundance in seagrass bed and its adjacent bare sand area of Swan Lake 浮游植物丰度的时空变化 |
浮游植物第1优势种组成表现出明显的季节变化(表 4)。5月时,海草床和裸沙区的第1优势种分别为硅藻门的刚毛根管藻(Rhizosolenia setigera)和范氏角毛藻(Chaetoceros vanheurckii),平均丰度为1.69×104 cells/m3和1.13×104 cells/m3,均高于其他调查月第1优势种的丰度。
|
|
表 4 天鹅湖海草床及其邻近裸沙区浮游植物第1优势种及优势度指数的时空变化 Tab.4 Spatial-temporal variation of the first dominant species and dominance index of phytoplankton in seagrass bed and its adjacent bare sand area of Swan Lake |
除裸沙区的均匀度指数外,海草床和裸沙区浮游植物群落结构特征指数表现出明显的季节变化(表 5)。其中,两区的多样性指数和丰富度指数均在11月达到最高值,在8月达到最低值,而海草床浮游植物的均匀度指数则在5月达到最低值。海草床和裸沙区之间浮游植物群落结构特征指数的差异不明显,仅在11月,裸沙区浮游植物丰富度指数显著高于海草床(P < 0.05)。
|
|
表 5 天鹅湖海草床及其邻近裸沙区浮游植物群落特征指数的时空变化(平均值±标准差) Tab.5 Spatial-temporal variation of phytoplankton community parameters in seagrass bed and its adjacent bare sand area of Swan Lake (Mean±SD) |
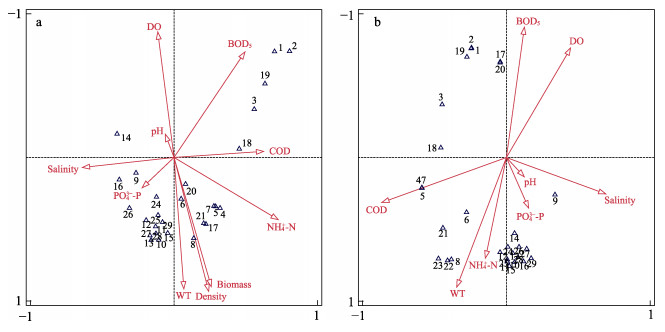
分别对海草床和裸沙区浮游植物优势种与环境因子进行CCA分析,如图 4所示。其中,海草床浮游植物群落前2个排序轴的特征值为0.849和0.673,对物种变量的解释量达72%。由图 4a可知,影响海草床浮游植物群落结构的主要因素为水温、鳗草植株密度和生物量,且格氏圆筛藻(Coscinodiscus granii)、刚毛根管藻等多数优势种与这3个因子表现为正相关。
|
图 4 天鹅湖海草床(a)及其邻近裸沙区(b)浮游植物优势种与环境因子的CCA排序图 Fig.4 CCA ordination of phytoplankton dominant species and associated environment factors in seagrass bed (a) and its adjacent bare sand area (b) of Swan Lake 1: 小等刺硅鞭藻D. fibula; 2: 卡氏角毛藻C. castracanei; 3: 条纹小环藻C. striata; 4: 格氏圆筛藻C. granii; 5: 刚毛根管藻R. delicatula; 6: 范氏角毛藻C. vanheurckii; 7: 长海毛藻T. longissimi; 8: 针杆藻Synedra spp.; 9: 丹麦细柱藻L. danicus; 10: 夜光藻N. scintillans; 11: 辐射列圆筛藻C. radiatus; 12: 虹彩圆筛藻C. oculus-iridis; 13: 圆筛藻Coscinodiscaceae sp.; 14: 中肋骨条藻S. costatum; 15: 并基角毛藻C. decipiens; 16: 舟形藻Navicula spp.; 17: 柔弱根管藻R. delicatula; 18: 海链藻Thalassiosira sp.; 19: 太阳漂流藻P. sol; 20: 琼氏圆筛藻C. jonesianus; 21: 曲舟藻Pleurosigma spp.; 22: 具槽帕拉藻B. sulcate; 23: 菱形藻Nitzschia sp.; 24: 中华盒形藻B. greville; 25: 并基海链藻T. decipens; 26: 三角角藻C. tripos; 27: 艾氏角毛藻C. eibenii; 28: 柔弱几内亚藻G. delicatula; 29: 罗氏角毛藻C. lauderi |
裸沙区浮游植物群落前2个排序轴的特征值为0.825和0.719,对物种变量的解释量达74%。由图 4b可知,影响裸沙区浮游植物群落结构的主要因素为水温和氨氮,且范氏角毛藻、针杆藻(Synedra spp.)、夜光藻(Noctiluca scintillans)等大多数优势种与这2个因子表现为正相关。
2.4 浮游动物群落结构 2.4.1 种类组成和丰度在鳗草草床及其邻近裸沙区共鉴定出浮游动物18种、幼虫3类(表 6)。其中,浮游动物成体隶属于刺胞动物门(Cnidaria)(1种)、甲壳动物门(Crustacea)(桡足类10种,枝角类3种,端足类1种,甲壳类1种)、毛颚动物门(Cheaetognatha) (1种)、尾索动物门(Urochordata)(1种)。浮游动物种类数呈现明显的季节变化,海草床和裸沙区均在11月达到最大值,显著高于其他月份(P < 0.05);两区之间浮游动物种类数差异不明显,仅在2月时,海草床浮游动物的种类数显著高于裸沙区(P < 0.05) (图 5)。
|
|
表 6 天鹅湖海草床及其邻近裸沙区浮游动物物种名录 Tab.6 List of zooplankton species in seagrass bed and its adjacent bare sand area of Swan Lake |

|
图 5 天鹅湖海草床及其邻近裸沙区浮游动物种类数的时空变化 Fig.5 Spatial-temporal variation of zooplankton species in seagrass bed and its adjacent bare sand area of Swan Lake |
调查结果显示,海草床与裸沙区的浮游动物丰度呈现明显的季节变化,且两区之间存在一定的差异(图 6)。海草床浮游动物丰度在2月达到最高值,为2.88×104 ind./m3,是8月海草床浮游动物丰度的14.5倍;裸沙区浮游动物丰度则在5月达到最高值,为2.14×104 ind./m3,是8月裸沙区浮游动物丰度的10.2倍。2月时,海草床浮游动物丰度显著高于裸沙区(P < 0.05),是裸沙区浮游动物丰度(1.25×104 ind./m3)的2.2倍;其余月份,海草床的浮游动物丰度亦高于裸沙区浮游动物丰度,但两区差异不显著(P > 0.05)。

|
图 6 天鹅湖海草床及其邻近裸沙区浮游动物丰度的时空变化 Fig.6 Spatial-temporal variation of zooplankton abundance in seagrass bed and its adjacent bare sand area of Swan Lake |
调查期间,海草床和裸沙区浮游动物第1优势种均为桡足类的小拟哲水蚤(Paracalanus parvus),其丰度具有明显季节变化,平均丰度均于5月达到最大值,分别为1.87×104 ind./m3和1.75×104 ind./m3,是8月平均丰度的25.9倍和29.2倍(表 7)。两区之间小拟哲水蚤的丰度也具有一定差异。2月时,海草床小拟哲水蚤平均丰度(1.06×104 ind./m3)为裸沙区的2.1倍;其余调查月份,两区之间差异不明显。
|
|
表 7 天鹅湖海草床及其邻近裸沙区浮游动物第1优势种及优势度指数的时空变化 Tab.7 Spatial-temporal variation of the first dominant species and dominance index of zooplankton in seagrass bed and its adjacent bare sand area of Swan Lake |
海草床和裸沙区的浮游动物群落结构特征指数表现出相同的季节变化,如表 8所示。其中,多样性指数和丰富度指数均在11月达到最高值,而均匀度指数则在5月达到最低值。两区之间群落特征指数差异不明显,仅2月时,海草床浮游动物丰富度指数显著高于裸沙区(P < 0.05)。
|
|
表 8 天鹅湖海草床及其邻近裸沙区浮游动物群落特征指数的时空变化(平均值±标准差) Tab.8 Spatial-temporal variation of zooplankton Community parameters in seagrass bed and its adjacent bare sand area of Swan Lake (Mean±SD) |
分别对海草床和裸沙区浮游动物优势种与环境因子进行RDA分析,如图 7所示。其中,海草床浮游动物前2个排序轴的特征值为0.58和0.27,物种变量的解释量达91%。由图 7a可知,影响海草床浮游动物群落结构的主要因素为水温、鳗草植株密度和生物量,且鸟缘尖头溞(Penilia avirostris)、太平洋真宽水蚤(Eurytemora pacifica)、细巧华哲水蚤(Sinocalanus tenellus)等优势种与这3个因子呈正相关。
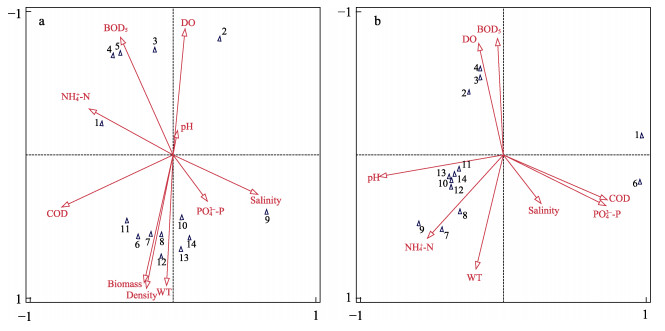
|
图 7 天鹅湖海草床(a)及其邻近裸沙区(b)浮游动物优势种与环境因子的RDA排序图 Fig.7 RDA ordination of zooplankton dominant species and associated environment factors in seagrass bed (a) and its adjacent bare sand area (b) of Swan Lake 1: 小拟哲水蚤P. parvus; 2: 强壮箭虫S. crassa; 3: 中华哲水蚤C. sinicus; 4: 猛水蚤Harpacticoida sp.; 5: 细长脚虫戎T. gracilipes; 6: 腹足类幼体Gastropod larvae; 7: 鸟缘尖头溞P. avirostris; 8: 太平洋真宽水蚤E. pacifica; 9: 细巧华哲水蚤S. tenellus; 10: 克氏纺锤水蚤A. clausi; 11: 太平洋纺锤水蚤A. pacifica; 12: 海洋伪镖水蚤P. marinus; 13: 火腿许水蚤S. poplesia; 14: 长尾住囊虫O. longicauda |
裸沙区浮游动物前2个排序轴的特征值为0.61和0.24,对物种变量的解释量达94%。由图 7b可知,影响裸沙区浮游动物群落结构的主要因素为pH、氨氮、水温,且鸟缘尖头溞、太平洋真宽水蚤、细巧华哲水蚤和克氏纺锤水蚤(Acartia clausi)等优势种与这些环境因子表现为正相关。
3 讨论 3.1 浮游生物群落结构的季节性变化特征天鹅湖海草床及其邻近裸沙区浮游植物种类组成与荣成附近海域浮游植物种类大致相同,以近岸广布种为主,硅藻占绝对优势(潘玉龙等, 2019)。浮游植物丰度在两区域表现出相同的季节变化,春季达到最高值,夏秋次之,冬季最低。另外,浮游植物数目的季节差异大于空间差异,种类数均在11月最高,且每个物种的个体丰度差异较小,导致生物多样性指数和丰富度指数在11月显著升高。生物多样性指数的高低反映生物群落结构的复杂程度,通常指数越高,群落越复杂,对环境的反馈和适应功能越强,群落的结构越稳定(李超伦等, 2010)。天鹅湖浮游植物多样性指数在1.7~2.8之间,均匀度指数在0.8~1.0之间,处于附近黄海已有研究结果变化范围之内,说明天鹅湖浮游植物群落处于较为稳定的状态(李超伦等, 2010; 慕建东等, 2009)。
天鹅湖海草床及其邻近裸沙区浮游动物种类组成以近岸低盐类群[海洋伪镖水蚤(P. marinus)和太平洋真宽水蚤等]和广温广盐类群[中华哲水蚤(C. sinicus)和小拟哲水蚤]为代表。浮游动物丰度在冬春季显著高于夏秋季,其中,冬春季节浮游动物丰度较高主要是由优势种小拟哲水蚤和中华哲水蚤较高的个体丰度造成的,而夏秋季节浮游动物丰度较低则可能与附近海域的养殖活动有关(刘萍等, 2013)。浮游动物种类数从高到低依次为11月> 8月> 5月> 2月,符合黄海浮游动物种类数夏秋季较多、春冬季较少的一般规律(杜明敏等, 2013)。本研究发现,小拟哲水蚤、强壮箭虫和中华哲水蚤为天鹅湖的主要优势种,这与帅莉等(2003)在天鹅湖的调查结果相同。海草床和裸沙区浮游动物种类数均在11月最高且物种个体丰度差异较小,导致11月生物多样性指数和丰富度指数显著升高。均匀度指数则在5月最低,这可能是由于5月小拟哲水蚤在海草床及裸沙区占据绝对优势,优势度分别为0.85和0.70,浮游动物种类过于单一,导致均匀度指数降低。
3.2 浮游生物群落变化的重要控制因素浮游生物群落结构受环境因素的综合影响,且在不同水体中环境因子对群落结构也存在差异。侯兴等(2021)对桑沟湾浮游植物的调查发现,各个季节浮游植物丰度与氨氮呈负相关,除秋季外,浮游植物与磷酸盐呈正相关。潘玉龙等(2019)对荣成近岸养殖海域浮游植物的调查发现,浮游植物群落结构主要受溶解氧、硅酸盐、铵盐、温度和pH等因素的影响。本研究发现,海草床浮游植物优势种主要与水温、鳗草植株密度和生物量相关,裸沙区浮游植物优势种主要与水温、氨氮相关。海草叶片是附生藻类生长繁殖的基质,尤其在春季时,海草叶片生长周期较长、更新速率较慢,利于附生藻类繁殖,累积更高的生物量(Lavery et al, 2002)。鳗草植株密度也可以通过改变水下光照条件影响浮游植物的生长发育(Maucha, 1942)。
荣成天鹅湖地处中纬度地区,季节分明,因此,温度对生物的影响较大,是影响浮游植物种类及生物量的关键因子(代龚圆等, 2012)。如硅藻适宜在较低温度的水体中生长,最适温度通常低于18 ℃ (Wasmund et al, 2011)。本研究发现,硅藻门物种所占比例为89%,且天鹅湖5月平均水温为15 ℃,有利于硅藻大量繁殖,可能是浮游植物丰度在5月达到最高值的主要原因。季节性的调查研究表明,随着可利用光和温度上升,浮游植物生物量通常随之增加(Alcoverro et al, 1997; Lepoint et al, 1999)。因此,温度与可利用光的相互结合很大程度上影响着海草床浮游植物的生长。氮是浮游植物生长所需的重要营养元素,也是限制元素(Ma et al, 2013)。氨氮作为一种重要的氮源,显著影响裸沙区浮游植物的生长繁殖,这可能是由于氨氮能被浮游植物直接利用,但利用程度取决于浮游植物种类(Balode et al, 1998; Strom et al, 2009)。本研究中,裸沙区圆筛藻等优势种与氨氮含量呈正相关,可以推测这些浮游植物能直接利用氨氮。
本研究发现,海草床浮游动物优势种主要与水温、鳗草植株密度和生物量相关,裸沙区浮游动物优势种主要与pH、氨氮和水温相关,因此,水温是天鹅湖浮游动物种类和丰度的关键因子。许多研究表明,水温能够影响浮游动物的体温、新陈代谢强度、生长发育以及繁殖周期,从而影响其丰度变化以及群落结构的分布(Lenz et al, 2005; Devreker et al, 2005; 姜会超等, 2015);另外,浮游植物可为浮游动物的生长繁殖提供饵料,水温也可通过影响浮游植物种类和丰度进而改变浮游动物的种类和丰度(叶文建等, 2021)。海草的存在对浮游动物具有显著影响,这是由于海草床的存在和其复杂的空间结构,减小了水流和捕食者的影响,为浮游动物提供了保护(Lo et al, 2020)。水流的削弱也会促进悬浮物沉积,与海草碎片一同作为浮游动物的碎屑食物来源(Roman et al, 1983; Fonseca et al, 1986、2007; Thresher et al, 1992)。此外,海草凋落叶含有丰富的非结构碳水化合物等活性物质,会以溶解有机碳(DOC)的形式释放进入水体或沉积物,并在微食物环作用下,DOC得以被浮游动物所利用(Vichkovitten et al, 2004; Lavery et al, 2013; 张明亮等, 2018)。因此,海草床复杂的物理空间带来的栖息、隐蔽、摄食环境是引起浮游动物丰度高的重要因素。裸沙区氨氮含量可能通过限制浮游植物的生长进而对浮游动物产生间接影响(赵鑫等, 2021)。刘潇等(2019)对荣成近岸海域浮游动物群落进行RDA分析发现,pH是第1排序轴重要的负相关影响因子,和本研究裸沙区浮游动物与环境因子RDA的结果较为一致。
3.3 海草床对浮游生物群落的影响及其生态学意义本研究发现,天鹅湖海草床浮游植物和浮游动物的年平均丰度分别为5.4×104 cells/m3和1.6×104 ind./m3,是裸沙区浮游植物和浮游动物年平均丰度的1.4倍和1.5倍。相比裸沙区,海草床复杂的物理空间和环境条件以及海草叶片、碎屑的可利用性可能是海草床浮游生物丰度和生物量水平较高的关键因素,这些特性可为浮游生物提供基质、食物和庇护(Nagelkerken, 2009; Nanjo et al, 2014)。海草床对浮游生物群落的生态学意义主要有:(1) 海草叶片阻碍光向水底的传播,具有或明或暗的光环境,这对某些浮游植物生长、浮游动物的产卵和幼体发育具有重要作用(Przeslawski, 2004; Sridhar et al, 2008; Fernandes et al, 2011);(2) 海草叶片不仅是附生藻类和黏性卵良好的附着基,还是生物幼体固着变态发育过程理想的固着基(Allen, 2014);(3) 海草叶片与附生藻类之间有着密切的营养物质交换关系,大部分从海草植株释放至周围水柱的营养物质通常在被水流稀释之前可被附生藻类所摄取和利用,同时海草凋落叶会释放DOC到周围环境中,经微食物环被浮游动物所利用(McRoy et al, 1974; Vichkovitten et al, 2004; Lavery et al, 2013; 张明亮等, 2018);(4) 海草的存在可有效削弱水流,从而为浮游生物提供保护,同时,会促进悬浮物沉积和浮游植物附着,与海草碎屑一起作为浮游动物的食物来源(Kimmerer et al, 1985; Fonseca et al, 2007; Lo et al, 2020)。然而,海草床属于脆弱的生态系统,易受自然环境变迁和人类活动影响,因此,建议加强对海草床的有效保护和科学修复,促进海草床的恢复,并发挥其对资源养护和环境改善的重要作用。
ALCOVERRO T, DUARTE C M, ROMERO J. The influence of herbivores on Posidonia oceanica epiphytes. Aquatic Botany, 1997, 56(2): 93-104 DOI:10.1016/S0304-3770(96)01098-4 |
ALLEN R M. Oviposition site influences dispersal potential in a marine bubble snail. Marine Biology Research, 2014, 10(5): 515-522 DOI:10.1080/17451000.2013.831177 |
AMBO-RAPPE R. Differences in richness and abundance of species assemblages in tropical seagrass beds of different structural complexity. Journal of Environmental Science and Technology, 2011, 9(3): 246-256 |
AZMI A A, YOSHIDA T, TODA T, et al. Comparison of zooplankton abundance and community in seagrass and non-seagrass areas of Merambong shoal. AIP Publishing LLC, 2016, 1784(1): 060002 |
BALODE M, PURINA I, BEÉCHEMIN C, et al. Effects of nutrient enrichment on the growth rates and community structure of summer phytoplankton from the Gulf of Riga, Baltic Sea. Journal of Plankton Research, 1998, 20(12): 2251-2272 DOI:10.1093/plankt/20.12.2251 |
BECK M W, HECK K L, ABLE K W, et al. The identification, conservation, and management of estuarine and marine nurseries for fish and invertebrates: A better understanding of the habitats that serve as nurseries for marine species and the factors that create site-specific variability in nursery quality will improve conservation and management of these areas. BioScience, 2001, 51(8): 633-641 DOI:10.1641/0006-3568(2001)051[0633:TICAMO]2.0.CO;2 |
BLANDON A, ERMGASSEN P. Quantitative estimate of commercial fish enhancement by seagrass habitat in southern Australia. Estuarine Coastal and Shelf Science, 2014, 141(5): 1-8 |
DAI G Y, LI J, LI L, et al. The spatio-temporal pattern of phytoplankton in the north basin of Lake Dianchi and related environmental factors. Acta Hydrobiologica Sinica, 2012, 36(5): 946-956 [代龚圆, 李杰, 李林, 等. 滇池北部湖区浮游植物时空格局及相关环境因子. 水生生物学报, 2012, 36(5): 946-956] |
DEVREKER D, SOUISSI S, SEURONT L. Effects of chlorophyll concentration and temperature variation on the reproduction and survival of Temora longicornis (Copepoda, Calanoida) in the Eastern English Channel. Journal of Experimental Marine Biology and Ecology, 2005, 318(2): 145-162 DOI:10.1016/j.jembe.2004.12.011 |
DU M M, LIU Z T, WANG C S, et al. The seasonal variation and community structure of zooplankton in China Sea. Acta Ecologica Sinica, 2013, 33(17): 5407-5418 [杜明敏, 刘镇盛, 王春生, 等. 中国近海浮游动物群落结构及季节变化. 生态学报, 2013, 33(17): 5407-5418] |
EDGAR J G, SHAW C, WATSONA G F, et al. Comparisons of species richness, size-structure and production of benthos in vegetated and unvegetated habitats in Western Port, Victoria. Journal of Experimental Marine Biology and Ecology, 1994, 176(2): 201-226 DOI:10.1016/0022-0981(94)90185-6 |
FERNANDES D, PODOLSKY R D. Developmental consequences of association with a photosynthetic substrate for encapsulated embryos of an intertidal gastropod. Journal of Experimental Marine Biology and Ecology, 2011, 407(2): 370-376 DOI:10.1016/j.jembe.2011.07.033 |
FONSECA M S, CAHALAN J A. A preliminary evaluation of wave attenuation by four species of seagrass. Estuarine, Coastal and Shelf Science, 1992, 35(6): 565-576 DOI:10.1016/S0272-7714(05)80039-3 |
FONSECA M S, FISHER J S. A comparison of canopy friction and sediment movement between four species of seagrass with reference to their ecology and restoration. Marine Ecology Progress Series, 1986, 29(1): 15-22 |
FONSECA M S, KOEHL M, KOPP B S. Biomechanical factors contributing to self-organization in seagrass landscapes. Journal of Experimental Marine Biology and Ecology, 2007, 340(2): 227-246 DOI:10.1016/j.jembe.2006.09.015 |
GULLSTRÖM M, BERKSTRÖM C, ÖHMAN M C, et al. Scale-dependent patterns of variability of a grazing parrotfish (Leptoscarus vaigiensis) in a tropical seagrass-dominated seascape. Marine Biology, 2011, 158(7): 1483-1495 DOI:10.1007/s00227-011-1665-z |
HECK K L, HAYS G, ORTH R J. Critical evaluation of the nursery role hypothesis for seagrass meadows. Marine Ecology Progress Series, 2003, 253: 123-136 DOI:10.3354/meps253123 |
HOU X, GAO Y P, DU M R, et al. Temporal and spatial variation in phytoplankton community structure and their relationship with environmental factors in Sanggou Bay. Progress in Fishery Sciences, 2021, 42(2): 18-27 [侯兴, 高亚平, 杜美荣, 等. 桑沟湾浮游植物群落结构时空变化特征及影响因素. 渔业科学进展, 2021, 42(2): 18-27] |
JERNAKOFF P, NIELSEN J. Plant-animal associations in two species of seagrasses in Western Australia. Aquatic Botany, 1998, 60(4): 359-376 DOI:10.1016/S0304-3770(97)00100-9 |
JIANG H C, CHEN H G, SONG X K, et al. Zooplankton community structure in Jincheng area of Laizhou Bay and its relationship with environmental factors. Acta Ecologica Sinica, 2015, 35(22): 7308-7319 [姜会超, 陈海刚, 宋秀凯, 等. 莱州湾金城海域浮游动物群落结构及与环境因子的关系. 生态学报, 2015, 35(22): 7308-7319] |
KIMMERER W J, MCKINNON A D. A comparative study of the zooplankton in two adjacent embayments, Port Phillip and Westernport Bays, Australia. Estuarine, Coastal and Shelf Science, 1985, 21(2): 145-159 DOI:10.1016/0272-7714(85)90094-0 |
LAVERY P S, MCMAHON K, WEYERS J, et al. Release of dissolved organic carbon from seagrass wrack and its implications for trophic connectivity. Marine Ecology Progress Series, 2013, 494(3): 121-133 |
LAVERY P S, VANDERRKLIFT M A. A comparison of spatial and temporal patterns in epiphytic macroalgal assemblages of the seagrasses Amphibolis griffithii and Posidonia coriacea. Marine Ecology Progress Series, 2002, 236: 99-112 DOI:10.3354/meps236099 |
LENZ P H, HARTLINE A. Temperature compensation in the escape response of a marine copepod, Calanus finmarchicus (Crustacea). The Biological Bulletin, 2005, 209(1): 75-85 DOI:10.2307/3593143 |
LEPOINT G, HAVELANGE S, GOBERT S, et al. Fauna vs flora contribution to the leaf epiphytes biomass in a Posidonia oceanica seagrass bed (Revellata Bay, Corsica). Hydrobiologia, 1999, 394: 63-67 DOI:10.1023/A:1003557303904 |
LI C L, ZHANG Y S, SUN S, et al. Species composition, density and seasonal variation of phytoplankton in Sanggou Bay, China. Progress in Fishery Sciences, 2010, 31(4): 1-8 [李超伦, 张永山, 孙松, 等. 桑沟湾浮游植物种类组成、数量分布及其季节变化. 渔业科学进展, 2010, 31(4): 1-8 DOI:10.3969/j.issn.1000-7075.2010.04.001] |
LIU J Y, LI W T, QIN L Z, et al. Spatio-temporal variations in benthic and macrobenthic molluscs in Swan Lake, Shandong, China. Marine Sciences, 2017, 41(1): 113-122 [刘建影, 李文涛, 覃乐政, 等. 山东荣成天鹅湖海草场大型底栖贝类时空分布研究. 海洋科学, 2017, 41(1): 113-122] |
LIU P, SONG H J, FU M Z, et al. Seasonal variability of zooplankton community characteristics in the Rongcheng Bay contiguous waters. Acta Oceanologica Sinica, 2013, 35(4): 168-175 [刘萍, 宋洪军, 傅明珠, 等. 荣成湾毗邻海域浮游动物群落季节分布特征. 海洋学报, 2013, 35(4): 168-175] |
LIU X, PANG Y L, SUN B B, et al. Structure of zooplankton community and its relation with environmental factors in Rongcheng adjacent waters. Modern Agricultural Science and Technology, 2019(10): 177-179 [刘潇, 潘玉龙, 孙蓓蓓, 等. 荣成近岸海域浮游动物群落结构及其与环境因子的关系. 现代农业科技, 2019(10): 177-179 DOI:10.3969/j.issn.1007-5739.2019.10.113] |
LO S L, YAP T K, CHEN C A, et al. Zooplankton in seagrass and adjacent non-seagrass habitats in Tun Mustapha Park, Sabah, Malaysia. Borneo Journal of Marine Science and Aquaculture, 2020, 4(1): 6-13 DOI:10.51200/bjomsa.v4i1.1747 |
LUGENDO B R, NAGELKERKEN I, VAN DER VELDE G, et al. The importance of mangroves, mud and sand flats, and seagrass beds as feeding areas for juvenile fishes in Chwaka Bay, Zanzibar: Gut content and stable isotope analyses. Journal of Fish Biology, 2006, 69(6): 1639-1661 DOI:10.1111/j.1095-8649.2006.01231.x |
MA C X, YU H X. Phytoplankton community structure in reservoirs of different trophic status, Northeast China. Chinese Journal of Oceanology and Limnology, 2013, 31(3): 471-481 DOI:10.1007/s00343-013-1264-6 |
MAUCHA R. Das gleichgewicht des limnischen Lebensraumes. Magyar Boil Kutatantezet Munka, 1942, 14: 192-230 |
MCROY C P, GOERING J J. Nutrient transfer between the seagrass Zostera marina and its epiphytes. Nature, 1974, 248(5444): 173-174 DOI:10.1038/248173a0 |
METILLO E B, NISHIKAWA J, ROSS O B, et al. Diel patterns of zooplankton community structure in nearshore waters of different substrates off Tinggi and Sibu Islands, Malaysia, with special reference to copepods. Aquatic Ecosystem Health and Management, 2019, 22(1): 86-102 DOI:10.1080/14634988.2018.1505139 |
MOORE K A. Influence of seagrasses on water quality in shallow regions of the lower Chesapeake Bay. Journal of Coastal Research, 2004, 2009(10045): 162-178 |
MU J D, DONG W, CHEN B J, et al. Ecological characteristics of phytoplankton in Sanggou Bay. Progress in Fishery Sciences, 2009, 30(3): 91-96 [慕建东, 董玮, 陈碧鹃, 等. 桑沟湾浮游植物生态特征. 渔业科学进展, 2009, 30(3): 91-96] |
NAGELKERKEN I. Evaluation of nursery function of mangroves and seagrass beds for tropical decapods and reef fishes: Patterns and underlying mechanisms. Ecological connectivity among tropical coastal ecosystems. Springer, Dordrecht, 2009, 357-399 |
NAKAMURA Y, SANO M. Comparison of invertebrate abundance in a seagrass bed and adjacent coral and sand areas at Amitori Bay, Iriomote Island, Japan. Fisheries Science, 2005, 71(3): 543-550 |
NANJO K, KOHNO H, NAKAMURA Y, et al. Differences in fish assemblage structure between vegetated and unvegetated microhabitats in relation to food abundance patterns in a mangrove creek. Fisheries Science, 2014, 80(1): 21-41 |
PAN Y L, LIU X, SHA J J, et al. Influence of environmental factors on phytoplankton community structure and its relationship with coastal aquaculture in the waters adjacent to Rongcheng. Progress in Fishery Sciences, 2019, 40(5): 26-33 [潘玉龙, 刘潇, 沙婧婧, 等. 荣成近岸养殖海域浮游植物群落结构及与环境因子的关系. 渔业科学进展, 2019, 40(5): 26-33] |
PARK H J, CHOY E J, LEE K, et al. Trophic transfer between coastal habitats in a seagrass-dominated macrotidal embayment system as determined by stable isotope and fatty acid signatures. Marine and Freshwater Research, 2013, 64(12): 1169-1183 |
PRZESLAWSKI R. A review of the effects of environmental stress on embryonic development within intertidal gastropod egg masses. Molluscan Research, 2004, 24(1): 43-63 |
ROMAN M R, REEVE M R, FROGGATT J L. Carbon production and export from Biscayne Bay, Florida. I. Temporal patterns in primary production, seston and zooplankton. Estuarine Coastal and Shelf Science, 1983, 17(1): 45-59 |
SHUAI L, YIN X C, YANG X N, et al. Studies on phytoplankton and zooplankton in the Yuehu inlet, Shongdong Peninsula. Journal of Qingdao University, 2003, 18(4): 70-75 [帅莉, 殷效彩, 杨小妮, 等. 山东荣成月湖浮游动植物的研究. 青岛大学学报, 2003, 18(4): 70-75] |
SRIDHAR R, THANGARADJOU T, KANTIAN L. Comparative investigation on physico-chemical properties of the coral reef and seagrass ecosystems of the Palk Bay. Indian Journal of Marine Sciences, 2008, 37(2): 207-213 |
STROM S L, BRIGHT K J. Inter-strain differences in nitrogen use by the coccolithophore Emiliania huxleyi, and consequences for predation by a planktonic ciliate. Harmful Algae, 2009, 8(5): 811-816 |
TANG C, YI Y, YANG Z, et al. Planktonic indicators of trophic states for a shallow lake (Baiyangdian Lake, China). Limnologica, 2019, 78: 125712 |
THRESHER R E, NICHOLS P D, GUNN J S, et al. Seagrass detritus as the basis of a coastal planktonic food chain. Limnology and Oceanography, 1992, 37(8): 1754-1758 |
UNSWORTH R K F, NORDLUND L M, CULLEN-UNSWORTH L C. Seagrass meadows support global fisheries production. Conservation Letters, 2019, 12(1): e12566 |
VICHKOVITTEN T, HOLMER M. Contribution of plant carbohydrates to sedimentary carbon mineralization. Organic Geochemistry, 2004, 35(9): 1053-1066 |
WASMUND N, TUIMALA J, SUIKKANEN S, et al. Long-term trends in phytoplankton composition in the western and central Baltic Sea. Journal of Marine Systems, 2011, 87(2): 145-159 |
YE W J, DU P, SHOU L, et al. Spatio-temporal variation of marco and mesozooplankton communities and the controlling factors around Zhoushan Archipelago. Acta Ecologica Sinica, 2021, 41(1): 254-267 [叶文建, 杜萍, 寿鹿, 等. 舟山海域大中型浮游动物群落时空变化及受控要素. 生态学报, 2021, 41(1): 254-267] |
ZHANG M L, QI Z H, LI B, et al. A preliminary study on energy contribution of terrestrial organic carbon to zooplankton in the Laizhou Bay. Marine Fisheries, 2018, 40(3): 319-325 [张明亮, 齐占会, 李斌, 等. 陆源有机碳对莱州湾浮游动物能量贡献的初步研究. 海洋渔业, 2018, 40(3): 319-325] |
ZHANG X, XU X F, DAI Y Y, et al. Phytoplankton community characteristics and variation at artificial reefs of Tianjin offshore. Progress in Fishery Sciences, 2018, 39(6): 1-10 [张雪, 徐晓甫, 戴媛媛, 等. 天津近岸人工鱼礁海域浮游植物群落及其变化特征. 渔业科学进展, 2018, 39(6): 1-10] |
ZHANG X, ZHOU Y, LIU P, et al. Temporal pattern in biometrics and nutrient stoichiometry of the intertidal seagrass Zostera japonica and its adaptation to air exposure in a temperate marine lagoon (China): Implications for restoration and management. Marine Pollution Bulletin, 2015, 94(1/2): 103-113 |
ZHAO X, WANG L, ZHENG S, et al. Analysis on community characteristics and environmental factors of plankton and zoobenthos in headwater area of Wudinghe River watershed: A tributary of mid Yellow River. Water Resources and Hydropower Engineering, 2021, 52(10): 121-132 [赵鑫, 王琳, 郑帅, 等. 黄河中游支流无定河流域源头区浮游生物和底栖动物群落特征与环境因子分析. 水利水电技术, 2021, 52(10): 121-132] |



