2. 黑龙江省冷水性鱼类种质资源及增养殖 重点开放实验室 黑龙江 哈尔滨 150070;
3. 上海海洋大学 水产科学国家级实验教学示范中心 上海 201306
2. Key Open Laboratory of Cold Water Fish Germplasm Resources and Breeding of Heilongjiang Province, Harbin 150070, China;
3. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China
拟赤梢鱼(Pseudaspius leptocephalus)隶属鲤科(Cyprinidae)、雅罗鱼亚科(Leuciscinae)、拟赤梢鱼属(张觉民, 1995),在中国主要分布于黑龙江流域,是当地珍稀名贵经济鱼类之一。近年来,由于环境污染、过度捕捞,拟赤梢鱼的野生资源量迅速下降(李明德, 2011)。目前,对拟赤梢鱼的研究在肌肉营养(吴善福等, 2016)、胚胎发育(杨建等, 2021)等方面有少量报道。拟赤梢鱼的保护性研究工作于2015年陆续展开,2019年成功攻克了拟赤梢鱼的人工繁殖难题(张颖等, 2016)。2021年,实现拟赤梢鱼全人工繁育(杨建等, 2021)。目前,亟需开展拟赤梢鱼性腺分化、发育特征和成鱼性腺发育周年变化规律等方面的研究,为其人工繁育提供理论指导。
性腺分化与发育是一个复杂的基因调控过程,已有多个性别决定相关基因相继被发现。其中,sox3基因(sry related high mobility group box 3)作为转录调控因子sox家族成员之一,是唯一定位于X染色体上的sox家族基因,且与雄性性别决定基因sry在HMG (histidine, methionine, glycine-rich)结构域上的同源性最高(Rajakumar et al, 2014),被认为是参与个体性别决定和分化相关的重要基因(许可等, 2017)。
本研究通过RACE技术克隆了拟赤梢鱼sox3基因,同时利用实时荧光定量PCR (qRT-PCR)技术检测其在不同组织和性腺早期分化、发育过程中的时空表达特征,并结合组织切片技术观察拟赤梢鱼早期卵巢分化、发育的结构变化特征,以期初步阐明sox3基因在拟赤梢鱼卵巢发育与分化中的作用,为开展拟赤梢鱼的人工繁育研究提供理论依据。
1 材料与方法 1.1 实验材料实验用拟赤梢鱼亲鱼取自中国水产科学研究院黑龙江水产研究所呼兰试验站,经池塘人工肥育后使用药物催产获得受精卵,将受精卵置于室内水温22 ℃条件下孵化。仔鱼破膜、平游后,移至室内循环水养殖系统培育,水温21~23 ℃,孵化后45 d内投喂丰年虫;45~85 d期间,使用丰年虫和升索S4级鲤鱼幼鱼商品料混合投喂;85~360 d,幼鱼置于室内养殖池培育,期间投喂鲤鱼颗粒饲料。
1.2 样品采集性腺发育组织切片样品采集:仔鱼破膜0~85 d,每5 d采集一次整鱼样本,每个时间点采集20尾;85~360 d,每20 d采集一次性腺组织样本,每次采集20尾。采集的样品用波恩氏液固定48 h后,置于75%酒精保存,以备组织切片观察性腺分化时间及各发育时期特点。不同生长时期拟赤梢鱼体长数据见表 1。
|
|
表 1 拟赤梢鱼生长数据(平均值±标准差) Tab.1 The growth data of Pseudaspius leptocephalus (Mean±SD) |
qRT-PCR样品采集:挑选4龄雌性、雄性成鱼各3尾,体长为(26.862±2.172) cm,体重为(194.033± 9.734) g,分别采集其脑、眼睛、鳃、心脏、肝、肾、脾、肠、肌肉、精巢和卵巢等组织,液氮保存,以备sox3基因组织表达特征分析;根据组织切片结果,采集性腺分化期仔鱼20尾,每条仔鱼于背鳍附近切取5 mm厚的鱼段,波恩氏液固定,用于组织切片确定性腺类型,剩余样本液氮保存,以备sox3基因在性腺分化过程表达特征分析;采集孵化后85、160、260、360 d幼鱼及4龄成鱼各20尾,一侧性腺固定于波恩氏液,用于组织切片确定性腺类型,另一侧液氮保存,以备sox3基因在性腺发育过程表达特征分析。
1.3 性腺发育组织切片取波恩氏液固定好的样品,经梯度酒精脱水、二甲苯透明、浸腊、包埋、连续切片、二甲苯脱蜡、梯度酒精复水、H.E染色、透明、中性树胶封片、烘片等步骤后用显微镜观察、拍照。
1.4 总RNA提取和cDNA合成采取Trizol法提取拟赤梢鱼不同组织及性腺不同发育时期样品的总RNA,并用1%琼脂糖凝胶电泳和超微量核酸蛋白测定仪(Thermo Scientific)检测总RNA的完整性和浓度。取1 μg总RNA作为模板,按照GoScriptTM Reverse Transcription Mix, Oligo (dT)试剂盒(Promega)说明书进行反转录合成第一链cDNA,产物稀释5倍后于–20 ℃保存备用。
1.5 拟赤梢鱼sox3基因cDNA克隆根据斑马鱼(Danio rerio) sox3基因cDNA序列(GenBank: NM_001001811.2)设计引物(表 2)。以拟赤梢鱼成鱼卵巢cDNA为模板进行PCR扩增,反应体系为20 μL,反应程序:94 ℃ 5min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,30个循环;72 ℃ 5 min。产物经1%琼脂糖凝胶电泳后进行胶回收、纯化,纯化片段连接到pMD18-T载体(TaKaRa),转化至大肠杆菌DH5α感受态细胞(TaKaRa),经菌落PCR鉴定,挑选阳性克隆菌落送金唯智生物科技有限公司测序。
|
|
表 2 实验所用引物及序列 Tab.2 Sequences of primers used in this study |
根据获得的sox3基因中间片段分别设计5′-RACE和3′-RACE特异性引物(表 2),按照SMARTer® RACE 5′/3′试剂盒(TaKaRa)说明书,以RACE Ready cDNA第一链为模板,进行PCR扩增,反应程序:94 ℃ 30 s,72 ℃ 2 min,5个循环;94 ℃ 30 s,70 ℃ 30 s,72 ℃ 2 min,5个循环;94 ℃ 30 s,68 ℃ 30 s,72 ℃ 2 min,25个循环;4 ℃保持。扩增产物经胶回收、纯化、连接、转化及阳性菌落筛选,挑选阳性克隆菌落送金唯智生物科技有限公司测序。
1.6 sox3基因生物信息学分析将拟赤梢鱼sox3基因部分CDS区、5′/3′端序列通过SeqMan软件进行拼接,得到cDNA全长序列;使用DNAMAN 8.0软件分析开放阅读框(ORF)结构,推导氨基酸序列,并进行氨基酸同源对比;使用专业蛋白分析系统(Expert Protein Analysis System)分析SOX3蛋白基本理化性质;使用MEGA 5.0软件,采用邻接法构建sox3基因系统进化树,Bootstrap重复次数设置为1 000;使用Swiss-Model预测拟赤梢鱼SOX3蛋白三级结构。
1.7 qRT-PCR检测sox3基因的表达规律根据获得的sox3基因全长cDNA序列设计qRT-PCR特异性引物(表 2);以拟赤梢鱼不同发育阶段性腺样本及各组织cDNA为模板,18S基因为内参,使用ABI 7500荧光定量PCR仪(Applied Biosystems),按照TB Green Premix Ex Taq Ⅱ试剂盒(TaKaRa)说明书进行操作,每个样品重复测定3次。反应体系10 μL,反应条件:95 ℃ 30 s;95 ℃ 30 s,60 ℃ 30 s,40个循环。
1.8 数据处理采用2−ΔΔCT法计算基因的相对表达量,结果用平均值±标准差(Mean±SD)表示。用SPSS 22.0进行单因素方差分析(one-way ANOVA)和Duncan多重比较,显著性水平设为P < 0.05。
2 结果与分析 2.1 拟赤梢鱼性腺发育组织学观察 2.1.1 性腺分化孵化后1 d,拟赤梢鱼原始生殖细胞(PGCs)位于脊索下方体壁腹膜背侧,体积明显大于周围体细胞,呈圆形(图 1-a)。孵化后5 d,PGCs数量增加至多个,并在脊索下方前肾管聚集(图 1-b);15 d时,PGCs被上皮细胞包围,形成纺锤形原始性腺,由肠系膜粘附在鳔和肠道之间(图 1-c);40 d时,性腺呈现椭圆形和梭形2种不同的形态(图 1-e、f);至45 d时,椭圆形性腺中央可观察到中空的卵巢腔结构,且性腺细胞数量较多(图 1-h),卵巢分化形成;至75 d时,梭形性腺体积明显增大,出现大量弱嗜碱性的精原细胞,可见精小管(图 1-i),精巢分化形成。

|
图 1 拟赤梢鱼卵巢分化与不同发育时期形态结构变化
Fig.1 The changes of morphosis in ovary differentiation and development of P. leptocephalus at different stages
a:1 d;b:5 d;c:15 d;d:35 d;e和f:40 d;g和h:45 d;i:75 d;j:100 d;k:120 d;l:160 d;m:260 d。n:360 d PGC:原始生殖细胞;No:脊索;PG:原始性腺;K:肾;G:肠;ME:肠系膜;Sb:鳔;GC:生殖细胞;PE:腹膜上皮;SC:体细胞;OC:卵巢腔;ED:精小管;OV:卵巢;TE:精巢;SG:精原细胞;Og:卵原细胞;Nu:核仁;OO:卵母细胞;FC:滤泡细胞;V:液泡;YN:卵黄核;BV:血管;St:光滑边缘;Et:生殖上皮 a: 1 d; b: 5 d; c: 15 d; d: 35 d; e and f: 40 d; g and h: 45 d; i: 75 d; j: 100 d; k: 120 d; l: 160 d; m: 260 d; n: 360 d. PGC: Primordial germ cell; No: Notochord; PG: Primary gonad; K: Kidney; G: Gut; ME: Mesentery; Sb: Swim bladder; Gc: Germ cell; PE: Peritoneum; SC: Somatic cell; OC: Ovarian cavity; ED: Efferent duct; OV: Ovary; TE: Testis; SG: Spermatogonia; Og: Oogonium; Nu: Nucleolus; OO: Oocyte; FC: Follicular cells; V: Vacuole; YN: Yolk nuclear; BV: Blood vessel; St: Smooth type; Et: Germinal epithelium. |
孵化后100 d时,拟赤梢鱼卵巢体积和生殖细胞数目明显增加,卵巢处于Ⅰ期发育阶段(图 1-10);120 d时,卵母细胞核增大,核内含1~3个大而圆的核仁,且分布在细胞核膜附近(图 1-k);至160 d时,卵母细胞质出现液泡,及少量的滤泡细胞,标志着卵巢发育进入Ⅱ期(图 1-l);260 d时,卵母细胞呈不规则多角形,形态发生改变,在卵巢中松散分布,部分卵母细胞质出现卵黄核(图 1-m);360 d卵母细胞卵质加厚,卵黄核明显,未见辐射带及滤泡层出现,仍处于Ⅱ期(图 1-n)。
2.2 拟赤梢鱼sox3基因cDNA序列分析拟赤梢鱼sox3基因cDNA全长为1 800 bp (GenBank登录号为MT952206),包括5′非编码区(5′-UTR, 209 bp)、3′非编码区(3′-UTR, 691 bp)和开放阅读框(ORF, 900 bp),共编码299个氨基酸,第34~104位为HMG保守结构域(图 2)。拟赤梢鱼SOX3蛋白分子式为C1425H2259N427O443S25,相对分子量为33.26 kDa,理论pI值为9.63,蛋白质的不稳定系数为66.11。

|
图 2 拟赤梢鱼sox3 cDNA序列及氨基酸序列 Fig.2 cDNA and amino acid sequence of P. leptocephalus sox3 灰色阴影:起始密码子(ATG)、终止密码子(TGA);黄色阴影:HMG-box序列;黑色方框:SOXp motif;下划线:5′/3′-UTR;斜体加粗:加强信号和Poly A尾。 Grey shadow: Initiation codon (ATG), termination codon (TGA); Yellow shadow: HMG-box; Black box: SOXp motif; Underline: 5′/3′-UTR; Italics bold: Strengthen the signal and poly A tail. |
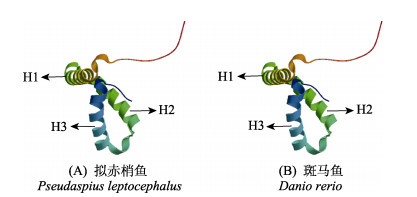
在NCBI数据库中,拟赤梢鱼与其他物种sox3基因编码的氨基酸序列比对结果显示,拟赤梢鱼与其他硬骨鱼类同源性在98.66%~92.33%之间;与翘嘴鲌(Culter alburnus)氨基酸同源性最高,与高等哺乳动物小鼠(Mus musculus)的同源性达61.33% (表 3)。利用DNAMAN 8.0软件比较分析拟赤梢鱼与其他物种SOX3蛋白氨基酸序列,不同物种SOX3蛋白氨基酸序列中均存在高度保守的HMG结构域(图 3)。此外,拟赤梢鱼SOX3蛋白三级结构与斑马鱼高度一致,均含有3个α螺旋和2个环区(图 4)。
|
|
表 3 拟赤梢鱼SOX3蛋白氨基酸序列同源性比对 Tab.3 Homology comparison of amino acid sequence of P. leptocephalus SOX3 |

|
图 3 拟赤梢鱼SOX3蛋白氨基酸序列同源性比对 Fig.3 Homology comparison of amino acid sequence of P. leptocephalus SOX3 红色方框:HMG结构域Red box: HMG domain |
|
图 4 拟赤梢鱼与斑马鱼SOX3蛋白分子三级结构 Fig.4 The spatial structure of SOX3 proteins of P. leptocephalus (A) and Danio rerio (B) α螺旋用H1~H3表示。 Alpha helices are indicated as H1~H3. |
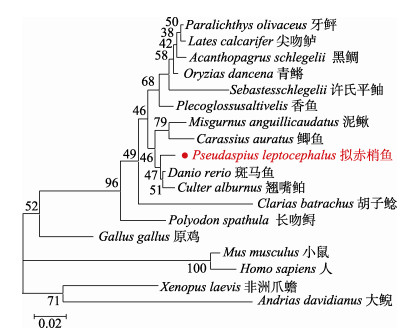
拟赤梢鱼与其他硬骨鱼类聚为一支,人(Homo sapiens)、小鼠等哺乳动物聚为一支,两栖类单独聚为一支(图 5)。其中,拟赤梢鱼与斑马鱼、翘嘴鲌sox3基因氨基酸序列相似度最高,与人、鼠和原鸡(Gallus gallus)等较高等脊椎动物的亲缘关系较远。
|
图 5 拟赤梢鱼与其他脊椎动物sox3基因构建的系统进化树 Fig.5 Phylogenetic tree of sox3 of P. leptocephalus and other species |
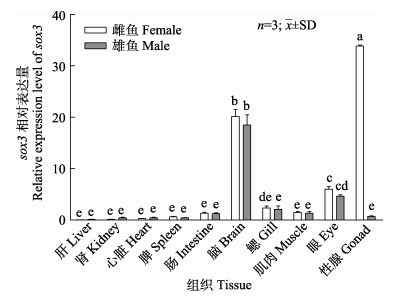
如图 6所示,sox3基因在拟赤梢鱼肝、肾、心、脾、肠、脑、鳃、肌肉、眼和性腺10种组织中的表达水平存在显著差异(P < 0.05),在卵巢中表达量最高,脑次之,眼睛再次之,在精巢和其他组织中均微量表达。此外,sox3基因在性腺中的表达具有显著的性别差异(P < 0.05),卵巢中的表达量约为精巢中表达量的46倍,而在其他组织中的表达无性别差异(P > 0.05)。
|
图 6 sox3基因在拟赤梢鱼不同组织中的表达 Fig.6 The expression levels of sox3 in different tissues of P. leptocephalus 不同字母表示组织间存在显著差异(P < 0.05)。 Different letters indicate significant differences between tissues (P < 0.05). |
根据组织切片结果选择未分化性腺、卵巢和精巢3种类型性腺样品检测sox3基因表达量,sox3基因在上述3种不同类型性腺中的表达存在显著差异,卵巢中sox3基因表达量显著高于未分化性腺和精巢(P < 0.05),精巢中的表达量最低,仅为卵巢表达量的1/8 (图 7-A)。

|
图 7 拟赤梢鱼sox3基因在性腺分化、发育不同阶段中的表达 Fig.7 Expression of sox3 of P. leptocephalus during different gonad differentiation and development stages A:性腺分化阶段;B:卵巢分化后。不同字母表示存在显著差异(P < 0.05)。 A: Gonad differentiation stages; B: Gonad development stages after differentiation. Different letters indicate significant differences (P < 0.05). |
在85~360 d卵巢早期发育过程中,sox3基因的表达呈显著上升的变化趋势。其中,360 d时,sox3基因表达量约为85 d时的127倍,成熟卵巢中sox3基因的表达量显著高于85 d、160 d卵巢发育期(P > 0.05),但显著低于260 d、360 d发育期(P > 0.05);在孵化后85 d、360 d的精巢发育过程及成熟精巢中,sox3基因表达量在各发育阶段无显著差异(P > 0.05),始终微量表达(图 7-B)。
3 讨论目前,关于鱼类性腺分化时间及特征主要从解剖学和细胞学特征来区分,如卵巢腔、输精管、精小叶的发生(刘亚秋等, 2019; 刘淑琰, 2017);而细胞学分化主要是以生殖细胞的减数分裂为标志(Nagasawa et al, 2013),但这一划分标准仍存在一定的争议。不同鱼类早期性腺分化时的结构特征存在显著差异,如南方鲶(Silurus meridionalis)性腺横切面呈梨形的分化为卵巢,呈长条形的将分化成精巢(张修月等, 2005);而大黄鱼(Larimichthys crocea)早期性腺呈梨形的分化成精巢,呈长条形的分化成卵巢(游秀荣, 2012)。
鱼类的性腺分化方式主要分为两类,一类是由原始性腺直接发育为精巢或卵巢,称为可分化的雌雄异体型(刘晨斌等, 2019),如四大家鱼(刘晓蕾, 2013);另一类是先由原始性腺发育为类卵巢结构,类卵巢继续发育为卵巢,结构退化的类卵巢则发育为精巢,称为不分化的雌雄异体型,如斑马鱼(王晶等, 2011)等。本研究结果显示,拟赤梢鱼原始性腺在孵化后40 d时,出现椭圆形和梭形2种形态差异显著的原始性腺;孵化后45 d的椭圆形性腺首次出现卵巢腔结构,标志着卵巢分化的开始;75 d时,梭形性腺中出现精细小管及精原细胞,标志着精巢分化形成。在拟赤梢鱼性腺分化期间,未发现类卵巢结构特征的原始性腺,因此,本研究认为拟赤梢鱼性腺分化方式属于可分化的雌雄异体型。
鱼类性腺分化的时间存在种属差异,青鳉(Oryzias latipes)(张静, 2013)在孵化后5~10 d发生性腺分化,人工养殖的中华鲟(Acipense sinensis)(陈细华等, 2004)性腺直至9月龄才开始分化,而同属鲤科鱼类的鲫鱼(Carassius auratus)(岳敏娟等, 2009)与拟赤梢鱼性腺分化时间相近,在2月龄开始出现分化。此外,大多数硬骨鱼类卵巢分化要早于精巢分化(Rasmussen et al, 2006),如黄河鲤(Cyprinus carpio)(Jiang et al, 2019)、花鲈(Lateolabrax maculatus)(李冰玉等, 2021);在本研究中拟赤梢鱼卵巢分化较精巢早约30 d。
拟赤梢鱼及其他硬骨鱼类和哺乳动物的sox3基因同源比较和系统进化树分析结果表明,拟赤梢鱼sox3基因与硬骨鱼类聚为一簇,且SOX3蛋白与同属鲤科鱼类翘嘴鲌和斑马鱼SOX3蛋白的HMG结构域高度一致,亲缘关系最近,这表明sox3基因在进化上具有一定保守性。拟赤梢鱼SOX3蛋白三维结构与Hou等(2017)报道SOX3蛋白结构相一致,3个α螺旋组成的空间结构是一个L型,便于结合DNA分子。HMG结构域能够识别DNA特异性结合位点,SOX蛋白可以依靠HMG与目的DNA结合,进而调节目的基因的转录(贺超等, 2017),其高度保守性保证了sox3基因在不同物种间功能的发挥。
sox3基因参与生物体性腺分化与发育的整个过程,在性别分化和性腺发育中起着不可或缺的作用(Cheah et al, 2015)。目前,关于sox3基因在鱼类性腺发育中的具体功能还存在一定的争议。在许氏平鲉(Sebastes schlegelii)卵巢分化和卵子发生时,sox3基因发挥着重要作用(Ma et al, 2019);而在黑鲷(Acanthopagrus schlegelii)中的sox3基因在精巢中表达量强于卵巢(Shin et al, 2009)。本研究中检测到sox3基因在拟赤梢鱼卵巢中表达量最高,脑次之,其次是眼睛,在精巢等其他组织中均微量表达,具有显著的组织特异性;切片结果可知,卵巢分化早于精巢,孵化后75 d精巢出现分化,在该时期同时存在未分化性腺、卵巢和精巢3种类型性腺,sox3基因在卵巢中的表达显著高于未分化性腺,而在精巢中的表达处于较低水平,由不同性腺类型表达差异推测,sox3基因可能在拟赤梢鱼卵巢分化过程中发挥一定作用。拟赤梢鱼孵化后160 d,卵巢发育开始进入Ⅱ期,此时sox3基因转录水平显著升高,显著高于成熟期卵巢,在精巢中始终持续低水平表达,由组织特异性结果显示,sox3基因在维持拟赤梢鱼卵巢发育过程中可能发挥更重要的作用。这与斑马鱼中的研究结果相一致(Qiang et al, 2019)。sox3基因同样参与斜带石斑鱼(Epinephelus coioides)卵巢发生和功能维持,在其未成熟卵巢中大量表达,在卵母细胞成熟期微弱表达(姚波等, 2003)。
sox3基因还广泛参与软骨组织生成、血细胞形成以及心脏和神经系统发生发育等(郭稳杰等, 2014)。本研究结果显示,sox3基因在拟赤梢鱼眼睛和脑组织中存在较高表达,这与之前的报道相一致(Kamachi et al, 2013)。推测sox3基因参与鱼类眼睛晶状体和神经系统的发生发育。
CHEAH P S, THOMAS P Q. sox3 expression in the glial system of the developing and adult mouse cerebellum. SpringerPlus, 2015, 1(4): 400-407 |
CHEN X H, WEI Q W, YANG D G, et al. Histological studies on gonadal origin and differentiation of cultured Acipenser sinensis. Journal of Fisheries of China, 2004, 28(6): 633-639 [陈细华, 危起伟, 杨德国, 等. 养殖中华鲟性腺发生与分化的组织学研究. 水产学报, 2004, 28(6): 633-639 DOI:10.3321/j.issn:1000-0615.2004.06.005] |
GUO W J, YU X M. Cloning and sequence evolution analysis of sox genes in bighead carp (Aristichthys nobilis). Acta Hydrobiologica Sinica, 2014, 38(4): 664-668 [郭稳杰, 俞小牧. 鳙sox基因克隆及序列进化分析. 水生生物学报, 2014, 38(4): 664-668] |
HE C, HONG G, WU J X, et al. Study on cloning and tissue expression of sox9 in Betta splendens. Journal of Anhui Agricultural Sciences, 2017, 45(8): 151-155 [贺超, 洪广, 吴静娴, 等. 泰国斗鱼sox9基因的克隆及组织表达研究. 安徽农业科学, 2017, 45(8): 151-155 DOI:10.3969/j.issn.0517-6611.2017.08.051] |
HOU L, SRIVASTAVA Y, JAUCH R. Molecular basis for the genome engagement by SOX proteins. Seminars in Cell Developmental Biology, 2017, 63: 2-12 DOI:10.1016/j.semcdb.2016.08.005 |
JIANG M, JIA S, CHEN J, et al. Timing of gonadal development and dimorphic expression of sex-related genes in gonads during early sex differentiation in the Yellow River carp. Aquaculture, 2020, 518: 734825 DOI:10.1016/j.aquaculture.2019.734825 |
KAMACHI Y, KONDOH H. SOX proteins: Regulators of cell fate specification and differentiation. Development, 2013, 140(20): 4129-4144 DOI:10.1242/dev.091793 |
LI B Y, WEN H S, WANG L Y, et al. Histology of gonadal differentiation and expression analysis of sex-related genes cyp11b and cyp19a1a in spotted sea bass (Lateolabrax maculatus). Progress in Fishery Sciences, 2021, 42(6): 185-193 [李冰玉, 温海深, 王灵钰, 等. 花鲈性腺分化组织学及性别相关基因cyp11b和cyp19a1a的表达分析. 渔业科学进展, 2021, 42(6): 185-193] |
LI M D. The ecology of economic fishes in China. Tianjin: Tianjin Science and Technology Press, 2011: 28-30 [李明德. 中国经济鱼类生态学. 天津: 天津科学技术出版社, 2011: 28-30]
|
LIU C B, XU G F, HUANG T Q, et al. A review of research progress on gonadal development in fish. Chinese Journal of Fisheries, 2019, 32(1): 46-54 [刘晨斌, 徐革锋, 黄天晴, 等. 鱼类性腺发育研究进展. 水产学杂志, 2019, 32(1): 46-54] |
LIU S Y. The occurrence and development of the testis and the sperm characteristics of Silurus asotus. Master´s Thesis of Henan Normal University, 2017 [刘淑琰. 鲇精巢发生、发育规律及其精子特性研究. 河南师范大学硕士研究生学位论文, 2017]
|
LIU X L. Primary studies on sex differentiation and the ovary development and oogenesis of Myxocyprinus asiaticus. Master´s Thesis of Southwest University, 2013 [刘晓蕾. 胭脂鱼性腺分化与卵巢发育和卵子发生的初步研究. 西南大学硕士研究生学位论文, 2013]
|
LIU Y Q, LI X H, LI Y F, et al. A histological study on gonadal development of black amur bream (Megalobrama terminalis). South China Fisheries Science, 2019, 15(1): 113-118 [刘亚秋, 李新辉, 李跃飞, 等. 广东鲂性腺发育组织学研究. 南方水产科学, 2019, 15(1): 113-118] |
MA L M, WANG W J, SHANG R J, et al. Characterization of sox3 gene in an ovoviviparous teleost, black rockfish (Sebastes schlegeli). Journal of Ocean University of China, 2019, 18(2): 431-440 DOI:10.1007/s11802-019-3803-z |
NAGASAWA K, FERNANDES J, YOSHIZAKI G, et al. Identification and migration of primordial germ cells in Atlantic salmon, Salmo salar: Characterization of vasa, dead end, and lymphocyte antigen 75 genes. Molecular Reproduction and Development, 2013, 80(2): 118-131 DOI:10.1002/mrd.22142 |
QIANG H, CONG L, YING R, et al. Loss-of-function of sox3 causes follicle development retardation and reduces fecundity in zebrafish. Protein Cell, 2019, 10(5): 347-364 DOI:10.1007/s13238-018-0603-y |
RAJAKUMAR A, SRNTHILKUMARAN B, et al. Expression analysis of sox3 during testicular development, recrudescence, and after hCG induction in catfish, Clarias batrachus. Sexual Development, 2014, 8(6): 376-386 DOI:10.1159/000368864 |
RASMUSSEN T H, JESPERSEN A, KORSGAARD B. Gonadal morphogenesis and sex differentiation in intraovarian embryos of the viviparous fish Zoarces viviparus (Teleostei, Percifrmes, Zoarcidae): A histological and ultrastructural study. Journal of Morphology, 2006, 267(9): 1032-1047 DOI:10.1002/jmor.10453 |
SHIN H S, AN K W, PARK M S, et al. Quantitative mRNA expression of sox3 and dmrt1 during sex reversal, and expression profiles after GnRHa administration in black porgy, Acanthopagrus schlegeli. Comparative Biochemistry and Physiology, B: Biochemistry and Molecular Biology, 2009, 154(1): 150-156 |
WANG J, WANG B, LI J T, et al. Histologicals observation of zebrafish gonads developments. Genomics and Applied Biology, 2011, 30(2): 168-174 [王晶, 王冰, 李纪同, 等. 斑马鱼性腺发育的组织学观察. 基因组学与应用生物学, 2011, 30(2): 168-174] |
WU S F, ZHANG Y, MA B, et al. Evaluation of nutritional quality and proximate composition in the muscle of Pseudaspius leptocephalus in Ussuri River. Journal of Biology, 2016, 33(6): 52-56 [吴善福, 张颖, 马波, 等. 乌苏里江拟赤梢鱼肌肉营养成分分析与品质评价. 生物学杂志, 2016, 33(6): 52-56] |
XU K, YANG H B, PAN H, et al. Function and mutation of sox3 gene. Chinese Journal of Health Laboratory Technology, 2017, 27(8): 1214-1216 [许可, 阳洪波, 潘慧. sox3基因的功能及其突变. 中国卫生检验杂志, 2017, 27(8): 1214-1216] |
YANG J, GENG L W, WANG Y, et al. Embryonic and larval-juvenile developmental characteristics of Pseudaspius leptocephalus. Acta Hydrobiologica Sinica, 2021, 45(3): 636-644 [杨建, 耿龙武, 王雨, 等. 拟赤梢鱼的胚胎发育和仔稚鱼生长特性观察. 水生生物学报, 2021, 45(3): 636-644] |
YAO B, ZHOU L, GUI J F. Studies on cDNA cloning and temporal and spatial expression of sox3 gene in grouper Epinephelus coioides. High Technology Letters, 2003, 13(5): 74-81 [姚波, 周莉, 桂建芳. 斜带石斑鱼sox3基因cDNA的克隆及其时空表达特征分析. 高技术通讯, 2003, 13(5): 74-81] |
YOU X R. Histological studies on the origin and migration of the primordial germ cells and gonadal sex differentiation in large yellow croaker Larimichthys crocea. Master´s Thesis of Jimei University, 2012 [游秀荣. 大黄鱼原始生殖细胞发生、迁移及性腺性别分化的组织学研究. 集美大学硕士研究生学位论文, 2012]
|
YUE M J, YOU Y L, LIN D. The influence of temperature on sex differentiation of Carassius auratus. Chinese Journal of Zoology, 2009, 44(1): 9-16 [岳敏娟, 尤永隆, 林丹. 温度对鲫鱼性腺分化的影响. 动物学杂志, 2009, 44(1): 9-16] |
ZHANG J. Expression analysis of dmy and dmrt1, involved in gonad sexual differentiation and histological observation of Medaka, Oryzias latipes, gonadal sex development. Master´s Thesis of Shanghai Ocean University, 2013, 26 [张静. 青鳉性腺发育的组织学观察和dmy、dmrt1基因的表达分析. 上海海洋大学硕士研究生学位论文, 2013, 26]
|
ZHANG J M. Fishes of Heilongjiang Province. Harbin: Heilongjiang Science and Technology Press, 1995: 243-245 [张觉民. 黑龙江省鱼类志. 哈尔滨: 黑龙江科学技术出版社, 1995: 243-245]
|
ZHANG X Y, JIAO B W, WU T L, et al. Histological observation on gonadal sex differentiation in the southern catfish, Silurus meridionalis. Chinese Journal of Zoology, 2005, 40(1): 41-48 [张修月, 焦保卫, 吴天利, 等. 南方鲶性腺分化的组织学观察. 动物学杂志, 2005, 40(1): 41-48] |
ZHANG Y, MA B, ZHANG Y Q, et al. Artificial method of oxytocin in Pseudaspius leptocephalus, CN105340791A. 2016–2–24 [张颖, 马波, 张永泉, 等. 拟赤梢鱼人工催产 方法, CN105340791A. 2016-2-24]
|



