2. 浙江万里学院生物与环境学院 浙江省水产种质资源高效利用技术研究重点实验室 浙江 宁波 315000;
3. 上海海洋大学 水产种质资源发掘与利用教育部重点实验室 上海 201306
2. Key Laboratory of Aquatic Germplasm Resource of Zhejiang, College of Biological and Environmental Sciences, Zhejiang Wanli University, Ningbo 315000, China;
3. Key Laboratory of Exploration and Utilization of Aquatic Genetic Resources, Ministry of Education, Shanghai Ocean University, Shanghai 201306, China
贝类作为一种无脊椎动物,体内不存在特异性免疫细胞和相应的抗体,主要依靠先天性免疫系统发挥免疫功能。先天性免疫反应的第一步是通过模式识别受体(pattern recognition receptor, PRR)来感知病原体相关的分子模式(pathogen associated molecular pattern, PAMP),启动特定的信号通路,抵御病原体的入侵(Medzhitov, 2007)。Toll样受体(Toll-like receptor, TLR)是研究最广泛和深入的模式识别受体之一,在先天性免疫系统中发挥着重要功能。果蝇(Drosophila melanogaster)的Toll-1是第一个被发现的TLR,其通过激活转录因子NF-κB信号通路来指导胚胎的早期发育(Medzhitov et al, 1998),随后证实Toll基因在果蝇抗感染免疫方面也发挥重要的作用(Lemaitre et al, 1997)。典型的TLR蛋白包括3个主要的结构域,一是富含亮氨酸重复序列(leucine-rich repeat, LRR)的胞外结构域;二是跨膜结构域(transmembrane domain, TMD);三是含有TIR (Toll/interleukin-1 receptor)的胞内结构域。根据其胞外结构域的变化,TLR可分为两大类:单半胱氨酸簇TLR (single cysteine cluster TLR, sccTLR)和多半胱氨酸簇TLR (multiple cysteine cluster TLR, mccTLR),sccTLR的特征是在LRR的C-末端存在1个与细胞膜并列的半胱氨酸簇,而mccTLR胞外结构域具有2个或更多的半胱氨酸簇(Leulier et al, 2008)。Brennan等(2018)推测,mccTLR起源于刺胞动物门(Cnidaria),而sccTLR类群在软体动物门(Mollusca)显著扩张,TLR在低等生物体中具有免疫和发育双重功能。
TLR基因作为先天免疫的重要组成部分,在脊椎动物中受到广泛研究,但海洋无脊椎动物TLR的分子特征和功能的研究仍处于初步阶段。相对于脊椎动物,海洋无脊椎动物基因组中TLR数目均存在不同程度的扩张现象。前期的研究表明,在文昌鱼(Branchiostoma floridae)和海胆(Strongylocentrotus purpuratus)中分别鉴定出72个和222个TLR (Satake et al, 2012);Toubiana等(2013)在地中海贻贝(Mytilus galloprovincialis)中通过转录组数据鉴定出23个TLR,其中,3个TLR为mccTLR,其他TLR均属于sccTLR;Zhang等(2015)从长牡蛎(Crassostrea gigas)基因组中注释得到83个TLR,根据蛋白结构域的特点,将其分为V、P、sP、sPP和Ls共5种类型,其中19个TLR在病毒和细菌的刺激下差异表达;Gorbushin (2020)从厚壳玉黍螺(Littorina littorea)血细胞转录组中鉴定出43个TLR,根据TLR蛋白的最新分类标准,将它们分为V型和Twin-TIR型两类;除此之外,Ren等(2021)从菲律宾蛤仔(Ruditapes philippinarum)转录组文库中鉴定出8个TLR,并将其分为V、P、sP和Ls型。
贝类生活在水体中,易受病原菌的感染,如弧菌(Vibrio)和病毒对贝类养殖产业产生极大危害并造成严重的经济损失(张颖雪等, 2020; 白昌明等, 2021)。缢蛏(Sinonovacula constricta)是我国传统的四大海水养殖贝类之一,广泛分布于西太平洋沿岸的潮间带和河口水域(Zhao et al, 2017)。然而,随着养殖环境恶化及各种细菌病毒病的暴发,给缢蛏养殖产业带来较大的经济损失,因此,深入了解缢蛏的免疫防御机制有利于制定有效的抗病策略。先前的研究表明,副溶血弧菌(Vibrio parahemolyticus)感染后,缢蛏鳃和肝胰腺组织中部分免疫相关的基因发生了应答(Zhao et al, 2017);急性高温胁迫下缢蛏的免疫反应也会发生很大的变化(孔祥辉等, 2022)。然而,对缢蛏免疫相关信号通路的研究仍相对较少,仅少数免疫基因被克隆和表征,如组织蛋白酶(Niu et al, 2013a、b)、纤维蛋白原相关蛋白(Wu et al, 2021)、肽聚糖识别蛋白(Meng et al, 2022)以及C-型凝集素(Xu et al, 2020)等。本文通过对缢蛏全基因组中TLR基因的鉴定和分类、其组织表达模式的分析以及副溶血弧菌感染前后其在鳃和肝胰腺免疫组织的表达变化研究,进一步了解缢蛏TLR基因的扩张现象,并为深入探讨不同TLR基因在缢蛏天然免疫中发挥的作用提供研究基础。
1 材料与方法 1.1 缢蛏TLR基因鉴定基于已有的缢蛏全基因组数据(Dong et al, 2020),对TLR家族基因进行全基因组范围内的鉴定。从Pfam蛋白质家族数据库(http://pfam.xfam.org/)查询TIR结构域(PF01582)和LRR结构域(PF13855)的Pfam编号,基于缢蛏全基因组编码基因蛋白序列的InterProScan分析结果文件,根据Pfam编号,对同时包含LRR和TIR两种结构域的蛋白编码基因进行检索。利用检索获得的基因蛋白序列作为种子序列,通过TBLASTN程序在全基因组DNA序列内进一步鉴定出基因组注释过程中未正确注释出的TLR基因。通过SMART网站(http://smart.embl-heidelberg.de/)对已鉴定的TLR蛋白结构域进一步分析和确认,结构域对比结果阈值设定为E < 1×10–5。完整的TLR蛋白序列应该至少由LRR和TIR两个结构域组成,且具有较高的序列保守性。对于蛋白结构域不完整的TLR基因,利用Softberry网站(http://www.softberry.com/)的FGENESH+在线基因预测程序,利用基因组序列对其基因结构进行校正。基于校正后的基因序列进行数据分析(缢蛏TLR基因cDNA和蛋白序列见https://figshare.com/s/958beb427d81530b78a0)。
1.2 软体动物TLR家族基因的比较和系统发育分析对软体动物4个纲9个代表物种[多板纲:石鳖(Acanthopleura granulate);头足纲:中国真蛸(Octopus vulgaris);腹足纲:加州海兔(Aplysia californica)、福寿螺(Pomacea canaliculata)、霸王莲花青螺(Lottia gigantean);双壳类:栉孔扇贝(Chlamys farreri)、马氏珠母贝(Pinctada martensi)、美洲牡蛎(Crassostrea virginica)、长牡蛎]的TLR家族基因进行分类,并与缢蛏TLR基因分类进行比较。TLR基因分类基于其蛋白结构域序列,根据Gerdol等(2017)提出的方法进行分类。本研究9种软体动物校正的TLR蛋白序列参考王璐等(2021)。
获取缢蛏全长TLR蛋白序列中保守的TIR结构域,利用ClustalW (Thompson et al, 1994)对TIR蛋白序列进行多重序列比对,然后再利用MEGA7软件(Kumar et al, 2016)基于邻接法(neighbor-joining method, NJ)构建系统发育树,使用P-distance模型及Bootstrap抽样自展法估算进化树分支节点的支持率,重复数为1 000。系统发育树结果用iTOL (https://itol.embl.de/index.shtml)(Letunic et al, 2016)进行可视化。
1.3 实验样品与组织收集本实验所用缢蛏的平均壳长为(6.7±0.2) cm,湿重为(12.0±0.5) g,采自浙江省台州市三门县。实验前,将缢蛏在水温为20 ℃、盐度为20的海水中暂养1周,然后随机挑选9只健康个体,用1 mL的注射器从闭壳肌采集血淋巴,立即于4 ℃ 800 g离心10 min,弃上清液,获得血细胞。加入1 mL TRIzol (诺唯赞R401-01)重悬血细胞,提取血细胞总RNA。然后再收集外套膜、斧足、水管、鳃、性腺和肝胰腺等组织样品,放入RNase-free的离心管中,立即液氮速冻,然后放入–80 ℃冰箱保存备用。将60只规格一致、暂养1周的缢蛏随机分为2组,即细菌攻毒组和对照组,每组各30只。用1 mL注射器向攻毒组缢蛏的斧足中注射100 μL PBS稀释后浓度为1×108 CFU/mL的副溶血弧菌,对照组注射相同体积的PBS无菌缓冲液。于注射后12 h和48 h后分别从实验组和对照组随机选取6只缢蛏,收集鳃和肝胰腺组织,提取总RNA,每组选取3只缢蛏合格RNA用于转录组文库的构建和测序。
1.4 RNA的提取使用TRIzol (诺唯赞R401-01)提取缢蛏各组织总RNA,NanoDrop 2000 (Thermo Scientific, 美国)和1%琼脂糖凝胶电泳分别检测其浓度和完整性。将提取的RNA放入–80 ℃冰箱保存备用。
1.5 实时荧光定量PCR分析为探究缢蛏TLR基因在成体组织中的表达模式,从33个结构域完整的TLR基因中随机选取6个基因,分别为mccTLR类中的ctg294.3 (sPP型)、ctg1017.8 (sPP型)和ctg1228.10 (P型)及sccTLR类中的ctg1513.3 (Ls型)、ctg5741.1 (sP型)和ctg169.28 (Ls型)。利用实时荧光定量PCR (qRT-PCR)技术对其在健康成体组织中的表达水平进行定量分析。具体步骤如下:将缢蛏7种组织的RNA,分别利用HiScript® Ⅱ Q RT SuperMix for qPCR (诺唯赞R223-01)试剂盒反转录成cDNA,然后以18S rRNA为内参基因,进行qRT-PCR定量(表 1)。定量反应利用ChamQ Universal SYBR qPCR Master Mix预混液(诺唯赞Q712),在Roche LightCycler® 480Ⅱ荧光定量PCR系统上进行。反应体系:10 μL 2× SYBR qPCR Master Mix,0.4 μL正向引物(0.4 μmol/L),0.4 μL反向引物(0.4 μmol/L),2 μL cDNA模板,ddH2O补至20 μL。采用两步法程序进行反应:95 ℃预变性30 s;95 ℃变性10 s,60 ℃退火和延伸30 s,进行40个循环。健康缢蛏组织TLR基因的表达模式分析,以血细胞中阈值循环数(CT值)作为对照,计算TLR在其他组织(实验组)中的表达水平。将血细胞(对照组)和其他组织(实验组)的mRNA表达水平标准化到同一样本的18S rRNA基因表达水平。实验重复3次,以2–∆∆CT法计算基因的表达量。使用GraphPad Prism 8.4.3软件进行单因素方差分析(one-way ANOVA)及作图,其中,P < 0.05表示差异显著,P > 0.05表示差异不显著。
|
|
表 1 实时荧光定量PCR引物 Tab.1 Sequence of primers used for qRT-PCR |
将转录组测序得到的干净读段(clean reads)使用HISAT2软件将比对到缢蛏参考基因组上(Mortazavi et al, 2008),然后,根据比对结果利用FeatureCounts统计每个基因上的读段数目(Liao et al, 2014)。最后,利用DESeq2进行不同样品组间差异基因表达分析(Love et al, 2014),从分析结果中检索42个TLR基因的表达量数据绘制热图,根据差异表达基因绘制维恩图。差异表达标准为|log2FoldChange| > 1且P < 0.05 (TLR基因在不同样品中表达量的具体数值和统计分析结果见https://figshare.com/s/958beb427d81530b78a0)。
2 结果与分析 2.1 缢蛏TLR家族基因全基因组水平的鉴定基于氨基酸序列的相似性和蛋白结构域的组成,本研究在缢蛏全基因组序列中共鉴定出42个TLR基因(表 2)。通过对结构域编码不完整的TLR基因利用FGENESH+基因预测程序在基因组序列层面进行校正,并结合SMART网站对TLR蛋白结构域分析,结果显示,33个TLR蛋白具有LRR结构域、跨膜结构域和胞内TIR结构域,为典型的完整TLR蛋白,其他9个为TLR样蛋白,其中,4个TLR蛋白缺乏胞内TIR结构域,2个缺乏跨膜结构域,1个缺乏LRR结构域,其他2个缺乏TIR和TM结构域或LRR和TM结构域。
|
|
表 2 缢蛏全基因组中鉴定出的TLRs Tab.2 TLRs identified in the genome of Sinonovacula constricta |
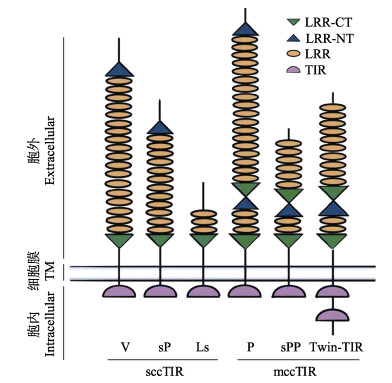
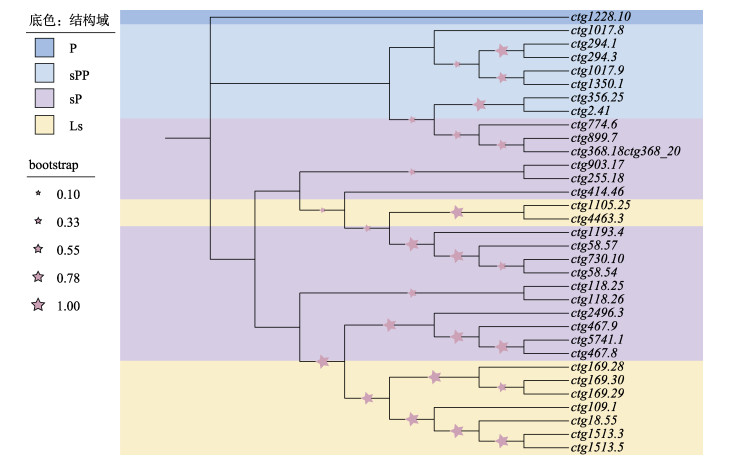
基于胞外LRR结构域的特征,软体动物TLR可以分为两大类:sccTLR和mccTLR,并进一步细分为6个亚类(图 1),其中,sccTLR包括3个亚类:(1) V型TLR,经典的sccTLR,其N端和C端的LRR结构域(LRR-NT和LRR-CT)位于LRR两侧;(2) sP型TLR,类似于V型TLR,但略短;(3) Ls型TLR,无LRR-NT结构域,胞外为不规范或退化的LRR结构域。mccTLR也分为3个亚类:(4) P型TLR,类似于果蝇Toll基因,其特征是典型的2个LRR结构域被LRR-NT和LRR-CT结构域分隔;(5) sPP型TLR,类似于P型TLR,但略短;(6) Twin-TIR型TLR,类似于P型和sPP型TLR,但具有2个连续的TIR结构域(Gerdol et al, 2017)。此外,对于缺乏LRR或者TIR结构域的蛋白统称为TLR样蛋白(TLR-like protein) (Brennan et al, 2018)。缢蛏42个TLR基因包括25个sccTLR、8个mccTLR和9个TLR样蛋白(表 2)。为了更好地研究缢蛏TLR家族基因的结构和系统演化关系,将缢蛏33个完整TLR蛋白基于TIR结构域序列构建系统发育树。根据TLR结构域注释及系统发育分析发现,缢蛏的33个完整TLR分属在4个亚类,分别为P型、sPP型、sP型和Ls型,其中,sP和Ls型TLR分散于进化树不同的亚支(图 2)。
|
图 1 不同亚类TLR蛋白结构域模式 Fig.1 Pattern of protein domains in different subtype of TLRs LRR:亮氨酸重复序列;LRR-CT:LRR的C末端;LRR-NT:LRR的N末端;TIR:TIR结构域。 LRR: Leucine-rich repeat; LRR-CT: C-terminus of the LRR; LRR-NT: N-terminus of the LRR; TIR: Toll/interleukin-1 receptor domain. |
|
图 2 缢蛏32个完整TLR的分类及系统发育树 Fig.2 Classification and phylogenetic tree of 32 complete TLRs identified in the genome of S. constricta |
基于TLR蛋白结构域特点,并根据Gerdol等(2017)提出的TLR分类方法,进行包括缢蛏在内的10种软体动物TLR家族基因分类和数目比较(表 3)。从表 3可以看出,缢蛏中不存在V型和Twin-TIR型TLR,且sccTLR数目多于mccTLR,其中,sccTLR中的sP型TLR最多,有16个;而mccTLR中的P型TLR与大多数软体动物一样数目较少,仅有1个。此外,缢蛏中存在9个TLR样蛋白,这在大部分软体动物中都有发现,如长牡蛎和马氏珠母贝中分别有6个和11个。通过对10种软体动物TLR家族基因分类和数目比较可以看出,不同软体动物的TLR基因的数目存在较大差异,腹足纲的霸王莲花青螺仅有16个TLR,而双壳纲的美洲牡蛎却有高达130个TLR;作为同属的长牡蛎和美洲牡蛎,其TLR的数目也存在较大差异,长牡蛎有83个TLR;除此之外,Ls型和sP型TLR在软体动物中占主导地位,与其他类型的TLR相比数目明显偏多,且存在于脊椎动物中的V型TLR在部分软体动物中也存在,但数量较少,在1~4个之间。
|
|
表 3 软体动物TLR基因的分类 Tab.3 Classification of TLR genes in molluscs |
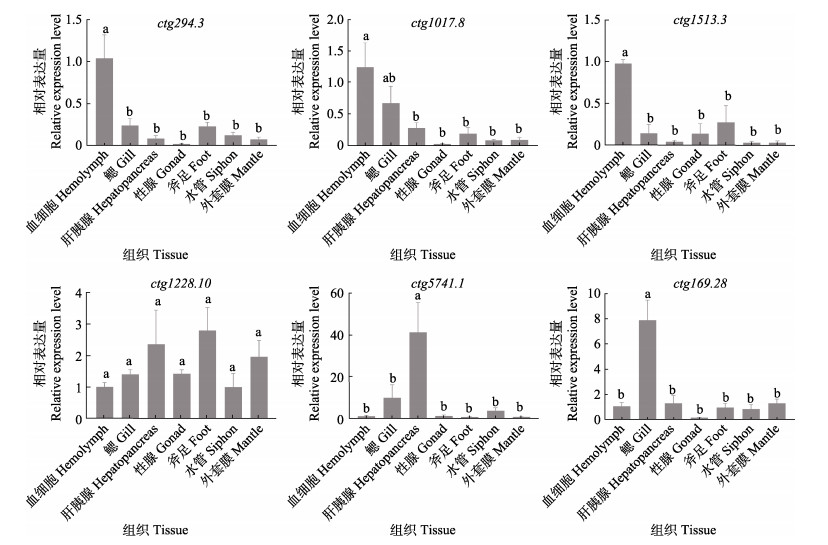
TLR基因成体组织表达特征分析结果显示,6个TLR基因在所检测的7个组织中,包括血细胞、鳃、肝胰腺、性腺、斧足、外套膜和水管中均有不同程度的表达(图 3)。其中,ctg294.3 (sPP型)、ctg1017.8 (sPP型)和ctg1513.3 (Ls型) 3个基因均在血细胞中显著高表达(P < 0.05),其次是鳃,而在水管、外套膜和性腺等组织中表达量较低(P > 0.05)。除血细胞外,ctg294.3和ctg1513.3的表达量在其他组织间差异不显著,而ctg1017.8鳃组织与其他组织差异较显著(P < 0.05)。ctg5741.1 (sP型)和ctg169.28 (Ls型) 2个基因分别在肝胰腺和鳃中表达量最高(P < 0.05),在斧足和性腺中表达较低(P > 0.05),而ctg1228.10 (P型)基因在各组织中广泛表达,表达水平不存在显著性差异。TLR基因成体组织表达模式与其结构特征未表现出相关性。
|
图 3 缢蛏6个TLR基因在不同组织中的相对表达水平 Fig.3 Relative expression level of six TLR genes in the different tissues of S. constricta 相同字母代表差异不显著(P > 0.05),不同字母代表差异显著(P < 0.05)。 The same letters indicate no significant difference (P > 0.05), while different letters indicate significant difference (P < 0.05). |
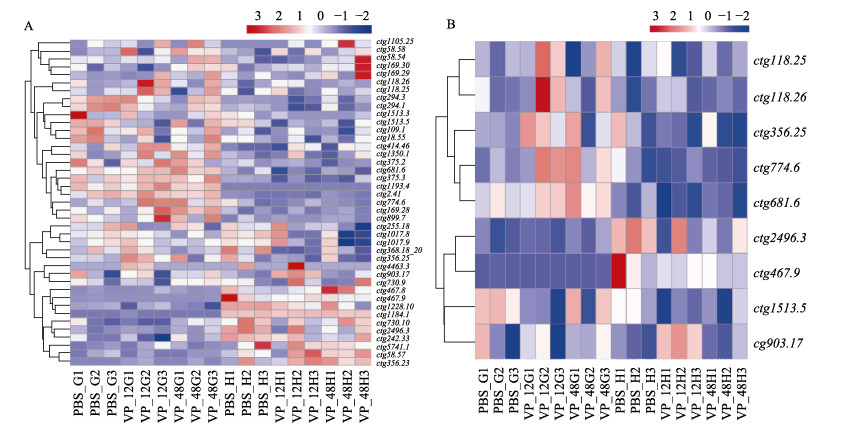
根据转录组中基因表达水平数据,绘制TLR基因表达热图(图 4A),可以看出,在PBS对照组中,42个基因中41个基因均有表达(FPKM > 1),但不同基因表达模式有明显的差别,有些基因只在1种组织(鳃或肝胰腺)中明显表达,有些基因在2种组织(鳃和肝胰腺)中均明显表达。如ctg1184.1在肝胰腺中高表达(PBS_H组3个重复FPKM值分别为1 672、1 370和2002),鳃中几乎不表达(PBS_G组3个重复FPKM值分别为0.027、0和0.029);ctg2.41在鳃中明显表达(PBS_G组3个重复FPKM值分别为3.04、9.33和12.97),肝胰腺中几乎不表达(PBS_H组3个重复FPKM值分别为0.49、0.43和0.07),而ctg356.25在鳃和肝胰腺中均有表达(PBS_G组3个重复FPKM值分别为2.86、2.77和2.23;PBS_H组3个重复FPKM值分别为6.01、3.08和1.43)。在弧菌感染实验组中,一些TLR基因在弧菌感染12 h和/或48 h后在鳃或肝胰腺中的表达量发生了变化,根据差异表达基因筛选标准,共有9个TLR基因在鳃或肝胰腺中的表达量发生了显著变化。差异基因表达热图(图 4B)显示,感染弧菌后,5个基因(ctg118.25、ctg118.26、ctg356.25、ctg774.6和ctg681.6)在鳃组织中表达量上调,前4个基因在感染12 h变化较显著,仅ctg681.6在感染48 h变化较显著;ctg1513.5在感染弧菌后的鳃组织表达量下调且12 h变化较显著;ctg903.17、ctg467.9和ctg2496.3在弧菌感染后的肝胰腺中表达量显著变化,其中,ctg2496.3和ctg467.9表达量下调且48 h较为显著,ctg903.17表达量上调且12 h较为显著。
|
图 4 TLR基因在鳃和肝胰腺中的表达量热图(A)和不同组间差异表达基因的表达量热图(B) Fig.4 Heat map of TLR expression level in gill and hepatopancreas (A) and heat map of genes deferentially expressed between different groups (B) PBS_G:对照组鳃组织;PBS_H:对照组肝胰腺;VP_12G:副溶血弧菌感染12 h鳃组织;VP_48G:副溶血弧菌感染48 h鳃组织;VP_12H:副溶血弧菌感染12 h肝胰腺;VP_48H:副溶血弧菌感染48 h肝胰腺。 PBS_G: Gill of control group; PBS_H: Hepatopancreas of control group; VP_12G: Gill of Vibrio parahemolyticu (VP) infection for 12 h; VP_48G: Gill of VP infection for 48 h; VP_12H: Hepatopancreas of VP infection for 12 h; VP_48H: Hepatopancreas of VP infection for 48 h. |
在长期进化过程中,海洋无脊椎动物已进化出独特的免疫防御体系,如通过免疫基因的大量扩张等策略来适应环境。TLR是模式识别受体家族中的重要一员,它可以特异地识别病原体相关的分子模式,激活信号级联反应,释放各种细胞因子和干扰素来消除病原微生物,在抵御病原微生物过程中发挥重要作用。本研究利用基因组数据鉴定了缢蛏的TLR,并对其进行了特征分析和分类。和大多数软体动物一样,缢蛏基因组中的TLR数目也发生了显著性扩张,共鉴定出42个TLR,其中33个TLR具有LRR结构域,跨膜结构域和胞内TIR结构域,为典型的TLR蛋白,而剩余的9个TLR结构域不完整,称为TLR样蛋白,可能是基因组序列不完整,或是基因长期进化过程中结构域丢失造成的。
根据TLR蛋白结构域注释及系统发育分析,缢蛏的TLR分为mccTLR和sccTLR两大类,mccTLR进一步分为P型和sPP型,而sccTLR进一步分为Ls和sP型,缢蛏基因组中未发现其他软体动物中存在的V型和Twin-TIR型TLR (表 3)。mccTLR典型的特征为LRR被LRR-NT和LRR-CT结构域分隔,而sccTLR中单个LRR-NT和LRR-CT结构域位于典型的LRR两侧。由于结构上的差异,mccTLRs和sccTLRs一直被认为具有独立的起源(Luo et al, 2000)。从图 2可以看出,sPP、sP和Ls型TLR在缢蛏中均发生明显的扩张现象,其中sP型TLR的扩张占主导地位,这与长牡蛎TLR的扩张现象一致(Zhang et al, 2015)。缢蛏中TLR的扩张现象证实了TLR在宿主免疫防御中功能的多样化和复杂性。
为进一步了解软体动物不同类型TLR的扩张现象,根据Gerdol等(2017)提出的TLR分类方法,本研究对软体动物4个纲10个代表物种的TLR进行分类。P型TLR与昆虫Toll具有高度的结构相似性,支持所有无脊椎动物P型TLR共同起源的假设(Toubiana et al, 2013)。软体动物中仅有少量的P型TLR (表 3),如缢蛏和长牡蛎基因组中分别有1个和2个P型TLR,表明这类TLR在软体动物中没有经历过扩张。先前的研究表明,sPP型TLR是一个基因数目相对较少的TLR类型,如长牡蛎中仅有2个sPP型TLR (Zhang et al, 2015);在这10种软体动物中,sPP型TLR数量不等,在1~13个之间,数目变化较大,马氏珠母贝和福寿螺中sPP型TLR数量分别为12和13个。目前,sPP型TLR在软体动物中的功能尚不清楚。Twin-TIR型TLR为mccTLR的新成员,其存在2个连续的胞内TIR结构域,三角帆蚌(Hyriopsis cumingii) Toll-2为贝类中发现的第1个Twin-TIR型TLR,其能够通过诱导AMP的表达参与抗菌免疫反应(Ren et al, 2014)。目前,仅在少数软体动物中发现Twin-TIR型TLR。sccTLR为起源较晚的TLR类群。与P型TLR类似,V型TLR与其他动物门包括脊椎动物门中发现的sccTLR也显示出惊人的相似性(Gerdol et al, 2017),而在软体动物中,仅在少数动物中鉴定出少量的V型TLR,缢蛏基因组中未发现V型TLR。除此之外,sP和Ls型TLR作为软体动物中数目最多的TLR类群,在10种软体动物中均发生了不同程度的扩张,可能是软体动物长期应对复杂多变的环境进化出的一类特殊的免疫机制,然而这类TLR具体的作用机制目前尚不清楚。根据Gerdol等(2017)提出的TLR分类原则,我们还发现了一些TLR蛋白不能归类到现有的TLR类型,定义为TLR样蛋白,其分类原则和功能有待进一步研究。综上所述,mccTLR作为起源古老的TLR类群,在无脊椎动物中的分布范围很广,在软体动物中没有经历大规模的扩张,而起源较晚的sccTLR类群在软体动物的进化中发生了大规模的扩张。本研究结果丰富了双壳类TLR的信息,并为进一步研究TLR在缢蛏非特异性免疫中的功能奠定了基础。
3.2 缢蛏TLR基因在成体组织中的表达特征作为重要的模式识别受体,TLR在动物非特异性免疫防御中发挥重要作用。在软体动物中,尽管不同的TLR一般在各个组织都有表达,但它们的表达水平有显著差异。如长牡蛎CgToll1和CgTLR6、皱纹盘鲍(Haliotis discus discus) AbTLR-A、栉孔扇贝CfToll-1、厚壳贻贝(Mytilus coruscus) McTLR2及菲律宾蛤仔8个RpTLR基因主要在血细胞中表达(Li et al, 2019; Priyathilaka et al, 2019; Qiu et al, 2007; Ren et al, 2021; Wang et al, 2016; Zhang et al, 2011), 而厚壳贻贝McTLRj在肝胰腺中表达水平最高,其次是鳃和血细胞,而性腺和外套膜中表达量中等,肝胰腺和闭壳肌中表达较弱(Xu et al, 2019)。皱纹盘鲍AbTLR-B主要在鳃中表达(Priyathilaka et al, 2019),三角帆蚌的HcToll1在血细胞、肝胰腺、鳃和外套膜中高表达(Ren et al, 2013),而三角帆蚌另一个新型HcTLR在所有组织中均广泛表达,在鳃和肝胰腺中表达水平较高(Yin et al, 2021)。为了检测缢蛏TLR基因的组织表达规律,我们从结构域编码完整的TLR基因中随机选择6个TLR,利用qRT-PCR技术检测其在健康缢蛏组织中的表达模式,结果显示,ScTLR在所有检测组织中广泛表达,其中,血细胞、鳃和肝胰腺中表达水平较高,而其他组织表达量差异不显著,这些ScTLR基因的不同表达谱可能暗示它们在缢蛏中发挥的功能不同。不同的TLR基因在血细胞或鳃中不同程度地呈现高表达水平,也证实了血细胞和鳃是软体动物中主要的免疫组织(Xu et al, 2019),同时也表明ScTLR可能在缢蛏的非特异性免疫防御中发挥重要作用。
3.3 缢蛏TLR基因对弧菌感染的响应根据缢蛏转录组数据,我们对TLR基因的表达量进行了分析,在鉴定的42个TLR基因中,41个基因在鳃或者肝胰腺中有表达,但表达量各不相同且具有明显的组织差异,这反映了鳃和肝胰腺组织在缢蛏免疫防疫反应中的分工。此外,有9个TLR在弧菌感染前后在鳃和肝胰腺中表达量发生显著变化,其中6个TLR表达量显著上调,可能在抵御弧菌的入侵过程中发挥了重要的作用,这与栉孔扇贝和厚壳贻贝中TLR的表达模式一致(Lu et al, 2016; Xu et al, 2019),而对于表达量显著下调的3个TLR,其在抵御病原菌的入侵中可能发挥了不同作用。总之,这些结果表明,在弧菌胁迫下缢蛏可能通过鳃和肝胰腺两种重要免疫器官中不同TLR基因的表达,协同控制下游免疫相关基因的表达,以达到免疫防御的效果。
4 结论本研究基于缢蛏全基因组序列,系统地鉴定出42个ScTLR基因,其中,33个编码典型的TLR蛋白,其他的9个为TLR样蛋白;根据其蛋白结构域的位置特点将其进一步分为P型、sPP型、sP型和Ls型4种类型。此外,通过与9种软体动物TLR蛋白比较,在缢蛏基因组中未发现其他软体动物中存在的V型和Twin-TIR型TLR;起源古老的mccTLR类群在软体动物中没有经历大规模的扩张,而起源较晚的sccTLR类群却发生了大规模的扩张。TLR基因组织表达水平检测结果显示,缢蛏TLR在血细胞或鳃组织中高表达,进一步证实血细胞和鳃是软体动物中主要的免疫组织。最后,弧菌胁迫下缢蛏鳃和肝胰腺转录组数据显示,41个TLR基因在鳃和肝胰腺中表达量各不相同且具有明显的组织差异,这反映了鳃和肝胰腺组织在缢蛏免疫反应中的分工;缢蛏可能通过鳃和肝胰腺2种重要免疫器官中不同TLR基因的表达,协同控制下游免疫相关基因的表达,以达到免疫防御的效果。本研究结果为深入探讨不同TLR基因在缢蛏天然免疫中发挥的作用提供了基础。
BAI C M, XIN L S, WANG C M. Malacoherpesviruses and their associated damages to mollusk aquaculture industry. Progress in Fishery Sciences, 2021, 42(1): 214-226 [白昌明, 辛鲁生, 王崇明. 软体动物疱疹病毒及其对贝类养殖产业的危害. 渔业科学进展, 2021, 42(1): 214-226 DOI:10.19663/j.issn2095-9869.20200527001] |
BRENNAN J J, GILMORE T D. Evolutionary origins of Toll-like receptor signaling. Molecular Biology and Evolution, 2018, 357: 1576-1587 |
DONG Y, ZENG Q, REN J, et al. The chromosome-level genome assembly and comprehensive transcriptomes of the razor clam (Sinonovacula constricta). Frontiers in Genetics, 2020, 11: 664 DOI:10.3389/fgene.2020.00664 |
GERDOL M, VENIER P, EDOMI P, et al. Diversity and evolution of TIR-domain-containing proteins in bivalves and Metazoa: New insights from comparative genomics. Developmental and Comparative Immunology, 2017, 70: 145-164 DOI:10.1016/j.dci.2017.01.014 |
GORBUSHIN A M. Toll-like signaling pathway in the transcriptome of Littorina littorea. Fish and Shellfish Immunology, 2020, 106: 640-644 DOI:10.1016/j.fsi.2020.08.012 |
KONG X H, WANG S S, DONG Y H, et al. Analysis of expression characteristics of related genes in response to acute thermal stress in the razor clam Sinonovacula constricta. Progress in Fishery Sciences, 2022, 43(2): 194-203 [孔祥辉, 王莎莎, 董迎辉, 等. 缢蛏急性高温胁迫应答主要候选基因的表达特征分析. 渔业科学进展, 2022, 43(2): 194-203 DOI:10.19663/j.issn2095-9869.20201223002] |
KUMAR S, STECHER G, TAMURA K. MEGA7: Molecular evolutionary genetics analysis version 7. 0 for bigger datasets. Molecular Biology and Evolution, 2016, 337: 1870-1874 |
LEMAITRE B, REICHHART J M, HOFFMANN J A. Drosophila host defense: Differential induction of antimicrobial peptide genes after infection by various classes of microorganisms. Proceedings of the National Academy of Sciences of the United States of America, 1997, 94(26): 14614-14619 |
LETUNIC I, BORK P. Interactive Tree of Life (iTOL) v3: An online tool for the display and annotation of phylogenetic and other trees. Nucleic Acids Research, 2016, 44(W1): W242-W245 DOI:10.1093/nar/gkw290 |
LEULIER F, LEMAITRE B. Toll-like receptors: Taking an evolutionary approach. Nature Reviews Genetics, 2008, 9(3): 165-178 DOI:10.1038/nrg2303 |
LI Y F, LIU Y Z, CHEN Y W, et al. Two Toll-like receptors identified in the mantle of Mytilus coruscus are abundant in haemocytes. Fish and Shellfish Immunology, 2019, 90: 134-140 DOI:10.1016/j.fsi.2019.05.001 |
LIAO Y, SMYTH G K, SHI W. FeatureCounts: An efficient general purpose program for assigning sequence reads to genomic features. Bioinformatics, 2014, 30(7): 923-930 DOI:10.1093/bioinformatics/btt656 |
LOVE M I, HUBER W, ANDERS S. Moderated estimation of fold change and dispersion for RNA-seq data with DESeq2. Genome Biology, 2014, 15(12): 550 DOI:10.1186/s13059-014-0550-8 |
LU Y, ZHENG H, ZHANG H, et al. Cloning and differential expression of a novel Toll-like receptor gene in noble scallop Chlamys nobilis with different total carotenoid content. Fish and Shellfish Immunology, 2016, 56: 229-238 DOI:10.1016/j.fsi.2016.07.007 |
LUO C H, ZHENG L B. Independent evolution of Toll and related genes in insects and mammals. Immunogenetics, 2000, 512: 92-98 |
MEDZHITOV R, PRESTON-HURLBURT P, KOPP E, et al. MyD88 is an adaptor protein in the hToll/IL-1 receptor family signaling pathways. Molecular Cell, 1998, 22: 253-258 |
MEDZHITOV R. Recognition of microorganisms and activation of the immune response. Nature, 2007, 449(7164): 819-826 DOI:10.1038/nature06246 |
MENG Y, DAI W, LIN Z, et al. Expression and functional characterization of peptidoglycan recognition protein-S6 involved in antibacterial responses in the razor clam Sinonovacula constricta. Developmental and Comparative Immunology, 2022, 129: 104331 DOI:10.1016/j.dci.2021.104331 |
MORTAZAVI A, WILLIAMS B A, MCCUE K, et al. Mapping and quantifying mammalian transcriptomes by RNA-Seq. Nature Methods, 2008, 57: 621-628 |
NIU D H, JIN K, WAN L, et al. Molecular characterization and expression analysis of four cathepsin L genes in the razor clam, Sinonovacula constricta. Fish and Shellfish Immunology, 2013a, 35(2): 581-588 DOI:10.1016/j.fsi.2013.06.001 |
NIU D H, JIN K, WANG L, et al. Identification of cathepsin B in the razor clam Sinonovacula constricta and its role in innate immune responses. Developmental and Comparative Immunology, 2013b, 41(1): 94-99 DOI:10.1016/j.dci.2013.04.014 |
PRIYATHILAKA T T, BATHIGE S, LEE S, et al. Transcriptome- wide identification, functional characterization, and expression analysis of two novel invertebrate-type Toll-like receptors from disk abalone (Haliotis discus discus). Fish and Shellfish Immunology, 2019, 84: 802-815 DOI:10.1016/j.fsi.2018.10.062 |
QIU L, SONG L, XU W, et al. Molecular cloning and expression of a Toll receptor gene homologue from Zhikong scallop, Chlamys farreri. Fish and Shellfish Immunology, 2007, 22(5): 451-466 DOI:10.1016/j.fsi.2006.05.003 |
REN Q, LAN J F, ZHONG X, et al. A novel Toll like receptor with two TIR domains (HcToll-2) is involved in regulation of antimicrobial peptide gene expression of Hyriopsis cumingii. Developmental and Comparative Immunology, 2014, 45(1): 198-208 DOI:10.1016/j.dci.2014.02.020 |
REN Q, ZHONG X, YIN S W, et al. The first Toll receptor from the triangle-shell pearl mussel Hyriopsis cumingii. Fish and Shellfish Immunology, 2013, 34(5): 1287-1293 DOI:10.1016/j.fsi.2013.02.014 |
REN Y, LIU H, FU S, et al. Transcriptome-wide identification and characterization of Toll-like receptors response to Vibrio anguillarum infection in Manila clam (Ruditapes philippinarum). Fish and Shellfish Immunology, 2021, 111: 49-58 DOI:10.1016/j.fsi.2021.01.007 |
SATAKE H, SEKIGUCHI T. Toll-like receptors of deuterostome invertebrates. Frontiers in Immunology, 2012, 3: 34-40 |
THOMPSON J D, HIGGINS D G, GIBSON T J. ClustalW: Improving the sensitivity of progressive multiple sequence alignment through sequence weighting, position-specific gap penalties and weight matrix choice. Nucleic Acids Research, 1994, 22(22): 4673-4680 DOI:10.1093/nar/22.22.4673 |
TOUBIANA M, GERDOL M, ROSANI U, et al. Toll-like receptors and MyD88 adaptors in Mytilus: Complete cds and gene expression levels. Developmental and Comparative Immunology, 2013, 40(2): 158-166 DOI:10.1016/j.dci.2013.02.006 |
WANG L, CHAN J L, LI Q, et al. Evolutionary history of the Toll-like receptor and Myd88 in molluscs. Oceanologia et Limnologia Sinica, 2021, 52(4): 936-946 [王璐, 产久林, 李倩, 等. 海洋贝类Toll样受体及其接头蛋白MyD88的分子进化研究. 海洋与湖沼, 2021, 52(4): 936-946] |
WANG W, ZHANG T, WANG L, et al. A new non-phagocytic TLR6 with broad recognition ligands from Pacific oyster Crassostrea gigas. Developmental and Comparative Immunology, 2016, 65: 182-190 DOI:10.1016/j.dci.2016.07.010 |
WU Y, ZHENG Y, LI Y, et al. Two fibrinogen-related proteins (FREPs) in the razor clam (Sinonovacula constricta) with a broad recognition spectrum and bacteria agglutination activity. Developmental and Comparative Immunology, 2021, 121: 104075 DOI:10.1016/j.dci.2021.104075 |
XU K, ZHANG Z, XU Z, et al. A novel invertebrate Toll-like receptor is involved in TLR mediated signal pathway of thick shell mussel Mytilus coruscus. Developmental and Comparative Immunology, 2019, 97: 11-19 DOI:10.1016/j.dci.2019.03.012 |
XU X R, LIAO K, SHI P, et al. Involvement of a novel Ca2+-independent C-type lectin from Sinonovacula constricta in food recognition and innate immunity. Fish and Shellfish Immunology, 2020, 104: 374-382 DOI:10.1016/j.fsi.2020.05.074 |
YIN S, CHEN J, ZHU M, et al. Characterization of a novel Toll-like receptor and activation NF-kappaB signal pathway in triangle sail mussel Hyriopsis cumingii. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2021, 255: 110608-110617 DOI:10.1016/j.cbpb.2021.110608 |
ZHANG L, LI L, GUO X, et al. Massive expansion and functional divergence of innate immune genes in a protostome. Scientific Reports, 2015, 5: 8693-8703 DOI:10.1038/srep08693 |
ZHANG L, LI L, ZHANG G. A Crassostrea gigas Toll-like receptor and comparative analysis of TLR pathway in invertebrates. Fish and Shellfish Immunology, 2011, 30(2): 653-660 DOI:10.1016/j.fsi.2010.12.023 |
ZHANG Y X, SU J, FAN J F, et al. Outbreaks of vibriosis in mariculture shellfish and its research progress. Marine Environmental Science, 2020, 39(3): 480-487 [张颖雪, 苏洁, 樊景凤, 等. 海水养殖贝类弧菌病流行暴发及其环境影响因素研究进展. 海洋环境科学, 2020, 39(3): 480-487] |
ZHAO X, DUAN X, WANG Z, et al. Comparative transcriptome analysis of Sinonovacula constricta in gills and hepatopancreas in response to Vibrio parahaemolyticus infection. Fish and Shellfish Immunology, 2017, 67: 523-535 |



