2. 中国水产科学研究院黄海水产研究所 青岛海洋科学与技术试点国家实验室深蓝渔业工程联合实验室 山东 青岛 266071
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences; Joint Laboratory for Deep Blue Fishery Engineering of Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071, China
黄条鰤(Seriola aureovittata)是一种在全球水域广泛分布的暖温性中上层掠食性长距离洄游鱼类,我国沿海均有分布(张春霖, 1955; 刘静等, 2015)。黄条鰤体型大、游泳速度快,肉质鲜美、营养丰富、生食口感可媲美三文鱼,经济价值较高。2017年以来,中国水产科学研究院黄海水产研究所突破了黄条鰤苗种培育关键技术,然而,黄条鰤在苗种早期培育阶段,对水温、光照、营养等条件的应答较为敏感,导致苗种在早期因应激而批量死亡的问题较为突出,直接导致苗种早期培育成活率低。因此,有必要认识黄条鰤早期生长发育对环境因子胁迫的生理应答机制,为建立稳定的苗种培育技术提供理论依据。
热休克蛋白(heat shock proteins, HSPs)是一类具有高度保守结构的分子伴侣,广泛存在于细菌、哺乳动物和植物中,在应对环境压力等方面发挥着关键作用(Hartl, 1996)。根据分子量大小和氨基酸序列同源性,热休克蛋白一般分为5个主要家族:HSP100、HSP90、HSP70、HSP60和低分子量HSP (Surajit et al, 2011)。HSP70是热休克蛋白家族中最为重要的一员,具有分子伴侣、保护DNA、增强细胞耐受能力等生物学功能,特别是在高温下,HSP70能协助变性蛋白复性、保护生物体免受损伤(Heredia, 2008; Deane, 2006; Rosic et al, 2011)。在水产生物中,对HSP70的研究较为广泛,主要集中在其应对环境胁迫适应的蛋白稳态和细胞修复方面(Hangzo et al, 2016; Abha et al, 2020; Sun et al, 2021);在鱼类早期生长发育方面研究较少,对鳜鱼(Siniperca chuatsi)和斑马鱼(Danio rerio)的研究发现,hsp70参与晶状体的形成过程(王鹏飞, 2014; Evans et al, 2005)。本研究采用RACE法(rapid- amplification of cDNA ends)克隆获得了黄条鰤hsp70基因的cDNA序列,并揭示了其组织表达特性,探明了其在胚胎和仔稚幼鱼生长发育过程中的差异表达调控特性,旨在为开发黄条鰤生长发育应答环境胁迫的应激消减调控技术提供理论基础。
1 材料与方法 1.1 实验材料实验用1龄黄条鰤取自大连富谷食品有限公司,全长为(44.0±3.5) cm,体重为(822.5±212.9) g。用MS-222 (80 mg/L)的麻醉鱼,快速解剖取出脑、垂体、鳃、心、肝、脾、肾、头肾、胃、肠、肌肉和性腺,置于液氮中保存,带回实验室后转移到–80 ℃冰箱保存备用。
2020年的黄条鰤繁殖和苗种培育季节,在大连富谷食品有限公司采集了17个不同发育时期的胚胎样品,包括受精卵、2细胞期、4细胞期、8细胞期、16细胞期、32细胞期、64细胞期、多细胞期、桑葚胚期、高囊胚期、低囊胚期、原肠早期、原肠后期、神经胚期、胚体包被1/2期、胚体包被2/3期和破膜孵化期;采集了仔稚幼鱼样品:孵化出膜后1、4、7、10、15、20、25、30、40、50、60 d样品。将样品贮存于液氮中带回实验室,转移至–80 ℃冰箱中保存。
1.2 总RNA提取和cDNA第一链合成取黄条鰤成鱼不同组织样品各约20 mg,按照TRIzol试剂(TaKaRa, 日本)说明书进行RNA提取。总RNA以NanoDrop2000C (Thermo, 美国)分光光度计测定浓度,取高质量RNA用于反转录。以SMARTer® RACE 5′/3′ kit (TaKaRa, 日本)合成5′及3′-RACE cDNA第1链,用于hsp70基因全长克隆。以PrimeScriptTM Ⅱ1st strand cDNA synthesis kit (TaKaRa, 日本)合成cDNA第1链,用于hsp70 mRNA组织表达特性分析。反转录操作按照说明书进行。
1.3 黄条鰤 hsp70基因核心片段克隆以脑组织cDNA为模板,设计3对引物(HSP70 F1、HSP70 R1;HSP70 F2、HSP70 R2;HSP70 F3、HSP70 R3) (表 1),使用重组Taq DNA聚合酶混合物(TaKaRa, 日本)进行扩增,分别对hsp70基因核心片段进行PCR扩增。3次PCR体系均为25 μL:0.2 μL TaKaRa Ex Taq、2.5 μL 10×Taq Buffer、2.0 μL dNTP Mix (2.5 μmol/L)、0.5 μL模板、1.0 μL正向引物(HSP70 F1、HSP70F2、HSP70F3)、1.0 μL反向引物(HSP70 R1、HSP70R2、HSP70R3)、17.8 μL ddH2O。PCR条件:95 ℃预变性10 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,共38个循环;最后72 ℃延伸5 min。将产物利用1.2%的琼脂糖凝胶电泳检测,目的条带产物利用SteadyPure DNA凝胶回收试剂盒(AG, 中国)回收,回收产物连接到pEASY-T1 simple载体(TransGene Biotech, 中国),后转入Transl-T1 Phage Resistant感受态细胞(TransGene Biotech, 中国),摇菌培养1 h后,涂布于含有氨苄的固体培养基,37 ℃过夜培养;挑单克隆菌落于含有氨苄的LB液体培养基中,37 ℃下200 r/min振荡2 h,菌液PCR验证后,将筛选出的阳性克隆送至生工生物工程(上海)股份有限公司测序。
|
|
表 1 黄条鰤 hsp70基因克隆及定量表达所用引物 Tab.1 The primer used for cloning and quantitative expression of S. aureovittata hsp70 |
根据获得的hsp70基因核心片段设计RACE引物(表 1)。使用Smart RACE Advantage 2 PCR试剂盒(TaKaRa, 日本)进行扩增。第1次PCR体系:17.5 μL RNase free H2O、2 μL Buffer、2 μL 50×dNTP mix、0.5 μL 50×Advantage 2 polymerase mix、1 μL cDNA、1 μL引物(HSP70 3'F1和HSP70 5'R1) (表 1) 和1 μLUPM (long),共25 μL。PCR扩增条件:95 ℃ 5 min;95 ℃ 30 s,54 ℃ 1 min,72 ℃ 5 min,38个循环;72 ℃ 5 min;12 ℃保存。以第1次PCR的产物稀释10倍为模板,进行巢式PCR扩增,反应体系:16.5 μL ddH2O、2 μL Buffer、2 μL 50×dNTP mix、0.5 μL 50×Advantage 2 polymerase mix、2 μL cDNA、1 μL UPM (short)和1 μL引物(HSP70 3′F2和HSP70 5′R2) (表 1),共25 μL。PCR扩增条件同第1次PCR。PCR产物于1.2%琼脂糖凝胶电泳检测后,对目的条带进行胶回收、载体连接、转化、筛选阳性克隆并测序。
1.5 黄条鰤 hsp70基因的定量表达检测根据黄条鰤 hsp70 cDNA序列设计定量引物,以18S rRNA为内参。使用Light Cycler 96 Real-time PCR仪(Roche, 瑞士),使用SYBR® Green Premix Pro Taq HS qPCR Kit Ⅱ试剂盒(AG, 中国),在黄条鰤不同组织、胚胎和仔稚幼鱼中扩增检测。PCR体系为20 μL:2×SYBR® Green Pro Taq HS Premix Ⅱ 10 μL、ddH2O 7.4 μL、cDNA模板1 μL、引物(10 μmol/L)各0.8 μL。PCR扩增条件:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,72 ℃延伸30 s,共40个循环。采用2–ΔΔCt方法计算hsp70基因的表达量。
1.6 数据处理及分析通过软件SignalP 5.0 Server (http://www.cbs.dtu.dk/services/SignalP/)预测黄条鰤 hsp70基因的信号肽,利用ExPASy (www.expasy.org/tools/protparam.html)预测蛋白结构和分子量等。使用软件DNAman 6.0 (LynnonBiosoft, 美国)将得到的hsp70基因cDNA序列片段进行拼接,得到完整的cDNA序列;使用NCBI数据库(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)进行结构域的预测;通过SWISS- MODEL自动化蛋白质建模服务器ProModⅡ程序估计三级蛋白质结构(http://www.expasy.org/swissmod/SWISS-MODEL.html);采用MEGA 7.0软件进行同源序列比对,应用邻接法构建氨基酸的系统进化树,1 000次重复计算自展值。采用SPSS 26.0软件(IBM, 美国)进行单因素方差分析(one-way ANOVA),通过Duncan统计比较各个基因在不同组织和不同发育阶段的相对表达水平的差异,显著性水平P设置为0.05,当P < 0.05时认为差异显著。
2 结果 2.1 黄条鰤 hsp70的序列全长和结构特征黄条鰤 hsp70基因的cDNA全长为2 332 bp,其中,5′-UTR长度为187 bp,ORF长度为1 920 bp,3′-UTR长度为225 bp,编码氨基酸639个,蛋白质分子量为70.1 kDa,等电点为5.16 (图 1)。序列中存在非细胞器特征的基序RARFEEL和位于C-端的细胞质定位特征基序EEVD。拥有3个典型的HSP70家族标签基序IDLGTTYS、IFDLGGGTFDVSIL和IVLVGGSTRIPKIQK。

|
图 1 黄条鰤 hsp70基因全长cDNA序列及推导的氨基酸序列 Fig.1 The complete cDNA sequence and deduced amino acid sequence of S. aureovittata hsp70 ORF用大写字母表示,5′-UTR和3′-UTR用小写字母表示。起始密码子加框显示,终止密码子以星号标注。阴影部分为hsp70家族保守基序。 The ORF domain is indicated with uppercase letters, and the 5′-UTR domain and 3′-UTR domain are indicated with lowercase letters. The start codon is boxed and the stop codon is indicated with asterisk. The conservative motif domains of hsp70 gene are shown in shadow. |
应用SWISS-MODEL软件中ProModⅡ程序对获得的黄条鰤 hsp70空间结构进行预测(图 2)。结果显示,hsp70空间结构由3部分组成:ATP酶结合结构域、底物多肽结构域和C端结构域。其中,ATP酶结合结构域是由4个亚域构成的2个叶状结构;底物多肽结构域具有结合底物多肽的功能,由2个亚域组成,它们之间由螺旋结构相连。

|
图 2 预测的黄条鰤 HSP70三级结构 Fig.2 The predicted tertiary structure of HSP70 of S. aureovittata |
对黄条鰤和其他脊椎动物的hsp70基因的氨基酸序列进行同源序列比对(表 2),并绘制了基于氨基酸序列的NJ系统进化树(图 3)。结果显示,黄条鰤与同为鲈形目(Perciformes)的长背鰤(S. lalandi dorsalis)的hsp70同源性最高,达99.5%,其次为高体鰤(Seriola dumerili),达98.9%,与鲤形目(Cypriniformes)和鲑形目(Salmoniformes)的亲缘关系较远,与哺乳纲其他动物的亲缘关系更远。系统进化分析表明,我国黄条鰤 HSP70与长背鰤和高体鰤HSP70聚为一个小分支,与其他鲤形目和鲑形目鱼类聚为大分支,表明鲹科(Carangidae)鱼类hsp基因的进化亲缘关系最为接近。
|
|
表 2 黄条鰤与其他脊椎动物hsp70基因氨基酸序列同源性分析/% Tab.2 Homology analysis of amino acid sequences of hsp70 gene of S. aureovittata and other vertebrates/% |

|
图 3 黄条鰤 HSP70与其他脊椎动物的NJ系统进化树 Fig.3 The phylogenetic tree of HSP70 of S. aureovittata and other vertebrates by neighbor-joining method |
检测了hsp70基因在雌雄成鱼组织中的表达,发现各组织中均可检测到hsp70基因mRNA表达(图 4),雌鱼中以卵巢组织表达水平最高,其次为鳃、心、脾脏,在肾脏和垂体等其他组织中低表达;雄鱼中以鳃组织hsp70 mRNA表达水平显著高于其他组织,其次在垂体、头肾和精巢中也显著高表达,在脾脏等其他组织中相对低表达,表明hsp70基因在黄条鰤成鱼的组织表达模式和生理功能各不相同,具有明显的性别二态性。
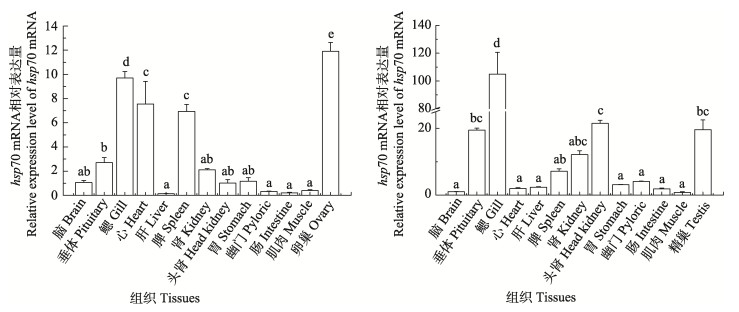
|
图 4 黄条鰤 hsp70基因在雌性(左)和雄性(右)中的组织表达分布特性 Fig.4 The differential spatial expression patterns of hsp70 mRNA in female (left) and male (right) S. aureovittata |
本研究发现,在未卵裂前的受精卵中可检测到hsp70的表达,表明其具有亲本遗传的特性。在胚胎发育过程的各个时期都可检测到hsp70 mRNA的表达,在低囊胚前各发育阶段,hsp70 mRNA一直保持较低表达水平,在原肠前期开始显著上调表达,其后保持相对较高表达水平至胚胎孵化出膜期达峰值(P < 0.05)(图 5)。
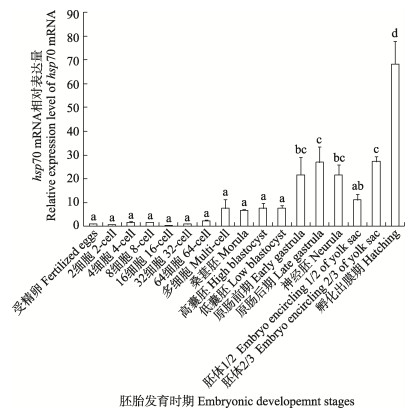
|
图 5 黄条鰤胚胎发育过程中hsp70 mRNA表达特性 Fig.5 The temporal expression pattern of hsp70 mRNA of S. aureovittata during embryonic development |
检测了hsp70 mRNA在仔稚幼鱼生长发育过程中的表达变化(图 6)。结果显示,hsp70 mRNA在1 d仔鱼中高表达,在4 d仔鱼中显著降低(P < 0.05),自7 d仔鱼开始显著上调表达至15 d仔鱼达峰值(P < 0.05),在20 d仔鱼中显著下降(P < 0.05),并在25 d稚鱼及其后均保持相对较低表达水平。

|
图 6 黄条鰤仔稚幼鱼生长发育过程中hsp70 mRNA表达水平变化 Fig.6 The temporal expression pattern of hsp70 mRNA of S. aureovittata larvae and juveniles |
有关hsp基因家族的研究始于20世纪发现了果蝇(Drosophila)的HSP蛋白(Ritossa, 1962),其后各种HSP家族的功能因子的结构与功能研究逐步深入。HSP70家族是进化最为保守也是研究最为广泛的HSPs (Sun et al, 2021)。本研究通过同源克隆和RACE方法获得了黄条鰤 hsp70基因的全长cDNA序列,揭示了其结构特征、系统进化地位以及在胚胎和仔稚幼鱼生长发育过程中的表达调控特性,为鱼类hsp70基因的生理功能研究添加了新的基础资料。
HSP家族基因序列高度保守,无论在脊椎动物还是无脊椎动物的不同种属之间均有很高相似性,因此,先前研究认为这些蛋白具有相似的功能(Gething et al, 1992)。目前,已有数十种鱼类的hsp70基因的结构和组织表达特性公开报道(Rosic et al, 2011; Ma et al, 2020)。本研究发现,黄条鰤 hsp70基因具有真核生物hsp70家族的典型结构特征,包括3个功能结构域和3个典型的hsp70家族标签基序;存在非细胞器基序RARFEEL,说明它定位于胞质中,进一步验证了鱼类hsp70基因的结构保守特性(Sun et al, 2021)。在组织表达特性方面,对杂交黄颡鱼(Pelteobagrus fulvidraco ♀×P. vachelli ♂)的研究表明,hsp70基因主要在肝脏中表达,其次为脑、鳃和肌肉(朱凌威等, 2021)。在草鱼(Ctenopharyngodon idella)中,hsp70基因主要在脑中表达,其次为肝胰脏、鳃和肌肉(林亚秋等, 2009)。而淞江鲈(Trachidermus fasciatus) hsp70基因主要在鳃中最高表达,其次为脑、肌肉和肝脏(刘庆全, 2013)。在鳜鱼(Siniperca chuatsi)中,以卵巢、肠道和头肾中的表达水平较高(王鹏飞, 2014)。本研究中,雌性黄条鰤卵巢中hsp70基因表达最高,其次为鳃、心和脾脏,而雄性黄条鰤中鳃组织hsp70基因显著高表达,其次为垂体、头肾和精巢,与其他已报道的鱼类有一定的差异,表明hsp70基因的组织表达特性具有典型的物种特异性。更有趣的是,黄条鰤 hsp70基因的组织表达也具有较为明显的性别二态性,其具体的生物学意义和生理学功能有待于进一步深入解析。
先前研究表明,热休克蛋白在动物胚胎发育过程中也起着非常重要的生理作用,除了作为分子伴侣维持胞内蛋白稳态以外,还参与组织或器官的形态建成,HSPs在胚胎发育中的表达具有发育阶段依赖性和组织特异性(Rupik et al, 2011)。但有关hsp70对水生生物胚胎发育的调控作用及机制研究报道较少,对斑马鱼(Danio rerio)的研究表明,在卵母细胞发生过程中可检测到hsp70基因表达,且与胚胎发育过程中晶状体和脑等器官的发生发育密切相关(Evans et al, 2005、2007)。本研究中,黄条鰤未发生卵裂的受精卵中检测到hsp70 mRNA的表达,表明其具有亲本遗传的特性,这与斑马鱼中hsp70参与卵母细胞发育过程的结果类似(Rupik et al, 2011),但黄条鰤 hsp70基因主要来自母本还是父本或者父母本双方,有待于进一步在性腺分化发育过程中的表达检测来验证。另外,在黄条鰤胚胎发育各阶段均可检测到hsp70基因的转录表达,在原肠前期开始显著上调表达直至胚胎孵化出膜期达峰值,该结果与鳜鱼hsp70在胚胎发育过程中的表达模式相似(王鹏飞, 2014)。在黄条鰤胚胎发育过程中,自原肠期原口关闭后,胚体形成,其后视囊和晶体等器官相继发生和发育(徐永江等, 2019),hsp70的这种特定发育期的高表达模式表明其可能参与了黄条鰤胚胎发育阶段器官形成发育的调控,具体的作用及机制有待于进一步研究确证。
在黄条鰤仔稚幼鱼生长发育阶段,hsp70在1 d仔鱼中高表达,这与亲本遗传有关。其后,在4 d仔鱼中显著下调表达,这一时期是黄条鰤开口由内源性营养向外源性营养过渡的关键时期,仔鱼初次接触到外源性营养供给,可能会造成一定的生理适应性的改变,而hsp70的下调表达特性也表明其可能参与了内外营养转化过程的生理适应调控。黄条鰤 7 d仔鱼已完全积极地摄食外源营养,鳔已充气,10~15 d仔鱼消化系统发育完全、生长加速,且15 d仔鱼尾椎开始完全准备进入变态期(徐永江等, 2019),这一时期hsp70的高表达可能提示其在黄条鰤变态前期摄食与生长发育过程中起着重要的生理调控作用,具体的途径与机制有待于深入研究。黄条鰤 20 d仔鱼进入变态期,至25 d变态完成进入稚鱼期,此时的苗种各种表观器官发育更为完善且生长更为迅速,而hsp70显著下调表达,表明其在变态期和变态完成后的调控作用发生变化。下一步,本实验室将借助基因敲降等手段深入探究黄条鰤胚胎发育过程中hsp70基因对器官发生发育的调控作用与生理机制。
ABHA G, ANKUSH B, KAZUE H. HSP70 and HSP90 in neurodegenerative diseases. Neuroscience Letters, 2020, 716: 134678 DOI:10.1016/j.neulet.2019.134678 |
DEANE E E, WOO N Y S. Impact of heavy metals and organochlorines on hsp70 and hsc70 gene expression in black sea bream fibroblasts. Aquatic Toxicology, 2006, 79(1): 9-15 DOI:10.1016/j.aquatox.2006.04.009 |
EVANS T G, YAMAMOTO Y, JEFFERY W R, et al. Zebrafish Hsp70 is required for embryonic lens formation. Cell Stress Chaperones, 2005, 101: 66-78 |
EVANS T G, BELAK Z, OVSENEK N, et al. Heat shock factor 1 is required for constitutive Hsp70 expression and normal lens development in embryonic zebrafish. Comparative Biochemistry and Physiology Part A:. Molecular and Integrative Physiology, 2007, 146(1): 131-140 DOI:10.1016/j.cbpa.2006.09.023 |
GETHING M J, SAMBROOK J. Protein folding in the cell. Nature, 1992, 355: 33-45 DOI:10.1038/355033a0 |
HARTL F U. Molecular chaperones in cellular protein folding. Nature, 1996, 381(6583): 571-579 DOI:10.1038/381571a0 |
HEREDIA P. Heat shock protein (HSP70) RNA expression differs among rainbow trout (Oncorhynchus mykiss) clonal lines. Comparative Biochemistry and Physiology Part B:. Biochemistry and Molecular Biology, 2008, 149(4): 552-556 DOI:10.1016/j.cbpb.2007.05.012 |
HANGZO H, BANERJEE B, SAHA S, et al. Ammonia stress under high environmental ammonia induces Hsp70 and Hsp90 in the mud eel, Monopterus cuchia. Fish Physiology and Biochemistry, 2016, 43: 77-88 |
LIN Y Q, ZHEN Y C, JI H. Partial sequence cloning of HSP70 gene and differences in tissue expression in grass carp. Freshwater Fisheries, 2009, 39(4): 67-71 [林亚秋, 郑玉才, 吉红. 草鱼HSP70基因cDNA部分序列克隆及其组织表达差异. 淡水渔业, 2009, 39(4): 67-71] |
LIU J, CHEN Y X, MA L. Yellow Sea and Bohai Sea fish atlas. Beijing: Science Press, 2015, 172 [刘静, 陈咏霞, 马琳. 黄渤海鱼类图志. 北京: 科学出版社, 2015, 172] |
LIU Q Q. A preliminary study on the cloning and expression of the full sequence of Trachidermus fasciatus Heckel HSP70. Master´ s Thesis of Fudan University, 2013, 25-27 [刘庆全. 淞江鲈(Trachidermus fasciatus Heckel) HSP70全序列的克隆及其表达的初步研究. 复旦大学硕士研究生学位论文, 2013, 25-27] |
MA F, LUO L. Genome-wide identification of Hsp70/110 genes in rainbow trout and their regulated expression in response to heat stress. PeerJ, 2020, 8: e10022 DOI:10.7717/peerj.10022 |
RITOSSA F. A new pattern induced by a temperature shock and DNP in Drosophila. Experientia, 1962, 18: 571-573 DOI:10.1007/BF02172188 |
ROSIC N N, PERNICE M, DOVE S, et al. Gene expression profiles of cytosolic heat shock proteins Hsp70 and Hsp90 from symbiotic dinoflagellates in response to thermal stress: Possible implications for coral bleaching. Cell Stress and Chaperones, 2011, 16(1): 69-80 DOI:10.1007/s12192-010-0222-x |
RUPIK W, JASIK K, BEMBENEK J, et al. The expression patterns of heat shock genes and proteins and their role during vertebrate's development. Comparative Biochemistry and Physiology Part A:. Molecular and Integrative Physiology, 2011, 159(4): 349-366 DOI:10.1016/j.cbpa.2011.04.002 |
SUN Y, WEN H, TIAN Y, et al. HSP90 and HSP70 families in Lateolabrax maculatus: Genome-wide identification, molecular characterization, and expression profiles in response to various environmental stressors. Frontiers in Physiology, 2021, 12: 784803 DOI:10.3389/fphys.2021.784803 |
SURAJIT S, DHRUBA S, RENU Y, et al. Heat shock proteins: Molecules with assorted functions. Frontiers in Biology, 2011, 6(4): 312-327 DOI:10.1007/s11515-011-1080-3 |
WANG P F. Cloning and expression of heat shock proteins and hypoxic reaction genes in Siniperca chuatsi. Doctoral Dissertation of Sun Yat-Sen University, 2014 [王鹏飞. 鳜热休克蛋白和低氧反应基因的克隆和表达研究. 中山大学博士研究生学位论文, 2014]
|
XU Y J, ZHANG Z R, LIU X Z, et al. Early growth and development characteristics of Seriola lalandi. Journal of Fishery Sciences of China, 2019, 26(1): 172-182 [徐永江, 张正荣, 柳学周, 等. 黄条鰤早期生长发育特征. 中国水产科学, 2019, 26(1): 172-182] |
ZHANG C L. Fish survey report of the Yellow Sea and Bohai Sea. Beijing: Science Press, 1955: 116-119 [张春霖. 黄渤海鱼类调查报告. 北京: 科学出版社, 1955: 116-119]
|
ZHU L W, ZHANG C Y, LIU Z, et al. Cloning, expression and tissue expression of the core sequence of hsp70 gene in Pelteobagrus fulvidraco and its tissue expression under high temperature stress. Progress in Fishery Sciences, 2021, 42(1): 47-55 [朱凌威, 张朝阳, 刘钊, 等. 杂交黄颡鱼hsp70基因核心序列的克隆、表达及其在高温应激下的组织表达. 渔业科学进展, 2021, 42(1): 47-55] |



