2. 中国海洋大学 海水养殖教育部重点实验室 山东 青岛 266003
2. Ocean University of China, Key Laboratory of Mariculture, Ministry of Education, Qingdao 266003, China
我国是水产养殖大国,养殖产量和面积均位于世界首位,其中,牡蛎养殖产量占全球牡蛎总养殖产量的80% (于潇等, 2020)。但伴随着养殖产业的迅猛发展,也产生了一系列的问题。近年来,为了追求经济利益,养殖海区内牡蛎养殖密度不断增加,辽宁大连大窑湾海区、广西钦州、北海和防城港等地均因为牡蛎养殖密度不断增加,出现产量下降、个体变瘦、牡蛎大量死亡和病害频繁发生等问题(隋锡林等, 2002; 潘英等, 2021)。因此,迫切需要探索新型养殖模式,以期解决上述问题。
随着人们对海洋生态系统的深入研究,生态养殖模式逐渐被人们接受并加以推广,其中,多营养层次综合养殖模式(integrated multi-trophic aquaculture, IMTA)是公认的环境友好型养殖模式。该养殖模式的核心是将不同生态位的种类,按照适当比例在同一水体中进行养殖,部分生物的排泄物作为另一生物的饵料,在减少废物排放的同时,增加经济效益,使能量和营养得到充分利用。目前,许多研究证实,该养殖模式应用效果显著(Ashkenazi et al, 2019; Gui et al, 2018),可以增加单位面积产出(于潇等, 2020)、改善海域环境(张继红等, 2013)、提高物质利用率(吴文广等, 2021)。
规模化养殖的滤食性贝类,在摄食后会产生大量的生物沉积物,将水体中的颗粒物质由上层搬运至底层(聂梦晨等, 2022)。大量有机物以生物沉积物的形式累积到养殖区海底,会对底质环境造成一定负面影响(Hatcher et al, 1994)。研究表明,海参能大量摄食贝类产生的富含有机质的沉积物,加快系统内营养盐的循环,降低沿海贝类及鱼类养殖造成的营养负荷(赵聚萍, 2018; 秦培兵等, 1999)。因此,在多营养层次综合养殖原理的基础上,利用具有沉积食性的海参对滤食性贝类产生的生物沉积物进行摄食,可能形成一种新型的综合养殖模式。基于此,本研究通过改进养殖方式,尝试在长牡蛎(Crassostrea gigas)的下层水体中养殖仿刺参(Apostichopus japonicus),进行牡蛎–海参筏式综合养殖,目的是使牡蛎产生的生物沉积物得到原位利用,降低牡蛎养殖密度,维持经济效益。
1 材料与方法 1.1 实验生物来源实验所使用的牡蛎为长牡蛎,海参为仿刺参,均由山东荣成楮岛水产有限公司提供。挑选规格相近、活力好的长牡蛎和仿刺参用于实验。长牡蛎和仿刺参初始体重分别为(60±15) g和(40±10) g。
1.2 实验设计本研究选择了2个具有代表性的牡蛎养殖海域(图 1):山东省荣成市桑沟湾海域(37°03′58″N, 122°33′28″E)和山东省乳山市挂子场渔港附近海域(36°43′48″N, 121°36′21″E)。
|
图 1 实验海域示意图 Fig.1 Sketch map of experimental sea area |
使用牡蛎养殖笼(直径为31 cm,高约为170 cm,孔径为1.6 cm,共10层)进行实验。长牡蛎和仿刺参隔层放养,奇数层放养总重0.6 kg的长牡蛎,每个养殖笼内长牡蛎的初始总重为3 kg;偶数层放养仿刺参,其数量根据如下实验分组确定:每偶数层放养仿刺参分为3个密度,分别为1、2和4头,标记为海参密度1、2、4头/盘。偶数层的养殖盘分为普通养殖盘和无孔养殖盘2种,分别标记为P和W处理;同时,在部分无孔养殖盘的笼内放置约为2倍养殖盘面积的无结网,标记为J处理。每个海域9个处理组编号见表 1。本研究在2个海域进行,共18个处理组,每个处理组5个重复,每个实验海域使用45个养殖笼,实验共使用90个养殖笼。
|
|
表 1 处理组编号 Tab.1 Treatment group number |
实验时间为2020年11月—2021年6月,每月定期前往2个实验海域进行样品采集。现场随机选取5个取样位点,使用YSI多参数水质分析仪(Eureka公司,美国)测量实验海域的水温(T)、盐度(S)、溶解氧(DO)和pH值。每个位点采集2.5 L表层水,参照《海洋监测规范GB17378.4-2007》进行现场固定,将水样带回实验室进行相关分析。
每2个月采集1次长牡蛎和仿刺参样品,每个处理组采集长牡蛎个体30个、仿刺参个体5个,用于测量生长指标。养殖实验结束后,对所有养殖笼内长牡蛎和仿刺参进行称重和计数,计算不同处理组长牡蛎和仿刺参的平均单笼总重和成活率。
1.4 样品测定使用游标卡尺测量长牡蛎壳高、壳长和壳宽,使用电子天平(0.01 g精度)测量长牡蛎的总湿重、软体部湿重和仿刺参湿重。将长牡蛎软体部和壳在70 ℃烘箱内烘干72 h至恒重后,测量长牡蛎软体部干重和壳干重。
叶绿素a (Chl-a)参照《海洋监测规范GB 17378.7- 2007》使用分光光度法测定;颗粒有机物(POM)参照《海洋调查规范GB/T 12763.9-2007》,使用预先灼烧称重后的GF/F玻璃纤维滤膜测定;活性磷酸盐(PO43–-P)、亚硝酸盐(NO2–-N)、硝酸盐(NO3–-N)和铵盐(NH4+-N)参照《海洋调查规范GB/T 12763.4-2007》分别使用抗坏血酸还原磷钼蓝法、重氮–偶氮法、锌镉还原法和次溴酸钠氧化法测定。
1.5 计算公式和数据分析牡蛎个体肥满度(condition index, CI)计算公式(Walne, 1976):
| $\mathrm{CI}=\mathrm{DW}_{\mathrm{t}} / \mathrm{DW}_{\mathrm{s}} \times 100 \%$ |
式中,DWt表示牡蛎软体部干重,DWs表示牡蛎壳干重。
实验数据均采用平均值±标准差(Mean±SD)表示。使用SPSS 23.0统计分析软件分析数据;采用Shapiro-Wilk检验和Levene检验方法对数据进行正态分布检验和方差齐性检验。使用双因素方差分析(two-way ANOVA)检验不同海域和取样月份对海域Chl-a、POM、PO43–-P、NO2–-N、NO3–-N和NH4+-N的影响;使用三因素方差分析(three-way ANOVA)检验不同海域、养殖盘和海参密度对长牡蛎单笼总重、仿刺参单笼总重、仿刺参个体体重、仿刺参成活率、长牡蛎个体体重和长牡蛎肥满度的影响,以P < 0.05作为差异显著水平,P < 0.01作为差异极显著水平。对存在显著交互效应的因变量,分析各处理组间的简单效应;对不存在显著交互效应、仅存在显著主效应的因变量,使用单因素方差分析(one-way ANOVA)和Duncan多重比较分析各处理组间是否存在显著差异。使用GraphPad Prism 7.0软件绘制图表。
2 结果 2.1 养殖区环境因子变化 2.1.1 叶绿素a和颗粒有机物双因素方差分析显示,海域对Chl-a和POM影响不显著(P > 0.05);取样月份对Chl-a和POM影响均极显著(P < 0.01);海域和取样月份交互效应对Chl-a影响显著(P < 0.05),对POM影响极显著(P < 0.01) (表 2)。
|
|
表 2 海域与取样月份对海域环境因子影响的双因素方差分析结果 Tab.2 Two-way ANOVA analysis of the influence of sea area and month on the environmental factors |
12月和翌年5月两海域Chl-a含量存在显著差异(P < 0.05),其他各月份两海域Chl-a含量无显著差异(P > 0.05)。相同海域内各月份Chl-a含量差异显著(P < 0.05),桑沟湾海域变化范围为0.92~2.11 μg/L,挂子场海域变化范围为0.88~2.41 μg/L (图 2a)。

|
图 2 实验海域叶绿素a和颗粒有机物含量变化 Fig.2 Variation of Chlorophyll a content and POM content in experimental sea areas 不同大写字母表示桑沟湾海域不同月份数据差异显著(P < 0.05);不同小写字母表示挂子场海域不同月份数据差异显著(P < 0.05);*表示相同月份不同海域数据差异显著(P < 0.05),下同。 Different capital letters indicate significant differences (P < 0.05) among different months in Sanggou Bay, and Different lowercase letters indicate significant differences (P < 0.05) among different months in Guazichang. * indicates significant differences (P < 0.05) between sea areas in the same month, the same as below. |
12月两海域POM含量存在显著差异(P < 0.05),其他各月份两海域POM含量无显著差异(P > 0.05)。相同海域各月份差异显著(P < 0.05),桑沟湾海域变化范围为3.57~12.52 mg/L,挂子场海域变化范围为4.02~11.59 mg/L (图 2b)。
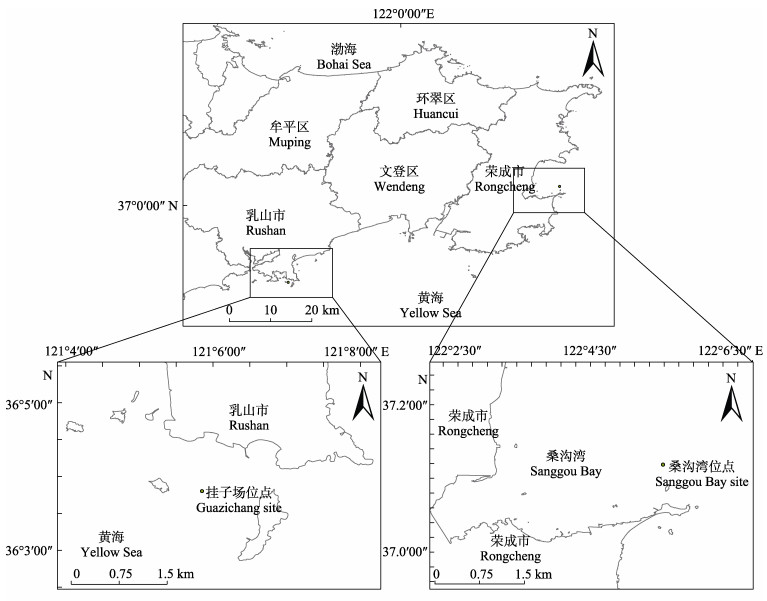
2.1.2 营养盐双因素方差分析显示,海域和取样月份对4项营养盐指标的影响均极显著(P < 0.01);海域和取样月份交互效应对PO43–-P和NO3–-N的影响极显著(P < 0.01),对NO2–-N和NH4+-N的影响不显著(P > 0.05) (表 2)。
12月桑沟湾海域PO43–-P浓度显著低于挂子场海域(P < 0.05),其他各月桑沟湾海域均高于挂子场海域,除1月和6月以外的月份差异显著(P < 0.05);相同海域各月的PO43–-P浓度差异显著(P < 0.05),整体表现为先下降后上升的趋势(图 3a)。
|
图 3 实验海域营养盐含量变化 Fig.3 Variation of nutrient contents in experimental sea areas |
挂子场海域NO2–-N浓度整体高于桑沟湾海区,除3月、6月以外的月份差异显著(P < 0.05);相同海域各月NO2–-N浓度差异显著(P < 0.05),整体较为稳定(图 3b)。
桑沟湾海域NO3–-N浓度整体高于挂子场海域,除4月和6月以外的月份差异显著(P < 0.05);相同海域各月份NO3–-N浓度差异显著(P < 0.05),整体表现为下降趋势(图 3c)。
桑沟湾海域NH4+-N浓度整体高于挂子场海域,除2月和5月以外的月份差异显著(P < 0.05);相同海域各月份NH4+-N浓度差异显著(P < 0.05),整体较为稳定(图 3d)。
2.2 长牡蛎和仿刺参的生长 2.2.1 长牡蛎总重和仿刺参总重三因素方差分析显示(表 3),养殖盘和海参密度对仿刺参和长牡蛎单笼总重影响均极显著(P < 0.01),海域影响不显著(P > 0.05);两因素交互作用对仿刺参单笼总重影响不显著(P > 0.05),对长牡蛎单笼总重影响显著(P < 0.05);三因素交互作用对仿刺参单笼总重影响不显著(P > 0.05),对长牡蛎单笼总重影响显著(P < 0.05)。
|
|
表 3 海域、养殖盘和海参密度对长牡蛎及仿刺参生长指标的三因素方差分析结果 Tab.3 Three-way ANOVA analysis of the influence of sea area, aquaculture plate, and sea cucumber density on the growth index of the C. gigas and A. japonicus |
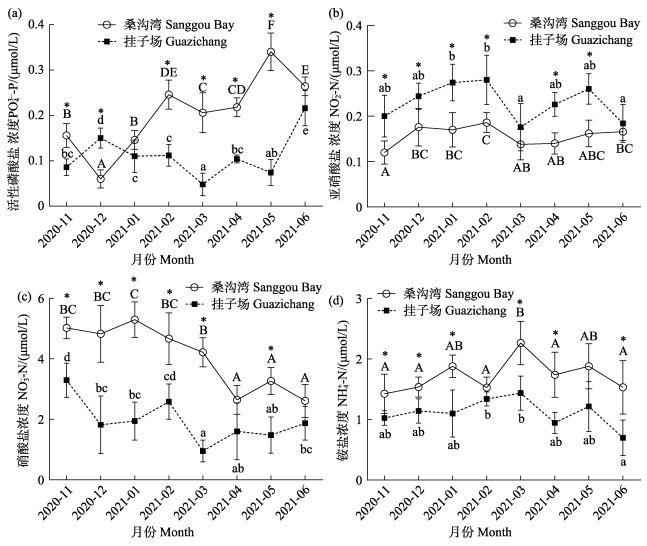
相同养殖盘和海参密度条件下,W2和J2处理组不同海域之间长牡蛎单笼总重存在显著差异(P < 0.05),其他各处理组不同海域之间均无显著差异(P > 0.05)。相同海域和海参密度条件下,密度为1头/盘时,W和J处理组显著高于P处理组(P < 0.05)。相同海域和养殖盘条件下,当养殖盘为普通养殖盘(P)时,2头/盘的处理组显著高于1头/盘的处理组(P < 0.05),与4头/盘的处理组差异不显著(P > 0.05) (图 4a)。
|
图 4 长牡蛎和仿刺参单笼总重比较
Fig.4 Comparison of total weight of C. gigas and A. japonicus in a single aquaculture cage
P代表普通养殖盘处理组,W代表无孔养殖盘处理组,J代表添加无节网处理组;数字1、2、4分别代表每层投放海参密度为1、2、4头/盘;不同大写字母表示相同海域和海参密度条件下不同养殖盘组数据差异显著(P < 0.05); 不同小写字母表示相同海域和养殖盘条件下不同海参密度组数据差异显著(P < 0.05); *表示相同处理条件下不同海域数据差异显著(P < 0.05),下同。 P represents the common aquaculture plate treatment group, W represents the holeless aquaculture plate treatment group, and J represents the treatment group of adding non-knot net. Numbers 1, 2, and 4 represent the density of sea cucumbers treated as 1, 2, and 4 ind./plate. Different capital letters indicate significant differences of different aquaculture plate groups in the same sea area and sea cucumber density (P < 0.05). Different lowercase letters indicate significant differences of different sea cucumber density groups in the same sea area and using the same kind of aquaculture plate (P < 0.05). * indicate significant differences (P < 0.05) between different sea areas in the same treatment group, the same as below. |
相同养殖盘和海参密度条件下,各处理组不同海域之间仿刺参单笼总重均无显著差异(P > 0.05)。相同海域和海参密度条件下,W处理组仿刺参单笼总重显著高于P和J处理组(P < 0.05)。相同海域和养殖盘条件下,密度为4头/盘的处理组仿刺参单笼总重显著高于1和2头/盘的处理组(P < 0.05)。相对于初始体重,1头/盘的处理组仿刺参单笼总重表现出增长,其他处理组均表现为下降(图 4b)。
2.2.2 仿刺参个体体重和存活率三因素方差分析显示(表 3),海域对仿刺参个体体重影响极显著(P < 0.01),对其成活率影响不显著(P > 0.05),海参密度对两指标影响均极显著(P < 0.01),养殖盘对两指标影响均不显著(P > 0.05);两因素交互作用中只有海域×海参密度交互作用对仿刺参个体体重影响显著(P < 0.05),其他两因素交互作用对两指标影响均不显著(P > 0.05);三因素交互作用对仿刺参个体体重影响显著(P < 0.05),对其成活率影响不显著(P > 0.05)。
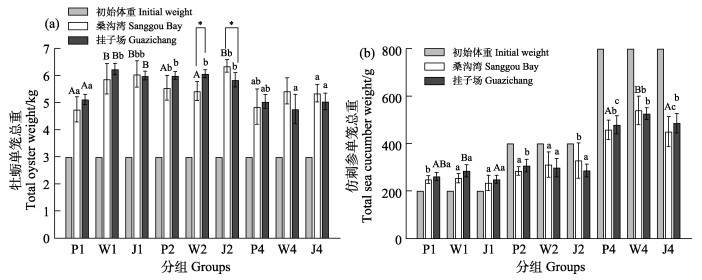
相同养殖盘和海参密度条件下,除W1、J1和P4处理组挂子场海域仿刺参个体体重显著高于桑沟湾海域以外(P < 0.05),其他各处理组不同海域之间均无显著差异(P > 0.05)。相同海域和海参密度条件下,挂子场海域的W1和J1处理组仿刺参个体体重显著高于P1处理组(P < 0.05)。相同海域和养殖盘条件下,密度为1头/盘的处理组显著高于2和4头/盘处理组(P < 0.05);同时,相对于初始仿刺参个体体重,仅有密度为1头/盘的处理组表现出增长,其他密度处理组均表现为下降(图 5a)。
|
图 5 仿刺参个体体重和成活率差异 Fig.5 Comparison of individual weight and survival rate of A. japonicus |
相同养殖盘和海参密度条件下,各处理组不同海域之间海参成活率均无显著差异(P > 0.05)。相同海域和海参密度条件下,仅有桑沟湾海域W2处理组显著低于P2和J2处理组(P < 0.05),其他各组之间无显著差异(P > 0.05)。相同海域和养殖盘条件下,海参密度为1头/盘的处理组显著高于2和4头/盘处理组(P < 0.05) (图 5b)。
2.2.3 长牡蛎个体体重和肥满度三因素方差分析显示,3种因素对长牡蛎个体体重及其肥满度均无显著影响(P > 0.05);两因素和三因素交互作用对两指标均无显著影响(P > 0.05) (表 3)。
在所有组别中,长牡蛎个体体重各组间均无显著差异(P > 0.05) (图 6a)。
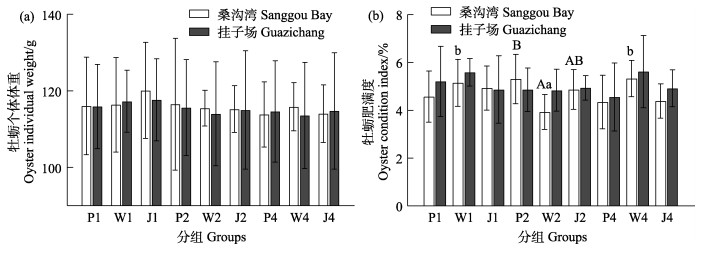
|
图 6 长牡蛎个体体重和肥满度差异 Fig.6 Comparison of individual weight and condition index of C. gigas |
相同养殖盘和海参密度条件下,各处理组不同海域之间长牡蛎肥满度均无显著差异(P > 0.05)。相同海域和海参密度条件下,仅有桑沟湾海域W2处理组长牡蛎肥满度显著低于P2处理组(P < 0.05),其他各组间无显著差异(P > 0.05)。相同海域和养殖盘条件下,仅有桑沟湾海域W2处理组长牡蛎肥满度显著低于W1和W4处理组(P < 0.05),其他各组间无显著差异(P > 0.05) (图 6b)。
3 讨论 3.1 实验海域水质条件变化对牡蛎养殖的启示桑沟湾和挂子场海域都是我国北方重要的水产养殖海域,其中,挂子场海域隶属于山东省乳山海域,以牡蛎养殖著称,有“中国牡蛎之乡”的美誉(Fang et al, 2016; 谭林涛等, 2019)。目前,很大一部分牡蛎在桑沟湾海区生长至一定规格后,转运去乳山海域中进行育肥养殖,这说明在生产实践中人们得出了乳山海域水质比桑沟湾海域更适合牡蛎生长的结论(徐雯雯等, 2021)。本研究中,测得桑沟湾海域Chl-a浓度范围为0.92~2.11 μg/L,与吴文广等(2016)于2014年测得Chl-a浓度(0.30~1.87 μg/L)大致相符;但测得挂子场海域Chl-a浓度范围为0.88~2.41 μg/L,显著低于陈辰等(2013)于2010年测得Chl-a浓度范围(0.76~9.94 μg/L);除12月和翌年5月以外,这2片海域的Chl-a浓度和POM含量相差较小,无显著差异(P > 0.05),这与传统认知中的“乳山水肥”相悖。由此可以推断,挂子场养殖区可能已经接近甚至超过了该海域的养殖容量。近年来,已有许多研究证实了这一点。徐雯雯等(2021)研究显示,乳山市牡蛎养殖面积由2008年的2 900 hm2已经发展至2020年的20 000 hm2;吕旭宁(2017)研究发现,在牡蛎的摄食压力作用下,养殖海域中浮游植物的生物量和悬浮颗粒物浓度迅速下降,难以支撑大规模牡蛎养殖的摄食和营养需求。本研究中,两海域长牡蛎生长和肥满度均无显著差异(P > 0.05),这也印证了环境数据的结果。同时,挂子场海域NO2–-N浓度显著高于桑沟湾海域,也可能是由于牡蛎的大规模养殖所导致。2021年市场调研发现,当年乳山海域养殖的牡蛎肥满度较差,相同养殖时间无法达到与往年相同的品质。综上所述,建议适当降低挂子场海域的牡蛎养殖密度,降低养殖户的养殖风险,有利于牡蛎养殖产业的可持续发展。
3.2 牡蛎–海参筏式综合养殖的可行性与优越性本研究中,海参密度为1头/盘的实验组经过8个月养殖后,个体体重较实验初始体重增重25%以上,同时,仿刺参的成活率都在90%以上,在较高密度的实验组中,个体体重均产生了不同程度的下降,成活率也显著低于密度为1头/盘实验组(P < 0.05)。这说明仿刺参在养殖笼有限的空间中,可通过摄食上层长牡蛎产生的粪便等生物沉积物以及附着在养殖盘上的藻类等附着物满足生长需求(Paltzat et al, 2008)。但海参密度增加后,食物需求也增加,笼内单位时间内产生的食物不足以满足仿刺参生长需求,导致个体体重下降、死亡率升高。
在6个密度为1头/盘的处理组中,挂子场海域仿刺参个体体重均显著高于桑沟湾海域(P < 0.05),这可能与不同海区附着在养殖笼内的藻类不同有关。相同海域和密度为1头/盘的条件下,W和J处理组的仿刺参个体体重高于P处理组,在挂子场海域有显著差异(P < 0.05)。推测认为,无孔养殖盘(W和J)相较于带孔养殖盘(P)表面积更大、水流冲刷弱、上层长牡蛎产生的生物沉积物会在养殖盘上积累更多,同时,无孔养殖盘上可供底栖硅藻附着的面积更大,为仿刺参提供了更多食物,促进其生长。J处理组相较于W处理组的仿刺参个体体重无显著差异(P > 0.05),虽然无节网上能附着更多藻类、生物沉积物等有机物,但考虑到海参活动能力较弱(许慈荣, 1983),无节网可能会阻碍仿刺参的活动,从而限制其活动范围,导致J处理组的个体体重未表现出更显著的增长。
本研究中,各处理组的长牡蛎生长无显著差异,说明通过该牡蛎–海参筏式综合养殖模式不会影响长牡蛎的生长,且通过养殖高经济价值的仿刺参,可以弥补牡蛎养殖密度下降带来的养殖收益下降问题。相较于底播养殖海参,筏式笼养模式安全性更高,可有效防止养殖海参被捕食,提高回捕率和成活率,且收获时无需潜水捕捞,降低了人力成本(刘园园等, 2013)。综上所述,在长牡蛎养殖笼中养殖适当数量的仿刺参可以降低牡蛎养殖密度,减少环境压力,同时,仿刺参可以弥补由于牡蛎密度降低造成的产量和收益下降。因此,该养殖模式可以作为牡蛎规模化养殖区的有益补充,从而促进牡蛎养殖产业的健康可持续发展。
ASHKENAZI D Y, ISRAEL A, ABELSON A. A novel two-stage seaweed integrated multi-trophic aquaculture. Reviews in Aquaculture, 2019, 11(1): 246-262 DOI:10.1111/raq.12238 |
CHEN C, LI Q, MU C M, et al. Analysis and evaluation of seasonal variation of water quality in the oyster cultivation regions of Rushan. Transactions of Oceanology and Limnology, 2013(1): 38-44 [陈辰, 李琪, 慕翠敏, 等. 乳山牡蛎养殖海域水质状况季节分析与评价. 海洋湖沼通报, 2013(1): 38-44] |
FANG J G, ZHANG J H, XIAO T, et al. Integrated multi-trophic aquaculture (IMTA) in Sanggou Bay, China. Aquaculture Environment Interactions, 2016, 8(1): 201-205 |
GUI J F, TANG Q S, LI Z J, et al. Aquaculture in China: Success stories and modern trends. John Wiley and Sons, 2018, 1: 103-104 |
HATCHER A, GRANT J, SCHOFIELD B. Effects of suspended mussel culture (Mytilus spp. ) on sedimentation, benthic respiration and sediment nutrient dynamics in a coastal bay. Marine Ecology-Progress Series, 1994, 115(3): 219-235 |
LIU Y Y, ZHANG J S, SHI F, et al. Contrastive experiment of sea cucumber culture in pond and cage. Hebei Fisheries, 2013(11): 46-47 [刘园园, 张劲松, 石峰, 等. 池塘和网箱养殖海参效果的对比试验. 河北渔业, 2013(11): 46-47] |
LÜ X N. Environmental effects and exploration of sustainable production model of large-scale mariculture of filter-feeding bivalves. Master´s Thesis of Shanghai Ocean University, 2017 [吕旭宁. 滤食性贝类规模化养殖的环境效应及可持续生产模式探索. 上海海洋大学硕士研究生学位论文, 2017]
|
NIE M C, HUANG C L, SUI Q, et al. Carbon and nitrogen stable isotope analysis and source identification of organic matter in sediments of Sanggou Bay. Progress in Fishery Sciences, 2022, 43(5): 84-97 [聂梦晨, 黄翠玲, 隋琪, 等. 桑沟湾沉积物有机质的碳氮稳定同位素分析及其来源解析. 渔业科学进展, 2022, 43(5): 84-97] |
PALTZAT D L, PEARCE C M, BARNES P A, et al. Growth and production of California sea cucumbers (Parastichopus californicus Stimpson) co-cultured with suspended Pacific oysters (Crassostrea gigas Thunberg). Aquaculture, 2008, 275(1/2/3/4): 124-137 |
PAN Y, LI J M, HUANG W D, et al. Analysis of current situations, existing problems of oyster industry and its developmental suggestions in Guangxi. Journal of Southern Agriculture, 2021, 52(9): 2608-2618 [潘英, 李坚明, 黄伟德, 等. 广西牡蛎产业现状分析及发展策略. 南方农业学报, 2021, 52(9): 2608-2618] |
QIN P B, LU J W, ZHAO Z X, et al. Change of POC and PN in different experiment ecosystems. Essays on Shellfish Science (Volume Ⅸ), 1999, 102-108 [秦培兵, 卢继武, 赵增霞, 等. 扇贝不同养殖模式室内模拟实验中POC、PN的变化比较. 贝类学论文集(第Ⅸ辑), 1999, 102-108] |
SUI X L, SUN J W, WANG F G, et al. Reasons of mass death-off in Pacific oyster cultured in Dalian sea shore. Journal of Dalian Fisheries University, 2002, 17(4): 272-278 [隋锡林, 孙景伟, 王富贵, 等. 大连沿海太平洋牡蛎大量死亡原因解析. 大连水产学院学报, 2002, 17(4): 272-278] |
TAN L T, WANG J G, XU W W, et al. Brief talk about the experience of Shandong Rushan oyster industry transform. China Fisheries, 2019(4): 50-52 [谭林涛, 王津果, 徐雯雯, 等. 浅谈山东乳山牡蛎产业转型经验. 中国水产, 2019(4): 50-52] |
WALNE P R. Experiments on the culture in the sea of the butterfish Venerupis decussata L. Aquaculture, 1976, 8(4): 371-381 |
WU W G, ZHANG J H, LIU Y, et al. Analysis of the effectiveness of the polyculture of shellfish and algae and influencing factors in the Xuejiadao sea cage aquaculture area. Progress in Fishery Sciences, 2022, 43(3): 146-155 [吴文广, 张继红, 刘毅, 等. 薛家岛海水网箱养殖海域贝藻综合养殖效果及其影响因素分析. 渔业科学进展, 2022, 43(3): 146-155] |
WU W G, ZHANG J H, WANG W, et al. Distribution of chlorophyll-a concentration and its control factors in spring in Sungo Bay. Acta Ecologica Sinica, 2016, 36(15): 4855-4863 [吴文广, 张继红, 王巍, 等. 桑沟湾春季叶绿素a浓度分布及其影响因素. 生态学报, 2016, 36(15): 4855-4863] |
XU C R. Morphological structure and living habits of sea cucumber. Bulletin of Biology, 1983(6): 22-24 [许慈荣. 海参的形态结构和生活习性. 生物学通报, 1983(6): 22-24] |
XU W W, ZHENG F Q, YU C S, et al. Rushan oyster industry development report. China Fisheries, 2021(12): 65-70 [徐雯雯, 郑富强, 于成松, 等. 乳山牡蛎产业发展报告. 中国水产, 2021(12): 65-70] |
YU X, LU Y B, LIU J Z, et al. Ecological farming of oyster. Journal of Aquaculture, 2020(4): 1–3, 7 [于潇, 卢钰博, 刘嘉卓, 等. 牡蛎的生态养殖. 水产养殖, 2020(4): 1–3, 7] |
ZHANG J H, WU T, GAO Y P, et al. Feeding behavior of 5 species filter-feeding bivalves on Paralichthys olivaceus feed, fecal and sediment particulates in cage farming area. Journal of Fisheries of China, 2013, 37(5): 727-734 [张继红, 吴桃, 高亚平, 等. 5种滤食性贝类对牙鲆的粪便、残饵及网箱养殖区沉降物的摄食行为. 水产学报, 2013, 37(5): 727-734] |
ZHAO J P. Study on three polyculture modes of Apostichopus japonicus. Master´s Thesis of Yantai University, 2018 [赵聚萍. 三种刺参混养模式的研究. 烟台大学硕士研究生学位论文, 2018]
|



