海草床是近岸海域生产力极高的生态系统之一,具有水质净化、海岸保护、碳封存等重要的生态功能,还可为众多海洋生物提供复杂多样的栖息、产卵、育幼和避敌等场所(Jackson et al, 2001; Marbà et al, 2007; Barbier et al, 2011; Christianen et al, 2013; Momota et al, 2022)。然而,受自然环境变迁和人类活动的影响,全球海草床的分布面积迅速减少,自1980年以来,全球约1/3的海草床已退化消失,且消失速率已从20世纪90年代的0.9%/yr上升至7%/yr (Waycott et al, 2009; Unsworth et al, 2019)。引起海草床衰退的因素主要包括台风、营养盐富集、水体浑浊度增加、渔业捕捞和围垦造田等,而因水体浊度增加导致的透明度下降是海草床退化和消失的主要因素之一(Li et al, 2021)。例如,2009年7月马来西亚东部老越海域发生浊度升高事件,水体浊度增加约2.5倍(浊度为10 NTU),海域内以羽叶二药草(Halodule pinifolia)为主的海草床的平均覆盖率在2个月后大约下降6% (Ahmad-Kamil et al, 2013)。
水体浊度增加的原因主要分为突发输入事件(如洪水、径流、降雨)和飓风、疏浚、拖网渔船作业及水产养殖等导致的沉积物再悬浮(Li et al, 2021)。水体浊度增加对沉水植物的负面影响往往是持续性的,短则持续数小时,长则可达数月(Chartrand et al, 2016)。相关研究发现,水体浊度升高对水生植物具有明显的消极影响(Samper-Villarreal et al, 2016)。例如,李强等(2006)研究发现,30~90 NTU水体浊度限制菹草(Potamogeton cripus)的生长,实验持续23 d时,植株株高和叶片数减少,90 NTU条件下,水下0.7 m处光照强度仅为水面光照强度(63 000 lx)的0.6%,菹草的株高和叶片数分别为对照组的86.5%和77.1%。Li等(2021)研究了水体浊度(4、50、100、200、300和400 NTU)和浊度突变持续时间(5、10、15和20 d)对鳗草(Zostera marina)存活和生长的影响(水深0.55 m),并对胁迫结束后的植株进行了30 d的恢复培育,发现浊度突变持续15 d,50~200 NTU浊度处理组鳗草的植株恢复努力(恢复结束时植株存活率与胁迫结束时植株存活率的比率)大于60%,而300~400 NTU浊度植株恢复努力为0,300 NTU浊度水平下,持续时间10 d植株地上生产努力(恢复结束时植株地上生产力与胁迫结束时植株地上生产力的比率)是5 d的66.7%。目前的研究主要集中于短周期水体浊度升高对沉水植物生长存活的影响,有关长周期水体浊度升高对海洋高等植物生长存活的影响及其生理响应过程的研究尚未见报道。
本研究以温带优势海草种类——鳗草为对象,通过3个月的室内实验,研究了不同水体浊度[2 (对照)、10、20、30和40 NTU]对鳗草存活和生长的影响,并探究了鳗草应对浊度长期胁迫的生理响应,以期为查明海草床的退化机理提供基础数据。
1 材料与方法 1.1 样品采集实验鳗草植株于2018年6月采自山东省荣成市天鹅湖海域(37°21′N,122°34′E)。采集期间,天鹅湖水体平均盐度为30.2,平均浊度为2 NTU。采集过程中,用手将鳗草植株从底部连根挖起,尽量保证植株根系完整,然后,将其用海水洗净,去除植株表面附着的泥沙、贝类和其他附生生物,运回马山集团有限公司育苗车间,置于12 m×1 m×0.6 m的循环水泥池暂养7 d。暂养期间,保持自然水温(23±1) ℃和光照条件(1 847.14~17 200.31 lx)。
1.2 实验设计以天鹅湖天然海草床的海水浊度(2 NTU)为对照组,浊度升高处理组则根据Li等(2021)的研究结论以及山东半岛成山角附近海域水体浊度(最高可达40 NTU以上) (王勇智等, 2014)等报道,分别设定为10、20、30和40 NTU。每个处理组设置12个重复,实验进行3个月。水体浊度配制所用泥沙为天鹅湖岸边土,将泥沙与海水混匀,静置5 min后,使用网目规格为100 µm的筛绢过滤上层悬浊液,将滤液在4个循环水泥池(8 m×1 m×0.8 m)中用海水分别配制成浊度为10、20、30和40 NTU的实验水体。水体浊度采用上海昕瑞WGZ-2型浊度仪测定。
1.3 实验过程 1.3.1 实验容器和基质使用60个聚乙烯盒(40 cm×30 cm×7 cm)作为移植容器,在聚乙烯盒中填充8 cm厚的基质。基质配比为25%细砂(粒度63~250 μm)与75%粉土和黏土(粒度 < 63 μm)的混合土壤(Zhang et al, 2015)。植株移植之前,先将装有基质的聚乙烯盒在海水中浸泡至少48 h,之后将其取出,于室温下晾晒2 h,以保证基质凝固,增加基质的固定性。
1.3.2 植株预处理和移植从暂养在室内循环水槽的植株中选取960株健康、生长状况良好的鳗草植株作为实验植株,并对实验植株进行标准化处理,即株高24~26 cm,叶片4~5片,茎节长5 cm,并对其进行标记。在植株维管束顶端即分生组织上方1 cm处使用针孔标记法标记所有叶片(Short et al, 2001),以进行植株生长速率测定。将标记植株随机平均分为60份,每份植株移植于1个聚乙烯盒中,移植时小心地将植株的根茎插入基质中约5 cm,随后于每个循环水泥池内随机放置12个聚乙烯盒并开始实验。
1.3.3 环境条件控制实验期间,海水盐度为30.0±1.2,自然水温为22.71~27.91 ℃,光照条件为1 847.14~17 200.31 lx,每天换自然海水1/2。为维持水体浊度的长期稳定,每个循环水泥池底各放置5个功率为200 W的水泵,以900 L/h的交换速率进行水体循环,各循环水泥池配备冷水机以控制水温。各处理组水下光照和温度使用美国Onset公司的HOBO温度/光照记录仪以15 min间隔进行连续监测,实验持续3个月。各处理组使用美国LI-Cor公司的LI-250数据采集器和LI-193SA球形光量子传感器同步测定水下光照,拟合光照强度(lx)和光合光量子通量密度[photosynthetic flux density, PFD, µmol/(m2·s)]之间的关系,将HOBO光照和温度数据采集器采集到的光照强度数据转换为PFD,并计算出日PFD [mol/(m2·d)]。根据Beer-Lambert表达式(Iz=Is×e–Kd Z,Z为深度,Iz为Z深度处的辐照度,Is为表面辐照度)计算不同浊度组的光照衰减系数(Kd, m–1) (Ruiz et al, 2003)。
1.4 样品采集与处理 1.4.1 存活与生长指标实验结束,统计各处理组鳗草植株的存活情况,并计算存活率(SR, %)。各处理组随机选取4组重复,每组重复随机选取6株植株监测鳗草的株高(H, cm)、新生的根长(R, cm)、茎节直径(I, mm)、单株叶面积(TLA, cm2/shoot)、叶片延伸速率[LER, cm/(shoot·d)]、茎节伸长速率[(IER, mm/(shoot·d)]、地上生产力[ADP, mg·DW/(shoot·d)]和地下生产力[BDP, mg·DW/(shoot·d)] (张沛东等, 2016; Xu et al, 2019)。
1.4.2 生理指标 1.4.2.1 光合色素各处理组中随机抽取4个重复组,每个重复中随机抽取1~2株植株,取植株第2片新叶2 cm2浸没于5 mL N, N-二甲基甲酰胺中,于黑暗条件下萃取3 d,采用萃取法测定叶片叶绿素a含量(Chl-a, mg/cm2)和叶绿素b含量(Chl-b, mg/cm2) (王文杰等, 2009)。
1.4.2.2 非结构性碳水化合物各处理组随机选取4个重复组,每个重复组随机选取1~2株植株,于60 ℃下烘干至恒重,并对干样进行研磨,采用蒽酮法测定植株可溶性糖含量(SS, mg/g)和淀粉含量(S, mg/g) (Lewis et al, 2007)。
1.5 数据分析对所有数据进行正态性和方差齐性检验,以满足参数统计分析的假设。对鳗草植株各指标进行单因素方差分析(one-way ANOVA)检验不同水体浊度对鳗草的影响,使用Duncan多重比较分析组间差异,结果使用平均值±标准差(Mean±SD)表示,显著性水平设置为P < 0.05。数据统计分析和曲线拟合使用SPSS 25.0软件进行,分析结果使用OriginLab 2023、R语言进行绘图。采用R语言ggplot2包对各处理组鳗草植株的存活和生长指标进行主成分分析(principal component analysis, PCA),以揭示鳗草植株生长与存活之间的关系并进行降维。采用R语言Corrplot包对鳗草植株存活率、生产力、可溶性糖和叶绿素等指标进行Spearman相关性分析,揭示生长、存活和生理之间的潜在相关性。
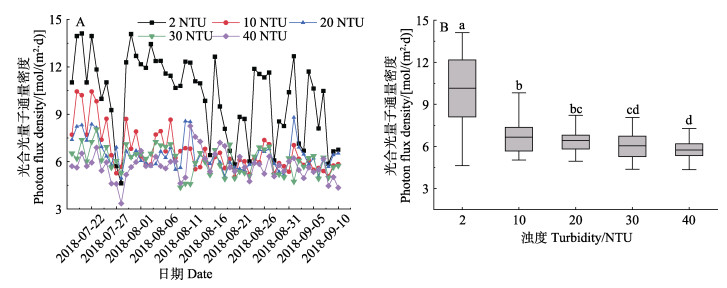
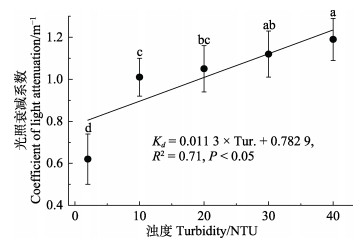
2 结果 2.1 水温和光合光量子通量密度(PFD)实验期间,水温范围为22.7~27.9 ℃,各处理组间无显著差异(P > 0.05)。不同处理组水体PFD存在显著不同(P < 0.05),呈现随水体浊度增加,水体PFD减弱的趋势;40 NTU处理组的平均PFD为5.8 mol/(m2·d),与对照组相比降低了40.3% (图 1)。光照衰减系数Kd值范围为0.62~1.19 m–1,随水体浊度增加,Kd值持续增大,曲线拟合显示,Kd和水体浊度(Tur.)呈现显著的线性关系(P < 0.05)(图 2)。
|
图 1 实验期间各处理组水下光合光量子通量密度的变化(A)和比较(B) Fig.1 The change (A) and comparison (B) of underwater photon flux density in each treatment during the experiment 不同字母代表组间差异显著, Duncan test, P < 0.05。下同。 Different letters represent significant differences among treatments, Duncan test, P < 0.05. The same as below. |
|
图 2 不同水体浊度水平光照衰减系数的变化 Fig.2 The change of coefficient of light attenuation under different turbidity levels |
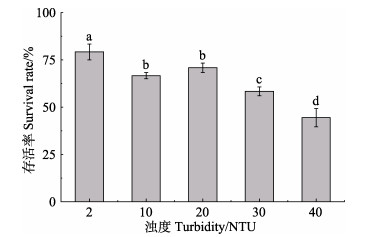
鳗草植株存活率随水体浊度增加呈现逐渐降低的趋势,至40 NTU处理组,植株存活率为44.4%,仅为对照组的56.1% (图 3)。单因素方差分析显示,各处理组之间存在显著差异,浊度升高处理组鳗草存活率均显著低于对照组(P < 0.05)。
|
图 3 不同水体浊度水平下鳗草植株存活率的变化 Fig.3 The change of survival rate of Z. marina under different turbidity levels |
单因素方差分析结果显示,10~40 NTU处理组鳗草植株的各项生长指标均显著低于对照组(P < 0.05) (表 1)。水体浊度升高对植株的根长、单株叶面积和茎节延伸速率影响最显著,其中,30和40 NTU处理组植株均未见新生根,40 NTU处理组植株的单株叶面积和茎节延伸速率均不足对照组的50%。水体浊度升高对植株的株高、茎节直径和叶片延伸速率亦有显著影响,40 NTU处理组植株3项指标分别是对照组的75.5%、74.1%和61.6%。鳗草的植株生产力随水体浊度增加呈显著降低趋势,至40 NTU处理组,植株地上和地下生产力与对照组相比下降64.6%和78.8%。
|
|
表 1 不同浊度水平下鳗草生长指标的变化 Tab.1 The changes of growth indices of Z. marina under different turbidity levels |
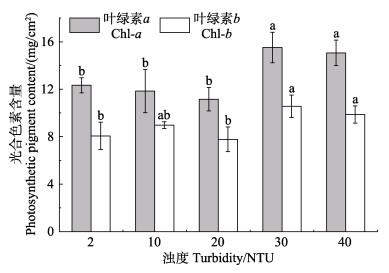
单因素方差分析结果显示,10和20 NTU处理组植株的叶绿素含量与对照组无显著差异(P > 0.05),而30和40 NTU处理组植株的光合色素含量均显著高于对照组(P < 0.05) (图 4)。其中,30和40 NTU处理组植株Chl-a含量平均是对照组的1.24倍,Chl-b含量则平均是对照组的1.27倍。
|
图 4 不同浊度水平下鳗草光合色素含量的变化 Fig.4 The changes of photosynthetic pigment contents of Z. marina under different turbidity levels |
实验发现,植株组织可溶性糖和淀粉含量随浊度增加基本呈逐渐降低的变化趋势(图 5)。单因素方差分析结果显示,各浊度升高处理组的鳗草组织可溶性糖和淀粉含量均显著低于对照组(P < 0.05)。10~40 NTU浊度组植株地上组织可溶性糖含量与对照组相比降低了20.2%~74.7%,植株地下组织可溶性糖含量分别为对照组的77.3%~ 62.3%。30 NTU浊度水平下,植株地上组织淀粉含量最低,与对照组相比下降了38.1%。至40 NTU处理组,植株地下组织淀粉含量为对照组的60.2%。

|
图 5 不同浊度水平下鳗草非结构性碳水化合物含量的变化 Fig.5 The changes of non-structural carbohydrates content of Z. marina under different turbidity levels |
对不同浊度水平之间鳗草植株的存活和生长指标进行主成分分析(图 6)。第1排序轴和第2排序轴对植株各指标的累计解释量达91.4%。除株高外,其他指标在第1排序轴附近聚成一簇,呈较强相关性,且相关性随矢量夹角的增加而降低。植株的株高H的贡献最大,其后依次是叶片延伸速率LER、地下生产力ADP和地上生产力BDP。将9个指标的射线延长,5个处理组均垂直投射到射线上,根据投影点到射线实心箭头处的相对距离为标准进行排序,综合结果为2 NTU(对照) > 10 NTU > 20 NTU > 30 NTU > 40 NTU,40 NTU浊度条件下,植株的存活率和生长指标均低于其他浊度处理组。

|
图 6 鳗草存活和生长指标的主成分分析 Fig.6 Principal component analysis of survival and growth indices of Z. marina H:株高;R:根长;I:茎节直径;TLA:单株叶面积;IER:茎节延伸速率;LER:叶片延伸速率;ADP:地上生产力;BDP:地下生产力;SR:存活率。 H: Shoot height; R: Root length; I: Internode diameter; TLA: Total leaf area; IER: Internode elongation rate; LER: Leaf elongation rate; ADP: Aboveground productivity; BDP: Belowground productivity; SR: Survival rate. |
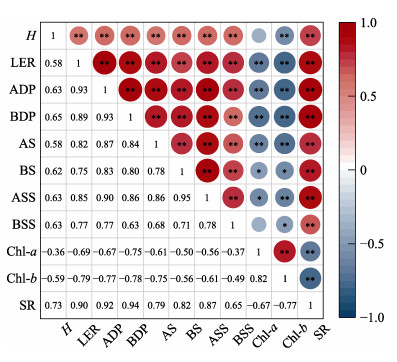
选取SR以及解释量较大的生长指标H、LER、ADP、BDP和生理指标进行相关性分析(图 7)。如图 7所示,植株的生态学指标与生理指标之间存在较强的相关性。植株存活率与地上组织可溶性糖含量呈极显著正相关关系(ρ=0.87, P < 0.01),植株生产力则与可溶性糖含量呈极显著的正相关(P < 0.01);植株Chl-a、Chl-b含量与植株的生长、存活间存在较强负相关性。因此,水体浊度增加主要是通过影响植株非结构性碳水化合物,进而对植株存活和生长造成负面影响。为适应高水体浊度下水体光照强度的降低,植株的光合色素含量升高,提高了植株的光合效率,以应对水体光照强度的降低。
|
图 7 鳗草生态学指标和生理指标的相关性分析 Fig.7 Correlation analysis between ecological indicators and physiological indices of Z. marina. H:株高;LER:叶片延伸速率;ADP:地上生产力;BDP:地下生产力;AS:地上组织淀粉;BS:地下组织淀粉;ASS:地上组织可溶性糖;BSS:地下组织可溶性糖;Chl-a:叶绿素a;Chl-b:叶绿素b;SR:存活率。*:P≤0.05;**:P≤0.01。 H: Shoot height; LER: Leaf elongation rate; ADP: Aboveground productivity; BDP: Belowground productivity; AS: Aboveground starch; BS: Belowground starch; ASS: Aboveground soluble sugar; BSS: Belowground soluble sugar; Chl-a: Chlorophyll a; Chl-b: Chlorophyll b; SR: Survival rate; *: P≤0.05; **: P≤0.01. |
长期水体浊度升高可导致海草床的急剧衰退。York等(2015)研究发现,澳大利亚昆士兰因波特港口于2006年开展了8个月的疏浚活动,造成了大量持续的浑浊水流[日总辐照度 < 0.5 mol/(m·d)],导致该区域的毛叶喜盐草(Halophila decipiens)和棘状喜盐草(Halophila spinulosa)在疏浚期间无法建植,且疏浚结束8个月后海草的平均生物量仅为疏浚前的1%,于2012年10月恢复至疏浚前生物量峰值的12%。本研究表明,水体浊度长时间升高严重限制了鳗草植株的存活和生长,当水体浊度持续3个月为40 NTU时,鳗草植株的存活率与对照组相比显著降低43.9%,叶片延伸速率和地上生产力则分别显著降低38.4%和64.6%。Bulmer等(2018)分析了水体浊度对新西兰凯帕拉湾3个海区的牟氏鳗草(Zostera muelleri)生长状况的影响,结果发现,牟氏鳗草的总生物量在Mairetahi Creek (水体浊度为41 g/m3)最低,为2.14 g/core,分别是Kakaria Flats (浊度为25 g/m3)和Tapora Bank (浊度为12 g/m3)的76.4%和57.8%。Li等(2021)研究发现,在200 NTU浊度水平下,持续时间为20 d时,鳗草的植株生产努力与持续时间为5 d时相比下降约28%,300 NTU浊度水平下植株的半致死时间(死亡率增加至对照组死亡率的50%的持续时间)为50 NTU浊度组的1/2左右。在一些淡水沉水植物的相关研究中也有类似发现,王晋等(2015)研究发现,水体浊度30 NTU (水深0.65 m)持续20 d菹草的植株高度显著降低至对照组的78%,持续至33 d时,植株大量死亡,叶片数降低至对照组的73%。综上,水体浊度升高对水生植物(包括海草)的生长发育具有一定限制作用,且随着浊度持续时间的增加抑制作用愈发明显。
水体浊度增加导致海水悬浮颗粒物水平增加,造成水下辐照度降低,从而导致海草的存活和生长受到限制(Vermaat et al, 1997)。一般而言,浊度升高导致的光照降低和叶片泥沙附着增加对海草生长存活的双重负面影响,更容易致使植株死亡。大量研究表明,光照是限制海草生长存活的关键因子(牛淑娜等, 2011),维持海草正常生长存活的表面辐照度通常需要大于11% (Ochieng et al, 2010; 符妙等, 2022a)。Bertelli等(2018)研究模拟了表面辐照度降低对鳗草生长的影响,发现40%和90%遮光条件下[冠层PFD分别为0.73和0.35 mol/(m2·d)]持续29 d时,鳗草叶片表面积与对照组相比分别降低了41.5%和44.0%。符妙等(2022b)在黎安港对海菖蒲(Enhalus acoroides)进行原位遮光实验,发现海菖蒲生物量随光照减弱而降低,其中,60%和90%遮光处理下,海菖蒲的地上组织生物量分别是全光照组的69%和56%。Li等(2021)研究也发现,浑浊水体中植株叶片上的泥沙负荷增加会降低海草的光可利用性。Bryars等(2004)调查发现,南澳大利亚阿德莱德港污水处理厂运行了15年的污泥排放口致使周边365 hm2区域的波状波喜荡海草(Posidonia sinuosa)、南极根枝草(Amphibolis antarctica)和塔斯鳗草(Zostera tasmanica)完全丧失。Lambert等(2021)调查研究了澳大利亚伯德金河河口沉积物再悬浮对海草生态特征的影响,发现悬浮颗粒物负荷与植株密度呈显著负相关,2011—2012年悬浮颗粒物强度达到20~30 Mt (1 Mt =103 kg),致使海草床面积一年内下降近50%。综上,导致鳗草植株存活率下降、植株生长速率降低、生产力下降的因素可能是水体浊度升高引起的叶片泥沙负荷增加和水下光照减弱。
3.2 海草对水体浊度升高的生理响应光合色素是植物进行光合作用不可或缺的物质,植物组织中储存的非结构性碳水化合物是光合作用的产物,在植物生命代谢过程发挥重要作用(江志坚等, 2012)。本研究结果显示,随水体浊度增加,鳗草植株的非结构性碳水化合物(可溶性糖和淀粉)含量显著下降,叶绿素含量增加;当水体浊度升高至40 NTU时,植株地上组织可溶性糖含量下降为对照组的25.3%,叶绿素a和叶绿素b含量则为对照组的1.2倍。
随着水体浊度升高,水体透光率降低,水下形成弱光照环境。另外,光质也随之发生变化,蓝光的吸收增加,海草叶片用于吸收蓝光的叶绿素b含量也相对于叶绿素a增加(符妙等, 2022b)。Longstaff等(1999)发现,遮光(冠层光照强度为0 lx) 78 d,羽叶二药草(Halodule pinifolia)叶片Chl-a/Chl-b下降至遮光前的86%,总Chl含量相比遮光前增加52%。海草叶片Chl含量增加、Chl-a和Chl-b含量比值降低是应对水体浊度升高(或水体透明度降低)的一种适应性反应(Longstaff et al, 1999)。为适应高浊度环境,植株叶片光合色素含量升高以生产更多的有机物质,平衡呼吸消耗的能量进行光补偿(Longstaff et al, 1999)。然而,在过高的浊度环境,光合效率降低,组织非结构性碳水化合物的消耗超过光合作用的净生产量,严重限制了植株的生长和存活(Durako, 1993; 丰玉等, 2018)。
水体浊度升高影响的是光照通透性,透光率降低,植株的光可利用性下降。在西班牙东南部黎凡特湾,高浊度的内港光可用性为表面辐照度(Surface irradiance, SI)的21.9%~24.6%,而低浊度的外港约为SI的30% (Ruiz et al, 2003)。弱光环境下,植株的光合作用受限制,海草光合作用产物不足以维持正常生长所需,组织中储存的非结构性碳水化合物作为能源被过量消耗(Alcoverro et al, 2001; Ruiz et al, 2003; Ralph et al, 2007; Eklof et al, 2009)。Longstaff等(1999)研究发现,遮光前羽叶二药草叶片13C同位素比值为–9‰,而在遮光(冠层光照强度为0 lx) 38和78 d时分别降至–9.5‰和–10.5‰。Silva等(2013)研究发现,处于24% [PFD=19.7 mol/(m2·d)]、40% [PFD=15.6 mol/(m2·d)]和75% [PFD=6.5 mol/(m2·d)]光衰减环境(水深3 m) 3周后,鳗草叶片和根茎的可溶性糖含量显著低于天然光照组[PFD=25.9 mol/(m2·d)],其中,根茎可溶糖含量相比对照组降低了70%~85%。Collier等(2008)研究发现,在3~4 m水深、遮光条件[冠层PFD为0.6 mol/(m2·d)]下,波状波喜荡草地下组织可溶性糖与对照组相比下降了32%~52%。Ruiz等(2003)研究发现,西班牙黎凡特湾港口高浊度区[光照衰减系数Kd为0.205 m–1,冠层PFD为6.67 mol/(m2·d)]大洋波喜荡草(Posidonia oceanica)植株根茎淀粉含量是中浊度区[Kd=0.184 m–1,冠层PFD为7.72 mol/(m2·d)]和低浊度区[Kd=0.131 m–1,冠层PFD为9.28 mol/(m2·d)]的57%和64%。综上所述,植株叶绿素含量增加、非结构性碳水化合物含量下降可能是海草应对水体浊度升高导致的水体透光率降低、植株光可利用性下降的重要生理响应过程。
4 结论水体浊度增加对沉水植物的负面影响往往是持续性的,导致的光照降低和叶片泥沙附着对海草生长存活的双重负面影响,更易致植株死亡。本研究以温带优势海草种类——鳗草为对象,探究了不同水体浊度对鳗草存活和生长的影响,分析了鳗草应对浊度长期胁迫的生理响应。实验结束时,10~40 NTU浊度组植株的存活率较对照组降低了15.8%~43.9%,30~40 NTU浊度组无新生根且其地上和地下生产力均低于对照组的50%;10~40 NTU浊度组植株地上组织可溶性糖含量与对照组相比降低了20.2%~74.7%,而植株叶绿素含量随水体浊度的升高而升高,其中,30和40 NTU处理组植株Chl-a和Chl-b含量平均分别为对照组的1.24和1.27倍。研究表明,水体浊度长时间增加能抑制鳗草植株的存活和生长扩繁,其主要通过影响植株非结构性碳水化合物,进而对鳗草的存活和生长造成负面影响,同时,鳗草植株通过增加光合色素含量,进而提高光合效率以应对高水体浊度条件下水下光照强度的降低。研究结果为阐明海草床的退化机理及选择适宜的修复区等提供了基础数据。
AHMAD-KAMIL E I, RAMLI R, IAAMAN S A, et al. The effects of water parameters on monthly seagrass percentage cover in Lawas, East Malaysia. Scientific World Journal, 2013, 2013: 892746 |
ALCOVERRO T, MANZANERA M, ROMERO J. Annual metabolic carbon balance of the seagrass Posidonia oceanica: The importance of carbohydrate reserves. Marine Ecology Progress Series, 2001, 211: 105-116 DOI:10.3354/meps211105 |
BARBIER E B, HACKER S D, KENNEDY C, et al. The value of estuarine and coastal ecosystem services. Ecological Monographs, 2011, 81(2): 169-193 DOI:10.1890/10-1510.1 |
BERTELLI C M, UNSWORTH R K F. Light stress responses by the eelgrass, Zostera marina (L). Frontiers in Environmental Science, 2018, 6: 39 DOI:10.3389/fenvs.2018.00039 |
BRYARS S, NEVERAUSKAS V. Natural recolonisation of seagrasses at a disused sewage sludge outfall. Aquatic Botany, 2004, 80(4): 283-289 DOI:10.1016/j.aquabot.2004.09.001 |
BULMER R H, TOWNSEND M, DRYLIE T, et al. Elevated turbidity and the nutrient removal capacity of seagrass. Frontiers in Marine Science, 2018, 5: 462 DOI:10.3389/fmars.2018.00462 |
CHARTRAND K M, BRYANT C V, CARTER A B, et al. Light Thresholds to prevent dredging impacts on the Great Barrier Reef seagrass, Zostera muelleri ssp. capricorni. Frontiers in Marine Science, 2016, 3: 106 |
CHRISTIANEN M J A, Van BELZEN J, HERMAN P M J, et al. Low-canopy seagrass beds still provide important coastal protection services. PLoS One, 2013, 8(5): e62413 DOI:10.1371/journal.pone.0062413 |
COLLIER C J, LAVERY P S, RALPH P J, et al. Shade-induced response and recovery of the seagrass Posidonia sinuosa. Journal of Experimental Marine Biology and Ecology, 2008, 370(1/2): 89-103 |
DURAKO M J. Photosynthetic utilization of CO2(aq) and HCO3– in Thalassia testudinum (Hydrocharitaceae). Marine Biology, 1993, 115(3): 373-380 DOI:10.1007/BF00349834 |
EKLOF J S, MCMAHON K, LAVERY P S. Effects of multiple disturbances in seagrass meadows: Shading decreases resilience to grazing. Marine and Freshwater Research, 2009, 60(12): 1317-1327 DOI:10.1071/MF09008 |
FENG Y, JIANG X L, LIN H Y, et al. Photosynthetic responce of Zostera japonica during environmental stress in the Yellow River Estuary. Journal of Beijing Normal University (Natural Science), 2018, 54(1): 25-31 [丰玉, 蒋湘丽, 林海英, 等. 黄河口日本鳗草(Zostera japonica)在环境胁迫下的光合响应研究. 北京师范大学学报(自然科学版), 2018, 54(1): 25-31] |
FU M, DENG N, LIAO L G, et al. Effects of shading on morphological characteristics and element content of Enhalus acoroides. Journal of Tropical Biology, 2022a, 13(3): 212-219 [符妙, 邓娜, 廖立国, 等. 遮光对海菖蒲形态特征及元素含量的影响. 热带生物学报, 2022a, 13(3): 212-219 DOI:10.15886/j.cnki.rdswxb.2022.03.002] |
FU M, LIAO L G, LIU Y S, et al. Research progress on the effect of light reduction on seagrass. Marine Fisheries, 2022b, 44(5): 648-656 [符妙, 廖立国, 刘应帅, 等. 光照减少对海草的影响研究进展. 海洋渔业, 2022b, 44(5): 648-656 DOI:10.13233/j.cnki.mar.fish.20220812.001] |
JACKSON E L, ROWDEN A A, ATTRILL M J, et al. The importance of seagrass beds as a habitat for fishery species. Oceanography and Marine Biology, 2001, 39: 269-304 |
JIANG Z J, HUANG X P, ZHANG J P. Effect of environment stress on non-structural carbohydrates reserves and transfer in seagrasses. Acta Ecologica Sinica, 2012, 32(19): 6242-6250 [江志坚, 黄小平, 张景平. 环境胁迫对海草非结构性碳水化合物储存和转移的影响. 生态学报, 2012, 32(19): 6242-6250] |
LAMBERT V, BAINBRIDGE Z T, COLLIER C, et al. Connecting targets for catchment sediment loads to ecological outcomes for seagrass using multiple lines of evidence. Marine Pollution Bulletin, 2021, 169(6): 112494 |
LEWIS M A, DANTIN D D, CHANCY C A, et al. Florida seagrass habitat evaluation: A comparative survey for chemical quality. Environmental Pollution, 2007, 146(1): 206-218 DOI:10.1016/j.envpol.2006.04.041 |
LI C, ZHANG Y H, WU X X, et al. Changes in survival and growth in response to different combinations of turbidity and duration in eelgrass Zostera marina plants. Estuarine, Coastal and Shelf Science, 2021, 249: 107108 DOI:10.1016/j.ecss.2020.107108 |
LI Q, WANG G X, PAN G Q, et al. Influence of water turbidity on germination of Potamogeton crispus and growth of germinated seedling. Acta Ecologica Sinica, 2006, 26(11): 3594-3601 [李强, 王国祥, 潘国权, 等. 水体浊度对菹草萌发及萌发苗光合荧光特性的影响. 生态学报, 2006, 26(11): 3594-3601 DOI:10.3321/j.issn:1000-0933.2006.11.010] |
LONGSTAFF B J, DENNISON W C. Seagrass survival during pulsed turbidity events: The effects of light deprivation on the seagrasses Halodule pinifolia and Halophila ovalis. Aquatic Botany, 1999, 65(1/2/3/4): 105-121 |
MARBÀ N, HOLMER M, GACIA E, et al. Seagrass beds and coastal biogeochemistry. Seagrasses: Biology, Ecology and Conservation, 2007, 135-157 |
MOMOTA K, HOSOKAWA S, KOMURO T. Small-scale heterogeneity of fish diversity evaluated by environmental DNA analysis in eelgrass beds. Marine Ecology Progress Series, 2022, 688: 99-112 DOI:10.3354/meps13994 |
NIU S N, ZHANG P D, ZHANG X M. Research progress in the effect of light intensity on the growth and photosynthesis of submerged aquatic vegetation. Modern Fisheries Information, 2011, 26(11): 9-12 [牛淑娜, 张沛东, 张秀梅. 光照强度对沉水植物生长和光合作用影响的研究进展. 现代渔业信息, 2011, 26(11): 9-12] |
OCHIENG C A, SHORT F T, WALKER D I. Photosynthetic and morphological responses of eelgrass (Zostera marina L.) to a gradient of light conditions. Journal of Experimental Marine Biology and Ecology, 2010, 382(2): 117-124 DOI:10.1016/j.jembe.2009.11.007 |
RALPH P J, DURAKO M J, ENRÍQUEZ S, et al. Impact of light limitation on seagrasses. Journal of Experimental Marine Biology and Ecology, 2007, 350(1/2): 176-193 |
RUIZ J M, ROMERO J. Effects of disturbances caused by coastal constructions on spatial structure, growth dynamics and photosynthesis of the seagrass Posidonia oceanica. Marine Pollution Bulletin, 2003, 46(12): 1523-1533 DOI:10.1016/j.marpolbul.2003.08.021 |
SAMPER-VILLARREAL J, LOVELOCK C E, SAUNDERS M I, et al. Organic carbon in seagrass sediments is influenced by seagrass canopy complexity, turbidity, wave height, and water depth. Limnology and Oceanography, 2016, 61(3): 938-952 DOI:10.1002/lno.10262 |
SHORT F T, DUARTE C M. Methods for the measurement of seagrass growth and production. Global Seagrass Research Methods, 2001, 155-182 |
SILVA J, BARROTE I, COSTA M M, et al. Physiological responses of Zostera marina and Cymodocea nodosa to light-limitation stress. PLoS One, 2013, 8(11): e81058 DOI:10.1371/journal.pone.0081058 |
UNSWORTH R K F, MTWANA NORDLUND L M, CULLEN- UNSWORTH L C. Seagrass meadows support global fisheries production. Conservation Letters, 2019, 12(1): e12566 DOI:10.1111/conl.12566 |
VERMAAT J E, AGAWIN N S R, FORTES M D, et al. The capacity of seagrasses to survive increased turbidity and siltation: The significance of growth form and light use. Ambio, 1997, 26(8): 499-504 |
WANG J, LIN C, ZHANG Y M, et al. Impact of water turbidity on growth of submerged plant Potamogeton cripus. Journal of Ecology and Rural Environment, 2015, 31(3): 353-358 [王晋, 林超, 张毅敏, 等. 水体浊度对沉水植物菹草生长的影响. 生态与农村环境学报, 2015, 31(3): 353-358] |
WANG W J, HE H S, GUAN Y, et al. Methodological comparison of chlorophyll and carotenoids contents of plant species measured by DMSO and acetone-extraction methods. Bulletin of Botanical Research, 2009, 29(2): 224-229 [王文杰, 贺海升, 关宇, 等. 丙酮和二甲基亚砜法测定植物叶绿素和类胡萝卜素的方法学比较. 植物研究, 2009, 29(2): 224-229] |
WANG Y Z, JU X, QIAO L L, et al. Water turbidity in the northern Yellow Sea in summer and winter. Oceanologia et Limnologia Sinica, 2014, 45(5): 928-937 [王勇智, 鞠霞, 乔璐璐, 等. 夏冬季北黄海水体浊度分布特征研究. 海洋与湖沼, 2014, 45(5): 928-937] |
WAYCOTT M, DUARTE C M, CARRUTHERS T J B, et al. Accelerating loss of seagrasses across the globe threatens coastal ecosystems. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(30): 12377-12381 |
XU J G, ZHANG Q, LI H C, et al. Changes in survival, growth and photosynthetic pigment in response to iron increase in the leaf and root-rhizome tissues of eelgrass Zostera marina. Aquatic Botany, 2019, 154: 60-65 |
YORK P H, CARTER A B, CHARTRAND K, et al. Dynamics of a deep-water seagrass population on the Great Barrier Reef: Annual occurrence and response to a major dredging program. Scientific Reports, 2015, 5(1): 13167 |
ZHANG P D, WU X X, XU Q, et al. Studies on promotion of exogenous auxin to Zostera marina growth. Periodical of Ocean University of China, 2016, 46(11): 99-107 [张沛东, 吴晓晓, 徐强, 等. 外源植物生长素对鳗草植株促生长作用的研究. 中国海洋大学学报(自然科学版), 2016, 46(11): 99-107] |
ZHANG Q, LIU J, ZHANG P D, et al. Effect of silt and clay percentage in sediment on the survival and growth of eelgrass Zostera marina: Transplantation experiment in Swan Lake on the eastern coast of Shandong Peninsula, China. Aquatic Botany, 2015, 122: 15-19 |



