海草是一类能够在海洋环境中完成整个生活史的高等被子植物,其在适宜环境中能够成片生长从而形成大面积的海草床(Short et al, 2011; 周媛媛, 2021)。海草床是近岸海域生产力最高的生态系统之一,在海洋生态环境改善、觅食与庇护所提供、防风固堤、碳封存等方面具有极其重要的生态功能(Stevenson, 1988)。然而,受人类活动及气候变化等影响,全球海草床的分布面积正以110 km2/yr的速度迅速衰退,目前,全球约有29%的海草床已完全消失,且退化速度仍在加快(吴钟解等, 2021)。
随着海草床退化趋势的日趋严重,有关海草床的生态修复与保护愈发受到国内外学者的关注(Steinbach et al, 1997; Martins et al, 2005; 王丽荣等, 2018)。大多数海草的种子数量多、易于采集和保存,海草种子生态修复法成为当前海草床规模化生态修复工程的首选,并得到广泛应用(周毅等, 2020)。但在海草床修复实践中,播种的海草种子受到埋藏深度、水流冲刷、生物捕食与扰动等多重因素影响(刘燕山等, 2014),其成苗率普遍在1%~10%之间(Orth et al, 2009)。此外,大部分海草的种子具有坚硬的种皮,休眠期长达几周至几年,导致播种种子的成苗率偏低(高春智等, 2012; 田璐, 2014)。因此,明确海草种子的播前促萌理论和方法,是提高海草播种种子成苗率的有效途径之一。
有关播前促萌打破海草种子休眠的研究已有较多报道。研究表明,盐度、温度、光照、溶解氧、激素和机械划破种皮等因素都是影响海草种子休眠或萌发的主要因素(刘永庆等, 1995; 李凤玲等, 2000; 李海平等, 2009),但不同因素对海草种子萌发的影响程度存在差异。刘云龙等(2016)研究发现,低盐条件能促进鳗草(Zostera marina)种子萌发,当盐度降至15以下时种子萌发率显著提高,且淡水处理的种子萌发率最高。一些研究表明,酸蚀、摩擦、刺破等方式破除种皮可促进某些采用物理方法休眠的海草种子萌发,如诺氏鳗草(Z. noltii)和鳗草(Loques et al, 1990; Harrison et al, 1992)。Conacher等(1994)研究发现,较高浓度的赤霉素(50 mg/L,GbA3和KN03)和硫脲(50 mg/L)处理可以促进牟氏鳗草(Z. muelleri)种子萌发。在种子萌发时,种子内部会进行一系列生理生化变化,包括能量代谢、贮藏物质的转化和细胞的修复与活化等。种子吸水是萌发的启动条件,随后种子的淀粉、脂肪、蛋白质等组分在呼吸作用下被分解和转化,用于种子的生长发育(潘瑞炽等, 2008)。尽管有关海草种子萌发生理的研究已有一些报道,但关于播前促萌对海草种子萌发和生理特性的影响还未见报道。
对陆生植物与水生植物的研究均表明,赤霉素和弱酸条件均能促进种子萌发(Jiang et al, 2016; 张敏等, 2021)。例如,田璐(2014)探究了不同种皮破除方式(摩擦、酸蚀、碱蚀等)以及赤霉素处理对鳗草种子萌发的影响,发现摩擦破除种皮、50 mg/L赤霉素处理和pH=6、浸种96 h的弱酸处理,对鳗草种子具有良好的促萌效果,2个处理的种子累积萌发率分别达到62.9%和77.9%。本研究在借鉴已有报道的基础上,以温带海域海草优势种——鳗草为对象,验证外源赤霉素处理(50 mg/L浸种15 d)和弱酸处理(pH=6浸种96 h)对鳗草种子破除休眠的影响,分析种子萌发过程中α-淀粉酶活性、淀粉和可溶性糖含量的变化,旨在查明鳗草种子对不同促萌手段的生理学响应过程,以期为建立鳗草种子人工促萌理论提供参考。
1 材料与方法 1.1 种子采集与保存实验用鳗草种子于2019年7月采集于山东省荣成市天鹅湖海域(37.3382°N~37.3588°N, 122.5551°E~ 122.5793°E)。天鹅湖鳗草海草床的平均种子产量可达(53 623.66±19 628.11) seeds/m2 (徐少春, 2017)。因此,采集时仅需选择2~3 m2的海草床即可满足本研究种子用量。采集时,仅摘取具有种子的佛焰苞,避免对营养枝造成影响。将摘取的佛焰苞放入网目孔径为1.0 mm的尼龙袋,封口后浸于自然海域1个月。待种子进一步成熟并自然脱落后,将内容物移入整理箱并反复加入海水搅拌,除去上层有机碎屑及贝壳等杂质,收集种子至广口瓶带回实验室,移入尼龙袋并置于室内4 ℃循环水槽在自然光照、盐度33的条件下暂养。
1.2 实验设计实验于2020年1—4月进行,共计120 d。实验设置3个处理组,分别为赤霉素处理组、弱酸处理组以及对照组。赤霉素处理组用盐度为33的人工海水将外源赤霉素纯品稀释至50 mg/L后浸泡鳗草种子15 d,后置于4 ℃环境下春化1周,弱酸处理组用0.1 mol/L HCl和2 mol/L NaOH溶液将盐度为33的人工海水调至pH=6后浸泡鳗草种子96 h,然后置于4 ℃环境下春化1周,对照组为不对鳗草种子进行促萌处理,置于4 ℃环境下春化1周。
1.3 实验过程与条件首先开展不同处理对种子的促萌,挑选90 000粒色泽较深、颗粒饱满的成熟鳗草种子,将种子随机平均分成30份,每个处理组随机选择10份(重复),按实验设计进行种子促萌处理,结束后将每份种子分别放入500 mL烧杯,加入300 mL盐度为33的无菌海水开始种子萌发。萌发期间,保持无光照和室温,每2 d换水1次。以子叶伸出种皮1 cm作为萌发的标志。每5 d观察种子萌发情况,统计各重复组萌发数量,计算累积萌发率和平均萌发历期(MTG),并进行一次取样,于每个处理组的各重复中随机取出100粒种子,共计1 000粒。然后将各处理组取出的种子均匀混合,平均分为4份,分别测定种子鲜重、干重、水分、呼吸速率、可溶性糖、淀粉、赤霉素、脱落酸含量和α-淀粉酶、β-淀粉酶活性。至种子萌发停滞(累积萌发率不再上升)时停止取样,共计80 d。
期间,将子叶长1 cm的幼苗按不同处理组分别移植于底部铺设有3 cm厚细沙的100 mL烧杯内,并在烧杯壁贴好标签,每个烧杯植入20株幼苗,移植时使细沙覆盖幼苗下胚轴。然后将烧杯放入40 cm×40 cm×20 cm (长×宽×高)的玻璃水槽中,添加海水至水深达到15 cm (完全覆盖烧杯),放入光照培养箱(GXZ-0288,宁波江南仪器厂)培养30 d。培养过程中隔天换水,水温设置为17 ℃,光照周期L∶D=12 h∶12 h,光照强度50 µmol/(m2∙s)。
培养结束后,统计幼苗数量,计算幼苗建成率。从各处理组中随机取出30株鳗草幼苗,测量幼苗的株高(cm)、叶鞘长(cm)、叶长(cm)和叶宽(mm)等形态学指标。
1.4 样品处理与分析 1.4.1 种子萌发和幼苗建成实验结束后,统计并计算种子的累积萌发率、平均萌发历期(MTG)和幼苗建成率:
| $ \text { 累积萌发率(%) }=\sum \frac{n_i}{N} \times 100 $ | (1) |
式中,ni为第i天种子的萌发数,N为萌发种子的总数;
| $ \operatorname{MTG}(\mathrm{d})=\sum \frac{n_i \times d}{N} $ | (2) |
式中,ni为第i天种子的萌发数,d为萌发的第i天,N为萌发种子的总数;
| $ \text { 幼苗建成率 }(\%)=\frac{m}{N} \times 100 $ | (3) |
式中,m为幼苗建成数量,N为播种的种子数量。
1.4.2 种子水分和内含物组分测定实验开始前,随机挑选成熟饱满的鳗草种子500粒,测定种子各项指标初始值;实验开始后,每5 d取样1次进行各项指标监测。水分含量的测定采用烘干法(杨敏, 2013);呼吸速率[v, mg/(g∙h)]通过海水溶氧含量的变化测定,选取50粒鳗草种子,用吸水纸吸除表面水分后称重,记为湿重M,然后放入25 mL封闭试管内,倒入10 mL海水,使用微电极溶氧仪测定海水的溶氧含量(记为C1),间隔1 h后再次测定海水的溶氧含量(记为C2),计算公式:
| $ v[(\mathrm{mg}/\mathrm{g} \cdot \mathrm{h})]=\frac{(C 1-C 2) V}{M \cdot T} $ | (4) |
式中,V为10 mL,T为1 h。
可溶性糖及淀粉含量的测定采用蒽酮法(Lewis et al, 2007)。α-淀粉酶、β-淀粉酶活性使用β-淀粉酶检测试剂盒测定,赤霉素水平使用植物赤霉素酶联免疫分析试剂盒测定,脱落酸水平使用植物脱落酸酶联免疫分析试剂盒测定,以上试剂盒均来自南京建成生物工程研究所。每组样品的同一指标重复测定4次。
1.5 数据处理根据种子水分含量的变化趋势将种子吸涨分为快速吸水期(1~30 d)、滞缓期(31~50 d)、二次吸水期(51~65 d)和二次平稳期(66~80 d),种子组分的分析基于与水分同样的分期。使用SPSS 19.0和Origin 8.5软件对数据进行分析作图,使用单因素方差分析(one-way ANOVA)分析组间差异,若差异显著,使用Tukey多重比较,以P < 0.05作为差异显著水平。并对种子萌发率和其他生理生化指标进行主成分分析,以P < 0.05作为差异显著水平,P < 0.01作为差异极显著水平。
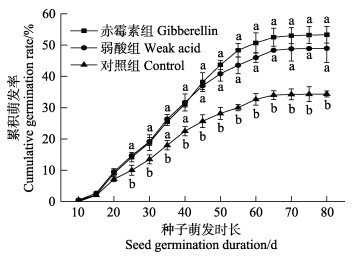
2 结果 2.1 鳗草的种子萌发和幼苗建成 2.1.1 累积萌发率随萌发时间增加,3个处理组鳗草种子的累计萌发率均呈逐渐升高趋势,后期趋于平缓。除15和20 d外,赤霉素处理组与弱酸处理组的种子累积萌发率均显著高于对照组(P < 0.05)。赤霉素处理组鳗草种子的累计萌发率最高,达到53.3%,是对照组的1.6倍;弱酸处理组鳗草种子的累积萌发率次之,达到49.0%,是对照组的1.4倍(图 1)。
|
图 1 不同促萌处理组鳗草种子累积萌发率的变化 Fig.1 Change in cumulative germination rate of seeds of Z. marina under different treatments 不同字母表示同一萌发时长各处理组之间存在显著差异(P < 0.05)。下同。 Different letters indicate significant differences among treatments at the same germination time (P < 0.05). The same as below. |
经过80 d的种子促萌,各处理组的种子平均萌发历期为37.3~39.1 d,各处理组的种子平均萌发历期差异不显著(P > 0.05)。
2.1.3 幼苗建成率经过80 d的种子促萌和30 d幼苗培养,赤霉素组、弱酸组和对照组鳗草的幼苗建成率存在显著差异(P < 0.05)。其中,赤霉素处理组的幼苗建成率最高,显著高于弱酸处理组和对照组,是对照组的1.6倍;弱酸处理组的幼苗建成率次之,亦显著高于对照组,是对照组的1.4倍(图 2)。

|
图 2 不同种子促萌处理对鳗草幼苗建成率的影响 Fig.2 Effects of different seed germination treatments on the seedling establishment rate of eelgrass |
经30 d幼苗培养,除叶宽外,弱酸处理组幼苗的生长指标均达到最大值,其中,叶鞘长显著高于对照组(P < 0.05) (表 1)。各处理组幼苗的株高、叶片数、叶长和叶宽均无显著差异(P > 0.05)。
|
|
表 1 不同促萌处理组幼苗形态学指标(平均值±标准差) Tab.1 Morphological indexes of seedlings at different treatments (Mean±SD) |
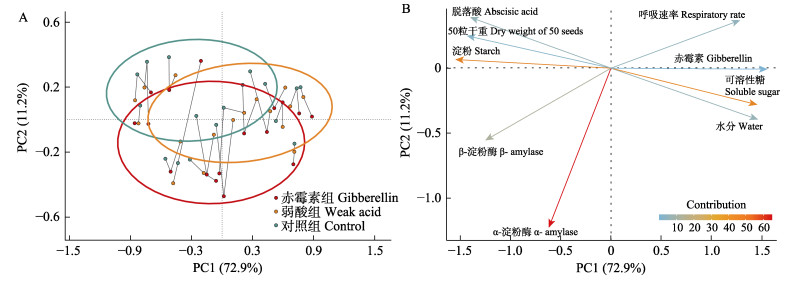
对鳗草不同处理组进行主成分分析,结果显示,不同处理间呈显著差异(图 3A)。对鳗草水分、干重、淀粉、可溶性糖、呼吸速率、赤霉素、脱落酸、α-淀粉酶、β-淀粉酶等生理指标进行PCA分析,如图 3B所示。前2个主成分(PC1和PC2)的特征值> 1,占变异性的80%以上。其中,α-淀粉酶、淀粉和可溶性糖3个指标的影响程度最高,贡献度超过40%。α-淀粉酶活性和淀粉含量呈正相关关系,可溶性糖与淀粉含量呈显著的负相关关系(P < 0.05)。结果表明,在α-淀粉酶影响下,淀粉和可溶性糖的相互转化可能是影响鳗草种子萌发的关键生理过程,因此,后续重点分析这3个指标。
|
图 3 不同处理组间(A)与鳗草各指标(B)主成分分析 Fig.3 Principal component analysis of different treatments (A) and eelgrass indicators (B) |
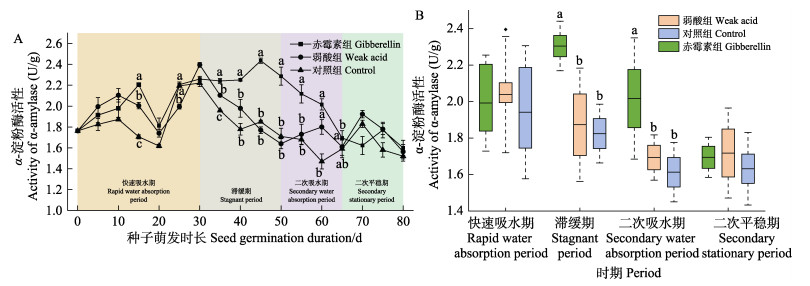
实验期间,种子α-淀粉酶活性的变化如图 4A所示,各时期不同促萌处理组种子α-淀粉酶活性的比较如图 4B所示。赤霉素组α-淀粉酶活性在滞缓期达到最大值,上升了20.7%,显著高于其他2组(P < 0.05)。二次吸水期赤霉素组α-淀粉酶活性达到2.02 U/g,显著高于其他2组(P < 0.05)。
|
图 4 实验期间(A)与不同时期(B)各处理组种子α-淀粉酶活性变化 Fig.4 The changes of α-amylase activity in seeds exposed to different treatments during the experiment (A) and different periods (B) |
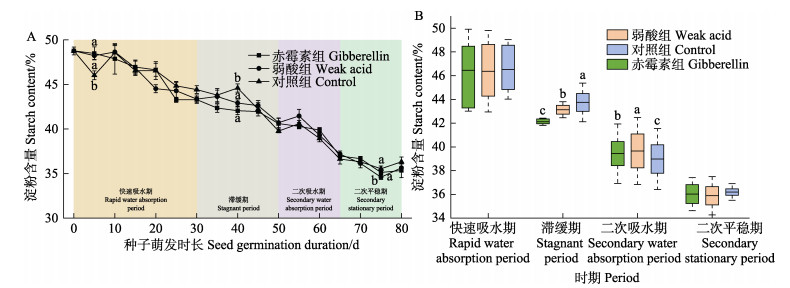
实验期间,不同促萌处理组种子淀粉含量的变化整体呈下降趋势(图 5A)。各时期不同促萌处理组种子淀粉含量的比较如图 5B所示。赤霉素处理组种子淀粉由初始值48.8%于滞缓期下降了6.6%,弱酸处理组下降了5.6%,均显著低于对照组(P < 0.05)。二次吸水期间,赤霉素处理组和弱酸处理组种子淀粉均显著高于对照组(P < 0.05)。
|
图 5 实验期间(A)与不同时期(B)各处理组种子淀粉含量变化 Fig.5 The changes of seed starch contents in seeds exposed to different treatments during the experiment (A) and different periods (B) |
实验期间,不同促萌处理组种子可溶性糖含量的变化整体呈上升趋势(图 6A)。各时期不同促萌处理组种子可溶性糖含量的比较如图 6B所示。其中,与初始值相比,滞缓期赤霉素处理组可溶性糖含量较初始值上升了2倍,弱酸组可溶性糖含量上升了1.9倍,均显著高于对照组(P < 0.05)。
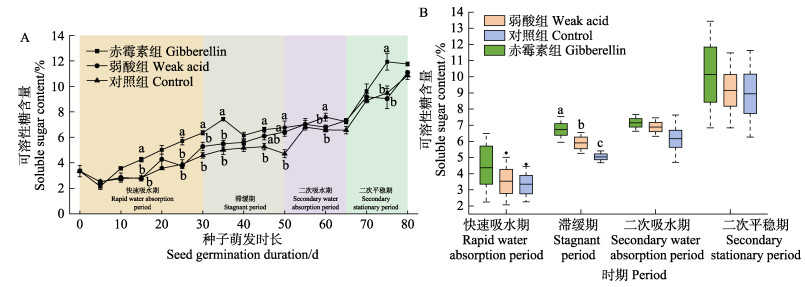
|
图 6 实验期间(A)与不同时期(B)各处理组种子可溶性糖含量变化 Fig.6 The changes of seed soluble sugar contents in seeds exposed to different treatments during the experiment (A)and different periods (B) |
外源赤霉素的添加以及酸化处理能有效促进种子萌发,打破种子的休眠。本研究发现,对鳗草种子进行赤霉素与弱酸促萌处理的累积萌发率和幼苗建成率均得到提高,分别达到对照组的1.6倍和1.4倍。田璐等(2014)研究发现,在pH=6的条件下浸泡鳗草种子96 h,种子累积萌发率高于其他各组,达到77.9%,是对照组的1.14倍;对种子进行50 mg/L的赤霉素激素处理能显著提高累积萌发率,达到51.1%。本研究弱酸处理组种子的萌发率低于田璐(2014)的实验结果,可能与本实验种子初始活力较低(63.3%)有关。
唐实玉等(2021)研究发现,200 mg/L赤霉素浸泡处理后,色木槭(Acer mono Maxim.)种子萌发率达到29.3%,是对照组的1.7倍。文湘穗等(2023)研究发现,对北五味子(Schisandra chinensis)种子进行250 mg/L GA3 + 50 mg/L 6-BA的激素浓度浸泡可以有效打破种子休眠,种子发芽率达到55%,较对照组增加27%。杨爽(2013)等研究发现,用15%的硫酸处理茅膏菜(Drosera spatulata)种子20 min,发芽率较对照组提高5.5倍,达到79.8%。这些研究说明外源赤霉素添加与酸化均能有效促进鳗草种子的萌发与幼苗建成,证实了外源赤霉素的添加以及酸化处理能有效破除鳗草种子休眠、促进萌发的假设。此外,盐度和温度也是影响海草种子萌发与幼苗建成的重要因素。Kahn等(2005)研究了盐度(0~70)对川蔓草(Ruppia maritima)种子萌发的影响,发现只有在低盐度条件下(0、10和20)时种子萌发,且盐度0处理组萌发率最高,达到40%。过高或过低的盐度条件会导致龟裂泰来草(Thalassia testudinum)幼苗的存活率降低甚至全部死亡,盐度30和40是幼苗生长的最适宜条件。Morita等(2010)研究发现,对鳗草种子7 ℃低温处理1个月,萌发率显著高于21~25 ℃处理组。
3.2 海草种子对人工促萌的生理响应种子萌发包括吸胀、萌动、发芽和成苗4个阶段,种子吸水是水分转向萌发的必要起始步骤(宋松泉等, 2008)。种子在休眠过程中,种子的营养物质与酶活性处于一定的动态变化过程(刘子凡等, 2016)。种子内存在丰富的营养物质,在萌发过程中逐步被分解利用,一方面在呼吸过程中转化为能量,另一方面通过代谢转化为新细胞的组成成分(Steinbach et al, 1997)。
本研究发现,赤霉素与弱酸处理对鳗草种子的休眠破除作用是多种因素共同作用的结果,综合各处理组鳗草种子萌发率和其他指标的主成分分析发现,α-淀粉酶活性、淀粉和可溶性糖含量是种子萌发期间的关键因素。促萌处理能显著提升种子萌发前期的吸水速率,随种子吸水吸胀的进程,淀粉酶活性提升,加快淀粉的分解速率,种子干重下降,淀粉在酶作用下被分解成可溶性糖,为种子萌发过程提供能量,可溶性糖含量迅速上升。进入滞缓期,种子停止吸水,此时α-淀粉酶活性达到最高,赤霉素组酶活显著高于其他2组,达到对照组的1.3倍,此时,赤霉素组和弱酸组淀粉含量均显著低于对照组,可溶性糖含量显著高于对照组。二次吸水期种子重新开始吸水,由于种子呼吸活动加剧各组可溶性糖含量上升缓慢。二次平稳期种子各项指标都趋于稳定,赤霉素组的可溶性糖含量显著高于其他2组。淀粉是种子萌发过程中能量代谢和物质代谢的基础。种子萌发和幼苗生长主要依赖于内源淀粉和可溶性糖的降解(Lv et al, 2021)。研究表明,种子萌发前期营养物质快速消耗,为种子萌发提供必要的能量与物质基础(闫晓娜等, 2020)。在种子萌发前利用赤霉素的拮抗作用减弱或消除脱落酸抑制萌发的生理效应是十分必要的(Sun et al, 2004)。
4 结论本研究探究了赤霉素与弱酸2种外源促萌处理对破除鳗草种子休眠的作用,分析了鳗草种子应对外源促萌处理的生理响应过程。结果发现,赤霉素与弱酸2种促萌方法均能有效促进鳗草种子萌发,其中以赤霉素的促萌效果最好,其种子累积萌发率和实生苗建成率分别达到53.3%和33.4%,是对照组的1.6倍;促萌处理提升了鳗草种子内源赤霉素含量,加快水分吸收,抑制脱落酸含量,进而提高α-淀粉酶活性,加快了营养物质的水解与转化,从而促进了种子的萌发,具体模式如图 7所示。外源赤霉素与弱酸对海草种子萌发的促进作用可能存在协同效应,因此,未来的研究需进一步探究赤霉素和弱酸对鳗草种子萌发和生理特性的协同影响。
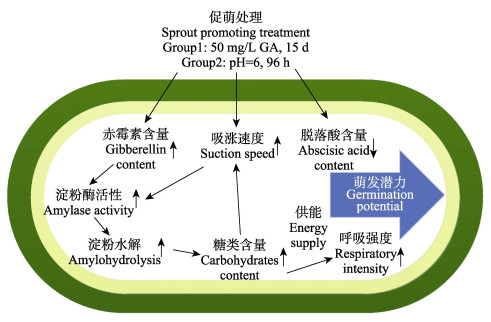
|
图 7 促萌模式 Fig.7 Pattern of promoting germination |
CONACHER C A, POINER I R, BUTLER J, et al. Germination, storage and viability testing of seeds of Zostera capricorni Aschers from a tropical bay in Australia. Aquatic Botany, 1994, 49(1): 47-58 DOI:10.1016/0304-3770(94)90005-1 |
GAO C Z, HE Y H, TIAN Y L, et al. Effect of different concentration of gibberellin on the seed germination of Pinus sylvestris var. Mongolicalitv. Journal of Inner Mongolia Agricultural University (Natural Science), 2012, 33(3): 67-72 [高春智, 何炎红, 田有亮, 等. 不同浓度赤霉素浸种对樟子松种子萌发的影响. 内蒙古农业大学学报(自然科学版), 2012, 33(3): 67-72 DOI:10.16853/j.cnki.1009-3575.2012.03.015] |
HARRISON P G, DURANCE C. Variation in clonal structure in an eelgrass (Zostera marina) meadow on the Pacific coast of Canada. Canadian Journal of Botany, 1992, 70(3): 653-657 DOI:10.1139/b92-085 |
JIANG Z, XU G, JING Y, et al. Phytochrome B and REVEILLE1/2-mediated signalling controls seed dormancy and germination in Arabidopsis. Nature Communications, 2016, 7(1): 12377 DOI:10.1038/ncomms12377 |
KAHN A E, DURAKO M J. The effect of salinity and ammonium on seed germination in Ruppia maritima from Florida Bay. Bulletin of Marine Science, 2005, 77: 453-458 |
LEWIS M A, DANTIN D D, CHANCY C A, et al. Florida seagrass habitat evaluation: A comparative survey for chemical quality. Environmental Pollution, 2007, 146(1): 206-218 DOI:10.1016/j.envpol.2006.04.041 |
LI F L, CHEN J C ZHAO Y J. Effects of gibberellin and light on seed germination and seedling growth of Arabidopsis. Plant Physiology Journal, 2000, 26(2): 101-104 [李凤玲, 陈季楚, 赵毓橘. 赤霉素和光对拟南芥种子萌发和幼苗生长的影响. 植物生理学报, 2000, 26(2): 101-104] |
LI H P, REN C W. Effect of GA seed soaking on germination physiological characteristics in buckwheat seeds. Journal of Shanxi Agricultural Sciences, 2009, 37(2): 19-21 [李海平, 任彩文. 赤霉素浸种对苦荞种子萌发生理特性的影响. 山西农业科学, 2009, 37(2): 19-21] |
LIU Y L, ZHANG X L. The effects of salinity on seed germination and seedling development of the seagrass, Zostera marina L. Acta Oceanologica Sinica, 2016, 38(2): 104-111 [刘云龙, 张学雷. 盐度对大叶藻种子萌发和幼苗发育的影响. 海洋学报, 2016, 38(2): 104-111] |
LIU Y Q, LUO Z M. A regulation role of gibberellin and abscisic acid on seed germination in tomato. Acta Horticulturae Sinica, 1995(3): 267-271 [刘永庆, 罗泽民. 赤霉素和脱落酸对番茄种子发芽的生理调控——文献综述. 园艺学报, 1995(3): 267-271] |
LIU Y S, ZHANG P D, GUO D, et al. Research progress in seagrass seed planting technology. Fisheries Science, 2014, 33(2): 127-132 [刘燕山, 张沛东, 郭栋, 等. 海草种子播种技术的研究进展. 水产科学, 2014, 33(2): 127-132] |
LIU Z F, WEI Y X, ZOU J. Spermology. Beijing: Chemical Industry Publishing House, 2016 [刘子凡, 魏云霞, 邹江. 种子学. 北京: 化学工业出版社, 2016]
|
LOQUES F, CAYE G, MEINESZ A. Germination in the marine phanerogam Zostera noltii Hornemann at Golfe Juan, French Mediterranean. Aquatic Botany, 1990, 38(2): 249-260 |
LV Z, ZHU F, JIN D, et al. Seed germination and seedling growth of Dendrocalumus brandisii in vitro, and the inhibitory mechanism of colchicine. Frontiers in Plant Science, 2021, 12: 784581 DOI:10.3389/fpls.2021.784581 |
MARTINS I, NETO J M, FONTES M G, et al. Seasonal variation in short-term survival of Zostera noltii transplants in a declining meadow in Portugal. Aquatic Botany, 2005, 82(2): 132-142 DOI:10.1016/j.aquabot.2005.03.006 |
MORITA T, KAKINUMA M, MIZUNO G, et al. Morphological characteristics of annual Zostera marina shoots at various germination temperatures. Aquatic Botany, 2010, 92(1): 49-54 |
ORTH R J, MARION S R, GRANGER S, et al. Evaluation of a mechanical seed planter for transplanting Zostera marina (eelgrass) seeds. Aquatic Botany, 2009, 90(2): 204-208 |
PAN R C, LI N H, WANG X J. Plant physiology. Beijing: Higher Education Press, 2008 [潘瑞炽, 李娘辉, 王小菁. 植物生理学. 北京: 高等教育出版社, 2008]
|
SHORT F T, POLIDORO B, LIVINGSTONE S R, et al. Extinction risk assessment of the world´s seagrass species. Biological Conservation, 2011, 144(7): 1961-1971 |
SONG S Q, CHENG H Y, JIANG X C. Seed biology. Beijing: Science Press, 2008 [宋松泉, 程红焱, 姜孝成. 种子生物学. 北京: 科学出版社, 2008]
|
STEINBACH H S, BENECH-ARNOLD R L, SANCHEZ R A. Hormonal regulation of dormancy in developing sorghum seeds. Plant Physiology, 1997, 113(1): 149-154 |
STEVENSON J C. Comparative ecology of submersed grass beds in freshwater, estuarine, and marine environments. Limnology and Oceanography, 1988, 33: 867-893 |
SUN T P, GUBLER F. Molecular mechanism of gibberellin signaling in plants. Annual Review of Plant Biology, 2004, 55: 197-223 |
TANG S Y, CUI N J, FENG Y C, et al. Effect of gibberellin concentration on seed germination of Acer mono Maxim. Chinese Journal of Applied and Environmental Biology, 2021, 27(3): 555-559 [唐实玉, 崔宁洁, 冯云超, 等. 赤霉素浓度对色木槭(Acer mono Maxim)种子萌发的影响. 应用与环境生物学报, 2021, 27(3): 555-559] |
TIAN L, ZHANG P D, NIU S N, et al. Effects of different treatments on seed germination and seedling establishment of eelgrass Zostera marina L. Chinese Journal of Ecology, 2014, 33(9): 2408-2413 [田璐, 张沛东, 牛淑娜, 等. 不同处理对大叶藻种子萌发和幼苗建成的影响. 生态学杂志, 2014, 33(9): 2408-2413] |
TIAN L. Effects of three exogenous factors on Zostera marina seed germination. Master´ s Thesis of Ocean University of China, 2014, 105 [田璐. 三种外源要素对大叶藻种子萌发的影响. 中国海洋大学硕士研究生学位论文, 2014, 105] |
WANG L R, YU H B, LI C T, et al. Progress in marine ecosystem restoration. Journal of Applied Oceanography, 2018, 37(3): 435-446 [王丽荣, 于红兵, 李翠田, 等. 海洋生态系统修复研究进展. 应用海洋学学报, 2018, 37(3): 435-446] |
WEN X S, ZHANG Y Q, WANG Y M, et al. The effect of exogenous hormone treatment on Schisandra seed during stratification. Molecular Plant Breeding, 2023, 21(2): 649-657 [文湘穗, 张誉荠, 王雨濛, 等. 外源激素处理对层积过程中北五味子种子生理生化的影响. 分子植物育种, 2023, 21(2): 649-657] |
WU Z J, CHEN S Q, CAI Z F, et al. Analysis of distribution change and restoration suggestion of the seagrass beds in Hainan Island. Marine Environmental Science, 2021, 40(4): 542-549 [吴钟解, 陈石泉, 蔡泽富, 等. 海南岛海草床分布变化及恢复建议. 海洋环境科学, 2021, 40(4): 542-549] |
XU S C. A study on seed ecology of the eelgrass Zostera marina L. in typical seagrass meadows in Shandong. Doctoral Dissertation of University of Chinese Academy of Sciences (Institute of Oceanography, Chinese Academy of Sciences), 2017 [徐少春. 山东沿海典型海草床鳗草种子生态学研究, 中国科学院大学(中国科学院海洋研究所)博士研究生学位论文, 2017]
|
YAN X N, ZHOU X, WANG F D, et al. Effect of three exogenous hormone on seed germination and physiological and chemical characteristics of Pinus pumila. Journal of Temperate Forestry Research, 2020, 3(4): 25-30, 51 [闫晓娜, 周鑫, 王福德, 等. 3种激素处理对偃松种子萌发及其生理生化的影响. 温带林业研究, 2020, 3(4): 25-30, 51] |
YANG M. Seed production and management. Hefei: Hefei University of Technology Press, 2013 [杨敏. 种子生产与管理. 合肥: 合肥工业大学出版社, 2013]
|
YANG S, ZHONG G H, TIAN F Y, et al. Effects of different chemical treatments on seed germination of sundew. Seed, 2013, 32(2): 76-77, 81 [杨爽, 钟国辉, 田发益, 等. 不同化学处理对茅膏菜种子萌发的影响. 种子, 2013, 32(2): 76-77, 81] |
ZHANG M, KANJANA N, LI R, et al. Environmental factors affecting seed germination of prairie grass (Bromus willdenowii) in Yunnan Province. Acta Prataculturae Sinica, 2021, 30(12): 143-151 [张敏, Nipapan Kanjana, 李铷, 等. 环境因子对云南扁穗雀麦种子萌发和出苗的影响. 草业学报, 2021, 30(12): 143-151] |
ZHOU Y Y. Study on the protection and sustainable development of seagrass bed resources. Territory and Natural Resources Study, 2021(2): 68-71 [周媛媛. 海草床资源保护与可持续发展研究. 国土与自然资源研究, 2021(2): 68-71] |
ZHOU Y, XU S C, ZHANG X M, et al. Construction technology of seagrass bed habitats in marine ranching. Science and Technology for Development, 2020, 16(2): 199-205 [周毅, 徐少春, 张晓梅, 等. 海洋牧场海草床生境构建技术. 科技促进发展, 2020, 16(2): 199-205] |



