2. 中国水产科学研究院黄海水产研究所 农业农村部海洋渔业可持续发展重点实验室 山东省渔业资源与生态环境重点实验室 山东 青岛 266071;
3. 青岛海洋科学与技术试点国家实验室海洋生态与环境科学功能实验室 山东 青岛 266237;
4. 国家海产贝类工程技术研究中心 山东 威海 264316;
5. 荣成东楮岛海洋科技有限公司 山东 威海 264312
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture and Rural Affairs, Shandong Provincial Key Laboratory of Fishery Resources and Eco-Environment, Qingdao 266071, China;
3. Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266237, China;
4. National Engineering and Technology Center of Marine Shellfish, Weihai 264316, China;
5. Rongcheng Dongchudao Marine Technology Co., Ltd, Weihai 264312, China
鲍素有海洋软黄金之称,位居海产八珍之首,也是我国出口创汇的重要海水养殖贝类(束靖等, 2008)。皱纹盘鲍(Haliotis discus hannai Ino)是我国重要的海洋生物资源,自然分布于渤海、黄海和日本海水域,是鲍科动物中最具经济价值的种类之一。近40年,在经历了野生采捕、底播增养殖等发展阶段后,目前,国内鲍养殖方式主要为筏式养殖(吴富村等, 2020; 姜向阳等, 2021),其中,南北接力养殖是主导养殖模式之一。在该模式中,养殖个体在福建等南方海域越冬,在山东等北方海域度夏,始终处于适宜的水温环境中,因而存活率高且养殖周期大为缩短。底播养殖模式中,养殖个体需耐受北方海域的冬季低温,因而死亡率高且养殖周期更长。相对更为高效的南北接力养殖的快速发展支撑了国内鲍养殖产量的大幅提升,2020年国内鲍养殖产量已经超过20万t (农业农村部渔业渔政管理局等, 2021)。在产业发展过程中,人们对养殖产量的提升更为关注,忽略了营养品质的提升,单一的南北接力养殖模式导致商品鲍上市时间集中、口感同质化等问题,使鲍的销售价格一路下跌,2021年更是近年来的最低价格。鲍之所以贵为“海产八珍”之冠,与其生活于野生环境有很大关系。南北接力养殖中,鲍一般摄食海带(Saccharina japonica)和龙须菜(Gracilariopsis lemaneiformis)等少数几个藻类品种,而底播养殖个体的食物来源丰富,这可能是商品鲍品质差异的主要原因之一。然而,不同养殖模式对商品鲍营养价值的影响少有报道(曾莉婷等, 2020)。
随着国家在海洋牧场、栖息地修复等海洋生态保护方面投入的增加,以及近些年在抗低温苗种品系培育、优化底播增养殖、生境营造等方面的技术突破,底播初期和越冬期高死亡率等问题得到了很大程度的解决,有力地为鲍底播养殖产业的发展壮大提供保障(刘丽娟等, 2021; 游伟伟等, 2021)。目前,国家正大力发展海洋牧场建设,截止2020年,山东省和辽宁省就已经有60多处获批的国家级海洋牧场示范区,其中,部分海洋牧场以鲍和海参等海珍品底播为特色,这也为鲍底播养殖产业的发展提供了优良的环境(田涛等, 2021; 李忠义等, 2019)。虽然,底播鲍养殖产业正在迅速发展,但仍存在越冬期鲍苗死亡率高的问题,而造成这一问题的主要原因之一是目前底播个体的耐低温能力不足。通常皱纹盘鲍最适生长温度为10~22 ℃(吴富村, 2008),在底播养殖中,北方冬季海水温度偏低,有时甚至会低于0 ℃,在这种条件下,鲍经受不住长期的低温胁迫,容易大量死亡。姚托等(2017)研究发现,连续多代的南方越冬养殖降低了鲍的低温耐受性,但并未对越冬鲍低温耐受性下降的生理机制开展深入研究,而国内也未见底播养殖对鲍低温耐受性方面影响的相关报道。低温环境条件下的存活率虽然能表征鲍的耐低温能力,但无法研究鲍个体在低温胁迫下的生理响应,而心率和耗氧率随温度变化明显,适合作为探究鲍低温胁迫下生理响应的指标。Liang等(2021)研究表明,在一定温度条件下,心率与温度间存在线性相关关系。因此,本研究选择2种养殖模式下的皱纹盘鲍,以耗氧率和心率来表征其低温耐受能力的差异,并以此分析不同养殖模式下,鲍响应低温胁迫的生理机制,以期为底播养殖及耐低温苗种培育工作提供参考。
1 材料与方法 1.1 实验材料皱纹盘鲍于2021年9月取自山东省荣成桑沟湾地区,2种养殖模式的鲍为同一个临近桑沟湾海域的鲍育苗场的同一批次的鲍苗,该苗种来自“大连一号”杂交鲍的后代群体。取样前,2种养殖模式的鲍分别经历了1年的南北接力养殖和底播养殖。其中,南北接力养殖个体在福建省湄洲湾海域越冬,在桑沟湾海域度夏,期间摄食的饵料主要为海带和龙须菜,水温在12~26 ℃之间;底播养殖个体一直栖息在桑沟湾南岸的岩礁区,摄食的饵料均为自然生长的底栖微型藻类、孔石莼(Ulva pertusa)和假根羽藻(Bryopsis corticulans)等,水温在–1~26 ℃之间。取样时,南北接力养殖个体的平均壳长为(80.32± 5.61) mm,平均全湿重为(64.52±12.57) g,肥满度为12.30±1.32;底播养殖个体平均壳长为(75.91±5.84) mm,平均全湿重为(54.55±9.97) g,肥满度为12.41±1.25。选取外壳完整、健康有活力且大小一致的北方底播鲍和接力养殖鲍2龄个体,将皱纹盘鲍放入体积为60 cm×40 cm×30 cm的聚乙烯水箱中暂养7 d。暂养过程中,保持连续充气,每天换水1次、投喂饵料2次。实验前1 d停止投喂。
实验在山东威海国家贝类产业技术中心进行,海水取自山东省荣成爱伦湾,盐度为31.3±0.3,使用NBS标度测量的pH (pHNBS)为8.17±0.02,经沉淀、砂滤后备用。
1.2 实验方法 1.2.1 肌肉营养成分测定本研究于9月选取接力养殖鲍个体和底播鲍个体进行营养成分测定,测定前将鲍进行24 h饥饿处理,随机选取2种养殖模式的皱纹盘鲍个体各2只,取下腹足肌肉组织作为1个样本进行营养成分测定,将此过程重复3次作为实验重复。水分测定参照《食品安全国家标准食品中水分的测定》(GB/T 5009.3-2016)中的直接干燥法,蛋白质测定参照《食品安全国家标准食品中蛋白质的测定》(GB/T 5009.3-2016)中的凯式定氮法,总糖(以葡萄糖计)测定参照《食品安全国家标准食品中果糖、葡萄糖、蔗糖、麦芽糖、乳糖的测定》(GB/T 5009.8-2016)中的酸水解–莱因–埃农氏法,氨基酸测定参照《食品安全国家标准食品中氨基酸的测定》(GB/T 5009.124- 2016)。灰分含量测定参照《食品中灰分的测定》(GB/T 5009.4-2016),采用550 ℃高温灼烧。有机物总含量通过样品干重减去灰重之后再除以样品干重的方式计算得出,以百分含量的形式表示。
1.2.2 耗氧率测定张明等(2005)研究发现,皱纹盘鲍成鲍期适宜水温为10~22 ℃,当水温高于26 ℃或低于0 ℃时出现死亡,结合取样时海区水温,将实验以24 ℃(室温水温)作为对照,选取9 ℃(低温)作为实验温度。利用冷水机降低海水温度并使其保持在9 ℃,另一组海水温度保持在24 ℃。在底播和接力养殖鲍中各选取12只健康有活力的皱纹盘鲍进行实验,将来自同一养殖模式下的鲍随机分为6组,共12组。随后,将一组中2只鲍附着在一块聚乙烯板上,将其放入3 L的呼吸瓶中,呼吸瓶的瓶盖处有2个小孔可放入探头连接氧探针和温度探针,用以连续监测水体的溶解氧(DO)和温度,使用四通道光纤测氧仪(OXY-4 mini,德国)测定各组在24 ℃和9 ℃时的DO,数据由电脑软件Precens采集并处理。
实验过程中,待水体中DO开始匀速下降时计时,实验时间为0.5~1 h。实验结束后,测量皱纹盘鲍壳长及湿重。以DO和实验时间t (min)作图,并线性拟合得到函数y=kt+b,OR计算公式为:
| $ \mathrm{OR}=-\mathrm{k} \cdot V / W $ |
式中,OR为单位体重耗氧率[mg/(g·h)],k为拟合直线斜率,W为皱纹盘鲍湿重(g),V为呼吸瓶体积(L)。
1.2.3 心率测定参考Chelazzi等(1999)和Dong等(2011)的测定方法并加以改进,使用软管、速干水泥、蓝丁胶(Blu-Tack, Bostik Ltd, 英国)将红外传感器固定在皱纹盘鲍距离心脏最近的外壳表面,心跳产生的光电流经信号放大器(AMP 03, heartbeat monitor, Newshift, 葡萄牙)放大过滤处理后,由数据采集(DAQ)设备(Powerlab 8/30, AD Instruments, 德国)记录,使用软件LabChart V8.0可计算心率(BPM)。心率测定温度设置和耗氧率测定相同,选择24 ℃(室温)和9 ℃(低温)进行心率测定,实验开始前,先使用低温水浴锅将海水分别控制在9 ℃和24 ℃。将实验鲍连接红外传感器后放入24 ℃水中适应5 min,待软件心电图稳定后开始计时,约0.5 h后将其转移至9 ℃水体中,重复上述实验步骤。实验分别测定2个组各12只皱纹盘鲍,使用软件LabChart计算个体心率,记录皱纹盘鲍心率变化。
1.3 统计分析数据以平均值±标准差(Mean±SD)表示,运用R 4.0.5软件对结果进行统计分析,数据首先经过bootstrap再抽样(n=1 000),服从正态分布后进行单因素方差分析(one-way ANOVA),差异的显著性水平设定为α=0.05。
2 结果与分析 2.1 肌肉组织生化成分差异 2.1.1 基本营养物质不同养殖方式的皱纹盘鲍9月取样个体的含水率和总糖含量存在显著差异(表 1)。其中,接力养殖和底播养殖的鲍个体含水率分别为(74.70±0.90)%和(72.85±0.75)%,总糖含量分别为(1.25±0.05)%和(3.20±0.00)%。接力养殖和底播养殖个体的蛋白质含量分别为(15.50±0.70)%和(15.60± 0.60)%,无显著差异(P > 0.05)。底播养殖鲍个体的灰分含量为(3.30±1.00)%,接力养殖鲍的灰分含量为(2.40±0.50)%,二者存在显著差异(P < 0.05),且2个组的皱纹盘鲍个体的有机物含量也有显著差异(P < 0.05),其中,底播养殖鲍个体的有机物含量达到(27.60±3.70)%,而接力养殖的鲍个体有机物含量仅为(14.80±2.70)%,反映出2种养殖模式下的皱纹盘鲍在营养物质含量上存在显著差异。
|
|
表 1 不同养殖模式中皱纹盘鲍营养成分比较 Tab.1 Nutrient comparison of H. discus hannai collected from different farming models/% |
2个组皱纹盘鲍均检测出16种氨基酸,接力养殖和底播养殖氨基酸含量分别为(12.75±0.45)%和(13.40±0.20)% (表 2),其中,包含7种人体必需氨基酸(EAA):苏氨酸(Thr)、亮氨酸(Leu)、蛋氨酸(Met)、苯丙氨酸(Phe)、异亮氨酸(Ile)、缬氨酸(Val)和赖氨酸(Lys),接力养殖和底播养殖必需氨基酸含量分别为(3.85±0.01)%和(4.19±0.09)%,底播养殖的鲍个体必需氨基酸含量较高,且与接力养殖存在显著性差异(P < 0.05)。
|
|
表 2 2种养殖模式下皱纹盘鲍氨基酸含量/(%湿重) Tab.2 Amino acid content in muscle of H. discus hannai individuals collected from two farming models/(% wet matter) |
如图 1所示,在24 ℃底播和接力养殖的皱纹盘鲍耗氧率分别为(0.077±0.024)和(0.082±0.012) mg/(g·h),在低温(9 ℃)条件下底播和接力养殖个体耗氧率分别为(0.017±0.006)和(0.018±0.009) mg/(g·h)。单因素方差

|
图 1 不同温度条件下2种养殖方式皱纹盘鲍耗氧率差异 Fig.1 Difference in oxygen consumption rate of H. discus hannai individuals collected from the two farming models under different temperatures |
分析(one-way ANOVA)显示,2种养殖模式的皱纹盘鲍在相同条件下耗氧率无显著差异(P > 0.05),而同一养殖模式下的皱纹盘鲍在室温(24℃)和低温(9℃)条件下的耗氧率有显著差异(P < 0.05),表明,低温环境会降低鲍的呼吸速率,但养殖方式的差异对耗氧率的影响并未体现。
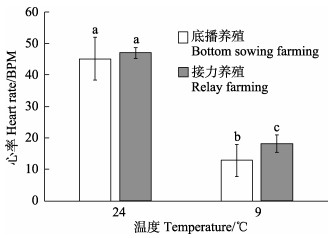
2.3 低温胁迫下的心率差异在皱纹盘鲍心率测定中,会因低温导致部分鲍个体出现心率失常现象(Liang et al, 2021)或因红外传感器接触不良而无法测得稳定的心率数值。本研究中,接力养殖和底播养殖皱纹盘鲍均有8个以上的个体获得了有效心率,心率波形如图 2所示,测量每个个体心率并将其取平均值后进行结果比较。如图 3所示,室温(24℃)条件下,底播养殖和接力养殖的皱纹盘鲍心率分别为(45.05±6.79)和(46.95±5.01) BPM,二者无显著差异(P > 0.05)。在低温条件下,底播养殖皱纹盘鲍个体的心率下降至(12.82±1.72) BPM,接力养殖皱纹盘鲍个体的心率下降至(18.11±2.79) BPM,二者差异显著(P < 0.05),表明室温条件下,不同养殖模式并不会对鲍的心率产生影响,但随着温度降低,不同养殖模式下的皱纹盘鲍个体在抵抗外界低温胁迫的对策上存在一定的差异。

|
图 2 不同温度条件下(9℃和24℃)皱纹盘鲍心率变化 Fig.2 Heart rate of H. discus hannai under different temperature conditions |
|
图 3 不同温度条件下2种养殖模式皱纹盘鲍心率差异 Fig.3 Difference in heart rate of H. discus hannai collected from the two farming models under different temperature |
糖类和蛋白质等是营养成分中的重要组成部分,含水率的高低也可从侧面反映肉的“肥瘦”(刘力源等, 2020)。本研究所选取的腹足部是皱纹盘鲍储存营养物质的主要部位,对其腹足部肌肉的营养成分测定能反映该个体的营养储存状况,由于鲍个体的营养成分含量会受到季节的影响,北方鲍在春秋两季生长速度较快(刘艳青, 2013),因此,选择9月进行取样测定营养成分。结果表明,底播养殖鲍的糖类、有机物总量和灰分含量均显著高于接力养殖鲍,其中,有机物总含量的差异尤为明显,水分含量也显著低于接力养殖鲍。(王珊珊 2021)和(杨洋等 2021)研究发现,皱纹盘鲍适当摄食浒苔(Enteromorpha clathrata)和石莼(Ulva pertusa Kiellm)等藻类有利于其生长发育,而底播鲍的养殖环境为进行过生境修复的海区,该区域的藻类不管是种类还是数量都显著高于自然海区,因此,鲍有充足的食物来源。另外,实验时间是海水温度适宜底播鲍生长的秋季,底播养殖鲍会在越冬前进行营养物质的储存,用以度过越冬期。糖类等物质在皱纹盘鲍越冬过程中发挥重要作用,作为生命活动的能源物质,在抵御低温环境时,鲍会先消耗糖类为其生命活动提供能量(任黎华等, 2012)。越冬过程中,体内总糖含量高的皱纹盘鲍会更加容易度过越冬期(Koyama et al, 2020; Ma et al, 2020)。因此,在底播生产过程中,可以在越冬前进行底播捕捞。
氨基酸的测定结果发现,2种养殖模式下的皱纹盘鲍在氨基酸总量上并无显著差异。尽管如此,研究仍发现,底播养殖的皱纹盘鲍必需氨基酸含量显著高于接力养殖的皱纹盘鲍,这种差异可能来源于这2组皱纹盘鲍栖息环境的不同,底播养殖区域的藻类丰富程度较高,并且该区域的藻类随着季节的更替,其优势种也会有变化,相较于只投喂海带和龙须菜等单一种类饲料的接力养殖鲍来说,底播养殖的皱纹盘鲍能从多种藻类中摄取到丰富的氨基酸,其营养价值也随之提高(Ansary et al, 2019)。在市场上,底播养殖鲍不仅价格更高,也因其口感普遍比接力养殖鲍更优,而更受到消费者的青睐(张红智等, 2020)。丁建姿等(2020)研究也发现,北方筏式养殖鲍的蛋白质和脂肪等营养成分要显著高于南方越冬鲍,总糖含量低于南方越冬鲍,但考虑其在5月进行取样,可能是因为北方筏式养殖鲍在越冬过程中消耗了大部分的总糖储备。
(曾莉婷等 2020)对南北接力养殖和全年南方养殖模式下的皱纹盘鲍进行营养成分分析,结果表明,总体上二者差别并不显著,究其原因可能是虽然2种养殖模式的水温等环境参数存在差异,实验个体所投喂饵料并无差异。本研究表明,底播养殖和南北接力养殖鲍营养成分差异显著,不同的生存环境和食物来源可能是造成这一结果的原因之一,同时也表明,底播和接力养殖模式能够显著影响皱纹盘鲍个体的生化组成及其响应低温胁迫的生理过程。底播养殖个体关键营养成分的含量显著高于接力养殖个体,因此认为,底播养殖的皱纹盘鲍有着更高的营养价值。
3.2 呼吸代谢与心率对低温胁迫的响应耗氧率和心率是衡量皱纹盘鲍生理状况的重要指标,呼吸作为贝类基础的生理活动,能很好的反映出在某一特定环境胁迫下该生物的生理和生存状态。耗氧率和心率可用来衡量贝类的能量消耗情况,从而反映贝类的生理状态(姜娓娓等, 2017; 梁爽, 2017)。利用红外探测的原理测定贝类心率,可以在不损伤贝类的情况下得到准确、可靠的数据指标(Braby et al, 2006),并且这种方法已经在贻贝(Mytilus edulis)、滨螺(Littorina)、菲律宾蛤仔(Ruditapes philippinarum)等贝类抗逆性研究中得到了广泛应用,在鲍研究中也屡见不鲜(Bakhmet et al, 2018; Chen et al, 2016; 林思恒等, 2016; Domnik et al, 2016)。皱纹盘鲍作为变温动物,其环境温度与生理代谢之间有着很高的关联性,与适宜温度条件相比,低温条件会造成鲍的耗氧与心率大幅度降低,对鲍的生命活动造成影响,耗氧与心率下降程度可作为评估鲍耐低温能力的指标之一(Chen et al, 2019)。在本研究中,2组皱纹盘鲍在相同实验条件下的耗氧率并无显著差异。室温(24℃)条件下,2组鲍的初始心率无显著差异,但随着温度骤降到9℃,底播养殖鲍的心率比接力养殖鲍的心率下降得更多。研究表明,越冬过程能量短缺会导致贝类个体死亡或繁殖能力下降,低温条件下,大部分贝类个体的生理活动减弱,生长缓慢,它们通过这种方式减少消耗来抵御低温环境胁迫(张家宝等, 2020; 李相涛等, 2017)。心率可作为生物代谢率的指示指标,高心率个体有着更高的能量代谢,以此来应对短期低温胁迫,但面对长期的低温环境,高能量代谢并不利于鲍的生存(王倩, 2014; Nowack et al, 2019)。本研究中,在温度骤降条件下,底播养殖鲍比接力养殖鲍有更低的心率水平,因此,认为底播养殖个体可能通过调节自身的生理代谢来增强低温耐受性能,从而更加耐受北方海域的冬季低温胁迫。心率调节可能是鲍应对低温胁迫的关键生理机制,因此,在耐低温品系培育和评价过程中,心率可作为一项参考指标。
ANSARY M W R, JEONG H S, LEE K W, etal. The effect of substituting Undaria pinnatifida in formulated feeds with Sargassum horneri on growth and body composition of juvenile abalone (Haliotis discus, Reeve 1846). Journal of Applied Phycology, 2019, 31(3): 2125-2132 DOI:10.1007/s10811-018-1672-2 |
BAKHMET I N, SAZHIN A, MAXIMOVICH N, etal. In situ long-term monitoring of cardiac activity of two bivalve species from the White Sea, the blue mussel Mytilus edulis and horse mussel Modiolus modiolus. Journal of the Marine Biological Association of the United Kingdom, 2018, 99(4): 833-840 |
BRABY C E, SOMERO G N. Following the heart: Temperature and salinity effects on heart rate in native and invasive species of blue mussels (genus Mytilus). The Journal of Experimental Biology, 2006, 209(13): 2554-2566 DOI:10.1242/jeb.02259 |
Bureau of Fisheries, Ministry of Agriculture and Rural Affairs, National Fisheries Technology Extension Center, China Society of Fisheries. China fishery statistical yearbook 2021. Beijing: China Agriculture Press, 2021 [农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 2021中国渔业统计年鉴. 北京: 中国农业出版社, 2021]
|
CHELAZZI G, WILLIAMS G A, GRAY D R. Field and laboratory measurement of heart rate in a tropical limpet, Cellana grata. Journal of the Marine Biological Association of the United Kingdom, 1999, 79(4): 749-751 DOI:10.1017/S0025315498000915 |
DING J Z, YAO Y Y, CHANG L R, etal. Nutritional components analysis from the Gastropod of Haliotis discus hannai. Science and Technology of Food Industry, 2020, 41(16): 297-303 [丁建姿, 姚艳艳, 常丽荣, 等. 皱纹盘鲍腹足营养成分分析. 食品工业科技, 2020, 41(16): 297-303 DOI:10.13386/j.issn1002-0306.2020.16.047] |
DOMNIK N J, POLYMEROPOULOS E T, ELLIOTT N G, etal. Automated non-invasive video-microscopy of oyster spat heart rate during acute temperature change: Impact of acclimation temperature. Frontiers in Physiology, 2016, 7: 236 |
DONG Y W, WILLIAMS G A. Variations in cardiac performance and heat shock protein expression to thermal stress in two differently zoned limpets on a tropical rocky shore. Marine Biology, 2011, 158(6): 1223-1231 DOI:10.1007/s00227-011-1642-6 |
JIANG W W, FANG J G, LI J Q, etal. Effects of temperature change on physiological and biochemical activities of Haliotis discus hannai Ino. Journal of Fishery Sciences of China, 2017, 24(2): 220-230 [姜娓娓, 方建光, 李加琦, 等. 温度胁迫对皱纹盘鲍生理和生化活动的影响. 中国水产科学, 2017, 24(2): 220-230] |
JIANG X Y, YU G L, SONG X K, etal. Survey and evaluation of the Qianliyan National Aquatic germplasm reserve. Progress in Fishery Sciences, 2021, 42(5): 1-7 [姜向阳, 于广磊, 宋秀凯, 等. 千里岩海域国家级水产种质资源保护区现状调查与评价. 渔业科学进展, 2021, 42(5): 1-7 DOI:10.19663/j.issn2095-9869.20200820002] |
KOYAMA M, FURUKAWA F, KOGA Y, etal. Gluconeogenesis and glycogen metabolism during development of Pacific abalone, Haliotis discus hannai. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology, 2020, 318(3): 619-633 DOI:10.1152/ajpregu.00211.2019 |
LI X T, WANG Y, LI M, etal. Comparison of cold hardiness of two toad-headed lizards from different altitudes. Sichuan Journal of Zoology, 2017, 36(3): 300-305 [李相涛, 王燕, 李梅, 等. 不同海拔两种沙蜥低温耐受性的比较. 四川动物, 2017, 36(3): 300-305] |
LI Z Y, LIN Q, LI J, etal. Present situation and future development of marine ranching construction in China. Journal of Fisheries of China, 2019, 43(9): 1870-1880 [李忠义, 林群, 李娇, 等. 中国海洋牧场研究现状与发展. 水产学报, 2019, 43(9): 1870-1880] |
LIANG S, YOU W W, LUO X, etal. Cardiac and respiratory metabolic analysis of low-temperature tolerance in two geographic genotypes of Haliotis diversicolor and the hybrid. Aquaculture Reports, 2021, 21: 100869 DOI:10.1016/j.aqrep.2021.100869 |
LIANG S. Physiological and molecular basis of cold and disease resistance heterosis in Haliotis diversicolor hybrid. Doctoral Dissertation of Xiamen University, 2017 [梁爽. 杂色鲍杂交种耐低温和抗病杂种优势的生理基础和分子机制研究. 厦门大学博士研究生学位论文, 2017]
|
LIN S H, WU F C, ZHANG G F. Variation in cardiac response to thermal stress in two different cultured populations of Pacific abalones. Marine Sciences, 2016, 40(11): 84-90 [林思恒, 吴富村, 张国范. 高温胁迫下皱纹盘鲍不同养殖群体心率变化比较. 海洋科学, 2016, 40(11): 84-90 DOI:10.11759/hykx20160328003] |
LIU L J, JIANG X Y, GAO J Q, etal. Comprehensive evaluation of the Xiaoshi Island Apostichopus japonicus national aquatic germplasm reserve. Progress in Fishery Sciences, 2021, 42(5): 8-15 [刘丽娟, 姜向阳, 高继庆, 等. 小石岛刺参国家级水产种质资源保护区综合评价. 渔业科学进展, 2021, 42(5): 8-15] |
LIU L Y, LU L F, CHANG L R, etal. Effects of low temperature on Haliotis discus hannai overwintering in southern and northern coast. Jiangsu Agricultural Sciences, 2020, 48(20): 195-199 [刘力源, 卢龙飞, 常丽荣, 等. 低温对南北越冬后皱纹盘鲍的影响. 江苏农业科学, 2020, 48(20): 195-199] |
LIU Y Q. Studies on the original and seasonal analysis of abalone (Haliotis discus hannai Ino) and anti-obesity activity of phospholipids from abalone viscera. Master´s Thesis of Ocean University of China, 2013 [刘艳青. 皱纹盘鲍地域及季节性差异分析及内脏磷脂减肥活性研究. 中国海洋大学硕士研究生学位论文, 2013]
|
MA S L, GUO Y L, SUN L, etal. Over high or low dietary protein levels depressed the growth, TOR signaling, apoptosis, immune and anti-stress of abalone Haliotis discus hannai. Fish and Shellfish Immunology, 2020, 106: 241-251 DOI:10.1016/j.fsi.2020.08.004 |
CHEN N, LUO X, GU Y T, etal. Assessment of the thermal tolerance of abalone based on cardiac performance in Haliotis discus hannai, H gigantea and their interspecific hybrid.. Aquaculture, 2016, 465(1): 258-264 |
CHEN N, HUANG Z K, LU C K, etal. Different transcriptomic responses to thermal stress in heat-tolerant and heat-sensitive Pacific Abalones indicated by cardiac performance. Frontiers in Physiology, 2019, 9: 1895 |
NOWACK J, TARMANN I, HOELZL F, etal. Always a price to pay: Hibernation at low temperatures comes with a trade-off between energy savings and telomere damage. Biology Letters, 2019, 15(10): 20190466 |
REN L H, ZHANG J H, WANG W Q, etal. Effect of periodic starvation on growth, feeding, defecation and granulocyte of Pacific abalone Haliotis discus hannai Ino. Progress in Fishery Sciences, 2012, 33(2): 86-91 [任黎华, 张继红, 王文琪, 等. 周期性断食对皱纹盘鲍生长、摄食、排粪和血细胞组成的影响. 渔业科学进展, 2012, 33(2): 86-91] |
SHU J, LI Q, YU R H, etal. Microsatellites analysis on genetic variation between wild and cultured populations of pacific abalone (Haliotis discus hannai). Periodical of Ocean University of China, 2008, 38(1): 52-58 [束靖, 李琪, 于瑞海, 等. 皱纹盘鲍野生与养殖群体微卫星标记遗传变异研究. 中国海洋大学学报: 自然科学版, 2008, 38(1): 52-58] |
TIAN T, ZHANG M Y, YANG J, etal. Analysis of System Construction and Future Development of International Marine Ranching. Ocean Development and Management, 2021(11): 55-61 [田涛, 张明燡, 杨军, 等. 国际化海洋牧场的体系构建及未来发展浅析. 海洋开发与管理, 2021(11): 55-61] |
WANG Q. Construction of zebrafish cold-tolerance model and functional analysis of fish related genes. Doctoral Dissertation of Institute of Oceanology, Chinese Academy of Sciences, 2014 [王倩. 斑马鱼抗寒模型的构建及鱼类相关基因功能探讨. 中国科学院研究生院(海洋研究所)博士研究生学位论文, 2014]
|
WANG S S. Effects of dietary Enteromopha prolifra supplementation on growth, survival and body composition of juvenile abalone, Haliotis discus hannai. Transactions of Oceanology and Limnology, 2021, 43(2): 91-98 [王珊珊. 饲料中添加浒苔对皱纹盘鲍幼鲍生长、存活及体成分的影响. 海洋湖沼通报, 2021, 43(2): 91-98] |
WU F C, QUE H Y, ZHANG G F. current status, and future development of the Pacific abalone seed release and sea ranching in China. Marine Sciences, 2020, 44(8): 56-68 [吴富村, 阙华勇, 张国范. 我国皱纹盘鲍底播增养殖历史、现状及未来发展趋势. 海洋科学, 2020, 44(8): 56-68] |
WU F C. Studies on genetic breeding and cultivation techniques of Pacific abalone, Haliotis discus hannai Ino. Doctoral Dissertation of Institute of Oceanology, Chinese Academy of Sciences, 2008 [吴富村. 皱纹盘鲍的遗传育种与养殖技术研究. 中国科学院研究生院(海洋研究所)博士研究生学位论文, 2008]
|
YANG Y, WANG J X, WANG Z P, etal. Effects of clonal ulva on growth, survival rate and water quality of juvenile abalone (Haliotis discus hannai Ino). Transactions of Oceanology and Limnology, 2021, 43(3): 70-76 [杨洋, 王金霞, 王昭萍, 等. 无性系石莼对皱纹盘鲍稚鲍生长与存活及其养殖水质的影响. 海洋湖沼通报, 2021, 43(3): 70-76] |
YAO T, JIA Y L, HE J, etal. Differences in high temperature stress and growth between southern and northern populations of Haliotis discus hannai. Journal of Fishery Sciences of China, 2017, 24(2): 258-267 [姚托, 贾艳丽, 何健, 等. 皱纹盘鲍南北方群体的高温应激和生长差异. 中国水产科学, 2017, 24(2): 258-267] |
YOU W W, LUO X, KE C H. Progress in genetics and breeding of abalone. Journal of Xiamen University (Natural Science), 2021, 60(2): 417-424 [游伟伟, 骆轩, 柯才焕. 鲍的遗传育种研究进展. 厦门大学学报(自然科学版), 2021, 60(2): 417-424] |
ZENG L T, ZHONG S Y, YOU W W, etal. Effects of south-north relay mode on the nutritive compositions of Haliotis discus hannai. Journal of Fisheries of China, 2020, 44(1): 111-117 [曾莉婷, 钟诗懿, 游伟伟, 等. 南北接力养殖对皱纹盘鲍营养成分的影响. 水产学报, 2020, 44(1): 111-117] |



