2. 上海海洋大学水产与生命学院 上海 201306;
3. 上海长江口渔业资源增殖和生态修复工程技术研究中心 上海 200090
2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China;
3. Shanghai Engineering Research Center of Fisheries Stock Enhancement and Habitat Restoration of the Yangtze Estuary, Shanghai 200090, China
中华绒螯蟹(Eriocheir sinensis)广泛分布于我国沿海及通海的水域中,具有重要的经济效益(王武等, 2013)。中华绒螯蟹具有降海洄游和溯河洄游2种生活习性,在秋季时,性成熟个体洄游到近海河口交配产卵,至翌年春季时,大眼幼体溯河而上,回到淡水水域中继续生长(堵南山, 2004)。盐度是影响中华绒螯蟹交配和产卵的关键因子,目前,有关盐度对蟹类影响的报道主要集中在渗透压调节(Onken et al, 1999;Gabriela et al, 2007)、营养代谢(王瑞芳, 2012)与能量代谢(Luvizotto-Santos et al, 2003)、退壳与性早熟研究(潘颖, 2018)等方面,但盐度对中华绒螯蟹亲蟹交配及产卵前后血淋巴中相关激素的影响研究尚未见报道。
Fostier等(1975)提出了类固醇激素包括孕酮、17α-双羟孕酮、20β-双羟孕酮和17α-20β-双羟孕酮(dihydroxyprogesterone, DHP)等,其中,最有效地诱导鲑鳟鱼类卵细胞成熟的是DHP,已在大西洋鲑(Salmo salar)、太平洋鲑(Oncorhynchus)、虹鳟(Salmo gairdneri)和红大麻哈鱼(Oncorhynchus keta)等鱼类中得到证实(Zhao et al, 1985; Idler, 1960)。促性腺激素(gonadotropin,GTH)是由脑垂体分泌作为一种诱导卵母细胞最后成熟的因子。早期研究表明,硬骨鱼类的排卵活动与血液中的GTH水平密切相关(Goetz, 1983)。前列腺素(prostaglandin, PG)是一类具有生理活性的不饱和脂肪酸,具有极其广泛而复杂的生物学作用(周定刚等, 2004)。其中,前列腺素E (PGE)、前列腺素F (PGF)和前列环素(PGI2)均可促进鱼类和甲壳动物排卵。雌二醇(estradiol, E2)是甲壳动物体内最重要的活性雌激素,在卵巢发育和卵黄发生过程中起着十分重要的作用。姜仁良等(1992)推测,诱导中华绒螯蟹性腺发育可能是E2和甾体激素的共同作用。Burns等(1984)在美国龙虾(Homarus americanus)雄体性腺和血淋巴中均发现了睾酮(testosterone),并认为甲壳动物体内也具有E2和睾酮,且对性腺发育有一定的影响。
本研究通过分析不同盐度条件下,中华绒螯蟹雌体交配及产卵前后血淋巴中相关激素的含量变化特征,旨在解析盐度对中华绒螯蟹交配及产卵的生理机制,为中华绒螯蟹的繁育生物学研究提供基础资料和参考。
1 材料与方法 1.1 实验动物实验所用亲蟹来自江苏省高邮湖养殖场,挑选四肢健全、活力好的雌蟹[(111.48±20.86) g] 240只、雄蟹[(125.84±8.10) g] 120只,共360只,运至中国水产科学研究院东海水产研究所实验室。雌雄蟹分别放置于4个淡水玻璃缸中(直径为1.8 m,高为0.8 m,保持水深为50 cm),暂养7 d后用于正式实验。每缸中蟹的总重量基本保持一致,每日09:00按照3%~5%体重投喂新鲜去壳缢蛏(Sinonovacula constricta),每天清除残饵和死亡个体。实验期间,保持自然光照和自然水温[(11.50±3.16) ℃],pH为7.5~8.5,溶解氧(DO)保持在(6.0±0.3) mg/L以上。
1.2 交配、产卵实验 1.2.1 交配实验配制盐度分别为0、2、4和6的水体用于交配实验,每个盐度设3个平行。实验时,从暂养水槽中各取雌蟹10只、雄蟹5只,置于事先配制好的不同盐度水槽中(直径为1.0 m, 高为0.6 m),池中水深为25 cm。交配实验前,在盐度分别为0、2、4和6实验组中,每只雄蟹的甲壳上均进行数字标记和荧光标记的双重标记,通过视频摄像系统对交配行为和交配过程进行全程跟踪和摄像,确保取样的准确性。待实验结束后,将所有盐度组剩余的雌蟹全部解剖,若雌体纳精囊中含有精荚,即可确定雌体交配成功。
1.2.2 产卵实验根据本实验室在长江口长期调查和监测中华绒螯蟹产卵蟹的盐度分布的结果(0~21),同时,为了验证盐度为9是否为产卵的下限,产卵实验设置盐度梯度分别为3、6、9、12、15、18和21(交配率及产卵率实验结果待发表)。实验时,从暂养水槽中各取雌蟹10只、雄蟹5只,置于事先配制好的不同盐度水槽中(直径为1.0 m, 高为0.6 m),池中水深为25 cm。同时,所有盐度分别设置1个正常养殖组,每缸中放10只雌蟹,每个盐度设3个平行。
1.2.3 饲养条件每天09:00在每缸中投喂去壳缢蛏,饵料量为蟹体重的3%~5%,同时,清除水中的残饵,换水依据当天水质而定,换水量为1/2~2/3,保持水质干净。每天4次记录各实验组的交配情况、水温和盐度,记录时间为08:00、12:00、16:00和20:00,水体盐度根据实测情况进行校准,使盐度控制在±0.2的范围内。实验期间,保持自然光照和自然水温,水温为(11.50±3.16)℃,pH为7.5~8.5,DO > (6.0± 0.3) mg/L。
1.3 血淋巴采集交配实验持续20 d。20 d后,从交配实验的各盐度组中取5只交配但未产卵蟹(盐度为6)和未交配蟹(盐度为0)进行血淋巴采集;在产卵实验中,若观察到实验组某个盐度中雌蟹已经产卵,从该盐度中取5只实验组产卵蟹和5只正常养殖组产卵蟹分别进行血淋巴采集。
采样时,将蟹在冰水中麻醉15 min,捞出后吸干表面水分,采用2 mL一次性无菌注射器从第3或第4步足基部关节处采集血淋巴,采集的血淋巴快速注入已提前加入乙二胺四乙酸二钾(EDTA-2K)抗凝剂的1.5 mL无菌离心管中,实验全程在冰上进行;将采集的样品震荡摇匀,4 ℃条件下,4 000 r/min离心10 min后,倒出上清液,再重复离心1次,合并上清液,然后放入–80 ℃冰箱中保存备用。
1.4 激素检测指标及测定方法血淋巴检测指标包括DHP、GTH、PG、E2和睾酮。5种激素含量测定均采用双抗体夹心法,试剂盒全部由青岛科创检测有限公司提供,测定方法按照试剂盒操作步骤进行,使用酶标仪(华东电子DG5033A)在450 nm波长下测定吸光度(OD值),通过标准曲线计算样品中激素浓度。DHP和GTH单位为ng/L,PG单位为ng/mL,E2单位为pmol/L,睾酮单位为nmol/L。
1.5 数据处理采用Origin软件进行数据输入和绘图,实验数据使用平均值±标准差(Mean±SD)表示,采用SPSS 11.5软件进行统计分析,使用Levene法进行方差齐性检验,当不满足齐性方差时,对百分比数据进行反正弦或者平方根处理,对实验结果采用单因素方差分析(one-way ANOVA),采用Tukey’s法进行多重比较,P < 0.05为差异显著。
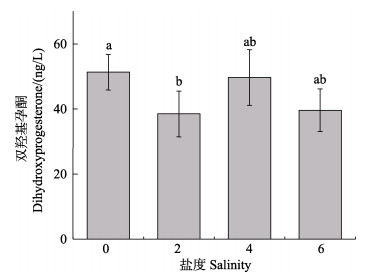
2 结果与分析 2.1 雌蟹交配及产卵前后血淋巴中DHP含量的变化雌蟹在低盐度条件下交配后,其血淋巴中DHP含量的变化见图 1。从图 1可以看出,在淡水中,雌蟹血淋巴中的DHP含量最高,平均为(51.31± 5.47) ng/L;随着盐度的升高,血淋巴中DHP含量呈下降的趋势,除盐度为2外,其他各盐度组相比均无显著差异(P>0.05)。
|
图 1 不同盐度下雌蟹交配后DHP含量的变化 Fig.1 Changes of DHP content in female crab after mating at different salinities 不同字母代表不同盐度组间存在显著差异(P < 0.05)。图 3、图 5、图 7和图 9同。 Different letters represent the significant difference between different salinity groups (P < 0.05). The same in Fig.3, Fig.5, Fig.7, and Fig.9. |
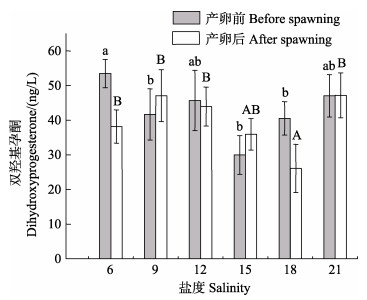
不同盐度条件下,雌蟹产卵前后血淋巴中DHP的变化见图 2。从图 2可以看出,在盐度为6、12和18时,雌蟹产卵结束后,血淋巴中的DHP有不同程度的降低,与此同时,在盐度为9、15和21时,产卵后血淋巴中DHP含量比产卵前有所上升,与产卵后其他各盐度组比较,盐度为18时,雌蟹产卵后,血淋巴中DHP含量最低(P < 0.05),平均值为(26.09±6.94) ng/L。
|
图 2 盐度对雌蟹产卵前后DHP含量的影响 Fig.2 Effects of salinity on DHP content of female crab before and after spawning 不同小写字母表示雌蟹产卵前存在显著差异,不同大写字母表示雌蟹产卵后存在显著差异(P < 0.05)。图 4、图 6、图 8、图 10同 Different small letters represent the significant difference between female crabs before spawning, and different capital letters represent the significant difference between female crabs after spawning (P < 0.05). The same in Fig.4, Fig.6, Fig.8, and Fig.10. |
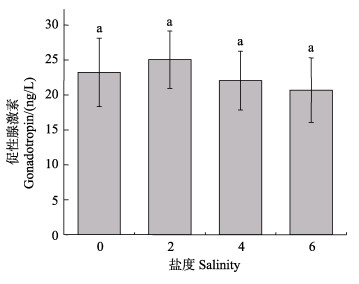
雌蟹在低盐度条件下,交配后血淋巴中GTH的含量变化见图 3。由图 3可知,在不同盐度水体中,雌蟹交配后血淋巴中GTH含量相比无显著差异(P > 0.05)。
|
图 3 不同盐度下雌蟹交配后GTH含量的变化 Fig.3 Changes of GTH content in female crab after mating at different salinities |
雌蟹在不同盐度条件下,产卵前后血淋巴中GTH的变化见图 4。从图 4可以看出,在盐度为6和15的水体中,雌蟹产卵后,血淋巴中GTH含量均有所升高,但在盐度为9、12、18和21时,产卵后GTH含量均降低,但产卵后各盐度组GTH含量相比均无显著差异(P > 0.05)。

|
图 4 盐度对雌蟹产卵前后GTH含量的影响 Fig.4 Effects of salinity on GTH content of female crab before and after spawning |
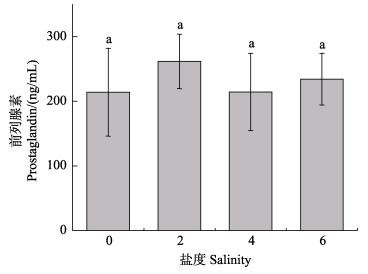
雌蟹在低盐度条件下交配后,血淋巴中PG的含量变化见图 5。从图 5可以看出,不同盐度条件下雌蟹交配后,血淋巴中PG含量相比无显著差异(P > 0.05)。
|
图 5 不同盐度下雌蟹交配后PG含量的变化 Fig.5 Changes of PG content in female crab after mating at different salinities |
雌蟹在不同盐度条件下,产卵前后血淋巴中PG含量的变化见图 6。从图 6可以看出,当水体中盐度为6和18时,雌蟹产卵后血淋巴中PG含量与产卵前相比有所下降,且在盐度为6时,雌蟹产卵后血淋巴中PG含量与产卵前相比无显著差异(P > 0.05);而在盐度为9、12、15和21时,产卵后血淋巴中PG含量呈上升趋势,但产卵前后各盐度组相比均无显著差异(P > 0.05)。产卵后,盐度为12中的雌蟹,其血淋巴中PG含量最高,平均为(274.30±37.58) ng/mL。
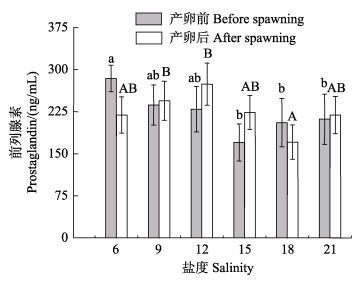
|
图 6 盐度对雌蟹产卵前后PG含量的影响 Fig.6 Effects of salinity on PG content of female crab before and after spawning |
雌蟹在低盐度条件下交配后,血淋巴中E2含量的变化见图 7。从图 7可以看出,在不同的盐度中,雌蟹血淋巴中E2含量相比无显著差异(P > 0.05)。
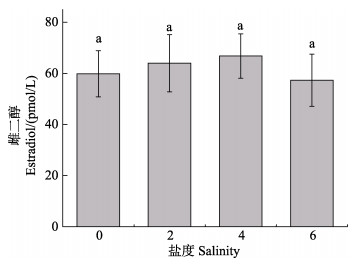
|
图 7 不同盐度下雌蟹交配后E2含量的变化 Fig.7 Changes of E2 content in female crab after mating at different salinities |
雌蟹在不同盐度条件下,产卵前后血淋巴中E2的含量变化见图 8。在盐度为9和18时,雌蟹产卵后血淋巴中E2含量降低,但其他盐度组中,产卵后E2含量均升高,其中,在盐度为15的水体中,雌蟹产卵后血淋巴中的E2含量显著升高(P < 0.05)。

|
图 8 盐度对雌蟹产卵前后E2含量的影响 Fig.8 Effects of salinity on E2 content of female crab before and after spawning |
雌蟹在低盐度下交配后,血淋巴中睾酮含量变化见图 9。从图 9可以看出,淡水中,雌蟹血淋巴中睾酮含量最低,平均为(16.82±1.02) nmol/L;随着盐度的升高,睾酮含量也逐渐升高,但各盐度组相比均无显著差异(P > 0.05)。
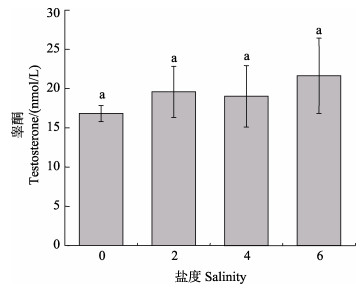
|
图 9 不同盐度下雌蟹交配后睾酮含量的变化 Fig.9 Changes of testosterone content in female crab after mating at different salinities |
雌蟹在不同盐度条件下,产卵前后血淋巴中睾酮含量的变化见图 10。从图 10可以看出,除盐度为18时,雌蟹产卵后血淋巴中睾酮含量下降外,其他盐度组均呈上升趋势;当盐度为6时,产卵前和产卵后血淋巴中的睾酮含量为最高,平均值分别为(21.68±3.25)和(23.21±0.86) nmol/L,但二者相比无显著差异(P > 0.05)。
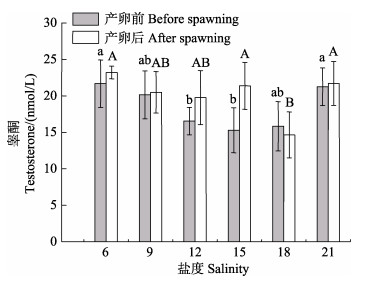
|
图 10 盐度对雌蟹产卵前后睾酮含量的影响 Fig.10 Effects of salinity on testosterone content of female crab before and after spawning |
在诱发鲑鳟鱼类卵细胞成熟过程中,DHP起了主导作用(林浩然, 1982)。(赵维信1987)研究发现,在鱼类卵细胞成熟后期且排卵开始时,DHP会形成一个峰值诱导卵巢滤泡成熟、卵核消失。Kraak等(1984)研究也表明,虹鳟在卵核消失时,DHP会持续上升进而保持在高水平上。这些研究都表明,DHP能直接作用于卵母细胞,诱发卵母细胞最终成熟,导致卵核消失并排卵。Scott等(1983)研究了有关鱼类卵母细胞的成熟机理,发现当鱼类卵母细胞在最后成熟时,17α-羟基孕酮(17α-OHP)在20β-类固醇脱羟酶(20β- HSD)作用下,DHP诱导卵母细胞胚泡破裂(germinal vesicle breakdown, GVBD)的发生,表明DHP是诱导鱼类卵母细胞最后成熟的一种有效的性类固醇激素。在日本鳗鲡(Anguilla japonica)(吴善, 1997; 柳凌等, 2005)和花鳗鲡(Anguilla marmorata)(林静, 2015)人工诱导排卵研究中,使用DHP进行催产,取得了显著的效果,认为DHP在鳗鲡的排卵和产卵过程中起着非常重要的作用。本研究中,在盐度为6、12和18时,雌蟹产卵后血淋巴中DHP含量降低,这与以上研究结果相一致,而其他盐度组却有所上升,分析原因可能是雌蟹正处于二次产卵前期,此时,DHP有所增加,为后续排卵做准备。同时,雌蟹盐度为0 (淡水)时无交配行为发生,在盐度低于6的水体中可以交配但不能产卵,其血淋巴中DHP含量呈下降趋势,尤其在盐度为2时,出现明显降低,可能是雌蟹交配后体内的营养物质大部分转移到卵巢中,体内因缺少某种营养物质导致DHP合成受阻。
GTH是硬骨鱼类脑垂体分泌在其生殖周期调节中起重要作用的激素。鱼类中存在2种典型的GTHs,即促卵泡激素(GTH-I)和促黄体素(GTH-Ⅱ)。鱼类卵母细胞最终成熟标志是卵泡破裂,只有达到最后的生理成熟,卵母细胞才能正常排卵、受精。在这个过程中,必须借助GTH刺激生殖细胞的生长、发育、成熟、排精及排卵(Otsu, 1963; Yano et al, 1988)。虹鳟在临近卵子成熟时,血淋巴中GTH-Ⅱ含量持续上升,然后稳定在高水平直到排出的卵全部产出(Fostier et al, 1978),以上研究都表明了GTH在鱼类排卵中起着重要作用。一般而言,鱼类排卵效应的时间与血淋巴中GTH峰值出现的时间保持一致(Aide,1988)。曲维良等(1986)采用脑垂体GTH诱导鱼类卵细胞的成熟是通过中介物质性类固醇激素在发挥作用,在DHP对卵细胞发挥作用前,必须借助于GTH的激发才能诱导排卵。同时,有学者研究发现,GTH也可以诱发大西洋鲑和虹鳟的卵巢滤泡产生DHP,直至卵核消失(Fostjer et al, 1978)。Jalabert等(1977)采用放射免疫法测定了鲤(Cyprinus carpio)在注射脑垂体后,血液中GTH明显升高,之后再注入DHP,可使鲤顺利产卵。本研究中,雌蟹产卵后,血淋巴中DHP和GTH变化趋势基本一致,表明在中华绒螯蟹雌蟹的排卵过程中,DHP同样需要GTH的参与共同发挥排卵作用。
PG在水产动物中均有广泛分布,有A、B、C、D、E、F、G、H和I等多种类型。邢金宝等(2019)研究表明,它可以促进性腺发育、帮助排卵,且与繁殖能力息息相关。Nagaraju等(2004)研究了PG (PGF2α, PGE2和PGD2)存在于色拉淡水蟹(Oziotelphusa senex senex)组织中,并可以促进蟹类的卵巢发育,且与生物的繁殖能力有关。Meunpol等(2010)研究发现,雌虾的卵巢和血淋巴中,PGE2水平随着卵巢发育阶段的不同而波动,且PGE2可以明显加快卵母细胞的生长。对溪红点鲑(Salvelinus fontinalis)而言,PGE2既可促进也可抑制其排卵,这主要取决于雌性个体(Goetz, 1983)。具有卵生、体外受精生殖方式的金鱼(Carassius auratus),它的性行为是由类固醇激素所刺激引起的,而产卵行为则由PG刺激引起的,且该激素引起的性行为或产卵行为仅局限在排卵后(赵维信,1986)。本研究中,不同盐度条件中,雌蟹交配后,血淋巴中PG含量无明显变化,表明PG含量对雌蟹交配作用不显著。与其他鱼类、哺乳类动物相比,除盐度为15外,其他盐度中华绒螯蟹雌蟹排卵前后血淋巴中PG含量差异不显著,原因可能是在不同的生物体中前列腺素对生物体的排卵作用有所差别。
黄金鲈(Perca flavescens)的卵泡在DHP刺激下生成大量PGE2和PGF2α,并产生排卵效应(Berndtson, 1989)。本研究中,雌蟹在盐度为18时,产卵结束后,血淋巴中GTH、DHP和PG含量显著减少(P < 0.05),原因可能是在盐度为18的水体中,雌蟹的产卵量、生殖力和生殖指数等繁殖性能参数均达到最大(本部分研究结果待发表),且这3种激素变化趋势基本一致,表明在中华绒螯蟹体内,这3种激素可能存在相互作用,它们之间的关系可能是GTH首先作用于DHP,DHP再刺激PG,从而产生排卵效应。而在其他盐度中,雌蟹产卵结束后,血淋巴中DHP和GTH略有上升,原因是雌蟹产卵并未全部完成,此时,可能处于二次产卵前期,导致这2种激素呈现升高的趋势。
3.2 盐度对中华绒螯蟹血淋巴中E2和睾酮含量的影响魏薇等(2007)对不同蜕皮周期中华绒螯蟹血淋巴中E2和睾酮的含量进行了研究,发现中华绒螯蟹血淋巴中E2含量的上升与盐度有关,且高盐度时,中华绒螯蟹血淋巴中E2含量的升高能促进性腺发育,进而导致性早熟的发生。研究表明,中华绒螯蟹的卵巢会进行二次发育(于智勇等, 2007; 李思发等, 2001)。本研究发现,在盐度为2和4的水体中,雌蟹交配后,血淋巴中E2和睾酮含量有所增加,原因可能是中华绒螯蟹在交配后卵巢进行二次发育所致,这也与另一研究中得出在盐度为2、4的水体中,雌蟹交配后的性腺成熟系数(GSI)有所升高的结果相一致(研究结果待发表);本研究同时也发现,当盐度为6时,雌蟹产卵前后血淋巴中的睾酮含量均为最大值,原因可能是当盐度为6时,雌蟹的繁殖性能最低,产卵量、生殖指数和生殖力均最小(研究结果待发表),此时,雌蟹体内仍保留大量营养,可能正处于二次产卵前期。
虹鳟卵黄发生末期,E2的含量达到最大值(Kraak et al, 1984),但卵母细胞最终成熟和排卵时E2浓度快速下降,之后逐渐上升直至平稳,原因是血淋巴中E2浓度降低,导致芳香酶活力快速减弱和类固醇激素对下丘脑和垂体的反馈抑制作用减弱,下丘脑快速促使垂体分泌大量GTH (Fostier et al, 1978)。硬骨鱼类卵巢可合成睾酮,睾酮又在芳香酶的作用下转化为E2 (Zhao et al, 1985)。虹鳟在排卵前30 d,血淋巴中E2含量下降,同时,GTH升高,GTH诱发卵巢产生了睾酮(Scott et al, 1983),但此时芳香酶活力微弱,致使很大一部分睾酮未能继续转化成E2,此时会形成排卵前一个短暂的峰值,这可能是为了调节DHP大量分泌的时间,这也是卵母细胞达到最终成熟和排卵不可或缺的一环(赵维信, 1987)。与本研究结果不同的是除盐度为18外,其他盐度组雌蟹产卵后血淋巴中睾酮含量均呈上升趋势,原因可能是在中华绒螯蟹产卵阶段,睾酮含量对雌蟹与其他鱼类的作用机制存在差异。此外,赵维信(1987)发现,睾酮能加强GTH诱发DHP的合成;而E2抑制GTH诱发DHP的合成,且睾酮可转化为E2 (Zhao et al, 1985),表明这2种激素在一定时期呈负相关。在本研究中,雌蟹产卵后血淋巴中睾酮含量下降,而E2含量上升,这与上述结果基本一致。
赵维信(1987)研究表明,虹鳟中E2和睾酮主要作用仅是与机体卵黄发生有关,与卵母细胞成熟和排卵并无显著关系。本研究中,E2和睾酮含量与盐度之间并无明显相关性,原因可能是这2种激素对亲蟹的影响主要集中在性腺发育阶段,在后续的交配产卵过程中发挥作用较小,这与已有相关研究结果基本一致。总之,目前,这2种激素对蟹类的生殖调控机制尚不清楚,还有待继续开展深入研究。
AIDE K. A reviw of plasma hormone changes during ovulation in cyprinoid fishes. Aquaculture, 1988, 74: 11-20 DOI:10.1016/0044-8486(88)90081-6 |
BERNDTSON A. In vitro ovulation, prostaglandin synthesis, and proteolysis in isolated ovarian components of yellow perch (Perca flavescens): Effects of 17 alpha, 20 beta-dihydroxy- 4-pregnen-3-one and phorbol ester. General and Comparative Endocrinology, 1989, 75(3): 454-465 DOI:10.1016/0016-6480(89)90181-0 |
BURNS B G, SANGALANG G B, FREEMAN H C, et al.. Isolation and identification of testosterone from the serum and testes of the American Lobster (Homarus americanus). General and Comparative Endocrinology, 1984, 54: 429-432 DOI:10.1016/0016-6480(84)90158-8 |
DU N S. Migration of Eriocheir sinensis. Aquatic Science and Technology Information, 2004, 31(2): 56-57 [堵南山. 中华绒螯蟹的洄游. 水产科技情报, 2004, 31(2): 56-57 DOI:10.3969/j.issn.1001-1994.2004.02.001] |
FOSTIER A, BTRTON B. Binding of steroids by plasma of a teleost: the rainbow trout, Salmo gairdnerii. Journal of Steroid Biochemistry, 1975, 6(3/4): 345-351 |
FOSTIER A, WEIL, C, TERQUI M, et al.. Plasma estradiol-17β and gonadotropin during ovulation in rainbow trout (Salmo gairdneri). Annales Biologie Animale Biochimie Biophysique, 1978, 18(4): 929-936 DOI:10.1051/rnd:19780527 |
GABRIELA T, MIREILLE C D, SILVIA C, et al.. Effects of longterm exposure to different salinities on the location and activity of Na+/K+-ATPase in the gills of juvenile mitten crab Eriocheir sinensis. Comparative Biochemistry and Physiology Part A, Molecular and Integrative Physiology, 2007, 147(2): 460-465 DOI:10.1016/j.cbpa.2007.01.020 |
GOETZ F W. Hormonal control of oocyte final maturation and ovulation in fishes. Fish Physiology Academic Press, 1983, 9: 117-170 |
IDLER D R, FAGERLUND U H M, RONALD A P. Isolation of pregn-4-ene-17α, 20β-diol-3-one from the plasma Pacific salmon (Oncorhynchus nerka). Biochemical and Biophysical Research Communications, 1960, 2(2): 133-137 DOI:10.1016/0006-291X(60)90204-7 |
JALABERT B, BRETON B, BRZUSKA E, et al.. A new tool for induced spawning: The use of 17α-hydroxy-20β-dihydro- progesterone to spawn carp at low temperature. Aquaculture, 1977, 10: 353-364 DOI:10.1016/0044-8486(77)90126-0 |
JIANG R L, TAN Y J, WU J M, et al.. Changes of hemolymph 20-hydroxyecdysone 17β-estradiol and testosterone levers in Eriocheir sinensis. Journal of Fisheries of China, 1992, 16(2): 101-104 [姜仁良, 谭玉钧, 吴嘉敏, 等. 中华绒螯蟹血淋巴中20α-羟基蜕皮酮、17β-雌二醇和睾酮含量的变动. 水产学报, 1992, 16(2): 101-104 DOI:10.3321/j.issn:1000-0615.1992.02.001] |
KAGAWA H. In vitro estradiol-17β and testosterone production by ovarian follicles of the goldfish, Carasius auralus. General and Comparative Endocrinology, 1984, 54: 139-143 DOI:10.1016/0016-6480(84)90209-0 |
KRAAK G V D, DYE H M, DONALDSON E M. Effects of LH-RH and des-Gly10 (D-Ala6) LH-RH-ethylamideon plasms gonadotropin levels and oocyte maturation in adult female salmon (Oncorhynchus kisutch). General and Comparative Endocrinology, 1984, 55: 36-45 DOI:10.1016/0016-6480(84)90126-6 |
LI S F, WANG C H, ZHAO N G. Studies on gonad developmental rule of lake stocked mitten crab of Yangtze population. Acta Hydrobiologica Sinica, 2001, 25(4): 350-356 [李思发, 王成辉, 赵乃刚. 湖泊放养长江水系中华绒螯蟹的性成熟规律研究. 水生生物学报, 2001, 25(4): 350-356 DOI:10.3321/j.issn:1000-3207.2001.04.008] |
LIN H R. The secretion of gonadotropin and its regulatory mechanism. Aquatic Life Collection, 1982, 7(4): 551-562 [林浩然. 硬骨鱼类促性腺激素的分泌及其调节机制. 水生生物集刊, 1982, 7(4): 551-562] |
LIN J. Content and changes of sex hormones in the gonad and serum of the artificially induced maturing Anguilla marmorata and A. japonica. Master´s Thesis of Shanghai Ocean University, 2015 [林静. 人工催产花鳗鲡(Anguilla marmorata)卵巢发育过程中性类固醇激素含量影响. 上海海洋大学硕士研究生学位论文, 2015]
|
LIU L, GUO F, ZHANG J M, et al.. Artificial induction of ovulation in Japanese eel Anguilla japonica. Journal of Fishery Sciences of China, 2005, 12(1): 49-54 [柳凌, 郭峰, 张洁明, 等. 日本鳗鲡排卵的人工诱导. 中国水产科学, 2005, 12(1): 49-54 DOI:10.3321/j.issn:1005-8737.2005.01.010] |
LUVIZOTTO-SANTOS R, LEE J T, PEREIRA-BRANCO Z P, et al.. Lipids as energy source during salinity acclimation in the euryhaline crab Chasmagnathus granulata Dana, 1851 (Crustacea-grapsidae). Jouranl of Experimental Zoology Part A: Comparative Experimental Biology, 2003, 295A: 200-205 DOI:10.1002/jez.a.10219 |
MEUNPOL O, DUANGJAI E, YOONPUN R, et al.. Detection of prostaglandin E2 in polychaete Perinereis spsp. and its effect on Penaeus monodon oocyte development in vitro. Fisheries Science, 2010, 76(2): 281-286 |
NAGARAJU G P C, REDDY P R, REDDY P S. Mandibular organ: It's relation to body weight, sex, molt and reproduction in the crab, Oziotelphusa senex senex Fabricius (1791). Aquaculture, 2004, 232: 603-612 DOI:10.1016/S0044-8486(03)00519-2 |
ONKEN H. Active NaCl absorption across split lamellae of posterior gills of Chinese crabs (Eriocheir sinensis) adapted to different salinities. Comparative Biochemistry and Physiology Part A: Molecular and Integrative, 1999, 123: 377-384 DOI:10.1016/S1095-6433(99)00078-1 |
OTSU T. Bihormonal control of sexual cycle in the freshwater crab Potamon dehaani. Embryologia, 1963, 8: 1-20 DOI:10.1111/j.1440-169X.1963.tb00183.x |
PAN Y. Comparison of protein level in accessory gland and 17 estradiol and testosterone concentrations in hemolymph between normal and precocious male Chinese mitten handed crab Eriocheir sinensis. Chinese Journal of Fisheries, 2018, 31(3): 35-39 [潘颖. 正常和早熟雄性河蟹副性腺蛋白和血淋巴中17β-雌二醇及睾酮浓度的比较. 水产学杂志, 2018, 31(3): 35-39 DOI:10.3969/j.issn.1005-3832.2018.03.008] |
QU W L, PAN W Z, GUO J E, et al.. Use 17α- Hydroxyl-20β effect of dihydroxy progesterone on ovulation of loach under low temperature. Fisheries Science and Technology Information, 1986, 2(3): 6-8 [曲维良, 潘伟志, 郭继娥, 等. 用17α-羟基-20β-双羟基黄体酮促使泥鳅在低温下排卵效应的研究. 水产科技情报, 1986, 2(3): 6-8] |
REDDY P S, REDDY P R, NAGARAJU G P. The synthesis and effects of prostaglandins on the ovary of the crab Oziotelphusa senex senex. General and Comparative Endocrinology, 2004, 135(1): 35-41 DOI:10.1016/j.ygcen.2003.08.002 |
SCOTT A P, SUMPTER J P, HARDIMAN P A. Hormone changes during ovulation in the rainbow trout (Salmo gairdneri Richardson). General and Comparative Endocrinology, 1983, 49: 128-134 DOI:10.1016/0016-6480(83)90016-3 |
WANG R F. Physical and behavioral response of Eriocheir sinensis broodstock, early developmental stages to salinity. Master´s Thesis of East China Normal University, 2012 [王瑞芳. 长江中华绒螯蟹亲体和早期发育阶段对盐度的生理与行为响应. 华东师范大学硕士研究生学位论文, 2012]
|
WANG W, WANG C H, MA X Z. Ecological breeding of crabs. Beijing: China Agricultural Press, 2013: 59-84 [王武, 王成辉, 马旭洲. 河蟹生态养殖. 北京: 中国农业出版社, 2013: 59-84]
|
WEI W, WU J M, WEI H. Physiological mechanism of precociousness influenced by salinity in juvenile Eriocheir sinensis. Journal of Fishery Sciences of China, 2007, 14(2): 275-280 [魏薇, 吴嘉敏, 魏华. 盐度对中华绒螯蟹性早熟生理机制的影响. 中国水产科学, 2007, 14(2): 275-280 DOI:10.3321/j.issn:1005-8737.2007.02.015] |
WU S. Changes of fertilization rate, hatching rate and time after ovulation of Japanese eel induced by DHP. Fishery Modernization, 1997(5): 18-20 [吴善. 用DHP诱导日本鳗鲡排卵后受精率和孵化率与时间的变化. 渔业现代化, 1997(5): 18-20] |
XING J B, YOU J G, LI X, et al.. Advances in prostaglandins in aquatic animals. Jiangxi Aquatic Science and Technology, 2019, 3(6): 46-43 [邢金宝, 由家国, 李旭, 等. 前列腺素在水产动物中的研究进展. 江西水产科技, 2019, 3(6): 46-43] |
YANO I, TSUKIMURA B, SWEENEY J N, et al.. Induced ovarian maturation of Penaeus vannamei by implantation of lobster ganglion. Journal of the World Aquaculture Society, 1988, 19: 204-209 DOI:10.1111/j.1749-7345.1988.tb00781.x |
YU Z Y, WU X G, CHANG G L, et al.. Changes in major biochemical components in ovary and liver pancreas during the second ovarian development. Acta Hydrobiologica Sinia, 2007, 31(6): 799-806 [于智勇, 吴旭干, 常国亮, 等. 中华绒螯蟹第二次卵巢发育期间卵巢和肝胰腺中主要生化成分的变化. 水生生物学报, 2007, 31(6): 799-806] |
ZHAO W X, Wright R S. The course of steroid release by intact ovarian follicles of Atlantic salmon (Salmo salar) incubated in vitro with and without gonadotrophin. General and Comparative Endocrinology, 1985, 57: 274-280 |
ZHAO W X. Changes of serum steroid levels during ovulation in rainbow trout (Salmon gairdneri). Journal of Fisheries of China, 1987, 11(3): 205-214 [赵维信. 虹鳟排卵前后血清中性类固醇激素浓度变化的研究. 水产学报, 1987, 11(3): 205-214] |
ZHAO W X. Hormonal pheromones have sex with fish. Journal of Shanghai Fisheries University, 1986, 5(4): 10-12 [赵维信. 激素信息素与鱼类的性行为. 上海水产大学学报, 1986, 5(4): 10-12] |
ZHOU D G, WEN A X. The changes of levers of 6-keto-PGF1αin serum during spawning induced with HCG in Monopteros albus. Acta Hydrobiological Sinica, 2004, 28(5): 572-574 [周定刚, 温安祥. HCG诱导排卵期间黄鳝血浆6-酮-前列腺素F1α含量的变化. 水生生物学报, 2004, 28(5): 572-574] |



