2. 中国水产科学研究院黄海水产研究所 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 山东 青岛 266071
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071, China
开展消化系统组织结构、消化酶活性和营养物质能量代谢水平分析是认识动物个体消化生理机能的重要研究手段。通过观察消化系统中各器官的组织结构,有助于人们明确各器官在消化过程中发挥的功能。长蛸(Octopus minor)消化系统的组织结构分析结果显示,前唾液腺、后唾液腺和肝脏含有大量的黏液细胞和分泌颗粒,是分泌消化酶的主要器官(崔龙波等, 2001)。通过分析消化过程中消化酶活性和营养物质代谢水平,有助于阐明动物个体对不同营养物质的消化能力,解析食物的消化吸收过程。在真蛸(Octopus vulgaris)的消化过程中,蛋白酶发挥重要作用,可溶性营养物质首先经过消化道的传递被快速吸收,随后结构复杂的大分子物质在蛋白酶等消化酶的作用下,水解为小分子营养物质并被机体吸收(Bastos et al, 2020)。基于消化酶活性分析结果发现,负蛸(Octopus mimus)的消化吸收过程大约持续400 min,而玛雅蛸(Octopus maya)为500 min (Gallardo et al, 2017; Linares et al, 2015)。
中华蛸(Octopus sinensis)在我国主要分布于东南沿岸,以浙江舟山,福建平潭、霞浦,广东汕头、湛江,广西北海等海域居多(Gleadall, 2016; 刘兆胜, 2013)。中华蛸具有蛸类食物转化率高、生长速度快的优良特性,且体型大、市场价格高,已成为福建和广东沿海重要的蛸类养殖品种。中华蛸以工厂化养殖和网箱养殖为主要养殖方式,网箱养殖过程中,个体间相互残食行为十分普遍,急需开展消化生理学研究明确其适宜的投喂量和投喂频率,减少经济损失(王怀忠等, 2018; 谢书秋, 2016; 蔡厚才等, 2007; 王朝新, 2007)。目前,未见中华蛸消化生理学的相关研究报道。本研究拟以中华蛸为研究对象,首先通过组织学手段观察各消化器官的组织结构,探明组织结构与消化功能的关系。随后检测摄食前后消化酶活性和营养物质代谢水平的动态变化,明确中华蛸消化吸收过程消耗的时间,为确定适宜的投喂频率、提升中华蛸养殖技术水平提供理论支持。
1 材料与方法 1.1 实验材料2020年6月中华蛸采集于福建连江海域,平均体重为(1 040.07±274.37) g,运输至烟台开发区天源水产开发有限公司进行实验。中华蛸放置于水泥池(5 m×5 m×1 m)进行驯化培育,养殖用水为砂滤天然海水,海水温度为21.7~24.6 ℃、盐度为33.8~34.2、pH为7.6~8.2,保持常流水和充气,日换水量100%。饵料为鲜活菲律宾蛤仔(Ruditapes philippinarum),每天07:00点足量投喂1次,投喂2 h后清理池底污物一次。
1.2 实验方法将中华蛸单独放置于半径65 cm、高70 cm的圆桶中进行实验,实验前停食24 h。组织学采样:麻醉中华蛸采集组织学样本。消化酶活性和营养物质含量分析参照Bastos等(2020)的实验方法,按中华蛸体重的5%投喂菲律宾蛤仔,投喂60 min后捞出剩余的食物,共设6个取样时间点,喂食后0、60、120、200、300和400 min,每个时间点3个重复样本。为保证取样时间的准确,采样临近的2只个体的喂食时间相差30 min,每只个体的麻醉和取样时间固定为30 min。
1.3 样品采集与处理解剖前用7.5%氯化镁溶液进行麻醉(朱之发等, 2020),使中华蛸处于麻醉状态,采用1 mL注射器插入背动脉抽取2~3 mL血液样本,4 ℃、2 000 r/min离心10 min获得上清液,血浆样本立即置于液氮。解剖取出完整的消化系统,依次采集前唾液腺、后唾液腺、嗉囊、肝脏、胃、盲囊及肠道样本,清理其中的内容物,各样本分装,每份1~2 g。腕基部获取肌肉组织样本,置于液氮保存。样品带回至实验室后,生理盐水洗涤并称量各消化器官,根据需要加入9倍体积的生理盐水或匀浆缓冲液混合,冰浴下UItraturrax匀浆器全速匀浆1 min。最后将匀浆置于离心机中,4 ℃、2 500 r/min离心10 min,上清液置于−80 ℃保存。
消化系统各器官(包括前唾液腺、后唾液腺、嗉囊、肝脏、胃、盲囊、肠道)置于Bouin固定液,固定24 h后置于70%酒精中保存。
1.4 消化酶活性、营养物质含量测定及组织学观察消化酶活性、血浆生化指标和肌肉糖原测定的试剂盒由南京建成生物工程研究所提供,按照盒内说明书进行检测。
组织学样品经酒精梯度脱水后使用二甲苯进行透明,最后浸蜡包埋,包埋好的组织通过旋转切片机(徕卡RM 2016)制作切片(5~7 μm),利用苏木精−伊红(H.E)进行染色。通过尼康DM 400B显微镜(日本)和Top view3.7软件进行拍照或使用Pannoramic MIDI切片扫描仪扫描切片,使用Photoshop CC或Case Viewer2.4.0软件对照片进行亮度和对比度调整。
1.5 数据处理采用单因素方差分析(one-way ANOVA)检验生化指标在采样时间点之间是否有统计学上的显著差异(P < 0.05),多重比较采用Duncan᾽s法。数据采用平均值±标准差(Mean±SD)表示。
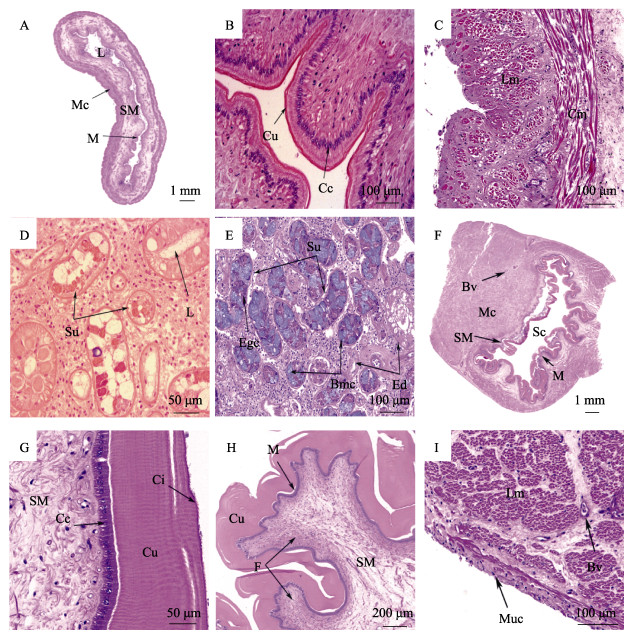
2 结果与分析 2.1 消化系统各器官组织学形态特征 2.1.1 嗉囊嗉囊为一个较大的管腔,由黏膜层、黏膜下层和肌层组成(图 1A)。黏膜层护膜较薄厚度约为2.57~5.44 μm,上皮向内形成波浪形褶皱,由单层柱状细胞构成,排列紧密,核位于细胞中部,黏膜下层厚度约(868.30±385.35) μm (图 1B)。肌层为外环肌内纵肌(图 1C)。
|
图 1 中华蛸嗉囊、唾液腺和胃的组织学结构 Fig.1 Histology of crop, salivary gland and stomach in O. sinensis A:嗉囊横切面;B:嗉囊褶皱和护膜;C:嗉囊肌层;D:前唾液腺横切面;E:后唾液腺横切面;F:胃横切面;G:胃护膜;H:胃褶皱;I:胃肌层;Bmc:嗜碱性黏液分泌细胞;Bv:血管;Cc:柱状细胞;Ci:纤毛;Cu:护膜;Cm:环肌;Ed:分泌导管;Egc:嗜酸性颗粒状分泌细胞;F:褶皱;L:管腔;Lm:纵肌;M:黏膜层;Mc:肌层;Muc:黏膜细胞;Sc:胃腔;Su:分泌单位;SM:黏膜下层。 A: Cross-section of the crop; B: Crop fold and cuticle; C: Crop mucosal layer; D: Cross-section of the anterior salivary glands; E: Cross-section of the posterior salivary glands; F: Cross-section of the stomach; G: Stomach cuticle; H: Stomach fold; I: Stomach muscular layer; Bmc: Basophilic mucous; Bv: Blood vessel; Cc: Columnar cell; Ci: Cilia; Cu: Cuticle; Cm: Circular muscle; Ed: Excretory ducts; Egc: Eosinophilic granular secretory cell; F: Fold; L: Lumen; Lm: Longitudinal muscle; M: Mucosal layer; Mc: Muscular layer; Muc: Mucosal cells; Sc: Stomach cavity; Su: Secretory units; SM: Submucosa. |
前唾液腺(图 1D)和后唾液腺(图 1E)均为复合管状腺,由椭圆形和圆形两种腺管及大量的分泌导管组成,腺细胞为柱形,HE染色显示2种分泌细胞:一种是嗜酸性颗粒状分泌细胞,呈紫红色,圆形核位于细胞底部,胞浆嗜碱性;另一种是嗜碱性黏液分泌细胞,在切片过程中,分泌颗粒容易破坏,因此着色很浅,呈泡状或空泡状,细胞核较扁,位于细胞基底部。
2.1.3 胃胃呈豆状,胃壁厚、平坦或凹凸不平,由黏膜层、黏膜下层和肌层构成,胃腔偏向一侧,胃壁向胃腔内突起,使得胃壁形成多个纵向褶皱,每个褶皱上又形成多个波浪形细小的褶皱(图 1F)。黏膜层护膜约99.97~383.82 μm,具有4.17~7.21 μm高的纤毛,黏膜层由排列紧密的单层柱状细胞构成,高约(41.31±12.35) μm,呈圆形或卵圆形,核位于细胞基部或中部(图 1G, H)。黏膜下层较薄而肌层极厚,肌层主要由纵肌构成(图 1I)。
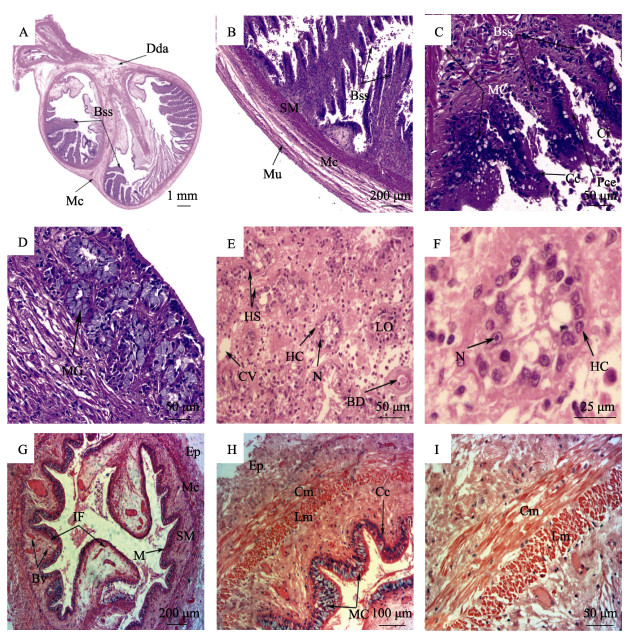
2.1.4 盲囊盲囊呈双螺旋状,主要由黏膜层、黏膜下层和肌层组成。盲囊一侧平坦,另一侧向内形成很长的侧褶,每条侧褶上具有很多呈放射状排列整齐的次生褶,侧褶和次生褶随着盲囊的扭曲而增大(图 2A)。盲囊肌层很薄,仅由环形肌构成(图 2B)。褶游离端被假复层纤毛柱状上皮覆盖,黏膜层由柱状细胞构成,细胞表面附有稀疏的纤毛。黏膜上皮可见黏液细胞,盲囊内壁平坦或次生褶皱部位黏液细胞数量较多,同时,在长侧褶的基部和游离端也大量存在,而中间部位则少量存在(图 2C)。在部分长侧褶游离端的黏膜下层含有少量的黏液腺,由多个圆形或锥形腺细胞构成,核被细胞内大量的分泌物挤至一边(图 2D)。
|
图 2 中华蛸盲囊、肝脏和肠的组织学结构 Fig.2 Histology of caecum, digestive gland and intestine in O. sinensis A:盲囊横切面;B:盲囊肌层;C:盲囊次生褶;D:盲囊侧褶游离端;E~F:肝脏横切面;G:肠横切面;H:肠肌层和褶皱;I:肠肌层;Bss:盲囊侧褶;Bv:血管;BD:胆管;Cc:柱状细胞;Ci:纤毛;Cm:环肌;CV:中央静脉;Dda:消化腺管附肢;Ep:上皮层;HC:肝细胞;HS:肝血窦;IF:肠褶皱;LO:肝小叶;Pce:假复层纤毛柱状上皮;M:黏膜层;Mc:肌层;MC:黏液细胞;MG:黏液腺;Mu:黏膜;N:细胞核。 A: Cross-section of the caecum; B: Caecum muscular layer; C: Caecum secondary fold; D: Caecum free end of side fold; E~F: Cross-section of the digestive gland; G: Cross-section of the intestine; H: Intestine muscular layer and fold; I: Intestine muscular layer; Bss: Blind sac side; Bv: Blood vessel; BD: Bile duct; Cc: Columnar cell; Ci: Cilia; Cm: Circular muscle; CV: Central vein; Dda: Digestive duct appendages; Ep: Epithelial; HC: Hepatocyte; HS: Hepatic sinusoid; IF: Intestinal folds; LO: Hepatic lobule; Pce: Pseudostratified ciliated epithelium; M: Mucosal layer; Mc: Muscular layer; MC: mucous cells; MG: Mucous glands; Mu: Mucosa; N: Nucleus. |
肝脏是中华蛸最大的消化器官,主要由肝小叶组成(图 2E),肝细胞聚集形成肝小叶,肝细胞呈圆形,排列较为紧密,形成肝细胞索,周围有肝血窦环绕,细胞核明显,位于细胞中央,肝脏导管内发现少量类似肝细胞的分泌颗粒,但肝脏内结缔组织不发达,因此,肝小叶界限不易分辨(图 2F)。
2.1.6 肠肠直径约2.50 mm,管壁较薄,有黏膜层、黏膜下层和肌层。肠黏膜形成波浪形黏膜纵行褶,其中,有一对较长的褶几乎占据整个肠道内腔(图 2G)。黏膜褶皱覆盖假复层纤毛上皮,黏膜层排列紧密的柱状细胞,上皮细胞有纤毛,在黏膜褶皱上含有大量圆形空泡状的分泌细胞(图 2H)。黏膜下层由疏松的结缔组织和大量的血管组成,肠肌层较薄由内纵肌外环肌构成(图 2I)。
2.2 摄食后各组织消化酶活性变化情况 2.2.1 胰蛋白酶胰蛋白酶活性的变化情况见图 3。摄食后中华蛸的胰蛋白酶活性肝脏显著高于其他组织,60 min最高达到(148.74±21.25) U/mg,然后开始降低,400 min恢复到摄食前水平(P > 0.05);摄食60 min胃胰蛋白酶活性处于最低值(7.9±2.23) U/mg,在120 min达到最大值(24.55±3.8) U/mg;前唾液腺、后唾液腺、嗉囊、盲囊、肠道胰蛋白酶活性均在摄食120 min时达到最大值。

|
图 3 中华蛸摄食后各组织胰蛋白酶活性变化 Fig.3 The activities of trypsin in different tissues of O. sinensis after feeding 同一组织的不同字母代表不同时间点间的数值差异显著(P < 0.05)。下同。 The different letters in each tissue indicate significantly different values between different sampling time point (P < 0.05). The same below. |
淀粉酶的变化见图 4。中华蛸淀粉酶主要存在于肝脏和胃中,摄食后各组织淀粉酶活性较低,均在60 min达到峰值,特别是肝脏和胃分别达最高值(3.68±0.59)和(2.48±0.64) U/mg,随后缓慢下降恢复到摄食前水平。

|
图 4 中华蛸摄食后各组织淀粉酶活性变化 Fig.4 The activities ofamylase in different tissues of O.sinensis after feeding |
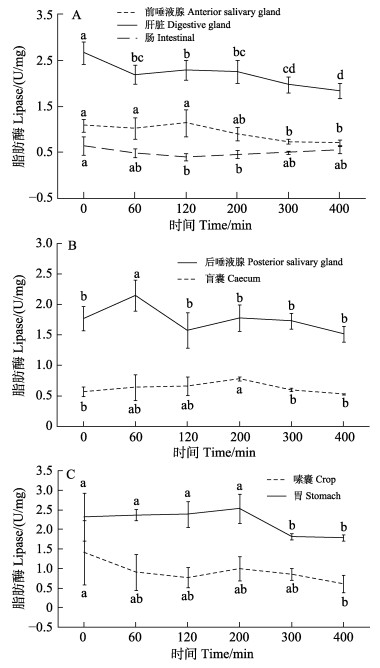
脂肪酶的变化见图 5。中华蛸肝脏和胃组织脂肪酶活性高于其他组织,消化过程中,肝脏脂肪酶活性从(2.66±0.24) U/mg降低至(1.84± 0.16) U/mg,后唾液腺脂肪酶在60 min达到最高值(2.15±0.25) U/mg。总体上各组织脂肪酶活性高低差异较小,摄食后变化幅度不大,变化规律不明显。
|
图 5 中华蛸摄食后各组织脂肪酶活性变化 Fig.5 The activities of lipase in different tissues of O. sinensis after feeding |
血浆甘油三酯、总胆固醇和总蛋白浓度的变化见图 6。中华蛸摄食后血浆甘油三酯(图 6A)和血浆总蛋白(图 6B)浓度都先下降后上升,在120 min分别达到最低值(0.13±0.22) mmol/L和(161.50±67.51) mg/mL;血浆胆固醇(图 6A)浓度在摄食后各时间点差异不显著(P > 0.05)。

|
图 6 摄食后中华蛸血浆生化指标变化 Fig.6 Changes of plasma biochemical indices of O.sinensis after feeding 同一指标的不同字母代表不同时间点间的数值差异显著(P < 0.05)。下同。 The different letters in each index represent significantly different values between different sampling time point (P < 0.05). The same below. |
血浆葡萄糖和肌糖原含量变化见图 7。由图 7可见,中华蛸摄食后200 min血糖浓度达到最高值(1.54± 0.44) mmol/L,与其他各点差异显著(P<0.05);摄食后肌糖原浓度60 min降到最低值(2.75±0.12) mg/g,0 min和200 min分别达到(4.64±0.36)和(4.75±0.13) mg/g显著高于其他时间点(P < 0.05)。

|
图 7 摄食后中华蛸血糖(A)和肌糖原(B)的变化 Fig.7 Changes of plasma glucose (A) and muscle glycogen (B) of O. sinensis after feeding |
嗉囊具有储存食物的作用,中华蛸嗉囊较大,其黏膜层形成的丰富的褶皱具有很强的伸缩性,有助于储存更多食物。而曼氏无针乌贼(Sepiella maindroni)(陆伟进, 2012)、中国枪乌贼(Uroteuthis chinensis) (刘梦娜, 2020)等乌贼目、枪形目头足类则缺乏嗉囊结构,储存食物能力相对较弱。中华蛸嗉囊肌肉壁薄,具有大量纵向褶皱,当摄食量增大时,管腔扩张,皱褶消失,管腔通畅,不受肌层影响。
胃是初步研磨消化食物的场所。本研究发现,中华蛸的胃具有发达的肌层和护膜,横向肌肉收缩可使胃腔变窄,胃腔内的褶皱增加了其与食物的接触面积,有助于将食物分解成更容易在盲囊消化的小片段,与长蛸、短蛸及曼氏无针乌贼的胃结构相似(崔龙波等, 2000; 陆伟进, 2012; 王宜艳等, 2007)。
中华蛸的盲囊接收胃中的食糜防止未经磨碎的食物直接进入肠道,同时接收肝脏分泌的消化酶,组织学特征与真蛸(Fernández-Gago et al, 2019)和红色肠腕蛸(Enteroctopus megalocyathus) (Garri et al, 2013)相似。盲囊腔内突出的长侧褶和次生褶增加了与食物接触的面积,褶皱表面的纤毛细胞有助于将食物与消化酶混合。盲囊具有消化吸收功能,营养物质可吸收进入黏膜下层丰富的血管中。根据曼氏无针乌贼和长蛸的研究结果推测(崔龙波等, 2000; 陆伟进, 2012),中华蛸盲囊长侧褶的游离端黏膜下层的黏液腺能分泌粘性多糖等物质,具有帮助食物运输等作用。
中华蛸肠较粗长,以肛门开口于外套腔,而曼氏无针乌贼肠较短,长蛸和短蛸的肠细长(崔龙波等, 2000; 陆伟进, 2012; 王宜艳等, 2007)。肠内的褶皱大大增加了食物吸收的表面积,肠内还有2个与其他褶皱明显不同的长嵴,占据大部分肠道空间,可能帮助食糜在小肠停留更长时间,有助于消化吸收。中华蛸嗉囊和胃中褶皱黏膜层含有不同厚度的护膜,胃的护膜最厚,嗉囊的护膜最薄,然而在肠道中没有护膜,与长蛸的研究结果相似(崔龙波等, 2000)。胃具有研磨功能,中华蛸胃中较厚的护膜有助于更好地将食物研磨为小片段,便于消化吸收。
中华蛸消化腺为肝脏、2对唾液腺,无胰脏;长蛸和短蛸消化腺为肝脏、2对唾液腺和胰脏;曼氏无针乌贼消化腺为肝脏、1对唾液腺和胰脏(崔龙波等, 2000; 陆伟进, 2012; 王宜艳等, 2007)。蛸类的前唾液腺和后唾液腺在进食过程中发挥着不同的作用,前唾液腺释放消化酶参与消化,而后唾液腺不仅分泌消化酶,还可以分泌毒素麻痹猎物(Hernández-García et al, 2000; Messenger et al, 1999; 蔡英亚等, 1982)。曼氏无针乌贼等许多头足类动物的唾液腺中发现含有多种蛋白质水解酶,有助于蛋白质消化(陆伟进, 2012; Ponte et al, 2017; Grisley et al, 1988)。同样中华蛸前后唾液腺富含分泌腺和颗粒细胞,能够产生大量的蛋白酶和淀粉酶。
肝脏是头足类动物消化系统的关键组成部分,是进行消化酶分泌和营养物质细胞内消化的主要器官(Costa et al, 2014; Mancuso et al, 2014; Boucaud-Camou et al, 1983、2009)。中华蛸的肝脏仅有一种腺细胞,与长蛸肝脏的研究结果相似(崔龙波等, 2001),而曼氏无针乌贼的肝脏中不仅有腺细胞还有胚细胞(陆伟进, 2012)。另外,中华蛸肝脏导管内发现少量类似肝细胞的分泌颗粒,推测其分泌的消化酶可通过导管进入盲囊,参与食糜的消化过程。
3.2 中华蛸消化酶活性变化摄食前,中华蛸消化酶活性处于一个基础水平,摄食后消化酶活性开始上升,高峰出现在60~120 min,400 min后恢复接近基础水平。摄食前后中华蛸胰蛋白酶活性变化较为剧烈,而淀粉酶和脂肪酶活性的变化较为缓慢,说明摄食对中华蛸消化系统中胰蛋白酶活性的影响更显著。中华蛸摄食后肝脏胰蛋白酶活性在0~60 min上升,60 min后下降;胃胰蛋白酶活性在60 min内下降,60~120 min上升,120 min后又逐渐下降。中华蛸摄食后短时间内胃内胰蛋白酶活性出现下降,这与大口黑鲈(Micropterus salmoides)(关胜军等, 2006)摄食后的现象相似,可能是短时间内胃中食物多而肝脏分泌的胰蛋白酶还未充分进入胃中,导致胃内胰蛋白酶浓度下降所致;60 min后,肝脏中的胰蛋白酶分泌减少并充分进入胃中,则肝脏胰蛋白酶的活性降低,而胃胰蛋白酶的活性升高,此时,胃腔中的食物消化反应剧烈;120 min后,随着营养物质进入肝脏内开始细胞内消化,则肝脏胰蛋白酶的活性上升及胃胰蛋白酶的活性下降。
肝脏是中华蛸分泌消化酶最重要的器官,胰蛋白酶的活性在肝脏最高,为其他消化器官的5~245倍;淀粉酶的活性肝脏 > 胃 > 嗉囊;而脂肪酶活性较高的分别是肝脏、胃和后唾液腺。这与Mangold (2010)研究的肝脏是真蛸分泌消化酶、消化食物和储存营养物质主要场所的结论一致。在不同消化酶中,胰蛋白酶活性[最高为(148.74±21.25) U/mg]显著高于脂肪酶[最高为(2.66±0.24) U/mg]和淀粉酶[最高为(3.68±0.59) U/mg],与曼氏无针乌贼、真蛸等其他头足类的研究结果一致(陆伟进, 2012; Mangold, 2010; Vlieg, 1984; Ballantyne et al, 1981)。头足类为高蛋白、低脂肪的肉食性动物,以蛋白质作为主要能量来源,且摄入的食物富含蛋白质,因而需要大量蛋白酶对蛋白质进行消化分解(Mangold, 2010; Vlieg, 1984; Ballantyne et al, 1981)。头足类体内碳水化合物含量不足1%,对碳水化合物和脂类的需求和分解利用能力有限(游岚等, 2015; O′dor et al, 1984),因而中华蛸体内淀粉酶和脂肪酶活性处于较低水平。
3.3 中华蛸营养物质含量变化营养物质含量的变化在一定程度上反应了动物的摄食消化过程。本研究中,中华蛸摄食后0~60 min体内血糖、血蛋白及肌糖原的浓度有所下降,表明它们可能参与为消化系统供能的过程;随着消化吸收的进行,120 min后,上述指标开始逐渐升高;400 min后,上述指标恢复至基础水平,表明消化吸收过程的结束。摄食后中华蛸血浆甘油三酯和胆固醇变化幅度较小,且浓度较低,这与脂肪酶活性处于较低水平的结果一致。在玛雅蛸的消化过程中,胆固醇储存于肝脏,没有释放到血液中(Linares et al, 2015)。中华蛸可能存在类似的生理过程,使胆固醇含量始终处于较低水平。
3.4 中华蛸的消化吸收过程在负蛸和玛雅蛸等蛸类中,消化过程分2个阶段进行:第1个阶段,发生的速度较快,食物通过食道进入嗉囊和胃部,与消化酶混合形成食糜,开始细胞外消化,可溶营养物质沿着消化道快速传递,在盲囊和肠道被机体吸收。第2个阶段,发生的速度较慢,食糜与消化液进一步混合,结构复杂的大分子物质水解为小分子营养物质;细胞外消化和细胞内消化同时进行,细胞外消化获得的营养物质运输到肌肉进行蛋白质合成,细胞内消化在肝脏进行,获得的营养物质储存于消化腺中作为能量来源(Bastos et al, 2020; Linares et al, 2015; Mangold, 2010; O′dor et al, 1984)。
消化酶活性和营养物质代谢水平结果显示,中华蛸的消化过程同样分为2个阶段。第1阶段发生在0~60 min,此时,食物进入嗉囊和胃部,诱使肝脏大量分泌胰蛋白酶,而胃内初始的胰蛋白酶与食物混合,导致胰蛋白酶活性下降;此阶段只有少量营养物质被吸收,并且机体还需要消耗营养物质为消化过程供能,因而观察到血糖、血蛋白和肌糖原含量的下降。第2阶段发生在120~300 min,肝脏分泌的胰蛋白酶使得胃、盲囊等器官的蛋白酶活性在120 min时显著上升,达到蛋白酶活性的顶峰;随着细胞外消化和细胞内消化的进行,各消化器官的蛋白酶活性逐渐降低,营养物质被消化吸收,血糖、血蛋白和肌糖原的含量逐步上升。在400 min时,蛋白酶活性、血糖、血蛋白和肌糖原指标恢复至摄食前水平,表明中华蛸消化吸收过程的结束。中华蛸的消化吸收过程约需400 min,这与真蛸(400 min),负蛸(400 min)和玛雅蛸(500 min)的消化时间接近(Bastos et al, 2020; Gallardo et al, 2017; Linares et al, 2015)。
4 结论本研究观察了中华蛸消化系统各器官的组织结构特征,分析了各器官的消化功能。消化酶活性结果显示,蛋白酶活性最高,肝脏是分泌消化酶的主要器官。在21~24 ℃间,中华蛸需400 min左右完成一次摄食消化,表明在养殖生产中,适宜的投喂间隔时间为6~7 h。
BALLANTYNE J S, HOCHACHKA P W, MOMMSEN T P. Studies on the metabolism of the migratory squid, Loligo opalescens: Enzymes of tissues and heart mitochondria. Marine Biology Letters, 1981, 2: 75-85 |
BASTOS P, FRACALOSSI D M, CHIMAL M E, et al.. Digestive enzymes and timing of digestion in Octopus vulgaris type Ⅱ. Aquaculture Reports, 2020, 16(C): 100262-100262 |
BOUCAUD-CAMOU E, BOUCHER-RODONI R, MANGOLD K. Feeding and digestion in cephalopods. New York: The Mollusca. Academic Press, 1983: 149-187
|
BOUCAUD-CAMOU E, YIM M. Fine structure and function of the digestive cell of Sepia officinalis (Mollusca: Cephalopoda). Journal of Zoology, 2009, 191(1): 89-105 |
CAI H C, ZHUANG D G, YE P, et al.. Net cage and cement tankculture of common, Alantit ocopus Octopus wlgaris in Nanji sland, Zeiang Province. South China Fisheries Science, 2007(2): 66-70 [蔡厚才, 庄定根, 叶鹏, 等. 浙江南麂岛真蛸网箱和水泥池养殖试验. 南方水产, 2007(2): 66-70] |
CAI Y Y, ZHANG Y, WEI R F. Introduction to shellfish. Shanghai: Shanghai Science and Technology Publishers, 1982: 54-56 [蔡英亚, 张英, 魏若飞. 贝类学概论. 上海: 上海科技出版社, 1982: 54-56]
|
COSTA P M, RODRIGO A P, COSTA M H. Microstructural and histochemical advances on the digestive gland of the common cuttlefish, Sepia officinalis L. Zoomorphology, 2014, 133(1): 59-69 DOI:10.1007/s00435-013-0201-8 |
CUI L B, ZHAO H. Histological and histochemical studies on alimentary canal of Octopus variabilis sasaki. Journal of Yantai University (Natural Science and Engineering), 2000, 24(4): 277-281 [崔龙波, 赵华. 长蛸消化道的组织学与组织化学研究. 烟台大学学报(自然科学与工程版), 2000, 24(4): 277-281 DOI:10.3969/j.issn.1004-8820.2000.04.009] |
CUI L B, ZHAO H. Histological and histochemical studies on salivary glands and digestive glands of Octopus variabilis sasaki. Marine Sciences, 2001, 25(7): 38-41 [崔龙波, 赵华. 长蛸唾液腺和消化腺的组织学与组织化学研究. 海洋科学, 2001, 25(7): 38-41] |
FERNÁNDEZ-GAGO, RAQUEL, MOLIST P, et al.. Anatomical and histochemical features of the digestive system of Octopus vulgaris Cuvier, 1797 with a special focus on secretory cells. Acta Zoologica, 2019, 100(3): 1-16 |
GALLARDO P, OLIVARES A, MARTÍNEZ-YÁÑEZ R, et al.. Digestive Physiology of Octopus maya and O. mimus: Temporality of digestion and assimilation processes. Frontiers in Physiology, 2017, 100(8): 320-355 |
GARRI R G, CIDRE L. Microanatomy of the digestive system of Enteroctopus megalocyathus (Cephalopoda, Octopoda) of the Southwest Atlantic. Bulletin of Marine and Coastal Research, 2013, 42(2): 255-274 |
GLEADALL I G. Octopus sinensis d'orbigny, 1841 (Cephalopoda: Octopodidae): Valid species name for the commercially valuable East Asian common octopus. Species Diversity, 2016, 21(1): 31-42 DOI:10.12782/sd.21.1.031 |
GRISLEY M S, BOYLE P R. Recognition of food in Octopus digestive tract. Journal of Experimental Marine Biology and Ecology, 1988, 118(1): 7-32 DOI:10.1016/0022-0981(88)90119-0 |
GUAN S J, WU R Q, XIE J, et al.. Effect of feeding on the activity of proteas and amylase in different digestive organs of largemouth bass (Micropterus salmoides). Marine Fisheries, 2006, 28(3): 190-194 [关胜军, 吴锐全, 谢骏, 等. 摄食对大口黑鲈消化器官蛋白酶和淀粉酶活力的影响. 海洋渔业, 2006, 28(3): 190-194 DOI:10.3969/j.issn.1004-2490.2006.03.003] |
HERNÁNDEZ-GARCÍA V, MARTÍN AY, CASTRO J J. Evidence of external digestion of crustaceans in Octopus vulgaris paralarvae. Journal of the Marine Biological Association of the UK, 2000, 80(3): 559-560 DOI:10.1017/S0025315400002320 |
LINARES M, CAAMAL-MONSREAL C, OLIVARES A, et al.. Timing of digestion, absorption and assimilation in octopus species from tropical (Octopus maya) and subtropical- temperate (Octopus maya) and subtropical- temperate (O. mimus) ecosystems. Aquatic Biology, 2015, 2(24): 127-140 |
LIU M N. Study on morphology and feeding ecology of Chinese squid (Uroteuthis chinensis). Master′s Thesis of Shanghai Ocean University. 2020 [刘梦娜. 中国枪乌贼形态学与摄食生态学研究. 上海海洋大学硕士研究生学位论文, 2020]
|
LIU Z S. Studies on fundamental biology and artificial reproductive technique of Octopus vulgaris. Master′s Thesis of Ocean University of China, 2013 [刘兆胜. 真蛸基础生物学和繁育技术研究. 中国海洋大学硕士研究生学位论文, 2013]
|
LU W J. The study on histology, cytology and enzyme chemistry of Sepiella maindroni digestive system. Master′s Thesis of Ningbo University, 2012 [陆伟进. 曼氏无针乌贼消化系统组织细胞学和酶化学的研究. 宁波大学硕士研究生学位论文, 2012]
|
MANCUSO M, GIORDANO D, GENOVESE L, et al.. Study of digestive enzymes in wild specimens of Sepia officinalis (Linnaeus, 1758) and Octopus vulgaris (Cuvier, 1797). Cahiers de Biologie Marine, 2014, 55(4): 445-452 |
MANGOLD R B K. Experimental study of digestion in Octopus vulgaris (Cephalopoda: Octopoda). Journal of Zoology, 2010, 183(4): 505-515 |
MESSENGER J B, YOUNG J Z. The radular apparatus of cephalopods. Philosophical Transactions of the Royal Society B: Biological Sciences, 1999, 354(1380): 161-182 DOI:10.1098/rstb.1999.0369 |
O′DOR R K, MANGOLD K, RODONI-BOUCHER R, et al.. Nutrient absorption, storage and remobilization in Octopus vulgaris. Marine and Freshwater Behaviour and Physiology, 1984, 11(3): 239-258 |
PONTE G, MODICAV M. Salivary glands in predatory mollusks: Evolutionary considerations. Frontiers in Physiology, 2017, 8: 580-588 |
VLIEG P. Proximate composition of New Zealand squid species. New Zealand Journal of Science, 1984, 27(2): 145-150 |
WANG C X. Experiment on sea cage culture technology of Octopus ocellatus. Journal of Aquaculture, 2007(6): 22-23 [王朝新. 真蛸海水网箱养殖技术试验. 水产养殖, 2007(6): 22-23] |
WANG H Z, QIAN Y S, ZHENG X D, et al.. Laboratory culture experiment of Octopus octopus in the coastal area of Northern Jiangsu. Journal of Aquaculture, 2018, 39(3): 11-12 [王怀忠, 钱耀森, 郑小东, 等. 苏北沿海真蛸室内养殖试验. 水产养殖, 2018, 39(3): 11-12] |
WANG Y Y, SUN H S, LIU Y S, et al.. The electron microscopic cytochemistry study of peroxidase and phenoloxidase in the mantle of Chlamys farreri. LudongUniversity Journal (Natural Science), 2007, 23(1): 76-79 [王宜艳, 孙虎山, 刘玉生, 等. 短蛸消化系统粘液细胞的类型与分布. 鲁东大学学报(自然科学版), 2007, 23(1): 76-79] |
XIE S Q. Sea cage culture technology of Octopus octopus. Scientific Fish Farming, 2016(7): 42-43 [谢书秋. 真蛸海水网箱养殖技术. 科学养鱼, 2016(7): 42-43] |
YOU L. Effects of the dietary lipid levels on the growth and feed utilization of Sepiella maindroni. Journal of Jimei University (Natural Science), 2015, 20(1): 6-13 [游岚. 饲料脂肪水平对曼氏无针乌贼生长的影响. 集美大学学报(自然科学版), 2015, 20(1): 6-13] |
ZHU Z F, BIAN L, LIU T X, et al.. Anesthetic effects of several anesthetics on Octopus minor. Journal of Fishery Sciences of China, 2020, 27(2): 195-203 [朱之发, 边力, 刘心田, 等. 12种麻醉剂对长蛸的麻醉效果. 中国水产科学, 2020, 27(2): 195-203] |



