2. 农业农村部东海渔业资源开发利用重点实验室 中国水产科学研究院东海水产研究所 上海 200090
2. Key Laboratory of East China Sea Fishery Resources Exploitation, Ministry of Agriculture and Rural Affairs, East China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Shanghai 200090, China
拟穴青蟹(Scylla paramamosain)俗称青蟹,是我国重要的海水养殖品种。病害是青蟹健康养殖主要的威胁(蔡小辉等, 2013; 郑天伦, 2014),青蟹呼肠孤病毒(mud crab reovirus, MCRV)是养殖青蟹的主要病原(Weng et al, 2007)。MCRV是一种双链无囊膜RNA病毒,基因组包含12个节段,预测可编码13个开放阅读框(ORF) (Chen et al, 2011、2012)。早期研究显示,该病毒感染可导致锯缘青蟹(Scylla serrata)近100%的死亡率(Weng et al, 2007)。近年来的研究显示,该病毒感染非常普遍,几乎所有青蟹养殖池塘都可以检测到该病毒(申亚阳等, 2017)。因此,筛选无MCRV种蟹,从繁育阶段净化病原、获取无MCRV病原苗种(SPF)势在必行。
目前,普通RT-PCR、RT-LAMP、巢式RT-PCR和荧光定量PCR (qRT-PCR)检测方法已应用于MCRV检测(熊娟, 2011; 张迪等, 2013a、b)。上述检测方法引物设计主要是基于VP1基因(病毒RNA聚合酶基因),考虑到该基因表达水平不高,限制了检测方法的灵敏性,需要挑选表达水平更高的靶标基因设计检测引物,提高检测方法的灵敏性。此外,目前的检测方法通常取青蟹鳃组织进行病毒检测,这种杀死青蟹进行病毒检测的方法显然不适用于良种场无毒种蟹筛选。因此,有必要研发对青蟹损伤小的取样方法。
qRT-PCR技术具有灵敏度高、特异性强、准确可靠等特点,已广泛应用于病原定量检测等(Lee et al, 2006)。与TaqMAN探针法、分子信标法和LUX引物法相比(Rekhviashvili et al, 2006; Liang et al, 2019; 宋增磊等, 2019; 桑松文等, 2021),基于SYBR Green的qRT-PCR检测方法引物设计简单、费用低且具有独特的熔解曲线分析程序,使其成为当前应用最为广泛的病原检测技术之一(李新苍等, 2012)。本研究将基于表达量更高的病毒基因设计引物,并借助SYBR Green qRT-PCR检测方法的灵敏性和实用性,研发对青蟹创伤小的MCRV检测方法,满足青蟹种蟹MCRV净化需要。
1 材料与方法 1.1 实验动物和病毒核酸样品实验用健康青蟹来自上海崇明某养殖场,将2021年5月采自海南的22只种蟹和2021年9月采自浙江的20只商品青蟹用于病原检测。MCRV为本实验室于2020年从浙江某养殖场分离鉴定的野毒株。青蟹双顺反子病毒(mud crab dicistrovirus, MCDV)、对虾白斑综合征病毒(white spot syndrome virus, WSSV)、十足目虹彩病毒1 (Decapod iridescent virus 1, DIV1)、虾肝肠胞虫(Enterocytozoon hepatopenaei, EHP)和副溶血弧菌(Vibrio parahaemolyticus) 5种病原核酸均来自本实验室保存的病原样品。
1.2 主要试剂和总RNA提取TB Green Ⅱ、反转录试剂盒(Primescript RT Master Mix)、DNA Marker等均购自TaKaRa公司,总RNA提取试剂盒(Transzol UP Plus RNA Kit)购自北京全式金生物。将青蟹冰浴5 min后,用无菌注射器抽取少量血淋巴(约50 µL)进行RNA抽提;随后,解剖青蟹,取鳃、肝胰腺、心、胃、肠和肌肉组织,抽提各组织的总RNA。总RNA提取及反转录具体步骤按照试剂盒操作说明书进行,以总RNA为模板,热变性后加入随机引物进行反转录,合成的cDNA用于随后的定量分析。
1.3 引物设计与合成参考MCRV基因组12个节段序列(GenBank编号HQ414127.1-HQ414138.1),利用在线软件预测病毒全部基因的编码区,在病毒基因编码序列内部设计定量引物;与此同时,选择18S rRNA作为内参基因并设计其定量引物。上述引物均由生工生物工程(上海)股份有限公司合成。
1.4 MCRV在青蟹各组织中的相对含量分析MCRV阳性青蟹采自浙江某养殖场,选取6只青蟹用于分析病毒侵染的组织分布情况。使用qRT-PCR方法分析MCRV在各组织中的相对含量,病毒基因引物为VP11RF和VP11RR,内参基因引物为18SF和18SR (表 1)。qRT-PCR体系和参数采用仪器推荐的快速反应程序。反应体系:TB Green Ⅱ 10 µL,上、下游引物各0.4 µL (10 µmol/L),无菌水6.8 µL,cDNA模板2 µL,ROX染料0.4 µL,总体积为20 µL。反应参数:95 ℃预变性3 min;95 ℃变性10 s,60 ℃退火60 s,读板1次;共40个循环;最后,将温度从60 ℃提高到95 ℃,期间每增加0.5 ℃检测1次荧光值。反应体系样品加入96孔反应板后置于荧光定量PCR仪(QuantStudio 6 Flex, ABI)上进行检测。病毒在各组织中的相对含量按照公式(病毒相对含量= 218S rRNA CT–MCRV CT)进行计算。使用GraphPad Prism 9软件对数据进行处理,t检验进行显著分析。
|
|
表 1 引物序列信息 Tab.1 Primers used in this study |
为分析MCRV基因相对表达水平,对13个预测的病毒基因分别设计并合成相应特异性引物(表 1)。以18S rRNA作为内参基因,通过qRT-PCR分析各基因的相对表达量。病毒感染青蟹血淋巴cDNA作为定量反应体系模板,反应条件和体系采用步骤1.4的快速反应程序。使用OriginPro 9.1软件对数据进行处理,t检验进行显著分析。
1.6 病毒VP11基因核酸片段扩增以病毒cDNA为模板,利用引物MCRVVP11F1和MCRVVP11R1进行PCR扩增,获取制备标准品质粒的核酸片段。反应体系:Ex Taq酶25 µL,灭菌水20 µL,上下游引物各2 µL(10 µmol/L),模板cDNA(200 ng/µL) 1 µL,总体积50 µL。PCR条件:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火45 s,72 ℃延伸50 s,共35循环;72 ℃延伸10 min,终止反应。
1.7 标准品质粒构建与稀释病毒VP11基因片段PCR产物经1%琼脂糖凝胶电泳分析,目标片段回收后连接到pMD19-T载体,随后转化大肠杆菌(Escherichia coli) DH5α感受态细胞,将PCR筛选获得的阳性克隆菌株进行培养。按照质粒提取试剂盒(TaKaRa)说明书提取质粒,送生工生物工程(上海)股份有限公司测序。确认质粒构建成功后,通过超微量分光光度计测其OD260 nm和OD280 nm值(1 OD吸光值相当于50 µg/mL的dsDNA),从而确定质粒纯度并计算质粒总质量。每微升质粒拷贝数(copies/µL)=质粒质量浓度(µg/µL)/质粒分子量;质粒分子量=2×330×nt (其中,nt为质粒的碱基数)。将标准品质粒进行9次10倍稀释,直到100 copies/µL,–20 ℃保存备用。
1.8 SYBR Green qRT-PCR体系及相关参数的确定以含VP11基因片段的标准品质粒为模板,使用引物VP11RF和VP11RR进行qRT-PCR,通过分析PCR产物的熔解曲线,确定引物的特异性与可行性。在此基础上,通过正交实验确定上、下游引物的最佳配比浓度(获得最小的CT值),并通过温度梯度实验,优化退火温度,由此建立最佳反应条件,并最终确定反应参数。
1.9 标准曲线绘制及引物扩增效率计算将1.7中系列稀释标准品作为反应模板,每个梯度设置5个重复,按照所建立的qRT-PCR体系和参数进行反应,由仪器自动绘制标准曲线并生成线性方程和相关系数(R2),根据斜率的线性方程计算引物的扩增效率。利用统计学方法计算各梯度CT值的变异系数(CV),分析其重复性和稳定性。
1.10 qRT-PCR的灵敏性检测在1.7中标准品质粒10倍系列稀释基础上,进一步制备了50、25和12.5 copies/µL标准品质粒。将倍比稀释质粒作为模板进行qRT-PCR,通过分析CT值变异系数,确定该方法的检测极限值。
1.11 qRT-PCR特异性检测为分析该检测方法的特异性,以携带MCRV鳃组织样本作为阳性对照,以健康青蟹鳃组织cDNA样本作为阴性对照,使用甲壳类常见病原核酸样本,如MCDV的cDNA以及WSSV、DIV1、EHP或副溶血弧菌的DNA,进行qRT-PCR,分析该检测方法的特异性。
1.12 MCRV感染情况调查为评估MCRV qRT-PCR检测方法的实用性、了解MCRV感染状况,使用该检测方法对来自海南的22只种蟹和浙江的20只商品青蟹分别进行MCRV检测。
1.13 MCRV在青蟹体内的增殖模式分析从上海某养殖场购买的青蟹经检测无MCRV感染后,挑选规格大体一致的健康青蟹6只(约250 g/只),用于病毒感染实验,实验水温设为21 ℃。按照熊娟(2011)的方法制备病毒粗提液,并将200 µL病毒粗提液从步足基部注入实验组青蟹体内。分别在病毒感染0、24、48、72、96、120、144、168和192 h时抽取少量血淋巴(约50 µL/只)提取RNA,用于分析病毒相对含量。病毒感染期间,统计青蟹死亡情况。
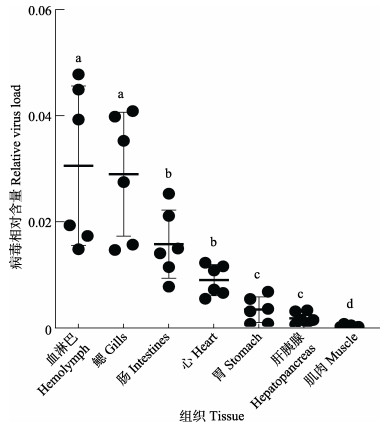
2 结果与分析 2.1 MCRV在感染青蟹的血淋巴和鳃中含量最高MCRV在感染青蟹各组织中的相对含量见图 1,病毒分布于所有检测组织中,其中,血淋巴和鳃组织中的病毒含量显著高于其他组织,病毒相对含量平均值由高到低依次为血淋巴、鳃、肠、心脏、胃、肝胰腺和肌肉。实验结果提示,以血淋巴作为MCRV检测的采样组织,能提高检测方法的灵敏性。
|
图 1 MCRV的组织分布 Fig.1 Relative load of MCRV in different tissues 不同字母表示组间差异显著。下同。 Different letters indicate significant differences among groups. The same as below. |
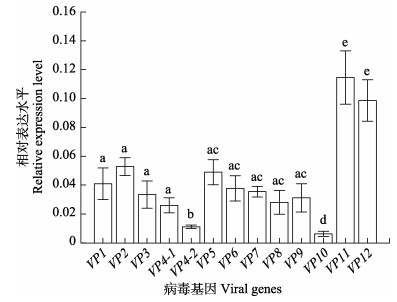
MCRV是具有合成mRNA能力的双链RNA病毒,为分析病毒各基因相对表达量(含基因组序列),实验使用随机引物对血淋巴总RNA进行反转录,合成病毒及其转录本cDNA作为基因表达量分析的模板。以病毒基因特异引物(13对引物)和内参基因引物分别检测各基因的相对表达量。结果显示,在MCRV感染过程中,各基因表达存在显著差异(图 2)。其中,VP11基因相对表达量的平均值最高,显著高于其他多数基因。研究结果提示,以VP11基因序列设计引物进行病毒检测,能显著提高检测灵敏性。
|
图 2 MCRV 13个预测基因在青蟹血淋巴中的相对表达量 Fig.2 Relative expression level of 13 predicted genes of MCRV in the hemolymph of mud crab |
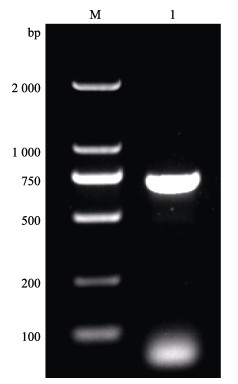
以MCRV的VP11 cDNA作为模板,使用引物MCRVVPF1和MCRVVPR1进行PCR扩增,获得1条约725 bp的条带,大小与预期目的片段相符(图 3)。插入该片段的pMD19-T载体经测序后,发现克隆序列与原序列一致。经检测,提取的标准品质粒OD260 nm/OD280 nm值为1.92,浓度为18 µg/µL。质粒全长为3 417 bp,由公式换算出标准品拷贝数为4.8× 109 copies/µL,随后,加灭菌双蒸水将质粒浓度调整为1.0×109 copies/µL。
|
图 3 病毒VP11基因部分DNA片段的扩增 Fig.3 The partial DNA fragment of VP11 obtained by PCR M:DNA Marker;1:扩增的VP11 DNA片段。 M: DNA Marker; 1: The amplified VP11 DNA fragment. |
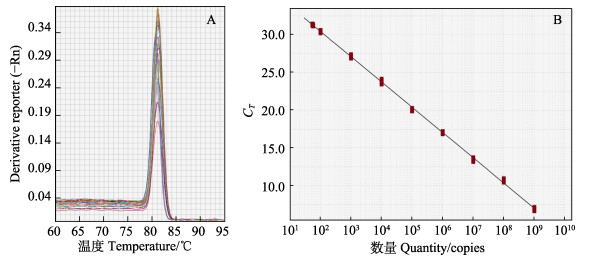
使用不同浓度引物进行正交实验,当引物MCRVVP11RF和MCRVVP11RR的终浓度均为2 µmol/L时,检测样品可获得较小的CT值和更强的荧光信号强度。同时,对扩增产物的熔解度曲线进行分析,只在81.5 ℃附近出现单峰,说明该引物为特异性扩增(图 4A)。经过实验优化,确定qRT-PCR体系为20 µL:TB Green Ⅱ 10 µL;ROX参比染料0.4 µL;上、下游引物各0.4 µL (10 µmol/L);无菌水6.8 µL;cDNA模板2 µL。反应参数:95 ℃预变性5 min;95 ℃变性10 s,60 ℃退火30 s,读板1次,共40个循环;最后,将温度从60℃提高到95 ℃,期间每增加0.5 ℃检测1次荧光值。
|
图 4 qRT-PCR产物熔解曲线(A)及标准曲线(B) Fig.4 Melting curves (A) of qRT-PCR amplified target DNA fragments and a standard curve (B) |
采用1×109、1×108、1×107、1×106、1×105、1×104、1×103、1×102、5×101 copies/µL的质粒模板绘制标准曲线。实验结果如图 4B所示,线性方程为CT = –3.346X+37.12 (X为质粒拷贝数的对数),相关系数R2=0.997,说明标准曲线具有良好的线性关系。基于标准曲线计算引物扩增效率为99.0%,处于最优范围内(95%~105%)。统计分析得到CT值变异系数(CV)处于0.2%~1.5%之间,说明该检测方法重复性好、稳定性高(表 2)。
|
|
表 2 MCRV标准品质粒的CT值和变异系数 Tab.2 The CT values and CVs obtained with MCRV standards and coefficient of variation |
从图 5A可以看出,以标准品质粒为模板时,所有反应均能有效扩增,得到良好的“S”型扩增曲线,质粒浓度为50 copies/µL时,样品间重复性很好,且检测值仍在标准曲线的线性范围内,表明该检测方法可用于纯品病毒粒子的绝对定量,灵敏度高达50 copies/反应。当质粒浓度为25.0和12.5 copies/µL时,检测值已非线性,已不适于样品的绝对定量。尽管如此,这2个梯度质粒样品都能获得“S”型扩增曲线,表明仍可用于病毒的定性检测,灵敏度达12.5 copies/反应(图 5B)。
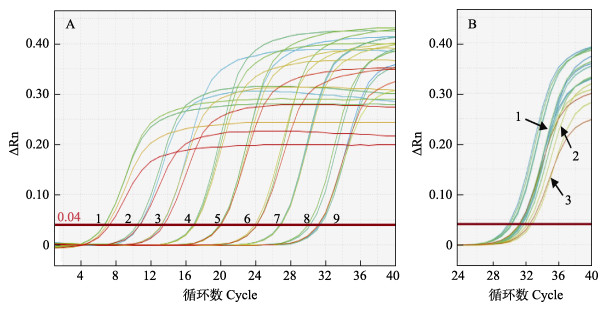
|
图 5 qRT-PCR扩增曲线和检测灵敏性分析 Fig.5 The qRT-PCR amplification curves and detection sensitivity analysis A图中1~9号标准品质粒浓度依次为1×109、1×108、1×107、1×106、1×105、1×104、1×103、1×102和5×101 copies/μL。B图中1~3号标准品质粒浓度为50、25和12.5 copies/μL,该检测方法检测极限可达12.5 copies/μL。 In panel A, the numbers of MCRV standard plasmids in samples 1~9 are 1×109, 1×108, 1×107, 1×106, 1×105, 1×104, 1×103, 1×102 and 5×101 copies/μL, respectively. In panel B, the numbers of the template are 50, 25 and 12.5 copies/μL, respectively. The minimum detection limit of this method is 12.5 copies/μL. |
此外,使用含MCDV、WSSV、DIV1、EHP和副溶血弧菌核酸的样品均未出现可见的扩增曲线,说明该检测方法特异性强,不会因上述病原混合感染或存在而影响MCRV检测结果(图 6)。
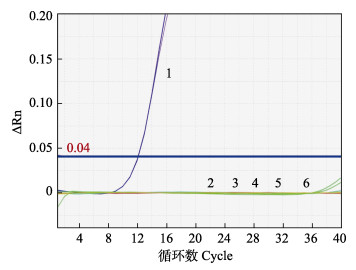
|
图 6 MCRV特异性检测实验结果 Fig.6 The results of MCRV-specific assay for primers used in qRT-PCR 1:MCRV阳性样品;2:青蟹双顺反子病毒;3:白斑综合征病毒;4:十足目虹彩病毒1;5:虾肝肠胞虫;6:副溶血弧菌 1: MCRV-positive control; 2: The cDNA sample from MCDV-infected gills of mud crab; 3~5: The DNA samples from WSSV, DIV1 and EHP; 6: V. parahemolyticus |
抽取来自海南的22只种蟹的微量血淋巴进行检测,其中,12只呈MCRV阳性,感染率为54.55%;对无MCRV感染的10只健康种蟹进行培育,后期均实现了抱卵和孵化。上述结果表明,该检测方法可用于筛选无MCRV种蟹,且从种蟹抽取少量血淋巴并不影响后期抱卵和孵化。此外,对购自浙江某养殖场的20只商品蟹进行检测,感染率为85.00%,表明该检测方法能满足青蟹病原感染情况调查的需要。
2.8 MCRV在青蟹体内的增殖模式MCRV感染健康青蟹后,病毒呈指数级增殖,24 h时即可检测到病毒,120 h时病毒增殖进入平台期,病毒的增殖速度开始减慢,此后,病毒含量稍有增加后开始呈现下降趋势(图 7)。整个感染周期内未出现青蟹死亡。
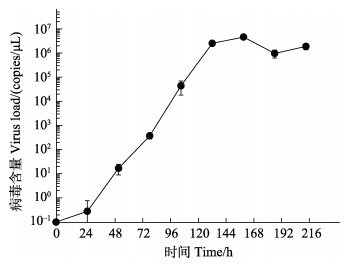
|
图 7 MCRV在青蟹血淋巴中增殖趋势(n=6) Fig.7 The number of MCRV in hemolymph of mud crab (n=6) |
目前MCRV感染较为普遍,严重影响了青蟹养殖产业的健康发展。为从源头限制该病原感染和传播,本研究开发了一种用于筛选无MCRV种蟹的qRT-PCR检测方法。该方法选择病毒含量最高的组织进行样品采集,以病毒表达水平最高基因为靶标序列设计特异引物,具有损伤低、灵敏性高和实用性强的特点,能满足在微创条件下筛选无MCRV种蟹的需要,也可应用于病原检测和感染相关研究。
目前已经建立的MCRV检测方法主要是通过提取鳃或肝胰腺RNA进行病原检测。这类检测方法通常需要杀死青蟹来获得组织样品,并且需要随机挑选青蟹,根据检测结果评估青蟹群体携带病毒情况。因此,这类检测方法显然不适用于无MCRV种蟹筛选。为获得一种适合筛选无MCRV种蟹的病毒检测方法,本研究首先分析了MCRV在感染青蟹中的组织分布特点,发现病毒感染青蟹中血淋巴和鳃组织病毒含量显著高于其他组织,并且血淋巴中病毒含量的平均值稍高于鳃组织中病毒含量的平均值。需要注意的是,血细胞中病毒含量低于血淋巴中病毒含量(未发表数据)。这提示病毒感染青蟹无血细胞(cell-free)血淋巴中也存在大量的病毒粒子。本研究通过抽取含毒量最高的血淋巴组织进行RNA抽提,并应用于MCRV检测,提高了检测的灵敏性。同时,由于这种方法抽取血淋巴数量很少,可低至20 µL,几乎不损伤青蟹个体,显著降低了经济损失并提高了检测效率。
前期研究预测MCRV的12个基因组节段可编码13个蛋白,即病毒感染过程中至少表达了13个基因。通过分析这13个基因的表达水平,发现基因间表达水平存在显著差异,其中VP11基因表达量最高。据报道,VP11为病毒的外衣壳蛋白(熊尚凌等, 2017),且与已报道的SsRV毒株相比,VP11序列非常保守。考虑到该外衣壳蛋白基因序列与数据库中其他序列相似性很低,认为VP11很适合作为靶标序列设计MCRV的检测引物。目前,MCRV检测引物主要是基于VP1 (RNA聚合酶)基因序列,由于VP11基因的表达量显著高于VP1基因,因此,在理论上基于VP11基因序列的检测方法的灵敏性要高于其他检测方法。
由于非特异扩增及环境中核酸样品污染导致的假阳性是目前病原检测难以克服的技术痛点之一。基于SYBR Green染料法建立的qRT-PCR检测方法,内设PCR产物解曲线分析程序,可根据熔点判断是否为非特异性扩增以及样品是否存在核酸污染,这是该检测方法最大的技术优势。由于SYBR Green染料自身条件的限制(背景较高),其检测灵敏性稍低于TaqMan探针法,但是通过优化引物设计,将本研究建立的检测方法的灵敏性提高到了50 copies/反应(定量检测),达到基于SYBR Green染料建立检测方法的理想水平。此外,使用该检测方法对常见甲壳类病毒感染组织的核酸样品(MCDV、WSSV、DIV1及EHP)进行检测,均未出现特异性扩增,仅有MCRV阳性样品出现特异扩增曲线,表明该检测方法特异性强,适用于多种常见病原混合感染样品检测。最后,使用SYBR Green染料建立的qRT-PCR检测方法操作简单、成本更低,很适合开展大批量样品病原检测。
为检验该检测方法的使用效果,分别对22只种蟹和20只商品蟹进行MCRV检测,阳性率分别为54.55%和85.00%,表明该病毒感染在青蟹中已非常普遍,养殖商品青蟹感染率与申亚阳等(2017)检测结果相似。值得注意的是,该检测方法只抽取了少量血淋巴,并未造成青蟹死亡,并且挑选的健康青蟹都完成了抱卵与孵化,提示该检测方法可应用于筛选无MCRV种蟹,在青蟹良种场建设方面具有很好的应用前景。此外,我们还使用建立的检测方法成功挑选了无MCRV青蟹,并在此基础上分析了MCRV在青蟹体内的增殖模式。发现病毒在血淋巴中的增殖模式与早期研究结果类似(熊娟, 2011),但本研究中病毒增殖达到平台期的时间更长,且未造成青蟹死亡。这很可能与实验水温较低有关,较高的温度更容易导致病毒快速增殖和青蟹死亡。当然,也可能是当前毒株毒力减弱造成的,毕竟该病毒从首次报道至今已10余年,感染更为普遍,且致死率有所降低。因此,后续有必要对该病毒基因组重测序,分析毒力变化分子机理。
此外,考虑到dsRNA制备相对复杂且易降解等问题,本研究并未选择dsRNA作为标准品,而是选择了更易制备和定量的质粒(dsDNA)。与前者相比,虽然质粒做模板缺少了反转录过程,但并不影响对引物扩增效率的计算,而且根据质粒标准品计算的检测灵敏度在理论上与反转录效率为100%时一致,其能较真实反映该检测方法的灵敏度。因此,其他RNA病毒也常采用质粒作为标准品(崔亚婷, 2015; 李天芝等, 2015; 谢守玉等, 2021)。
4 结论本研究建立了一种灵敏性高且实用的MCRV qRT-PCR检测方法。该方法能满足在微创条件下筛选无MCRV种蟹的需要,在青蟹良种场建设和无MCRV青蟹苗种生产方面具有很好的应用前景。此外,该检测方法也可应用于实验室中MCRV感染机制的研究。
CAI X H, PENG Y H, LIU X J, et al.. The pathogenicity of mud crab reovirus (MCRV) to green crab Scylla paramamosain. Fisheries Science, 2013, 32(3): 130-135 [蔡小辉, 彭银辉, 刘旭佳, 等. 青蟹呼肠孤病毒对拟穴青蟹的致病性研究. 水产科学, 2013, 32(3): 130-135 DOI:10.3969/j.issn.1003-1111.2013.03.002] |
CHEN J G, XIONG J, CUI B J, et al.. Molecular characterization of eight segments of Scylla serrata reovirus (SsRV) provides the complete genome sequence. Archives of Virology, 2012, 157(8): 1551-1557 DOI:10.1007/s00705-012-1298-7 |
CHEN J G, XIONG J A, YANG J F, et al.. Nucleotide sequences of four RNA segments of a reovirus isolated from the mud crab Scylla serrata provide evidence that this virus belongs to a new genus in the family Reoviridae. Archives of Virology, 2011, 156(3): 523-528 DOI:10.1007/s00705-010-0852-4 |
CUI Y T. Effect of temperature on the proliferation of mud crab dicistrovirus-1 and reovirus and their tissue distribution. Master´s Thesis of Shanghai Ocean University, 2015 [崔亚婷. 温度对青蟹双顺反子病毒-1和呼肠孤病毒增殖的影响以及病毒的组织分布. 上海海洋大学硕士研究生学位论文, 2015]
|
LEE C, KIM J, SHIN S G, et al.. Absolute and relative qPCR quantification of plasmid copy number in Escherichia coli. Journal of Biotechnology, 2006, 123(3): 273-280 DOI:10.1016/j.jbiotec.2005.11.014 |
LI T Z, YU X Y, WANG J L, et al.. Development of SYBR GreenⅠreal-time PCR assay for detection of Avian reovirus. Poultry Science, 2015(10): 10-14 [李天芝, 于新友, 王金良, 等. 禽呼肠孤病毒SYBR GreenⅠ荧光定量PCR检测方法的建立. 家禽科学, 2015(10): 10-14 DOI:10.3969/j.issn.1673-1085.2015.10.005] |
LI X C, ZHOU J F, FANG W H, et al.. Development and application of an economical real-time PCR for WSSV detection and quantification in ridgetail white prawns (Exopalaemon carinicauda). Journal of Fisheries of China, 2012, 36(10): 1554-1562 [李新苍, 周俊芳, 房文红, 等. 实用WSSV定量检测方法的建立及其应用于脊尾白虾病毒感染规律的研究. 水产学报, 2012, 36(10): 1554-1562] |
LIANG H, GENG J, BAI S, et al.. TaqMan real-time PCR for detecting bovine viral diarrhea virus. Polish Journal of Veterinary Sciences, 2019, 22(2): 405-413 |
REKHVIASHVILI N, STEVENS G, SCOTT L, et al.. Fluorogenic LUX primer for quantitation of HIV-1 by real-time RT-PCR. Molecular Biotechnology, 2006, 32(2): 101-109 DOI:10.1385/MB:32:2:101 |
SANG S W, LI X P, ZHANG Q L. Establishment and application of the TaqMan RT-PCR detection method for the shrimp movement disorder Nodavirus (MDNV). Progress in Fishery Sciences, 2021, 42(5): 77-85 [桑松文, 李小平, 张庆利. 虾类行动障碍野田村病毒(MDNV) TaqMan RT-PCR检测方法的建立与应用. 渔业科学进展, 2021, 42(5): 77-85] |
SHEN Y Y, YANG K, MA H L, et al.. Molecular epidemiological investigation of the mud crab reovirus and mud crab discistrovirus-1 in mud crab (Scylla paramamosain) along the coast of Guangdong Province. Ecological Science, 2017, 36(1): 17-24 [申亚阳, 杨铿, 马红玲, 等. 广东沿海地区拟穴青蟹呼肠孤病毒和双顺反子病毒-1的分子流行病学调查. 生态科学, 2017, 36(1): 17-24] |
SONG Z L, DONG X, ZHAO R H, et al.. Evaluation on the detection of Enterocytozoon hepatopenaei in pooled DNA samples of Litopenaeus vannamei based on TaqMan qPCR. Progress in Fishery Sciences, 2019, 40(3): 122-132 [宋增磊, 董宣, 赵若恒, 等. 基于TaqMan qPCR检测凡纳滨对虾样品中虾肝肠胞虫并样检测方法的评价. 渔业科学进展, 2019, 40(3): 122-132] |
WENG S P, GUO Z X, SUN J J, et al.. A reovirus disease in cultured mud crab, Scylla serrata, in southern China. Journal of Fish Diseases, 2007, 30(3): 133-139 DOI:10.1111/j.1365-2761.2007.00794.x |
XIE S Y, LIU H X, YIN Y W, et al.. Establishment and clinical application of multiplex TaqMan real-time RT-PCR for differential detection of DTMUV, NDRV and MDRV. Chinese Journal of Preventive Veterinary Medicine, 2021, 43(9): 952-958 [谢守玉, 刘惠心, 尹彦文, 等. 鸭坦布苏病毒、新型鸭呼肠孤病毒及番鸭呼肠孤病毒多重TaqMan荧光定量RT-PCR检测方法的建立与临床应用. 中国预防兽医学报, 2021, 43(9): 952-958] |
XIONG J. Sequencing and analysis of partial genome of Scylla serrata reovirus and RT-LAMP detection methods development. Master´s Thesis of Huazhong Agricultural University, 2011 [熊娟. 锯缘青蟹呼肠孤病毒部分基因序列的测定及其RT-LAMP检测方法的建立. 华中农业大学硕士研究生学位论文, 2011]
|
XIONG S L, XING J L, FAN D Y, et al.. Mapping interactions of Scylla serata reovirus in five structural proteins. Oceanologia et Limnologia Sinica, 2017, 48(5): 1108-1113 [熊尚凌, 邢峻梁, 范东洋, 等. 锯缘青蟹(Scylla serrata)呼肠孤病毒5个结构蛋白互作分析. 海洋与湖沼, 2017, 48(5): 1108-1113] |
ZHANG D, SU Y L, FENG J, et al.. Survey on infection of two viruses in the wild mud crab (Scylla paramamosain) in Yangjiang, Guangdong Province. South China Fisheries Science, 2013, a, 9(5): 137-141 [张迪, 苏友禄, 冯娟, 等. 广东省阳江地区野生拟穴青蟹2种病毒感染情况调查. 南方水产科学, 2013, a, 9(5): 137-141] |
ZHANG D, YANG K, SU Y L, et al.. A duplex nested-PCR assay for detection of mud crab reovirus and mud crab dicistrovirus-1. Journal of Fishery Sciences of China, 2013, b, 20(4): 808-815 [张迪, 杨铿, 苏友禄, 等. 青蟹呼肠孤病毒和青蟹双顺反子病毒-1双重巢式PCR检测方法的建立. 中国水产科学, 2013, b, 20(4): 808-815] |
ZHENG T L. A review of research progresses of diseases in mud crab Scylla paramamosain. Fisheries Science, 2014, 33(5): 326-330 [郑天伦. 拟穴青蟹病害研究进展. 水产科学, 2014, 33(5): 326-330] |



