2. 大洋渔业资源可持续开发省部共建教育部重点实验室 国家远洋渔业工程技术研究中心 农业农村部大洋渔业开发重点实验室 上海 201306
2. Key Laboratory of Sustainable Exploitation of Oceanic Fishery Resources, Ministry of Education; National Distant-Water Fisheries Engineering Research Center; Key Laboratory of Oceanic Fisheries Exploration, Ministry of Agriculture and Rural Affairs, Shanghai 201306, China
体征及生殖投入是生物个体生活史过程中重要的生物学特性,前者综合反映了生长发育过程中的健康状况(Green, 2001),后者则是能量积累对生殖发育的投入分配水平(McBride et al, 2015),二者共同决定了生物个体的繁殖价(reproductive value) (Schulte-Hostedde et al, 2005)及种群资源量(Barneche et al, 2018)。头足类(除鹦鹉螺外)具有生命周期短、生长速度快、终生一次繁殖产卵等生活史特征(Boyle et al, 2005),很多种类因世代更替快且资源量丰富而成为世界头足类渔业的重要捕捞对象(FAO, 2020)。头足类的性腺发育滞后于个体生长(Boyle et al, 2005),但在性腺发育开始之后,生殖发育的能量需求增大显著,生殖能量投入甚至高达体质量的50% (Jackson et al, 2004),并且与栖息海域环境的波动变化密切相关(Pecl et al, 2006)。已有研究初步显示,头足类的体征与生殖投入密切相关,前者影响着生殖投入的水平,而较高的生殖投入则对个体的健康状况产生负影响(韩飞等, 2019; 臧娜等, 2021)。因此,深入分析这些种类的体征与生殖投入,对掌握它们的生活史及资源量波动变化具有重要的理论和实践意义。
阿根廷滑柔鱼(Illex argentinus)是大洋性头足类,是西南大西洋重要的生物种类,资源量丰富,既是世界头足类渔业的重要经济种,也是我国远洋鱿钓渔业的主要捕捞对象之一(陈新军, 2019)。同时,阿根廷滑柔鱼在西南大西洋海域具有季节性的向岸–离岸洄游习性以及较长距离的南北向索饵–产卵洄游习性(Rodhouse et al, 2013),因其食性贪婪、食物组成多样,且是很多高营养级种类的主要食物来源,在西南大西洋生态系统中发挥着重要的“生物泵作用” (Arkhipkin, 2013)。类似于其他头足类属种,阿根廷滑柔鱼寿命短、生长快、营间歇性终端产卵(intermittent terminal spawning)(Lin et al, 2017a),生殖能量来源以现场摄食投入为主(Lin et al, 2019),体征的年间波动变化显著(臧娜等, 2021)。然而,现有的研究较多地集中于雌性个体,雄性个体的体征及生殖投入方面研究鲜有报道。此外,雄性个体性腺发育先于雌性个体(Rodhouse et al, 1990),雄性个体生殖投入的研究将有助于深入认识该种类的生物学特征。因此,本研究以2018—2021年采集的阿根廷滑柔鱼雄性成熟样本为研究对象,开展体征及生殖投入的研究,旨在深入认识阿根廷滑柔鱼的生殖发育特性,为掌握该种群资源的生活史策略提供参考。
1 材料与方法 1.1 样本采集本实验阿根廷滑柔鱼样本来自我国远洋鱿钓渔业作业渔船的渔获物,采集海域为56°15′~63°36′W、40°05′~49°39′S的西南大西洋公海海域(图 1),采样时间为2018年3月、2019年1—3月、2020年5—6月、2021年2—4月。根据鱿钓渔业作业渔船流动作业的特点,每个站点随机取样,样本经冷冻保存后运回实验室进行生物学分析。

|
图 1 西南大西洋阿根廷滑柔鱼采样海域和采样站点 Fig.1 Sampling region and sampling stations of I. argentinus in the southwest Atlantic Ocean |
阿根廷滑柔鱼样本室温解冻后进行生物学测定,测定内容包括胴长(mantel length, ML)、体质量(body weight, BW)、精巢质量(testis weight, TW)、精荚复合体质量(spermatophoric complex weight, SCW)、性腺成熟度(maturity stage, MAT)。胴长测定精确到1 mm,体质量的测定精确到1 g,精巢和精荚复合体的质量测定精确到0.01 g。性腺成熟度以ICES (2010)的划分标准为基础,结合林东明等(2014)的划分标准,将阿根廷滑柔鱼雄性个体的性腺成熟度划分为Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ、Ⅶ和Ⅷ共8个时期。其中,Ⅰ~Ⅲ期为性腺发育未成熟期,Ⅳ~Ⅵ期为性腺发育成熟期,Ⅶ期为繁殖期,Ⅷ期为繁殖后期。本研究选取所有性腺发育成熟的雄性个体样本进行分析,其中,2018年125尾,2019年349尾,2020年213尾,2021年251尾,共计938尾。
1.3 采样海域的环境因子本研究使用的环境因子为海表温度(sea surface temperature, SST)和叶绿素a质量浓度(chlorophyll a concentration, Chla),二者均为日平均值,下载自美国NOAA海洋观测中心ERDDAP数据服务终端(https://oceanwatch.pifsc.noaa.gov/erddap/index.html)。其中,海表温度数据库ID为CRW_sst_v3_1,各采样站点的海表温度为8.89~17.27 ℃ (图 2a);叶绿素a质量浓度数据库ID为noaa_snpp_chla_daily,各采样站点的叶绿素a质量浓度为0.43~3.91 mg/m3 (图 2b)。

|
图 2 采样站点的海表面温度(a)和叶绿素a质量浓度(b)分布 Fig.2 Sea surface temperature (SST) (a) and chlorophyll a concentration (Chla) (b) of sampling stations in the southwest Atlantic Ocean |
阿根廷滑柔鱼雄性成熟个体体质量与胴长关系采用非线性回归的方法,进行幂函数曲线拟合:
| $ {\rm{BW}} = a \times {\rm{M}}{{\rm{L}}^b} $ |
式中,BW为体质量(g),ML为胴长(mm),a、b为待估算参数。
性腺指数(gonadosomatic index, GSI, %)为阿根廷滑柔鱼雄性成熟个体的生殖系统组织质量与体质量之间的比值,计算公式(Sato, 2017)为:
| $ {\rm{GSI}} = {\rm{RW/BW}} \times 100\% $ |
式中,GSI为性腺指数(%),RW为生殖系统组织质量(g, 含精巢、输精管、精荚腺、精荚管、尼氏囊和端器),BW为体质量(g)。
根据阿根廷滑柔鱼雄性成熟个体的体质量–胴长幂函数关系,计算体质量–胴长的残差值并标准化:
| $R_s=e_i / s_e$ |
式中,Rs为体质量–胴长标准残差,ei为第i尾雄性成熟个体的体质量–胴长关系的残差值,se为体质量–胴长关系残差的标准差。
性腺指数是衡量生殖发育过程中生物个体的能量资源在性腺和肌肉组织之间的分配比例,一定程度表征了生物个体对生殖发育的能量投入水平(Chen et al, 2022);同时,体质量–胴长标准残差是独立于个体大小,能够反映个体肌肉组织的健康状况:残差值为负值,表示组织的健康状况不佳;残差值为正值,表示组织的健康状况良好(Green, 2001; Jackson et al, 2004)。因此,本研究分别以性腺指数作为阿根廷滑柔鱼雄性成熟个体的生殖投入的参考指标,体质量–胴长标准残差作为雄性成熟个体的体征(body condition)。
利用单因素方差分析(one-way ANOVA)检验体征指标、性腺指数不同年份之间的差异性,再利用Tukey HSD进行差异性随后检验。利用线性混合效应模型(linear mixed-effects models, LMM)拟合分析雄性成熟个体的性腺指数与体征的关系,模型随机效应因子为采样年份;利用广义加性混合效应模型(generalized additive mixed-effects models, GAMM)分别拟合分析雄性成熟个体性腺指数和体征与SST、Chla的关系,混合效应模型亦以采样年份为随机效应因子。LMM模型和GAMM模型分别采用R语言lmerTest数据包和mgcv数据包进行处理。所有数据的统计分析均利用R语言进行处理(R Core Team, 2020),结果用平均值±标准差(Mean±SD)表示。
2 结果 2.1 生长发育特性2018—2021年阿根廷滑柔鱼雄性成熟个体胴长为143~291 mm,体质量为89~559 g。体型以2020年最大,平均胴长和平均体质量分别为(233.81±17.53) mm和(327.57±78.37) g;2018年平均胴长为(191.98± 22.53) mm,平均体质量为(174.62±62.15) mm,体型最小(表 1)。阿根廷滑柔鱼雄性成熟个体体质量与胴长呈显著的幂函数关系,其中,2018年和2020年的幂函数关系a值均大于2019年和2021年的a值,并且2018年和2020年的幂函数关系b值与匀速生长(b=3)存在显著性差异(表 1)。
|
|
表 1 2018—2021年阿根廷滑柔鱼雄性成熟个体的胴长和体质量 Tab.1 The mantle length and body weight of mature male I. argentinus sampled from 2018 to 2021 |
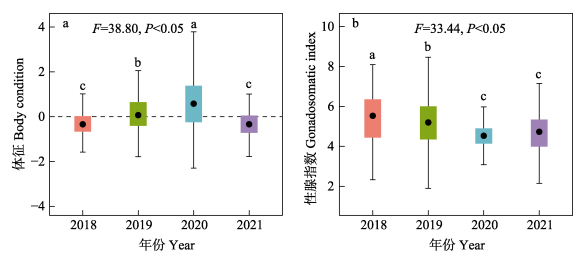
2018—2021年阿根廷滑柔鱼雄性成熟个体不同年份之间的体征存在显著性差异(F=38.80, P < 0.05),其中,2020年体征最好,2018年和2021年的体征较差(图 3a)。性腺指数也存在显著的年间差异性(F=33.44, P < 0.05) (图 3b)。其中,2018年的性腺指数为2.33%~10.93% (5.61±1.53),2019年的性腺指数为1.26%~12.04% (5.23±1.32),2020年的性腺指数为2.01%~7.63% (4.53±0.69),2021年的性腺指数为2.14%~7.54% (4.73±0.94)。
|
图 3 2018—2021年阿根廷滑柔鱼雄性个体的体征指标(a)和性腺指数(b)的分布 Fig.3 The distribution of body condition (a) and gonadosomatic index (b) of mature male I. argentinus sampled from 2018 to 2021 箱型图内黑色实心点表示平均值;误差线上标示的不同字母表示随后检验差异显著(P < 0.05)。 Black solid points in the boxplot represent the mean value; Different letters above error bars represent significant differences determined by HSD test (P < 0.05). |
线性混合效应模型结果显示,阿根廷滑柔鱼雄性成熟个体的性腺指数与体征没有显著的相关关系(t= –1.79, P=0.07),模型的合计方差解释率为14% (r2= 0.14) (表 2)。
|
|
表 2 阿根廷滑柔鱼雄性个体性腺指数与体征的线性混合效应模型结果 Tab.2 Results of linear mixed-effects models performed body condition on gonadosomatic index for mature male I. argentinus |
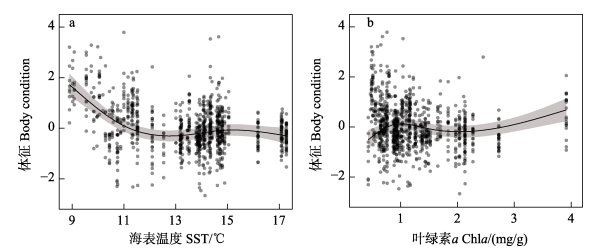
GAMM模型结果显示,阿根廷滑柔鱼雄性个体的体征与海表温度(SST)和叶绿素a质量浓度呈显著的相关关系,采样年份的偏差解释率占比为15.89% (表 3)。海表温度对体征具有负影响(模型参数估计值= –1.44),在海表温度为9.0~12.5 ℃时,体征先随温度增加呈下降趋势,随后处于稳定状态(图 4a)。叶绿素a质量浓度对体征具有正影响(模型参数估计值= 0.79),在叶绿素a质量浓度为1 mg/m3左右,阿根廷滑柔鱼雄性个体的体征处于较佳状态(图 4b)。
|
|
表 3 阿根廷滑柔鱼雄性成熟个体的体征与海表温度、叶绿素a质量浓度的广义加性混合效应模型结果 Tab.3 Results of generalized additive mixed-effects models performed body condition on sea surface temperature (SST) and chlorophyll a concentration (Chla) for mature male I. argentinus |
|
图 4 海表温度(a)和叶绿素a质量浓度(b)对阿根廷滑柔鱼雄性个体体征指标的影响关系 Fig.4 Smoothing plot of effects of sea surface temperature (a) and chlorophyll a concentration (b) on body condition of mature male I. argentinus |
GAMM模型显示,阿根廷滑柔鱼雄性成熟个体的性腺指数与海表温度(SST)呈显著的相关关系(F=7.10, P < 0.05),与叶绿素a质量浓度的关系不显著(F=0.67, P=0.55),采样年份的偏差解释率占比为22.60% (表 4)。其中,性腺指数与海表温度呈正相关关系(模型参数估计值= 0.43),在海表温度为15 ℃左右处于较大值(图 5)。
|
|
表 4 阿根廷滑柔鱼雄性成熟个体性腺指数与海表温度、叶绿素a质量浓度的广义加性混合效应模型结果 Tab.4 Results of generalized additive mixed-effects models performed gonadosomatic index on sea surface temperature (SST) and chlorophyll a concentration (Chla) for mature male I. argentinus |

|
图 5 海表温度对阿根廷滑柔鱼雄性成熟个体性腺指数的影响关系 Fig.5 Smoothing plot of effects of sea surface temperature on gonadosomatic index of mature male Illex argentinus |
阿根廷滑柔鱼种群结构复杂,根据产卵季节、产卵场、成熟胴长等可以划分为4个群体(表 5)。本研究结果显示,阿根廷滑柔鱼雄性成熟个体的采集月份较多集中在1—4月,采集海域在42°~48°S的大陆架海域,成熟个体的胴长在191~234 mm之间。因此,本研究的阿根廷滑柔鱼雄性成熟个体样本可能以夏季产卵种群为主,兼有部分南巴塔哥尼亚种群个体。具体的群体归属需要今后综合耳石和角质颚等硬组织微结构的年龄生长及孵化时间推算等加以确定。
|
|
表 5 阿根廷滑柔鱼不同产卵种群的性腺成熟胴长、产卵时间和产卵海域 Tab.5 Size-at-maturity, spawning season and spawning ground of different spawning stocks of I. argentinus |
体质量–体长幂函数回归关系是鱼类生长发育的重要研究手段之一(黄真理等, 1999),函数中的系数a值可作为个体健康指数和肥满度的参考指标(黄真理等, 1999; Green, 2001; 张小谷等, 2007),与环境因子中的饵料生物丰度密切相关(Froese, 2006);指数b值则用于表征研究对象生长发育中体质量与体长生长的均匀性(Froese, 2006)。通常,指数b值大小可以用来判断鱼类个体是否处于等速生长(Froese, 2006):b值接近于3时,体质量和体长的生长接近匀速生长;b < 3,体长生长速度大于体质量生长速度,个体呈负异速生长;b > 3,体长生长速度小于体质量生长速度,个体呈正异速生长。本研究结果显示,雄性成熟个体的体质量–胴长幂函数关系b值小于匀速生长(b=3),与宣思鹏等(2018)的研究结果相近。同时,2018年和2020年雄性成熟个体的体质量–胴长幂函数关系的b值与匀速生长(b=3)之间存在显著差异且小于3,而2019年和2021年则与匀速生长b=3的差异性不显著,表明2018年和2020年采集的雄性成熟个体为负异速生长,2019年和2021年采集的雄性成熟个体为匀速生长。臧娜等(2021)对2012—2014年采集的阿根廷滑柔鱼进行体质量–胴长幂函数分析时也发现,雄性个体的体质量和胴长生长存在年间差异性。这种差异性可能与阿根廷滑柔鱼雄性成熟个体健康状况的年间差异有关。本研究发现,2018年和2020年雄性成熟个体体质量–胴长幂函数关系的a值大于2019年和2021年,可见2018年和2020年雄性成熟个体具有较好的健康指数和肥满度,使得个体的生长更倾向于个体体型在长度上的生长(黄真理等, 1999; Green, 2001)。
3.2 体征和生殖投入与主要环境因子的关系体征及生殖投入作为生物个体生活史过程的重要生物学特性,二者之间的权衡影响着个体生长发育(McBride et al, 2015)。本研究发现,2018年阿根廷滑柔鱼雄性成熟个体具有较大的平均性腺指数、较差的体征;与此相反,2020年个体的体征最佳,平均性腺指数则相对较小,2019年和2021年个体的体征及其性腺指数处于相对中间水平。这些结果表明,阿根廷滑柔鱼雄性成熟个体的体征与其性腺指数呈负相关关系,二者之间的权衡影响着这些个体体质量与胴长的生长,与2018年和2020年个体的负异速生长、2019年和2021年个体的匀速生长的生长发育特性是相一致的。值得注意的是,阿根廷滑柔鱼雄性成熟个体性腺指数与体征的线性混合模型结果显示,尽管体征与性腺指数呈负相关关系(模型估计值= –0.07),但在显著性水平P < 0.05时,性腺指数与体征相关关系不显著(P=0.07)。这可能与阿根廷滑柔鱼营收入–资本混合型的生殖投入方式密切相关,生殖能量主要来源于现场的食物摄食与转化吸收(Lin et al, 2019)。同时,雄性个体的生殖投入水平较低也可能是性腺指数与体征相关关系不显著的原因之一。相较于雌性个体,阿根廷滑柔鱼雄性个体生殖投入的平均水平约等于雌性的1/2 (Rodhouse et al, 1992)。然而,具体的原因需后续结合组织能量密度、脂肪酸生物化学标志物等研究加以确证。
通常,头足类对栖息海域环境的波动变化敏感性高,在生长发育、能量积累及生殖投入方面具有环境选择适应特性(Boyle et al, 2005)。阿根廷滑柔鱼是西南大西洋海域的重要生物种类,资源量大,但容易受到栖息海域环境波动变化的影响(刘赫威等, 2020)。已有研究表明,阿根廷滑柔鱼的生长发育与海表温度、叶绿素a质量浓度等环境因子密切相关(Waluda et al, 2001; Lin et al, 2017b)。本研究发现,海表温度和叶绿素a质量浓度与阿根廷滑柔鱼雄性成熟个体的体征具有显著的相关关系,前者对体征产生负影响,后者则与体征呈正相关关系,与Lin等(2017b)基于组织能量积累与栖息海域海表温度、叶绿素a质量浓度的研究结果相一致。结合肌肉组织是阿根廷滑柔鱼等头足类的最大能量存储器官(林东明等, 2017),以及体征综合反映生长发育过程中的健康状况变化(Green, 2001),本研究结果表明,体征与海表温度、叶绿素a质量浓度的关系与其肌肉组织能量积累随着栖息海域环境波动变化密切相关。同时,采样年份的偏差解释率占比仅为15.89%,说明阿根廷滑柔鱼雄性成熟个体与栖息海域的海表温度、叶绿素a质量浓度的关系是一致的,不随年份推移而变化。本研究也发现,阿根廷滑柔鱼雄性成熟个体的体征在海表温度为9.0~12.5 ℃时呈下降趋势、在叶绿素a质量浓度为1 mg/m3左右处于较佳状态。这可能是因为海水温度上升加速其代谢速率和机体活动水平(Rosa et al, 2008),而在一定叶绿素a质量浓度的海域具有较好的饵料食物分布,促进个体的食物可获得性(Portner et al, 2020),进而有助于个体肌肉组织的生长和组织能量积累(Lin et al, 2017b)。此外,阿根廷滑柔鱼雄性成熟个体性腺指数与栖息海表温度呈显著的正相关关系,在海表温度为15 ℃时具有较大值,说明雄性成熟个体生殖投入随着海水温度升高而增大。已有研究表明,阿根廷滑柔鱼雄性个体的性腺先于雌性个体发育,且先于雌性个体向水温较高的海域进行产卵洄游,期间性腺组织持续生长发育并累积成熟精荚(Rodhouse et al, 2013),性腺指数随之增大。然而,性腺指数与栖息海域叶绿素a质量浓度无显著的相关关系,与雌性个体生殖投入随叶绿素a质量浓度增加而增大的正相关关系有所不同(Lin et al, 2017b)。这种差异可能是由雌雄性个体之间生殖投入的大小不同且雄性个体提前离开索饵场所致。通常,雄性个体投入性腺组织生长发育的能量较低(Rodhouse et al, 1992),且先行性腺发育的雄性个体会提前离开索饵场(Rodhouse et al, 2013)。因而,以叶绿素a质量浓度为表征的海域饵料食物丰度(Ramírez et al, 2017)对雄性个体生殖投入的作用影响较为不明显。同时,雄性个体性腺成熟后较活跃的繁殖行为(Rodhouse et al, 2013)也可能是其生殖投入与海域初级生产力关系不显著的原因之一。尽管头足类(除鹦鹉螺种类之外)的生命周期短,繁殖结束后便死去,但是,雄性个体在繁殖期间具有相对复杂的繁殖行为且能量需求较高(Rodhouse et al, 2013; Lin et al, 2019)。阿根廷滑柔鱼雄性个体在繁殖时需要抓牢雌性个体行“头对头”的交配行为,利用茎化腕向雌性个体传输精荚(Rodhouse et al, 2013)。该过程需要较高的能量投入且肌肉组织代谢需求也较高,因而,雄性个体可能在摄食能量投入分配中较多地倾向于肌肉组织,体征与叶绿素a质量浓度的正相关关系便是佐证之一。
4 结论本研究通过残差指标分析法以及混合效应模型统计分析,初步阐明了阿根廷滑柔鱼雄性成熟个体体征、性腺指数以及二者与栖息海域主要环境因子之间的关系。雄性成熟个体的体质量与胴长相对生长存在年间差异性,体征维持和生殖投入之间的权衡影响着体质量与胴长的生长。海表温度和叶绿素a质量浓度对体征具有显著的效应影响,前者对体征产生负影响,后者则对体征产生正影响。雄性成熟个体的性腺指数仅与海表温度呈显著的正相关关系。这些结果将为进一步认识阿根廷滑柔鱼的生物学特性提供基础,也为深入开展大洋性柔鱼类生殖投入策略及其环境响应研究提供科学支撑。
ARKHIPKIN A I. Squid as nutrient vectors linking Southwest Atlantic marine ecosystems. Deep-Sea Research Part Ⅱ: Topical Studies in Oceanography, 2013, 95: 957-20 |
ARKHIPKIN A, LAPTIKHOVSKY V. Seasonal and interannual variability in growth and maturation of winter-spawning Illex argentinus (Cephalopoda, Ommastrephidae) in the Southwest Atlantic. Aquatic Living Resources, 1994, 7(4): 221-232 DOI:10.1051/alr:1994025 |
BARNECHE D R, ROBERTSON D R, WHITE C R, et al. Fish reproductive-energy output increases disproportionately with body size. Science, 2018, 360(6389): 642-645 DOI:10.1126/science.aao6868 |
BOYLE P, RODHOUSE P. Cephalopods: Ecology and fisheries. Oxford, UK: Wiley-Blackwell, 2005
|
BRUNETTI N E, IVANOVIC M, ROSSI G, et al. Fishery biology and life history of Illex argentinus. In OKUTANI T (ed) Contributed papers to International Symposium on Large Pelagic Squids, July 18–19, 1996, for JAMARC's 25th anniversary of its foundation. Tokyo: Japan Marine Fishery Resources Research Center (JAMARC), 1998, 217–231
|
BRUNETTI N, IVANOVIC M, LOUGE E, et al. Estudio de la biología reproductiva y de la fecundidad en dos subpoblaciones del calamar (Illex argentinus). Frente Marítimo, 1991, 873-84 |
CHEN X J, LIU B L, LIN D L. Sexual maturation, reproductive habits, and fecundity of fish. In CHEN X J, LIU B L (eds) Biology of Fishery Resources. Singapore: Springer Singapore, 2022, 113–142
|
CHEN X J. Development status of world cephalopod fisheries and suggestions for squid jigging fishery in China. Journal of Shanghai Ocean University, 2019, 28(3): 321-330 [陈新军. 世界头足类资源开发现状及我国远洋鱿钓渔业发展对策. 上海海洋大学学报, 2019, 28(3): 321-330] |
CRESPI-ABRIL A C, BARÓN P J. Revision of the population structuring of Illex argentinus (Castellanos, 1960) and a new interpretation based on modelling the spatio-temporal environmental suitability for spawning and nursery. Fisheries Oceanography, 2012, 21(2/3): 199-214 |
FAO. FAO Yearbook: Fishery and aquaculture statistics 2018/FAO annuaire. Rome: FAO, 2020
|
FROESE R. Cube law, condition factor and weight-length relationships: History, meta-analysis and recommendations. Journal of Applied Ichthyology, 2006, 22(4): 241-253 DOI:10.1111/j.1439-0426.2006.00805.x |
GREEN A J. Mass/length residuals: Measures of body condition or generators of spurious results?. Ecology, 2001, 82(5): 1473-1483 DOI:10.1890/0012-9658(2001)082[1473:MLRMOB]2.0.CO;2 |
HAN F, CHEN X J, LIN D M, et al. The body condition and reproductive investment of Dosidicus gigas in the equatorial waters of eastern Pacific Ocean. Journal of Fisheries of China, 2019, 43(12): 2511-2522 [韩飞, 陈新军, 林东明, 等. 东太平洋赤道海域茎柔鱼体征生长及生殖投入. 水产学报, 2019, 43(12): 2511-2522 DOI:10.11964/jfc.20180611323] |
HUANG Z L, CHANG J B. Fractal characteristics of length-weight relationship in fish. Acta Hydrobiologica Sinica, 1999, 23(4): 330-336 [黄真理, 常剑波. 鱼类体长与体重关系中的分形特征. 水生生物学报, 1999, 23(4): 330-336 DOI:10.3321/j.issn:1000-3207.1999.04.006] |
ICES. Report of the workshop on sexual maturity staging of cephalopods. ICES CM 2010/ACOM: 49. Livorno, Italy: ICES, 2010
|
JACKSON G D, SEMMENS J M, PHILLIPS K L, et al. Reproduction in the deepwater squid Moroteuthis ingens, what does it cost?. Marine Biology, 2004, 145(5): 905-916 DOI:10.1007/s00227-004-1375-x |
LIN D M, CHEN X J, FANG Z. Preliminary study on reproductive biology of summer spawning stock of Illex argentinus in the southwestern Atlantic Ocean. Journal of Fisheries of China, 2014, 38(6): 843-852 [林东明, 陈新军, 方舟. 西南大西洋阿根廷滑柔鱼夏季产卵种群繁殖生物学的初步研究. 水产学报, 2014, 38(6): 843-852] |
LIN D M, CHEN X J, WEI Y R, et al. Energy accumulation of both somatic and reproductive tissuesand its allocation to reproduction in Argentinean short-fin squid (Illex argentinus). Journal of Fisheries of China, 2017, 41(1): 70-80 [林东明, 陈新军, 魏嫣然, 等. 阿根廷滑柔鱼雌性个体肌肉和性腺组织能量积累及其生殖投入. 水产学报, 2017, 41(1): 70-80] |
LIN D M, CHEN X J, CHEN Y, et al. Ovarian development in Argentinean shortfin squid Illex argentinus: Group-synchrony for corroboration of intermittent spawning strategy. Hydrobiologia, 2017a, 795(1): 327-339 DOI:10.1007/s10750-017-3154-y |
LIN D M, CHEN X J, WEI Y, et al. The energy accumulation of somatic tissue and reproductive organs in post-recruit female Illex argentinus and the relationship with sea surface oceanography. Fisheries Research, 2017b, 185: 102-114 DOI:10.1016/j.fishres.2016.09.023 |
LIN D M, HAN F, XUAN S, et al. Fatty acid composition and the evidence for mixed income-capital breeding in female Argentinean short-fin squid Illex argentinus. Marine Biology, 2019, 166(7): 90 DOI:10.1007/s00227-019-3534-0 |
LIU H W, YU W, CHEN X J. A review of Illex argentinus resources and the responses to environmental variability in the southwest Atlantic Ocean. Journal of Fishery Sciences of China, 2020, 27(10): 1254-1265 [刘赫威, 余为, 陈新军. 西南大西洋阿根廷滑柔鱼资源及其对环境响应的研究进展. 中国水产科学, 2020, 27(10): 1254-1265] |
MCBRIDE R S, SOMARAKIS S, FITZHUGH G R, et al. Energy acquisition and allocation to egg production in relation to fish reproductive strategies. Fish and Fisheries, 2015, 16(1): 23-57 DOI:10.1111/faf.12043 |
PECL G T, MOLTSCHANIWSKYJ N A. Life history of a short-lived squid (Sepioteuthis australis): Resource allocation as a function of size, growth, maturation, and hatching season. ICES Journal of Marine Science: Journal du Conseil, 2006, 63(6): 995-1004 DOI:10.1016/j.icesjms.2006.04.007 |
PORTNER E J, MARKAIDA U, ROBINSON C J, et al. Trophic ecology of Humboldt squid, Dosidicus gigas, in conjunction with body size and climatic variability in the Gulf of California, Mexico. Limnology and Oceanography, 2020, 65(4): 732-748 DOI:10.1002/lno.11343 |
R Core Team, 2020. R: A language and environment for statistical computing. 4.0.3 edn. R Foundation for Statistical Computing, Vienna, Austria
|
RAMÍREZ F, AFÁN I, DAVIS L S, et al. Climate impacts on global hot spots of marine biodiversity. Science Advances, 2017, 3(2): e1601198 DOI:10.1126/sciadv.1601198 |
RODHOUSE P G K, ARKHIPKIN A I, LAPTIKHOVSKY V, et al. Illex argentinus, Argentine shortfin squid. In ROSA R G PIERCE R O'DOR (eds) Advances in squid biology, ecology and fisheries Part Ⅱ: Oegopsid squids. New York: Nova Science Publishers, 2013, 109–148
|
RODHOUSE P G, HATFIELD E M C. Dynamics of growth and maturation in the cephalopod Illex argentinus de Castellanos, 1960 (Teuthoidea: Ommastrephidae). Philosophical Transactions of the Royal Society of London B: Biological Sciences, 1990, 329(1254): 229-241 DOI:10.1098/rstb.1990.0167 |
RODHOUSE P G, HATFIELD E M C. Production of soma and gonad in maturing male Illex argentinus (Mollusca: Cephalopoda). Journal of the Marine Biological Association of the United Kingdom, 1992, 72(2): 293-300 DOI:10.1017/S002531540003770X |
ROSA R, SEIBEL B A. Synergistic effects of climate-related variables suggest future physiological impairment in a top oceanic predator. Proceedings of the National Academy of Sciences, 2008, 105(52): 20776-20780 |
SCHULTE-HOSTEDDE A I, ZINNER B, MILLAR J S, et al. Restitution of mass-size residuals: Validating body condition indices. Ecology, 2005, 86(1): 155-163 DOI:10.1890/04-0232 |
WALUDA C M, RODHOUSE P G, PODESTÁ G P, et al. Surface oceanography of the inferred hatching grounds of Illex argentinus (Cephalopoda: Ommastrephidae) and influences on recruitment variability. Marine Biology, 2001, 139(4): 671-679 |
XUAN S P, CHEN X J, LIN D M, et al. The effective fecundity in male Illex argentinusin southwest Atlantic ocean. Acta Hydrobiologica Sinica, 2018, 42(4): 800-810 [宣思鹏, 陈新军, 林东明, 等. 西南大西洋阿根廷滑柔鱼雄性个体的有效繁殖力特性研究. 水生生物学报, 2018, 42(4): 800-810] |
ZANG N, LIAN J X, CHEN X J, et al. Research progress in growth and reproductive investment of Illex argentinus. Acta Hydrobiologica Sinica, 2021, 45(4): 906-916 [臧娜, 连晋欣, 陈新军, 等. 阿根廷滑柔鱼年间生长及体征变化. 水生生物学报, 2021, 45(4): 906-916] |
ZHANG X G, XIONG B X. On the relationship between body weight and body dimensions of Culter and Culterichthys in Lake Poyang. Journal of Lake Sciences, 2007, 19(4): 457-464 [张小谷, 熊邦喜. 鄱阳湖鲌属(Culter)和原鲌属(Culterichthys)鱼类体重与体维关系. 湖泊科学, 2007, 19(4): 457-464] |



