转录因子激活蛋白2α (transcriptional factor activating protein 2α, TFAP2α)又称激活蛋白AP2α,是一类分子量为46~52 kDa核转录因子,有物种细胞类型特异性,能特异地结合DNA,通过结合多种基因的启动子特定位点,参与基因的转录调控,在组织形态发育、细胞生长、分化、凋亡和肿瘤发生以及免疫反应中具有重要作用(Hoffman et al, 2007)。很多肿瘤的重要病理特征为特定转录因子的异常高表达,如乳腺癌中锌指蛋白转录因子高表达(吕昌新等, 2013),上皮癌细胞中转录因子Snail高表达(Wakahashi et al, 2013)。乳腺癌HER-2 (human epidermal growth factor receptor-2, HER-2)基因的表达与转录因子AP2α的表达量增高相关(Berlato et al, 2011)。抑制转录因子AP2α的表达,可以促进乳腺癌细胞的凋亡及对放疗及化疗的敏感性(Thewes et al, 2010)。HER-2的启动子上具有AP2α结合位点,AP2α是通过与结合癌基因HER-2的启动子结合并促进其转录而导致癌变(Hung et al, 2012),免疫组化证实人乳腺癌组织中AP2α表达上调,并与HER-2表达呈正相关(Powe et al, 2009)。此外,AP2α参与乳腺癌﹑黑色素瘤、前列腺癌和大肠癌等癌变过程(Berlato et al, 2011)。
黄姑鱼(Nibea albiflora)是一种具有重要经济价值的海水鱼类,在我国东南沿海地区(如浙江和福建省)广受欢迎(Liu et al, 2020; Xiang et al, 2020),并有较大的养殖规模。近几年来,黄姑鱼养殖遭受细菌病的严重困扰,造成很高的死亡率,特别是由哈维氏弧菌(Vibrio harveyi)引起的“红头病”造成了严重的经济损失(Xiang et al, 2020; Yin et al, 2018)。哈维氏弧菌是一种革兰氏阴性菌,在海水养殖产业中引发了多种细菌性疾病(沈桂明等, 2017)。因此,本实验室用哈维氏弧菌对黄姑鱼进行了人工攻毒实验,并对实验鱼群体进行全基因组重测序挖掘单核苷酸多态性(SNP)分子标记,以攻毒后正常存活时间作为抗病力的表型值进行全基因组关联分析(GWAS),结果显示,黄姑鱼转录因子AP2α基因位于定位区间中(Luo et al, 2021)。然而,目前尚无转录因子Ap2α基因参与鱼类抗病免疫过程的相关研究报道。本研究从黄姑鱼中克隆到AP2α基因,分析其分子结构特征,利用实时荧光定量PCR(RT-qPCR)技术检测其在健康组织和哈维氏弧菌感染后不同组织的表达情况,并研究AP2α蛋白的亚细胞定位,进行蛋白质原核克隆和诱导表达,旨在阐明黄姑鱼AP2α基因在黄姑鱼抵御哈维氏弧菌过程中的作用,并为深入研究黄姑鱼抗病分子机制奠定基础。
1 材料与方法 1.1 实验材料实验所用黄姑鱼幼鱼[(3.28±1.71) g, (4.56± 1.39) cm, 3月龄]取自福建省宁德市金铃水产科技有限公司。攻毒前,所有幼鱼在充气海水中驯养1周,水温保持在(27.1±2.1) ℃,盐度30,水深1.0 m。每天在固定时间(07:00和18:00)饲喂2次市售的黄姑鱼配合饲料(天马水产科技有限公司)。攻毒实验所用哈维氏弧菌菌株分离于自然发病鱼,由集美大学水产学院孙云章教授惠赠。
1.2 主要试剂Trans Zol Up Plus RNA kit购于北京全式金生物技术有限公司;GoScript™ Reverse Transcription System Protocol购于Promega公司;琼脂糖凝胶DNA回收试剂盒和无内毒素质粒小量提取试剂盒购自北京天漠科技开发有限公司;ClonExpress® Ⅱ One Step Cloning Kit和ChamQ™ Universal SYBR® qPCR Master Mix购自南京诺唯赞生物科技股份有限公司;Lipo8000™转染试剂、GFP Rabbit Monoclonal Antibody、辣根过氧化物酶标记山羊抗兔IgG (H+L)、DAPI、BeyoColor™彩色预染蛋白Marker (15~ 120 kDa)、SDS-PAGE蛋白上样缓冲液(5×)、BeyoBlue™考马斯亮蓝快速染色液、EGFP抗体和GST抗体和BeyoECL Plus化学发光试剂盒购自上海碧云天生物技术有限公司;胎牛血清(FBS)购于Gibco公司;PBS (pH=7.4)缓冲液、胰蛋白酶消化液(0.25%胰酶和0.02% EDTA)和DMEM High Glucose购于BI公司;双抗(青霉素10 000 IU/mL–链霉素10 mg/mL)购于MP公司;本研究所用引物均在厦门铂瑞生物科技有限公司合成。
1.3 样本采集攻毒前,采集用于组织表达分析的6尾正常黄姑鱼的器官或组织(包括心脏、肾脏、肝脏、皮肤、鳃、胃、脾脏、肠和血),存于RNA保护液中,随后–80 ℃冰箱保存,用于RNA提取。
哈维氏弧菌感染实验采用浸泡感染的方法进行:在一个面积为4 m2、深度为1.5 m的混凝土水池中,将8 L细菌悬浮液(109 CFU/mL)均匀泼洒到池水中,不间断充气,使其与受试幼鱼充分接触,细菌感染过程持续3 h,之后,将所有幼鱼转移到一个新的洁净海水的水泥池中;攻毒水池用次氯酸钠消毒。分别在哈维氏弧菌感染黄姑鱼后0、6、12、24、48、72和96 h采集黄姑鱼各6尾,采集头肾、肝脏和脾,置于RNA保护液中,随后保存在–80 ℃的冰箱中,用于RNA提取。动物实验操作遵循集美大学水产学院动物伦理委员会的要求进行。
1.4 RNA提取及cDNA的合成按照说明书步骤,使用Trans Zol Up Plus RNA kit对组织样品进行RNA提取并使用GoScript™ Reverse Transcription System Protocol逆转录合成cDNA的第一条链,黄姑鱼内参基因β-actin用于cDNA合成质量的检测。
1.5 黄姑鱼AP2α开放阅读框序列的克隆和载体构建从本实验室构建的黄姑鱼转录组数据库中获得AP2α的开放阅读框序列。根据ClonExpress® Ⅱ One Step Cloning Kit设计了具有XhoⅠ和EcoRⅠ限制性位点的特异性引物(表 1)。PCR的步骤:95 ℃,3 min预变性;30个循环(95 ℃变性15 s,58 ℃退火15 s,72 ℃延伸1 min 30 s),72 ℃彻底延伸5 min。将纯化后的AP2α产物分别连接到pEGFP-N1载体和pGEX-6P-1载体上(本实验室保存),并转化至大肠杆菌(Escherichia coli) DH5α中,抗性平板筛选阳性克隆并进行菌液PCR鉴定,然后送厦门铂瑞生物科技有限公司测序。其中,重组质粒pEGFP-N1-AP2α用于转染人胚胎肾细胞293T (HEK 293T)进行亚细胞定位,pGEX-6P-1-AP2α用于原核表达蛋白质。
|
|
表 1 黄姑鱼AP2α基因克隆、RT-qPCR及亚细胞定位所用的引物序列 Tab.1 Primers used for the cloning, RT-qPCR and subcellular localization of AP2α gene in the study |
使用ExPASy-Translate (https://web.expasy.org/translate/)对编码的氨基酸序列进行推导;扩增出的序列与推导的氨基酸序列经NCBI在线Blast (https://blast.ncbi.nlm.nih.gov/Blast.cgi)与其他物种进行相似性比对;不同物种SPHK1氨基酸序列在NCBI数据库中搜索获得,并利用ClustalW (https://www.ebi.ac.uk/Tools/msa/clustalo/; https://www.ncbi.nlm.nih.gov/)对其进行同源性比对;黄姑鱼与其他物种的AP2α蛋白系统发育进化树使用MEGA v6.06的最大似然法(ML)进行构建;蛋白质的理化性质,包括理论分子量、理论等电点和氨基酸组成等使用ExPASy-ProtParam (https://web.expasy.org/protparam/)进行分析(张志华等, 2022);蛋白中的结构域、信号肽切割位点和跨膜区域,分别使用SMART (http://smart.embl-heidelberg.de)、SignalP (http://www.cbs.dtu.dk/services/SignalP/)和TMHMM (http://www.cbs.dtu.dk/services/TMHMM/)进行预测;亚细胞定位预测在TargetP (http://www.cbs.dtu.dk/services/TargetP/)中进行;磷酸化位点预测在NetPhos (http://www.cbs.dtu.dk/services/NetPhos/)中进行;使用SWISS-MODEL (https://swissmodel.expasy.org/)和tFold (https://drug.ai.tencent.com/console/cn/tfold)对蛋白的三级结构进行预测,并结合VMD 1.9.2 (https://www.ks.uiuc.edu/Research/vmd/vmd-1.9.2)进行蛋白三级结构可视化。
1.7 RT-qPCR设计黄姑鱼AP2α特异性引物q-AP2α-F和q-AP2α-R,选择β-actin (引物为β-actin-F/ β-actin-R,表 1)为内参基因,以稀释80倍的cDNA为模板进行RT-qPCR。使用StepOne Plus荧光定量PCR仪,按照荧光定量染料ChamQ™ Universal SYBR® qPCR Master Mix说明书进行,反应体系(20 μL):2× ChamQ Universal SYBR qPCR Master Mix 10 μL;正向、反向引物各0.5 μL;cDNA模板4 μL;ddH2O 5.0 μL。反应程序:95 ℃预变性30 s;95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸30 s,循环40次;最后为熔解曲线步骤(95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s)。每个样品设置3个生物学重复。采用2–ΔΔCt法结合SPSS 20.0中的单因素方差分析(one-way ANOVA)及LSD Multiple Comparison Test进行基因差异表达分析,P<0.05为差异显著。
1.8 细胞培养及黄姑鱼AP2α的亚细胞定位和Western blot将构建成功的真核表达质粒pEGFP-YdSPHK1转染至人胚胎肾细胞293T (HEK 293T)中进行亚细胞定位,同时转染pEGFP-N1作为阴性对照。HEK 293T细胞接种到12孔板中,培养基为含有10% FBS和1%双抗的DMEM,5% CO2,37 ℃恒温培养24 h之后,使用Lipo8000™转染试剂进行转染。转染24 h后,收集细胞进行Western blot验证以检测黄姑鱼AP2α在HEK 293T细胞中表达。步骤如下:先用细胞裂解缓冲液裂解,制备蛋白样品,蛋白质样品通过12% SDS-PAGE分离,然后转移到PVDF膜上;将膜用含有5%胎牛血清白蛋白的TBST缓冲液在室温下封闭孵育2 h,然后转移到GFP一抗稀释液中4 ℃过夜;用TBST洗涤5次(每次5 min),将膜与二抗稀释液一起孵育2 h,然后用TBST洗涤7次(每次5 min)。膜用BeyoECL Plus化学发光试剂盒检测,用Image Quant LAS 4000 (GE Healthcare)拍照。同时,用4%的多聚甲醛固定细胞,0.2%的Triton X-100透化细胞,最后用0.2%的DAPI进行细胞核染色。使用共焦荧光显微镜Leica TCS SP8系统(Leica, 德国)观察绿色荧光蛋白在细胞中的分布。
1.9 黄姑鱼GST-AP2α重组蛋白诱导表达和检测将测序正确的重组质粒(pGEX-6P-1-AP2α)转化至大肠杆菌BL21(DE3)中,在含氨苄青霉素(100 g/mL)的LB培养基中,37 ℃、200 r/min振荡培养至OD600 nm为0.6。加入异丙基-β-D-硫代半苷(IPTG)至终浓度0.25 mmol/L,37 ℃继续振荡培养6 h。菌液5 000 r/min离心5 min,收集菌体。冰浴条件下超声裂解细菌,裂解液为含1% Triton X-100的冰冷PBS,超声时间为10 s,间隔时间为10 s,功率为200 W,超声直至菌液清亮。4 ℃下15 000 r/min离心20 min,收集上清液(含GST-AP2α融合蛋白)。样品分别与2×SDS上样缓冲液混合,煮沸5 min,12% SDS-PAGE凝胶电泳,同时设转化空载体的大肠杆菌BL21进行对照,电泳结束后,用0.025%考马斯亮蓝R250进行显色观察。同时,对转化pGEX-6P-1空载体的菌和pGEX-6P-1-AP2α重组载体的菌进行SDS-PAGE电泳分离,电转至PVDF膜,利用GST抗体进行Western blot检测以验证AP2α蛋白表达,Western Blot的方法同1.8。
2 结果 2.1 黄姑鱼AP2α基因序列分析AP-2α基因在基因组上由7个外显子组成(图 1),本研究克隆到AP2α的基因开放阅读框(ORF)为1 275 bp,编码424个氨基酸(图 3)。软件预测该蛋白的理论分子量为46.43 kDa,理论等电点(pI)为8.57。预测得到的AP2α蛋白结构与AP2α蛋白家族的共有结构类似,在N端为反式激活结构域,在中部为中心基本结构及在C端高度保守的helix-span-helix基序(图 2)。SignaIP-5.0 Server预测黄姑鱼AP2α不含信号肽。NCBI蛋白保守结构域的预测显示,黄姑鱼AP2α基因上的AP2α超家族保守结构域位于197~392 aa,黄姑鱼AP2α蛋白的三级结构预测如图 4所示。
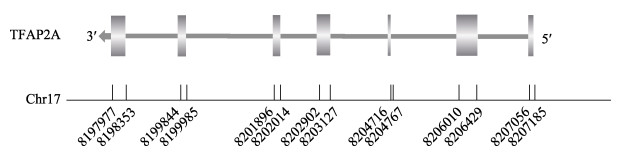
|
图 1 黄姑鱼AP2α的基因组结构 Fig.1 Genome structure of AP2α in N. albiflora |

|
图 2 黄姑鱼AP-2α的蛋白结构分析 Fig.2 Protein structures analysis of AP2α in N. albiflora |

|
图 3 黄姑鱼AP2α开放阅读框(ORF)序列和预测的氨基酸序列 Fig.3 Predicted amino acid sequence and the ORF sequence of AP2α gene 起始密码子和终止密码子加粗表示。AP2α超家族保守结构域使用灰色阴影突出显示。绿色框表示丝氨酸(Ser)磷酸化位点,蓝色框表示苏氨酸(Thr)磷酸化位点,黄色框表示酪氨酸(Tyr)磷酸化位点。 The start codon and the stop codon are shown in bold. The AP2α superfamily conserved domain is highlighted with a grey shadow. The green boxes indicate serine (Ser) phosphorylation sites, the blue boxes indicate threonine (Thr) phosphorylation sites, and yellow boxes indicate tyrosine (Tyr) phosphorylation sites. |
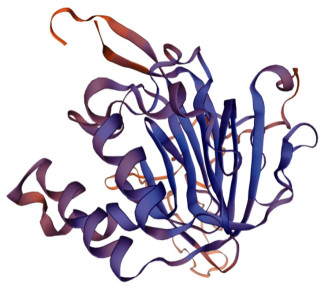
|
图 4 黄姑鱼AP2α蛋白三级结构预测 Fig.4 Tertiary structure of AP2α from N. albiflora |
将黄姑鱼AP2α的氨基酸序列与选取的16个其他物种的AP2α的氨基酸序列比对后,发现其与其他物种的AP2α蛋白的氨基酸序列同源性在80%以上(表 2)。值得注意的是,黄姑鱼AP2α蛋白与同属于石首鱼科(Sciaenidae)的大黄鱼(Larimichthys crocea)的同源性高达100%。选取鱼类、哺乳类、鸟类和两栖类中的代表物种,对它们的AP2α蛋白的氨基酸序列进行多重比对,结果如图 5所示,各物种AP2α蛋白中的3个重要的结构域相对较保守。
|
|
表 2 AP2α系统发育进化树及序列多重比对所用的氨基酸序列 Tab.2 Amino acid sequences used in multiple sequence alignment and phylogenetic analysis of AP-2α |

|
图 5 黄姑鱼AP2α的氨基酸序列的多重比对 Fig.5 Multiple sequence alignment of AP2α in N. albiflora |
系统进化分析结果显示,黄姑鱼AP2α在进化关系上与其他鱼类聚为一支;哺乳类、鸟类和两栖类各自聚为一支(图 6)。
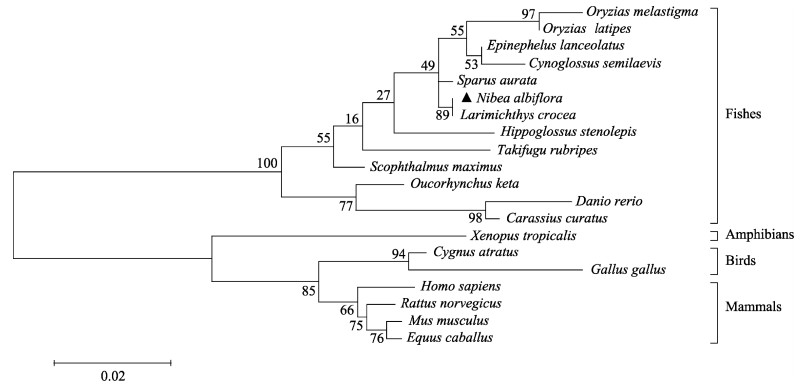
|
图 6 不同物种的AP2α氨基酸序列的ML系统发育进化树 Fig.6 Phylogenetic tree based on Maximum-Likelihood (ML) method of AP2α protein in different species 节点处数字为Bootstrap检验设置重复取样1 000次计算出的自展值;标尺(0.02)代表遗传距离;所用的AP2α蛋白氨基酸序列的GenBank登录号信息见表 2。 The numbers at the nodes indicate the bootstrap confidence values of 1 000 replicates; The scale bar (0.02) indicates the genetic distance; The GenBank accession numbers of amino acid sequences used are listed in Tab.2. |
如图 7A所示,黄姑鱼AP2α基因在所检测的黄姑鱼的9个组织或器官(皮肤、肝、心脏、鳃、肾脏、肠、脾脏、血液和胃)中均有表达,属于广谱型表达,但在不同组织中的表达量具有显著差异。其中,在血液和鳃中表达量最高,其次为肝脏、心脏和皮肤,而肾脏中表达量最低。
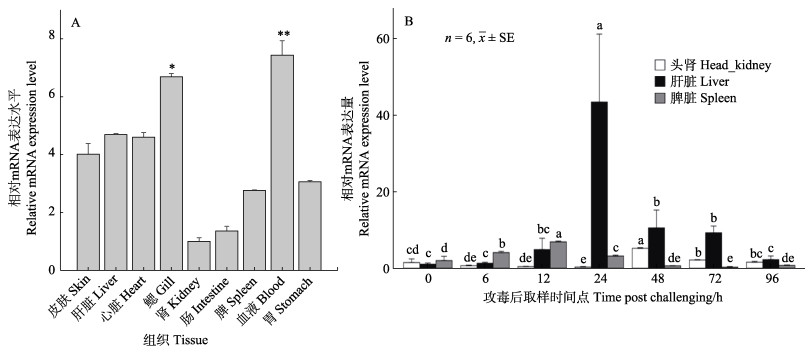
|
图 7 黄姑鱼AP2α组织表达谱及哈维氏弧菌攻毒后头肾、肝脏和脾脏中表达谱变化 Fig.7 Expression profiles of AP2α in tissues and the relative mRNA expressions in head-kidney, liver and spleen post V. harveyi challenging A:AP2α在健康黄姑鱼不同组织中的相对表达量;B:哈维氏弧菌攻毒后AP2α基因的mRNA在头肾、肝脏和脾脏组织中的相对表达量。*表示组织基因表达量与其他组织相比达到显著水平,**表示组织基因表达量与其他组织相比达到极显著水平。不同字母表示AP2α基因在不同组织表达量存在显著性差异。 A: Tissue profiles of AP2α expression in healthy yellow drum; B: Relative mRNA expressions of AP2α in head-kidney, liver and spleen after V. harveyi infection. * means that the gene expression level of the tissue has reached a significant level compared with other tissues, and ** means that the gene expression level of the tissue has reached a high significant level compared with other tissues. Different letters represent the significant difference of the AP2α gene expression among these tissues. |
经哈维氏弧菌浸泡攻毒后,黄姑鱼头肾、脾脏和肝脏中的AP2α基因的mRNA表达水平随着时间的延长而呈现不同的变化趋势(图 7B)。肝脏中,攻毒前后AP2α表达量变化最大,攻毒后12 h开始上调,在24 h达到最高水平,是攻毒前的39倍(P<0.05),此后逐渐下降至攻毒前的9.5倍(48 h)~2.1倍(96 h) (P<0.05)。头肾中,攻毒后48 h上调至攻毒前的3.5倍(P<0.05),其他时间点的表达量与攻毒前差异不显著;脾脏中,攻毒后6 h后AP2α的表达量就上调,12 h达到高峰,为攻毒前的3.4倍,24 h恢复至6 h的水平,48 h后表达量低于攻毒前的水平。
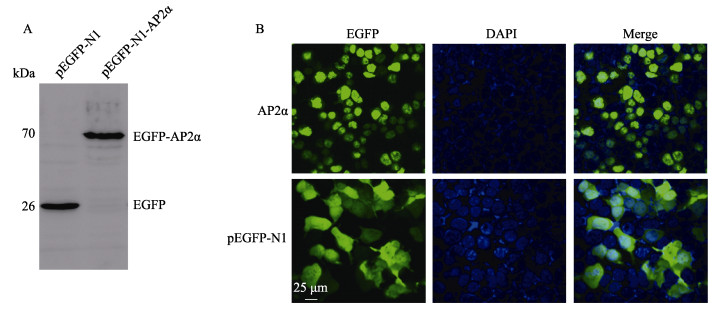
2.4 黄姑鱼AP2α的亚细胞定位Western blot表明pEGFP-AP2α蛋白在HEK 293T细胞中成功表达,在70 kDa以上出现一条非常明显的蛋白条带(AP2α蛋白预测大小为46.43 kDa,EGFP蛋白预测大小为26 kDa),与实际大小一致(图 8A)。AP2α蛋白的亚细胞定位结果显示,pEGFP-AP2α蛋白仅在细胞核中有分布,而对照pEGFP-N1在细胞核及细胞质均有分布(图 8B)。
|
图 8 黄姑鱼AP2α的亚细胞定位 Fig.8 The subcellular localization of AP2α A:Western blot检测EGFP-AP2α蛋白(72.43 kDa)与对照EGFP(26 kDa);B:共聚焦荧光显微镜下观察到EGFP-AP2α蛋白在HEK 293T细胞中定位于细胞核 A: Western blot of EGFP-AP2α protein (72.43 kDa) compared with control EGFP (26 kDa); B: Subcellular localization of EGFP-AP2α protein in HEK 293T cells was found in cytoplasm observed under the confocal fluorescence microscopy |
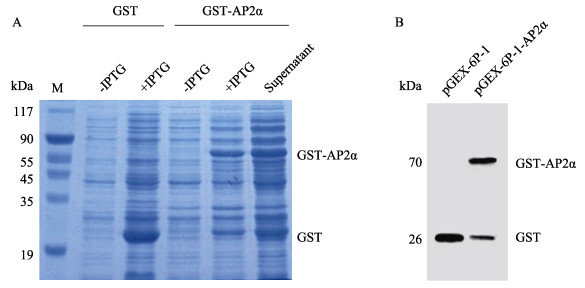
将重组菌株pGEX-6P-1-AP2α转化大肠杆菌BL21 (DE3),经IPTG诱导后在70 kDa以上出现一条非常明显的蛋白条带,而在表达载体pGEX-6P-1诱导和不诱导及重组质粒不诱导的对照中皆看不出此带,此带的大小与AP-2α蛋白(46.43 kDa)及与其融合的GST蛋白的分子量(26 kDa)之和相符,说明此基因插入表达载体pGEX-6P-1后在大肠杆菌中获得了高效表达。超声波破碎菌,高速离心后将菌液上清液经SDS-PAGE分析(图 9A)。Western blot显示,pGEX-6P- 1-AP2α蛋白在HEK 293T细胞中成功表达,在70 kDa以上出现一条非常明显的蛋白条带(AP2α蛋白预测大小为46.43 kDa,GST蛋白预测大小为26 kDa),与其实际大小一致(72.43 kDa) (图 9B),表明表达的GST-AP2α融合蛋白在菌体里为可溶性表达。
|
图 9 SDS-PAGE分析AP2α融合蛋白的表达(A)和Western blot验证(B) Fig.9 Expression analysis of the recombinant AP2α fusion protein by SDS-PAGE (A) and verification by Western blot (B) |
在人类和小鼠中发现转录因子激活蛋白AP2家族由AP2α、AP2β、AP2γ、AP2δ和AP2ε组成,在硬骨鱼中存在AP2α、AP2β、AP2γ和AP2ε的直系同源基因。AP2α发现最早,通常以二聚体形式结合到GC含量丰富的DNA元件上,特异性调控基因表达,参与脊椎动物生长发育、细胞增殖分化、细胞凋亡、免疫反应和抑癌作用等(毕杨等, 2011)。黄姑鱼AP2α蛋白由7个外显子编码,这与所有哺乳动物AP2蛋白均由7个外显子编码一致。AP2α家族的所有成员中共有3个保守的结构域,在N端(H2N)是富含脯氨酸和谷氨酰胺(P/Q-rich domain)的反式激活结构域,其后是一个中心基本结构及在C端(COOH)高度保守的helix-span-helix基序,负责结合DNA和蛋白质二聚化。大多数AP2α蛋白在反式激活结构域中有一个PY基序(XPPXY)和其他高度保守的关键残基。AP2α证实能与回文序列5′-GCCN3GGC-3′及其相似变体GCCN4GGC、GCCN3/4GGG等结合,在不同的细胞和病毒中可以行使增强剂的作用,可以促进一些基因和蛋白的表达(Pirone et al, 2019)。
序列同源比对显示,鱼类和哺乳动物Ap2α蛋白在进化上高度保守,黄姑鱼AP2α与斑马鱼(Danio rerio) AP2α蛋白具有95.06%的相似性,与人类(Homo sapiens) AP2α蛋白具有85.82%的相似性(图 6、表 2)。从鱼类到哺乳类选取了代表性物种的AP2α蛋白的氨基酸序列构建了系统进化树,其结果与传统的分类结果基本一致,黄姑鱼AP2α与其他鱼类的AP2α聚为一支,以哺乳类、鸟类和两栖类为单位选取的其他物种的AP2α各自形成一个分支。有趣的是,黄姑鱼AP2α与大黄鱼AP2α序列同源性高达100%,在分类地位上,大黄鱼与黄姑鱼同隶属于石首鱼科。
本研究中,AP2α在黄姑鱼的各组织、器官中广泛表达,这与该基因在人和鼠等的组织中广谱型表达模式一致(Pirone et al, 2019; Guo et al, 2016),说明AP2α参与生命活动的多种过程,并发挥重要作用。受到哈维氏弧菌感染后,Ap2α基因在黄姑鱼头肾、肝脏和脾脏3种主要免疫器官中的表达量均显著上调,特别是肝脏中AP2α mRNA表达量在攻毒后24 h升高到攻毒前的39倍,表明AP2α基因参与了黄姑鱼抵御哈维氏弧菌的抗病免疫过程。敲除小鼠的AP2α基因,可导致其神经管、面部、眼和四肢的胚胎形成受到影响而发育畸形甚至死亡(SulkaIa et al, 2002),说明AP2α参与生物免疫、发育等多种生命过程。在人类牙齿釉质形成的研究中,转录因子AP2α通过与基质金属蛋白酶20 (matrix metalloproteinase-20, Mmp-20)基因的启动子进行结合和相互作用,调控MMP-20的表达水平,牙齿特异表达的基质金属蛋白酶MMP-20主要在成釉细胞分泌期降解釉质蛋白。分析发现,Mmp-20基因启动子区含有AP2α结合位点,AP2α可以通过结合到Mmp-20基因启动子区域来影响Mmp-20基因的转录水平,从而影响釉质形成。借助小鼠成釉细胞,转染AP2α基因的siRNA后,成釉细胞中Mmp-20 mRNA的表达水平显著上调(赵娜等, 2012)。
在脂肪生成过程中,AP2α通过直接与DNA甲基转移酶3a (Dnmt3a)近端启动子区域结合,转录上调Dnmt3a的表达,从而使前脂肪细胞具有分化能力,增殖细胞通过接触抑制阶段(CI)进入细胞周期。用AP2α特异性siRNA处理前脂肪细胞,会抑制前脂肪细胞的分化。此外,将AP2α基因敲低会导致脂肪生成受损,而Dnmt3a的过表达能在一定程度上挽救这种脂肪生成受损。AP2α是前脂肪细胞通过CI期Dnmt3a表达上调而分化的能力的重要调节剂(Guo et al, 2016)。
4 结论基于之前的全基因组关联分析,发现转录因子AP2α与黄姑鱼抗哈维氏弧菌病相关。本研究发现,经哈维氏弧菌感染刺激后AP2α显著上调表达,表明AP2α在黄姑鱼的抗哈维氏弧菌病免疫过程中可能具有重要作用,其具体功能与机制还亟待更进一步的研究。
BERLATO C, CHAN K, PRICE A M, et al. Alternative TFAP2A isoforms have distinct activities in breast cancer. Breast Cancer Research, 2011, 13(2): R23 DOI:10.1186/bcr2838 |
BI Y, HE Y, GONG M, et al. Construction of recombinant adenovirus vector containing dominant negative mutant of transcriptional factor AP2α and its expression and activity in mesenchymal stem cells. Life Science Research, 2011, 15(5): 402-409 [毕杨, 何昀, 龚敏, 等. 显性负性突变体对AP2α转录因子及其活性的影响. 生命科学研究, 2011, 15(5): 402-409 DOI:10.16605/j.cnki.1007-7847.2011.05.002] |
GUO W, CHEN J N, YANG Y, et al. Epigenetic programming of Dnmt3a mediated by AP2 alpha is required for granting preadipocyte the ability to differentiate. Cell Death and Disease, 2016, 7(12): e2496 DOI:10.1038/cddis.2016.378 |
HOFFMAN T L, JAVIER A L, CAMPEAU S A, et al. Tfap2 transcription factors in zebrafish neural crest development and ectodermal evolution. Journal of Experimental Zoology Part B Molecular and Developmental Evolution, 2007, 308(5): 679-691 |
HUNG S W, CHIU C F, CHEN T A, et al. Recombinant viral protein VP1 suppresses HER-2 expression and migration/ metastasis of breast cancer. Breast Cancer Research and Treatment, 2012, 136(1): 89-105 DOI:10.1007/s10549-012-2238-7 |
LIU G, HAN Z, JIANG D, et al. Genome-wide association study identifies loci for traits related to swim bladder in yellow drum (Nibea albiflora). Aquaculture, 2020, 526: 735327 DOI:10.1016/j.aquaculture.2020.735327 |
LÜ C X, DING Y, LI L, et al. Analysis of clinical significance of KLF5 expression in breast cancer tissue. Chinese Journal of Cancer Prevention and Treatment, 2013, 20(11): 850-852 [吕昌新, 丁宇, 李良, 等. 乳腺癌组织KLF5表达临床意义分析. 中华肿瘤防治杂志, 2013, 20(11): 850-852] |
LUO S, LI W, XIE Y, et al. A molecular insight into the resistance of yellow drum to Vibrio harveyi by genome-wide association analysis. Aquaculture, 2021, 543(4): 736998 |
PIRONE L, SMALDONE G, SPINELLI R, et al. KCTD1: A novel modulator of adipogenesis through the interaction with the transcription factor AP2α. Biochimica et Biophysica Acta-Molecular and Cell Biology of Lipids, 2019, 1864(12): 158514 DOI:10.1016/j.bbalip.2019.08.010 |
POWE D G, AKHTAR G, HABASHY H O, et al. Investigating AP-2 and YY1 protein expression as a cause of high HER2 gene transcrip-tion in breast cancers with discordant HER2 gene amplification. Breast Cancer Research, 2009, 11(6): R90 DOI:10.1186/bcr2461 |
SHEN G M, LI C, SHI C Y, et al. Isolation and characterization of the extracellular products (ECPs) and secretory proteins of the pathogenic Vibrio harveyi strain ML01. Progress in Fishery Sciences, 2017, 38(4): 25-33 [沈桂明, 李晨, 史成银, 等. 哈维氏弧菌(Vibrio harveyi) ML01株胞外产物及分泌性蛋白的分离与特性分析. 渔业科学进展, 2017, 38(4): 25-33] |
SULKALA M, LARMAS M, SORSA T, et al. The localization of matrix metalloproteinase-20 (MMP-20, enamelysin) in mature human teeth. Journal of Dental Research, 2002, 81(9): 603-607 DOI:10.1177/154405910208100905 |
THEWES V, ORSO F, JÄGER R, et al. Interference with activator protein-2 transcription factors leads to induction of apoptosis and an increase in chemo- and radiation- sensitivity in breast cancer cells. BMC Cancer, 2010, 10: 192 DOI:10.1186/1471-2407-10-192 |
WAKAHASHI S, SUDO T, OKA N, et al. VAV1 represses E-cadherin expression through the transactivation of snail and slug: A potential mechanism for aberrant epithelial to mesenchymal transition in human epithelial ovarian cancer. Translational Research, 2013, 162(3): 181-190 DOI:10.1016/j.trsl.2013.06.005 |
XIANG J, CHEN R, XU D, et al. Characterization of pathological changes and immune-related gene expression in yellow drum (Nibea albiflora) in response to Pseudomonas plecoglossicida and poly I: C challenge. Aquaculture Reports, 2020, 17: 100350 DOI:10.1016/j.aqrep.2020.100350 |
YIN F, LIU W, BAO P, et al. Food intake, survival, and immunity of Nibea albiflora to Cryptocaryon irritans infection. Parasitology Research, 2018, 117(8): 2379-2384 DOI:10.1007/s00436-018-5923-6 |
ZHANG Z H, FENG B, ZHU T F, et al. Expression and regulation analysis of the p35a and p40c subunits of interleukin 12 in Cynoglossus semilaevis infected by Vibrio harveyi. Progress in Fishery Sciences, 2022, 43(3): 12-23 [张志华, 冯博, 朱腾飞, 等. 半滑舌鳎白细胞介素12的p35a和p40c亚基在哈维氏弧菌感染下的表达和调控分析. 渔业科学进展, 2022, 43(3): 12-23] |
ZHAO N, WANG Y M, SUN X L. Effects of AP-2α on expression of matrix metalloproteinase-20. Chinese Journal of Conservative Dentistry, 2012, 22(4): 183-188 [赵娜, 王玉民, 孙学玲, 等. AP-2α对基质金属蛋白酶-20作用的研究. 牙体牙髓牙周病学杂志, 2012, 22(4): 183-188] |



