2. 中国水产科学研究院黄海水产研究所 农业农村部海洋渔业与可持续发展重点实验室 山东 青岛 266071;
3. 海洋渔业科学与食物产出过程功能实验室 山东 青岛 266071
2. Key Laboratory of Marine Fisheries and Sustainable Development, Ministry of Agriculture and Rural Affairs, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China;
3. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao 266071, China
鲨鱼是海洋中最凶猛的鱼类之一,广泛分布于各大海域,从浅滩到深海,热带到极地都有存在,全世界已知现存约520种,有30种会主动攻击人,有7种可能会致人受伤,还有27种因为体型和习性的关系,具有危险性。ISAF(International Shark Attack File)编写的2020年鲨鱼袭击报告显示,鲨鱼攻击人类的次数在持续上升,全球每年大约有60起鲨鱼袭击的报道。根据国家海洋战略要求,海上交通、海洋科研、海洋资源开发等活动逐渐走向深蓝,各种应急、科研、保障任务增多,水下作业人员及舰船、飞机落水人员受鲨鱼攻击的概率增大。一旦遭受鲨鱼攻击,可能产生大面积、严重组织损伤,甚至致残、致死等问题。为此,海上作业人员需要佩戴相关驱鲨产品,以保障落水待援人员的生命安全。根据驱鲨原理的不同,常使用的驱鲨产品包括化学驱鲨剂和电脉冲驱鲨装置等(Hart et al, 2015)。目前,军民常用的便携式驱鲨用品多为化学驱鲨剂,虽然对人员有一定的保护作用,但对鲨鱼及使用海域海洋生物的生存具有威胁并对生态环境会造成一定污染。随着国家对生态环境保护的重视,对造成严重环境污染或生态破坏的装备及基建都提出了整改要求,基于电脉冲原理的驱鲨装置逐渐成为化学驱鲨剂的替代用具。到目前为止,对驱鲨产品的研究多集中于驱鲨效果的评估方面,对于相关驱鲨产品使用后对海洋环境影响及海洋生物的毒性作用尚未见到相关报道。因此,本研究从生态环境保护的角度出发,评估不同类型驱鲨产品对海水水质和几种代表性鱼类的毒性作用,以期为海洋活动中驱鲨产品的选择和驱鲨用品升级换代的必要性提供科学依据。
1 材料与方法 1.1 实验材料 1.1.1 驱鲨剂及电脉冲驱鲨设备实验所用驱鲨剂为天津市化学试剂四厂凯达化工厂生产的86型化学驱鲨剂,单袋产品为(168±2) g,主要成分包含十二烷基硫酸钠、染料组分(KBR、KNB)和溴氰菊酯。实验所用电脉冲驱鲨设备为中国人民解放军海军特色医学中心研发设计的一种电脉冲驱鲨器(刘李娜等, 2020),其工作的主要参数为脉冲串交替输出间隔≤4.2 s,脉冲宽度为80 μs,脉冲间隔为200 ms,脉冲信号幅度≥80V。
1.1.2 实验用鱼本研究选取牙鲆(Paralichthys olivaceus)、许氏鲆鲉(Sebastes schlegelii)和斑石鲷(Oplegnathus punctatus)3种代表性海水养殖鱼类为研究对象。选取依据:牙鲆为底栖鱼类的代表种,许氏鲆鲉为游泳性鱼类的代表种,斑石鲷为热带海域鱼类的代表种。选取鱼体健康、活力良好的幼鱼鱼苗,其中,牙鲆和许氏鲆鲉购自山东省青岛贝宝海洋科技有限公司,斑石鲷购自山东省莱州明波水产有限公司。实验用牙鲆、许氏鲆鲉和斑石鲷的平均规格分别为(125.32±2.38)、(95.62±6.24)和(146.42±5.87) g/尾。苗种购买后运至水族实验室,暂养7 d,暂养和实验使用直径为1.0 m、深度为1 m的圆形水槽,许氏鲆鲉和牙鲆的暂养水温为16~18 ℃,斑石鲷暂养水温为22~24 ℃,保持连续充气,待鱼体状态稳定后用于后续实验。
1.2 实验方法 1.2.1 实验设计驱鲨产品对水质影响的测定分为空白水质组、化学驱鲨剂组和电脉冲驱鲨设备组共3个实验组,每组3个平行。水槽容积为350 L,各测试水槽内均注入自然海水,保持连续充气,从设备或产品投入水体中开始计时,测定6 h后各水槽中海水的水质指标。使用YSI exo水质检测仪测定相应实验周期内化学驱鲨剂组、电脉冲驱鲨设备组和空白水质组水槽的海水的温度、盐度、溶解氧(DO)、pH等水质指标变化,采用黑白盘测定水体透明度。
在海水鱼类的毒性作用实验中,每种鱼都分为阴性对照组(有鱼无驱鲨产品)、化学驱鲨剂组和电脉冲驱鲨设备组共3个实验组,每组设置3个平行,每个水槽中放20尾实验鱼。将许氏鲆鲉、牙鲆和斑石鲷在水族实验箱暂养7 d后随机分组。实验水族箱有效容积为350 L。实验期间,许氏鲆鲉、牙鲆水温为16~18 ℃,斑石鲷水温为22~24 ℃,保持连续充气。
1.2.2 2种驱鲨方式对3种海水鱼生理行为的影响采用挂袋的方式将化学驱鲨剂吊挂在相应水槽中央,观察挂袋后各水槽中许氏鲆鲉、牙鲆和斑石鲷的活力、体色等变化,并记录死亡时间。将充满电的电脉冲驱鲨设备放入水槽中央的中层水体,打开开关,开始计时,至设备中的电量消耗完毕(约6.5 h),观察各水槽中许氏鲆鲉、牙鲆和斑石鲷的活力、体色等变化。
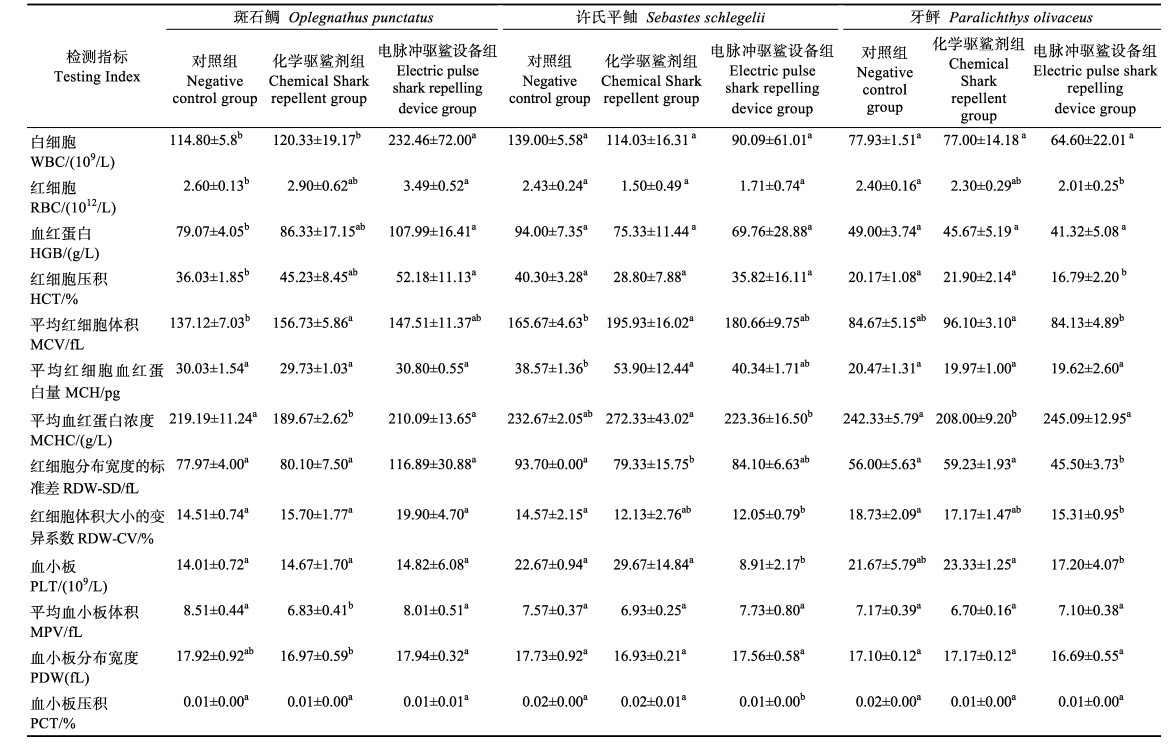
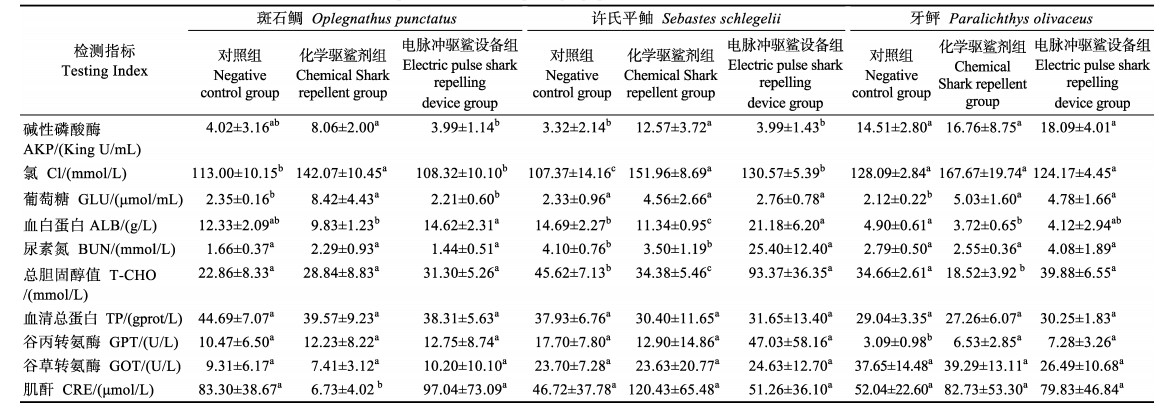
1.2.3 2种驱鲨方式对3种海水鱼血细胞和生化指标的影响由于化学驱鲨剂组在投入驱鲨剂后实验用鱼会出现急性死亡的中毒表现,因此,根据实验鱼的生理表现,在投入驱鲨剂10 min后,从相应实验组中随机采集10尾濒死的鱼作为检测样本;电脉冲驱鲨装置组在该装置启动6 h后,随机采集10尾鱼作为检测样本;实验结束时,自各阴性对照组中随机选取10尾实验鱼作为对照检测样本。对于采集的样品采用尾部静脉抽血的方式抽取静脉血,对采集的静脉血全血利用迈瑞BC-5000全自动血液细胞分析仪进行血细胞指标检测,检测指标包括白细胞数(WBC)、红细胞数(RBC)、血红蛋白含量(HGB)、红细胞压积(HCT)、平均红细胞体积(MCV)、平均红细胞血红蛋白量(MCH)、平均红细胞血红蛋白浓度(MCHC)、红细胞分布宽度(RDW-SD)、红细胞体积大小的变异系数(RDW-CV)、血小板计数(PLT)、血小板平均体积(MPV)、血小板分布宽度(PDW)和血小板压积(PCT)。收集所采集实验鱼的静脉血血清进行血液生化指标的检测,血液生化指标包括血清中谷丙转氨酶(GPT)、谷草转氨酶(GOT)、尿素氮(BUN)、肌酐(CRE)、总胆固醇(T-CHO)、总蛋白(TP)、血白蛋白(ALB)、葡萄糖(GLU)、氯(Cl)和碱性磷酸酶(AKP)等,均使用南京建成生物工程研究所生产的试剂盒进行检测。
1.2.4 2种驱鲨方式对3种海水鱼非特异性免疫酶活力的影响对1.2.3中所采集样品血清的非特异性免疫酶活性进行测定,测定指标包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽转移酶(GST)活性,均采用南京建成生物工程研究所生产的试剂盒,按照该试剂盒所附说明书进行检测。
1.2.5 2种驱鲨方式对3种海水鱼组织器官的毒性作用对化学驱鲨剂浸浴条件下濒死样品及电脉冲驱鲨装置运行结束后的实验鱼进行解剖,取鳃、肝脏、脾脏、心脏等组织器官,切成1 cm3的小块,在Davidson´s固定液中固定24 h后,固定液换为70%无水乙醇,再经无水乙醇梯度脱水、二甲苯透明、石蜡包埋、切片(5 μm)、HE染色、中性树胶封片后,在显微镜下观察并拍照。同样,取阴性对照组的鱼体进行固定、切片,作为对照,分析不同驱鲨方式对3种海水鱼的组织器官的毒性作用。
1.2.6 数据分析实验数据使用Microsoft Excel软件进行数据统计,使用SPSS14.0软件对实验组与对照组的结果进行差异显著性分析,使用Graphpad 6.0软件绘图。
2 结果 2.1 2种驱鲨方式对海水水质的影响化学驱鲨剂投入水中后,药物快速溶化扩散,水体快速呈深蓝色,在水槽中充氧产生的气流作用下,随着时间的延长,药物逐渐溶化,水体表面产生大量白色泡沫,水色透明度急剧下降,至实验结束时,水色呈墨蓝色,且透明度降低至0.15 m。对其他水质指标测定结果显示,化学驱鲨剂投入后,水槽中海水的pH显著降低,由7.91±0.02降低至7.52±0.04,而DO、盐度和温度无显著变化。电脉冲驱鲨设备组在实验期内,温度、盐度、pH、DO和透明度与空白组相比均无显著变化(表 1)。
|
|
表 1 2种驱鲨方式对海水水质的影响 Tab.1 Effect of two methods on the seawater quality |
在无任何处理的阴性对照组中,许氏鲆鲉、牙鲆和斑石鲷鱼苗活力强、体色亮,鳃丝鲜红,鱼苗在水槽中运动自然。将化学驱鲨剂投入水族箱后,药物迅速溶化扩散,水体呈深蓝色。1 min时,许氏鲆鲉、牙鲆和斑石鲷游动加强,漂浮于水面,口露出水面呼吸;5 min时,静伏桶底,活力减弱,游动失调;10 min时,许氏鲆鲉、牙鲆和斑石鲷处于濒死状态,头部、躯干部和鳍基部呈深蓝色,眼充血,鳃丝呈深蓝色或深红色,体表黏液增多;15 min时,幼鱼停止游动死亡。而在电脉冲装置组,苗种仅在设备投入水中的瞬间受到惊扰,出现躲避行为,在设备正常运行1 min后,3种幼鱼均恢复自然活动状态,体色、鳃丝颜色等与对照组均无区别(图 1)。

|
图 1 2种驱鲨方式对海水鱼类生理活动的影响 Fig.1 Effect of two methods on the physical activities of the three fishes A:空白对照组;B:化学驱鲨剂组;C:电脉冲驱鲨装置组。箭头指示化学驱鲨剂或电脉冲驱鲨装置 A: Blank control group; B: Chemical shark repellent group; C: Electric pulse shark-repelling device group. The red arrows indicate the chemical shark repellent or electric pulse shark-repelling device |
2种不同驱鲨方式下,斑石鲷、许氏鲆鲉和牙鲆的血常规指标检测结果见表 2。从表 2可以看出,化学驱鲨剂对3种鱼的血细胞数量影响不大,但斑石鲷和许氏鲆鲉的MCV显著增加,斑石鲷和牙鲆的MCHC显著降低(P < 0.05)。而受电脉冲驱鲨装置刺激后,斑石鲷的WBC、RBC、HGB和HCT会显著升高(P < 0.05),许氏平鲉血小板含量比阴性对照组降低60.70%且差异显著(P < 0.05),而牙鲆的只有在红细胞浓度和红细胞压积显著降低,其他血液指标变化不大。
|
|
表 2 化学驱鲨剂和电脉冲驱鲨设备对不同鱼类血液学指标的影响 Tab.2 Effects of chemical shark repellent and electric pulse shark-repelling equipment on hematological indexes of different fishes |
2种驱鲨方式对斑石鲷、许氏鲆鲉和牙鲆鱼苗血液生化指标的影响见表 3。从表 3可以看出,化学驱鲨剂对3种鱼血液中的尿素氮(BUN)含量均无显著影响,电脉冲驱鲨设备对3种鱼血液中的AKP活性和CRE含量无显著影响。在斑石鲷实验中,与阴性对照组相比,化学驱鲨剂组中Cl–的含量增长了0.3倍,GLU含量增长了2.5倍,CRE含量降低了91.92%,其他指标相比均无显著变化;电脉冲驱鲨设备组与对照组相比无显著差异。在许氏平鲉实验中,化学驱鲨剂组中AKP活性增长了3倍,Cl–含量增长了0.4倍,ALB含量降低了22.40%,T-CHO含量增长了0.5倍,其他指标相比无显著差异;电脉冲驱鲨设备组中,与阴性对照组相比,Cl–含量提高0.2倍,ALB含量提高0.4倍,BUN含量提高5倍,T-CHO含量提高1倍,其他指标与对照组相比无显著差异。在牙鲆实验中,化学驱鲨剂组中,GLU含量提高了1.3倍,ALB含量降低了24.08%,T-CHO含量降低了46.57%,GPT活性提高了1.1倍;在电脉冲驱鲨设备组中,GPT活性较对照组高1.4倍,GLU含量与对照组相比高1.3倍。化学驱鲨剂可显著升高3种鱼血液氯(Cl)的含量,2种驱鲨产品对3种鱼的TP和GOT含量均无显著影响。
|
|
表 3 化学驱鲨剂和电脉冲驱鲨设备对不同鱼类血液生化指标的影响 Tab.3 Effects of shark repellent and shark-repelling equipment on blood biochemical indexes of different fishes |
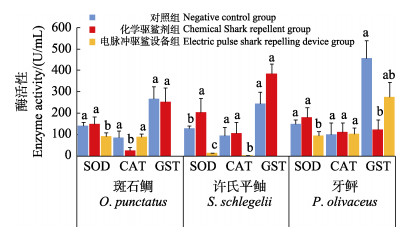
2种驱鲨方式对斑石鲷、许氏鲆鲉和牙鲆实验鱼血液免疫酶活性指标检测结果见图 2。从图 2可以看出,驱鲨剂作用下,斑石鲷血清中的CAT活性显著降低(P < 0.05),许氏鲆鲉血清中SOD活性显著升高(P < 0.05),牙鲆血清中GST活性显著降低(P < 0.05),对血清中的其他酶活性指标无显著影响(P < 0.05);受驱鲨设备影响,3种鱼血清中的SOD活性显著降低(P < 0.05),此外,许氏平鲉中CAT活性显著降低(P < 0.05),对其他酶活性指标无显著影响(P>0.05)。
|
图 2 驱鲨剂和驱鲨设备对不同鱼类血液免疫酶活性影响 Fig.2 Effect of shark repellent and shark-repelling equipment on blood immune enzyme activity of different fishes SOD:超氧化物岐化酶;CAT:过氧化氢酶;GST:谷胱甘肽转移酶 SOD: Superoxide dismutase; CAT: Catalase; GST: Glurathione transferase |
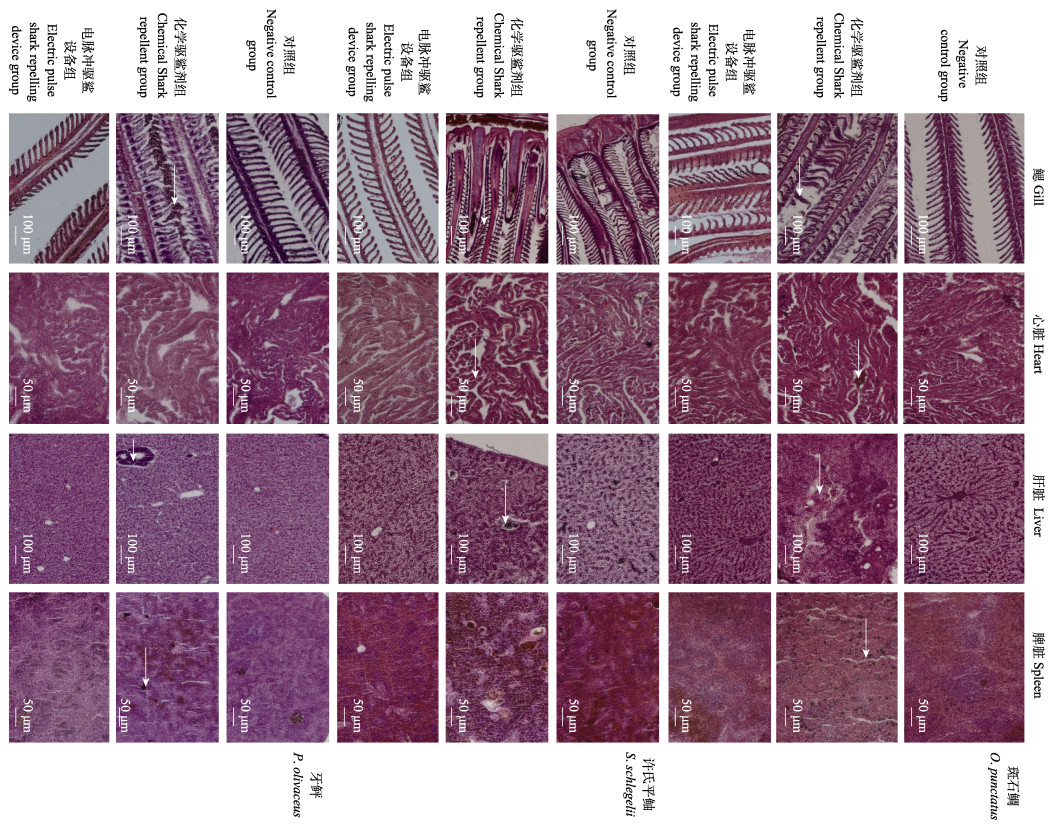
2种驱鲨方式下,3种海水鱼鳃、心脏、肝脏和肾脏影响的组织学观察结果见图 3。从图 3可以看出,电脉冲驱鲨装置组和对照组相比无明显差异,其组织结构都呈现出如下特点:许氏鲆鲉、牙鲆和斑石鲷的鳃丝,其鳃小叶整齐,呈梳形排列,组织结构清晰;肾脏结构完整清晰,质地均匀;脾脏组织结构清晰,由红髓和白髓组成,内充盈着红细胞和巨噬细胞;肝细胞呈多角状,成放射状围绕中央静脉紧密排列;心肌纤维形态清晰,排列有序,互相纵横交叉,构成复杂的网状结构。而化学驱鲨剂对3种鱼的器官组织结构影响较大,许氏鲆鲉、牙鲆和斑石鲷的鳃丝弯曲变形,相互黏连融合,结构模糊,呼吸上皮细胞严重脱落;脾脏组织有大量黑色素巨噬细胞浸润;肝组织中央静脉、小叶间胆管、小叶间动脉模糊不清,肝血窦瘀血,红细胞充盈,细胞核固化,染色加深;心肌纤维之间有大量红细胞聚集。
|
图 3 驱鲨剂和驱鲨设备对不同鱼类组织器官的毒理作用 Fig.3 Toxicological effects of shark repellent and shark-repelling equipment on tissues and organs of different fishes |
鲨鱼不仅拥有眼睛、内耳、侧线等一系列高度特化的感官系统,还有特异的洛仑兹尼壶腹(ampullae of Lorenzini)特异的电感受器(Kalmijn, 1982)。每一种感觉模式都使鲨鱼能在其周围环境中检测和应对不同的生物和/或非生物刺激(Kempster et al, 2013; Stein et al, 2005)。因此,基于化学刺激和电刺激驱赶鲨鱼的相关设备也陆续被开发利用。二战时期,美国和澳大利亚海军研究实验室发现,醋酸铜与另一种碱性染料(Methic Leather Black D.G.)结合使用在驱赶鲨鱼方面具有协同效应(Burden, 1945)。后来,Zlotkin等(1984)筛选出十二烷基硫酸钠(SDS)和十二烷基硫酸锂(LDS) 2种阴离子洗涤剂是强有力的鲨鱼驱避剂。1935年研究人员发现鲨鱼对电场存在定向逃避的现象,Kalmijn (1971)研究发现,小斑点猫鲨(Scyliorhinus canicula)在遇到1~10 mV/cm的直流电压梯度时,表现出强烈的逃避反应,这些发现助力了电驱鲨装置的逐步开发(Huveneers et al, 2013; McCutcheon et al, 2013)。O’Connell等(2014a、b)研究表明,磁铁和其他威慑技术的驱赶效率具有高度的物种特异性。此外,视觉和听觉刺激的组合已被证实是潜在有效的驱赶鲨鱼的行为控制措施(Popper et al, 1998)。鲨鱼种类多样且行为复杂,操纵一系列行为或感官系统的驱赶剂组合可能更有效。前期研究人员对驱鲨产品的开发多关注在驱鲨效果、价格等方面,随着生态环境保护意识的增强,还需要重视驱鲨技术对海洋生态环境可能产生的不利影响,因此,本研究选取了2种常用的个人佩戴型驱鲨产品-化学驱鲨剂和电驱鲨装置,采用生态模拟方法,测定了相应的驱鲨技术应用对水质和代表性鱼类的应激毒性作用,为未来驱鲨方式的选择提供科学依据。
3.2 不同驱鲨方式对海洋生态环境的影响本研究在相对封闭的水体中分析了使用化学驱鲨剂和电驱鲨装置对水质的影响。结果显示,电驱鲨装置未对养殖用水的温度、盐度、DO、pH和透明度产生影响。而投入化学驱鲨剂后,由于化学驱鲨剂中存在的KBR和KNB等染料快速溶解,水体的透明度迅速降低。此外,水面产生了大量白色泡沫,这是由于驱鲨剂中存在的主要成分十二烷基硫酸钠(SDS)是一种良好的表面活性剂,在充气气悬的作用下,产生的大量气泡。此外,驱鲨剂组的pH显著低于对照组和电脉冲驱鲨设备组,这可能是由于驱鲨剂成分中所含的SDS是一种阴离子表面活性剂,KBR和KNB等染料成分在海水中溶解造成的封闭水体的pH显著变化,结合驱鲨剂使用场景多位于开放水域,化学驱鲨剂在开放水域释放后,未对水体中pH的变化造成太大的影响。虽然SDS是稳定、易获取、价格便宜的化学试剂,在应用中具有很大的应用潜力,但向海洋环境释放大量的任何人工化学品是不可取的。此外,化学驱鲨剂中其他的化学成分,如本驱鲨剂中含有的溴氰菊酯是一种典型的农药类化学试剂,即使剧毒或驱赶性的化学品在开放的水中会被迅速稀释(Baldridge, 1990),其对生态环境的潜在危害也是不容忽视的。
3.3 不同驱鲨方式对海洋生物的毒性作用海洋中存在丰富的海洋生物物种,因此,驱鲨产品的选择除了需要考虑其驱鲨效果外,还需要测定其对海洋中其他生物的毒性作用。鉴于此,本研究选取了3种不同生态位的鱼类作为测试样本,评估了化学驱鲨剂和电驱鲨设备对海洋生物的急性毒性影响。多项研究表明,SDS对水生生物均有不同程度的毒害作用(王平等, 2020),对篮点笛鲷(Lutjanus cyanopterus)为中等毒性物质(施钢等, 2011),可以显著影响斑马鱼(Donio rerio)的抗氧化能力和克氏原螯虾(Procambarus clarkia)的抗氧化功能和酸性磷酸酶活性(李安娜等, 2008; 谭树华等, 2014),且对其他鱼、虾及浮游动物等也具有中等毒性作用(郑琰晶等, 2006)。而溴氰菊酯作为农药类的化学试剂,不仅对鱼、虾和蟹具有急性毒性作用(钟硕良等, 2017; 林岗等, 2011),还会造成组织结构损伤和氧化胁迫等影响(吴楠等, 2015; 杨宗英等2017),甚至造成DNA损伤等遗传毒性(洪宇航等, 2018)。本研究中,化学驱鲨剂实验组的3种鱼在短时间内均出现了急性毒性死亡的现象,其血液中离子浓度等关键指标显著变化,免疫酶活力降低、组织结构遭受破坏,究其原因是化学驱鲨剂中存在的SDS和溴氰菊酯等有毒的化学成分溶解到养殖水体中造成的。与化学驱鲨剂造成的幼鱼急性死亡、组织损伤相比,电子驱鲨设备组的实验鱼苗存活率均达到100%,各关键组织器官也未受到损伤,仅出现了血液生化指标和BUN、ALB等生理生化指标升高的现象,这可能是由于电驱鲨设备开启对鱼群造成的惊扰应激引发的。平慧敏等(1998)研究了不同脉冲幅度和脉冲频率的电脉冲对水库养鱼的刺激作用,结果表明,对于产生电刺激的脉冲主宽度必须>10 ms,脉冲幅度至少在300 V以上。而与大多数海洋生物不同,鲨鱼拥有一个对电压梯度极其敏感的电感系统,这使它们能够探测到低至1 nV/cm范围的电场。本研究所采用的电脉冲驱鲨器脉冲宽度80 μs,电压在80 V左右,可对鲨鱼产生驱逐效果,但对普通的鱼类除了在设备开启瞬间会产生短暂的惊扰刺激外,后续对鱼苗的生理活性并未产生显著影响。由此可见,电子驱鲨设备对海洋生物造成的毒性影响相对较小。
BALDRIDGE H D. Shark repellent: Not yet, may-be never. Military Medicine, 1990, 155: 358-361 DOI:10.1093/milmed/155.8.358 |
BURDEN W D. Development of a shark deterrent. Air Surgeon's Bulletin, 1945, 2: 344-347 |
HART N S, COLLIN S P. Sharks senses and shark repellents. Integrative Zoology, 2015, 10(1): 38-64 DOI:10.1111/1749-4877.12095 |
HONG Y H, HUANG Y. Effects of deltamehrin on DNA damage in hemocytes of Chinese mitten handed crab, Eriocheir sinensis. Fisheries Science, 2018, 37(4): 544-549 [洪宇航, 黄毅. 溴氰菊酯对中华绒螯蟹血细胞DNA的损伤. 水产科学, 2018, 37(4): 544-549] |
HUVENEERS C, ROGERS P J, SEMMENS J M, et al. Effects of an electric field on white sharks: In situ testing of an electric deterrent. PLoS One, 2013, 8(5): e62730 DOI:10.1371/journal.pone.0062730 |
KALMIJN A J. Electric and magnetic field detection in elasmobranch fishes. Science, 1982, 218(4575): 916-918 DOI:10.1126/science.7134985 |
KALMIJN A J. The electric sense of sharks and rays. Journal of Experimental Biology, 1971, 55(2): 371-383 DOI:10.1242/jeb.55.2.371 |
KEMPSTER R M, HART N S, COLLIN S P. Survival of the stillest: Predator avoidance in shark embryos. PLoS One, 2013, 8(1): e52551 DOI:10.1371/journal.pone.0052551 |
LI A N, ZHANG Y M, LI A L, et al. Effect of sodium dodecyl sulfate on antioxidant capability of Brachyclanio rerio. Sichuan Journal of Zoology, 2008, 27(6): 993-996 [李安娜, 张迎梅, 李瑷伶, 等. 十二烷基硫酸钠对斑马鱼抗氧化能力的影响. 四川动物, 2008, 27(6): 993-996] |
LIN G, ZHANG Q, RAO X Z, et al. Acute toxicity of Praziquantel, Mebendazole and Deltamethrin on marbled eel Anguilla marmorata. Marine Fisheries, 2011, 33(4): 467-471 [林岗, 张倩, 饶小珍, 等. 吡喹酮、甲苯咪唑、溴氰菊酯对花鳗鲡的急性毒性. 海洋渔业, 2011, 33(4): 467-471 DOI:10.3969/j.issn.1004-2490.2011.04.016] |
LIU L N, WANG S F, WANG W, et al. Electric pulse shark repellent device. 2020, CN112154980A [刘李娜, 王世锋, 王伟, 等. 一种电脉冲驱鲨器. 2020, CN112154980A]
|
MCCUTCHEON S M, KAJIURA S M. Electrochemical properties of lanthanide metals in relation to their application as shark repellents. Fisheries Research, 2013, 147: 47-54 DOI:10.1016/j.fishres.2013.04.014 |
O'CONNELL C P, ANDREOTTI S, RUTZEN M, et al. The use of permanent magnets to reduce elasmobranch encounter with a simulated beach net.2. The great white shark (Carcharodon carcharias). Ocean and Coastal Management, 2014a, 97: 20-28 DOI:10.1016/j.ocecoaman.2012.11.006 |
O'CONNELL C P, HE P, JOYCE J, et al. Effects of the SMART™ (Selective Magnetic and Repellent-Treated) hook on spiny dogfish catch in a longline experiment in the Gulf of Maine. Ocean and Coastal Management, 2014b, 97: 38-43 DOI:10.1016/j.ocecoaman.2012.08.002 |
PING H M, WU Y H, LIU Q. Observation and analysis of an experiment on the stupor reaction of fish stimulated by pulse electricity. Journal of Yunnan University (Natural Sciences), 1998(S1): 27-28 [平慧敏, 吴永汉, 刘琼. 鱼在脉冲电刺激后产生昏迷反应试验的观察和分析. 云南大学学报(自然科学版), 1998(S1): 27-28] |
POPPER A N, CARLSON T J. Application of sound and other stimuli to control fish behavior. Transactions of the American Fisheries Society, 1998, 127(5): 673-707 DOI:10.1577/1548-8659(1998)127<0673:AOSAOS>2.0.CO;2 |
SHI G, CHEN G, ZHANG J D, et al. Acute toxicity of sodium dodecyl sulfate(SDS) and dodecyl benzene sulfate(DBS) on Lutjanus rivulatus larva. Journal of Anhui Agricultural Sciences, 2011, 39(12): 7238-7240 [施钢, 陈刚, 张健东, 等. 表面活性剂对蓝点笛鲷幼鱼急性毒性研究. 安徽农业科学, 2011, 39(12): 7238-7240 DOI:10.3969/j.issn.0517-6611.2011.12.118] |
STEIN B E, WALLACE M T, STANFORD T R. Brain mechanisms for synthesizing information from different sensory modalities. In: Goldstein E B, ed. Blackwell Handbook of Sensation and Perception. Blackwell Publishing, Malden, 2005, 709–736
|
TAN S H, LI Y F, LIU W H, et al. Effects of sodium dodecyl sulfate on antioxidation function and acid phosphatase activity of Procambarus clarkii. Journal of Ecology and Rural Environment, 2014, 30(3): 392-397 [谭树华, 李玉峰, 刘文海, 等. 十二烷基硫酸钠(SDS)对克氏原螯虾抗氧化功能和酸性磷酸酶活性的影响. 生态与农村环境学报, 2014, 30(3): 392-397 DOI:10.3969/j.issn.1673-4831.2014.03.021] |
WANG P, SHENG J, LEI Y T, et al. Cell membrane instability caused by detergent monomers. Journal of Atomic and Molecular Physics., 2020, 37(4): 527-532 [王平, 盛洁, 雷一腾, 等. 表面活性剂单体引起的细胞膜失稳. 原子与分子物理学报, 2020, 37(4): 527-532] |
WU N, WEI H, SHEN H, et al. The toxic research of deltamethrin on the muscle tissue of the red swamp crayfish (Procambarus clarkia). Journal of Fisheries of China, 2015, 39(9): 1412-1421 [吴楠, 魏华, 沈竑, 等. 溴氰菊酯对克氏原螯虾肌肉组织的毒性研究. 水产学报, 2015, 39(9): 1412-1421] |
YANG Z Y, ZHANG Y L, HU K, et al. Effects of deltamethrin exposure on oxidative stress indexes and histological structure of hepatopancreas in Eriocheir sinensis. Acta Agriculturae Zhejiangensis, 2017, 29(8): 1261-1270 [杨宗英, 张一柳, 胡鲲, 等. 溴氰菊酯对中华绒螯蟹肝胰腺氧化胁迫效应和组织结构的影响. 浙江农业学报, 2017, 29(8): 1261-1270] |
ZHENG Y J, CHEN L, CHEN Y P, et al. acute toxicity of sodium dodecyl sulfate (SDS) on selected aquatic organisms. Journal of Agro-Environment Science, 2006(S2): 496-498 [郑琰晶, 陈琳, 陈燕平, 等. 十二烷基硫酸钠对水生生物的急性毒性影响. 农业环境科学学报, 2006(S2): 496-498] |
ZHONG S L, ZHENG H D, CHEN Y F, et al. The acute toxicity and bioaccumulation of deltamethrin in four species of mariculture organisms. Progess in Fishery Sciences, 2017, 38(6): 139-147 [钟硕良, 郑惠东, 陈宇锋, 等. 溴氰菊酯对4种海水养殖生物的毒性及其积累. 渔业科学进展, 2017, 38(6): 139-147] |
ZLOTKIN E, GRUBER S H. Synthetic surfactants: A new approach to the development of shark repellents. Archives of Toxicology, 1984, 56(1): 55-58 |