2. 中国水产科学研究院黄海水产研究所 山东省海洋渔业生物技术与遗传育种重点实验室 青岛市海水鱼类种子工程与生物技术重点实验室 山东 青岛 266071;
3. 海洋生物学与生物技术功能实验室 山东 青岛 266071;
4. 唐山牧海水产养殖有限公司 河北 唐山 063200
2. Shandong Key Laboratory of Marine Fisheries Biotechnology and Genetic Breeding, Qingdao Key Laboratory of Marine Fish Breeding and Biotechnology, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China;
3. Laboratory for Marine Biology and Biotechnology, Qingdao 266071, China;
4. Tangshan Muhai Aquaculture Co. Ltd., Tangshan 063200, China
红鳍东方鲀(Takifugu rubripes)是我国重要的养殖经济鱼类,属于暖温性、广温性鱼类,其适宜生长水温为14~27 ℃,最适水温为16~23 ℃(马爱军等, 2014)。水温在鱼类生存条件中占有重要位置,水温的变化会影响鱼类的新陈代谢,超出适宜水温会导致鱼类出现应激反应,对鱼类的生长和繁育造成不良影响,甚至会造成死亡(Atkinson et al, 1997; Barton, 2002; Jesus et al, 2013)。红鳍东方鲀主要在我国北方养殖,其越冬过程需要转移到室内,在转移过程中遇到外界刺激会立即出现应激反应,同时,捕捞过程中相互接触会相互攻击,造成一定损失(张迪等, 2017)。室内越冬也需要将海水加热至适宜的水温,增加了养殖成本,因此,选育具有耐低温性状品系的红鳍东方鲀对其产业发展极其重要。由于红鳍东方鲀在中国养殖的起步时间较晚,耐低温遗传选育研究也处于初期阶段,通过研究抗寒相关基因的功能,能够不断完善红鳍东方鲀耐低温的分子机制,为耐低温新品种选育和红鳍东方鲀产业发展提供理论依据。
随着水产养殖业的发展,水产动物温度耐受相关的分子标记筛选和基因的研究在不断推进。在红鳍东方鲀(袁晨浩等, 2022)、大菱鲆(Scophthalmus maximus) (马爱军等, 2011)、牙鲆(Paralichthys olivaceus)(池信才等, 2007)、大黄鱼(Larimichthys crocea)(高国强等, 2010; 陈小明等, 2017; 穆方申等, 2017)、凡纳滨对虾(Litopenaeus vannamei)(胡志国等, 2016)中都筛选出了与温度耐受相关的分子标记。常玉梅等(2012)克隆了鲤(Cyprinus carpio)脑组织中stearoyl-CoA desaturase (CcSCD)基因的全长cDNA序列,并预测其编码蛋白功能与鱼类的低温适应性有关,但该基因在鱼类抗寒中的分子作用机制目前仍不清楚。李伟业等(2021)通过荧光定量PCR技术(qRT-PCR)证实了金属硫蛋白基因MT、水通道蛋白基因AQP1、HSP60蛋白基因TCP1在大黄鱼低温适应过程中发挥重要作用,是潜在的研究大黄鱼耐寒机制的候选基因。刘晓菲等(2019)对大菱鲆耐高温QTL (quantitative trait locus)定位获得的4个候选基因p53、UBE2H、ZNF469和MAGI2进行RT-PCR检测,发现4个基因在高温胁迫中均呈现积极响应。温度耐受相关的分子标记筛选和基因的研究为耐温分子机制和选育发展奠定了基础,也为其他水产动物耐温选育提供了借鉴依据。鱼类低温胁迫相关基因的功能和控制机制的研究也在不断助推水产动物耐低温选育的发展。大黄鱼在急性低温胁迫下糖皮质激素受体基因表达水平升高,介导糖皮质激素的生理功能,有88个基因的转录始终受大脑中糖皮质激素的调节,能够抑制炎症、提高能量生产效率以及去除不必要或故障的细胞成分,以在应激反应期间保存能量和维持营养供应(Liu et al, 2021; Juszczak et al, 2018)。Cheng等(2018)在饲料中添加牛磺酸,发现其能提高暗纹东方鲀(Takifugu obscurus)在低温胁迫下的生长性能,并能增强抗氧化能力和非特异性免疫反应,降低低温应激诱导的氧化应激、细胞毒性和细胞凋亡。Qiang等(2013)研究发现,低温胁迫会对尼罗罗非鱼(Oreochromis niloticus)幼鱼红细胞、白细胞及血红蛋白浓度产生显著影响。
本课题组在红鳍东方鲀耐低温性状改良工作中,通过QTL定位获得多个与耐低温相关的单核苷酸多态性(SNP)位点,并通过比对全基因组信息,筛选出6个候选基因(袁晨浩, 2021)。本实验以红鳍东方鲀为研究对象,利用qRT-PCR技术对6个候选基因不同温度下在不同组织中的表达进行分析,初步了解6个候选基因在红鳍东方鲀应对低温胁迫时发挥的作用,以期为红鳍东方鲀低温应答的分子机制提供理论依据。
1 材料与方法 1.1 实验材料实验所用红鳍东方鲀来自课题组在唐山牧海水产养殖有限公司建立的同一家系(全同胞)、体表无损伤、活跃的8月龄鱼,体重为(106.6±23.6) g,体长为(15.00±0.05) cm。
1.2 实验设计实验设置3组恒温循环水养殖系统,每组系统有3个实验桶(1000 L)。挑选270尾鱼,平均放到9个实验桶中,实验开始前18 ℃暂养1周。设置3个温度梯度(18 ℃、13 ℃和8 ℃),18 ℃为对照组,13 ℃和8 ℃为低温组,每个温度梯度设3个平行,每个平行30尾幼鱼。实验开始后分别将2个低温组系统水温在12 h内调节至8 ℃和13 ℃,对照组系统水温保持在18 ℃,在自然光条件下恒定水温养殖4周,溶解氧保持在8 mg/L以上。分别在实验开始时、14 d、28 d3个时间点取样,每桶取3尾鱼,在200 mg/L的MS-222溶液中快速麻醉,在冰上迅速完成解剖,每尾鱼取肝脏、心脏和肾脏组织,立即放入冻存管中,置于液氮中速冻,之后放入–80 ℃中保存。
1.3 RNA提取和cDNA合成利用RNAsimple Total RNA试剂盒提取样品中的总RNA,并使用1%琼脂糖凝胶电泳检验RNA纯度。利用FastKing RT试剂盒进行cDNA第一条链的合成,放入–20 ℃供后续实验使用。
1.4 引物合成根据6个候选基因的GeneID,在NCBI上找到对应序列的ORF区,利用Primer 5.0软件设计引物,合成后进行PCR检验引物的有效性,qRT-PCR标准曲线检验引物效率。引物由生工生物工程(上海)有限公司合成。β-actin为内参引物。引物序列见表 1。
|
|
表 1 6个候选基因qRT-PCR引物序列 Tab.1 Primers of six candidate genes in qRT-PCR |
以反转录得到的cDNA为模板,使用TOROGreen qPCR Master Mix试剂盒(QST-100)在Applied Biosystems StepOnePlus PCR仪上进行qRT-PCR。反应体系为20 μL:Master Mix 10.0 μL,无RNase水6.4 μL,上下游引物各0.8 μL,模板2.0 μL。反应程序:95 ℃预变性60 s;95 ℃变性10 s;60 ℃退火30 s,循环40次。
1.6 数据分析qRT-PCR后,导出数据分别获得目的基因和内参基因的Ct值并计算平均值。使用ΔΔCt法计算平均表达量和方差。采用SPSS 18.0软件进行单因素方差分析(one-way ANOVA),检验各组平均表达量之间差异是否显著(P < 0.05表示存在差异显著)。用GraphPad Prism 6软件作图。
2 结果 2.1 pde10a基因在不同温度下的表达变化利用qRT-PCR检测不同温度下pde10a基因在肝脏、心脏和肾脏中表达量的变化,结果如图 1所示。在肝脏中,低温组中pde10a的表达量呈先升高后下降的趋势,且同一温度在不同时间的表达量差异显著(P < 0.05)。8 ℃组表达量显著高于13 ℃组和对照组(P < 0.05),13 ℃组的表达量显著高于对照组(P < 0.05)。在心脏中,低温组pde10a的表达量均呈先升高后下降的趋势,8 ℃组各时间点的表达量差异显著(P < 0.05),且表达量均显著高于13 ℃组和对照组(P < 0.05)。在肾脏中,低温组pde10a的表达量均呈先升高后下降的趋势,13 ℃组各时间点的表达量差异显著(P < 0.05)。14 d时,低温组的表达量均显著高于对照组(P < 0.05)。28 d时,8 ℃组的表达量显著高于13 ℃组和对照组(P < 0.05)。

|
图 1 低温胁迫下红鳍东方鲀肝脏、心脏和肾脏中pde10a基因在各时间点的表达量变化 Fig.1 Changes of pde10a gene expression in liver, heart and kidney of turbot under low temperature stress at different time points 不同字母代表组间差异显著(P < 0.05)。下同。 Different letters represent significant differences between groups (P < 0.05). The same as below. |
利用qRT-PCR检测不同温度下tacc2基因在肝脏、心脏、肾脏中表达量的变化,结果见图 2。在肝脏中,低温组tacc2基因的表达量呈先下降再趋于稳定的趋势,同一温度在不同时间的表达量差异显著(P < 0.05)。对照组表达量显著高于低温组(P < 0.05),13 ℃组的表达量显著高于8 ℃组(P < 0.05)。在心脏中,tacc2基因的表达量无明显变化趋势,14 d时,8 ℃组的表达量显著高于13 ℃组和对照组(P < 0.05);28 d时,13 ℃组的表达量显著高于8 ℃组和对照组(P < 0.05)。在肾脏中,低温组tacc2基因的表达量呈先升高再趋于稳定的趋势,且低温组的表达量均显著高于对照组(P < 0.05)。

|
图 2 低温胁迫下红鳍东方鲀肝脏、心脏和肾脏中tacc2基因在各时间点的表达量变化 Fig.2 Changes of tacc2 gene expression in liver, heart and kidney of turbot under low temperature stress at different time points |
利用qRT-PCR检测不同温度下unc5b基因在肝脏、心脏和肾脏中表达量的变化,结果如图 3所示。unc5b主要在肾脏中高表达,肝脏和心脏中表达量较低。在肝脏中,unc5b基因的表达量无明显变化趋势,13 ℃组的表达量显著高于8 ℃组和对照组(P < 0.05),对照组的表达量显著高于8 ℃组(P < 0.05)。在心脏中,低温组unc5b基因的表达量呈现缓慢上升趋势,8 ℃组表达量显著高于13 ℃组和对照组(P < 0.05)。在肾脏中,unc5b基因的表达量无明显变化趋势,14 d时,低温组的表达量显著高于对照组(P < 0.05);28 d时,8 ℃组的表达量显著高于13 ℃组和对照组(P < 0.05)。
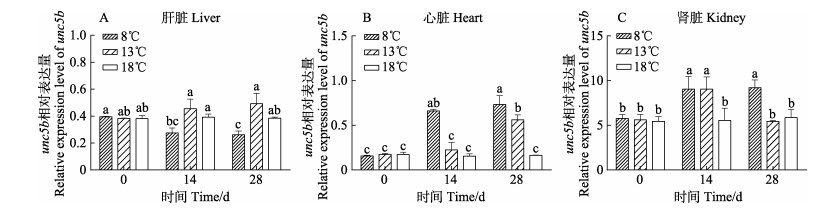
|
图 3 低温胁迫下红鳍东方鲀肝脏、心脏和肾脏中unc5b基因在各时间点的表达量变化 Fig.3 Changes of unc5b gene expression in liver, heart and kidney of turbot under low temperature stress at different time points |
利用qRT-PCR检测不同温度下exoc4基因在肝脏、心脏和肾脏中表达量的变化,结果见图 4。在肝脏中,低温组exoc4基因的表达量均呈先下降再趋于稳定的趋势,对照组表达量显著高于低温组(P < 0.05)。
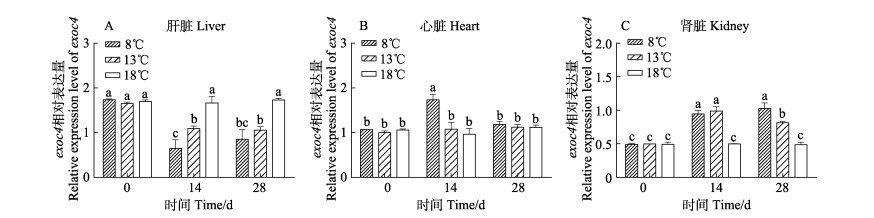
|
图 4 低温胁迫下红鳍东方鲀肝脏、心脏和肾脏中exoc4基因在各时间点的表达量变化 Fig.4 Changes of exoc4 gene expression in liver, heart and kidney of turbot under low temperature stress at different time points |
在心脏中,8 ℃组exoc4基因的表达量呈先上升后下降的趋势,14 d时,8 ℃组表达量显著高于13 ℃组和对照组(P < 0.05)。在肾脏中,对照组exoc4基因的表达量均呈上升趋势。14 d时,低温组表达量均显著高于对照组(P < 0.05);14 d时,8 ℃组表达量显著高于13 ℃组和对照组(P < 0.05),13 ℃组表达量显著高于对照组(P < 0.05)。
2.5 arhgap44a基因在不同温度下的表达变化利用qRT-PCR检测不同温度下arhgap44a基因在肝脏、心脏和肾脏中表达量的变化,结果如图 5所示。在肝脏中,低温组arhgap44a基因的表达量均呈上升趋势,且同一温度在不同时间的表达量差异显著(P < 0.05),8 ℃组的表达量显著高于13 ℃组和对照组(P < 0.05),13 ℃组表达量显著高于对照组(P < 0.05)。在心脏中,仅8 ℃组arhgap44a基因的表达量呈先上升后下降的趋势,14 d时,8 ℃组表达量显著高于13 ℃组和对照组(P < 0.05)。在肾脏中,各温度表达量无明显差异。

|
图 5 低温胁迫下红鳍东方鲀肝脏、心脏和肾脏中arhgap44a基因在各时间点的表达量变化 Fig.5 Changes of arhgap44a gene expression in liver, heart and kidney of turbot under low temperature stress at different time points |
利用qRT-PCR检测不同温度下fsip1基因在肝脏、心脏和肾脏中表达量的变化,结果如图 6所示。在肝脏中,低温组fsip1基因的表达量呈现下降趋势,14 d时,13 ℃组和对照组的表达量显著高于8 ℃组(P < 0.05);28 d时,对照组的表达量显著高于低温组(P < 0.05)。在心脏和肾脏中,低温组fsip1基因的表达量均呈先上升后下降的趋势,且同一温度在不同时间的表达量差异显著(P < 0.05),各时间点8 ℃组表达量显著高于13 ℃组和对照组(P < 0.05)。
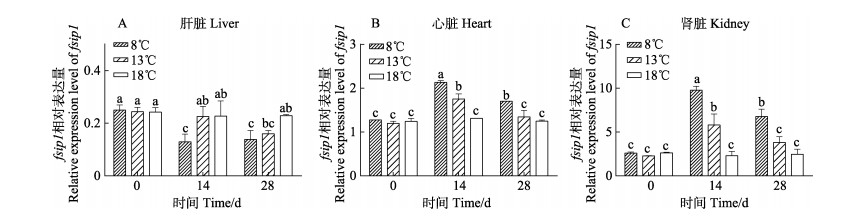
|
图 6 低温胁迫下红鳍东方鲀肝脏、心脏和肾脏中fsip1基因在各时间点的表达量变化 Fig.6 Changes of fsip1 gene expression in liver, heart and kidney of turbot under low temperature stress at different time points |
良好的水环境是鱼类生存的必要条件,适宜的水温是其中一个极为重要的因素。低温胁迫会引起鱼的各种应激反应,也会影响鱼体内的抗逆性和抗感染等生物分子活性、免疫应答、抗氧化和脂质代谢等能力(潘霞等, 2020; Wen et al, 2021)。本研究对从耐低温相关的QTL中筛选出了的6个与耐低温相关的基因进行了低温胁迫下的表达分析,结果显示,6个基因在低温胁迫下均在组织中呈现不同程度的表达,并呈现一定的表达规律,表明这些基因在红鳍东方鲀低温适应中发挥了潜在的调控功能。
3.1 pde10a基因在低温胁迫下的表达分析本研究中,随着温度和时间的变化,pde10a在肝脏、心脏和肾脏低温组中的表达均呈先升高后降低的趋势。磷酸二酯酶10A (phosphodiesterase 10A, PDE10A)能够参与水解第二信使环核苷酸一磷酸腺苷(cAMP)和鸟苷酸(cGMP) (Gross-Langenhoff et al, 2006; Jger et al, 2012),而第二信使具有广泛的参与调节细胞增殖、分化、迁移和凋亡等功能(闫军浩等, 2015)。同样,在鱼类研究中,PDE活性与cAMP、Ca2+、细胞钙调蛋白(cellular calmodulin, CaM)之间存在明显的相关性,细胞Ca2+浓度的增加导致CaM的增加,而CaM反过来刺激PDE活性,从而影响cAMP的降解(Mukhopadhyay et al, 1997)。据此可以推测,低温胁迫在前期导致鱼体内pde10a的表达量不断升高,抑制了cAMP和cGMP的生物传导和机体能量的消耗,造成鱼的行动和反应迟缓。随着时间的增加,鱼体在对低温环境不断适应后通过增加能量消耗来提升自己在低温下的生存能力,所以pde10a表达量开始降低。pde10a在鱼类中表达变化的调控机制还没有报道,但Hankir等(2016)研究发现,通过抑制剂MP-10抑制PDE10A的表达会增加小鼠和人类机体能量的消耗,因此,pde10a在鱼类中的表达变化可能也是通过某种抑制剂的表达来实现的。目前,鱼类低温胁迫pde10a基因的相关研究还很少,通过找出调控pde10a表达的信号通路和关键因子,控制pde10a基因的表达,会在很大程度上提升红鳍东方鲀在低温环境下的生存能力。
3.2 unc5b基因在低温胁迫下的表达分析UNC5同源蛋白家族共有UNC5A~UNC5D四种蛋白,是神经导向因子Netrin-1的受体,在神经发育、细胞运动和凋亡以及血管生成中发挥重要作用(Arakawah, 2004; Larrivee et al, 2007; 张佳润等, 2017)。结果显示,unc5b基因主要在肾脏中呈现高表达。研究表明,Netrin-1可通过作用于UNC5B减少肾缺血再灌注损伤及其相关的肾脏炎症(沈丕杰等, 2015)。因此,在本研究中,鱼体在低温胁迫下可能出现了炎症反应,为了减轻炎症带来的损伤,提高了unc5b在肾脏组织中的表达量。另外,28 d时,8 ℃组中unc5b基因仍保持高表达,13 ℃组中的表达量显著回落,可能的原因是鱼体在8 ℃环境下肾脏会产生持续的炎症反应,13 ℃下鱼体经过长时间的适应,炎症反应会逐渐消失。在本实验各时期,心脏和肝脏中unc5b基因的表达量较低,其中,在心脏中表现出低温诱导表达的现象,这可能是低温对红鳍东方鲀心脏血管产生了损伤,为了促进了心脏血管生成而提高unc5b基因在心脏中的表达。unc5b基因在红鳍东方鲀体内表达变化的作用机制可能与哺乳动物类似,由神经导向因子Netrin-1在接受低温信号刺激后控制的,但由于unc5b在鱼类的研究中还未见报道,在红鳍东方鲀各组织中的作用机制还需进一步研究验证。
3.3 exoc4基因在低温胁迫下的表达分析本研究结果显示,低温组肝脏中exoc4的表达均呈先下降再趋于稳定的趋势。蛋白质组学研究证实,所有的EXOC蛋白均在人类和小鼠血小板中表达,EXOC4的缺失可能会促进止血并加速动脉血栓形成(Walsh et al, 2021)。Sharda等(2020)的研究也证实,EXOC4的缺失增强了凝血酶诱导的血管性血友病因子从Weibel-Palade小体(WPB)中的释放。我们推测,低温胁迫会造成红鳍东方鲀鱼体和肝脏出血,而鱼类肝脏能够合成凝血酶原、调节凝血因子合成(钱云霞, 2003),因此,为了促进止血,肝脏通过合成凝血因子来抑制exoc4的表达。在8 ℃组前期心脏中exoc4的高表达可能是因为造成了心脏损伤而导致,而13 ℃组的表达量相对对照组无明显变化,可能是该温度下不足以对心脏产生明显负面影响。肾脏作为鱼类的泌尿器官(温龙岚等, 2007),当血糖中葡萄糖升高,会促进肾脏排出葡萄糖,增加尿量。同时,exoc4的表达可能会影响葡萄糖刺激的胰岛素释放以及胰岛素参与诱导的细胞葡萄糖摄取(Laramie et al, 2008)。据此我们推测,红鳍东方鲀在低温环境下会通过减少细胞葡萄糖的摄取来减少尿量,从而减少鱼体热量损失,提升红鳍东方鲀在低温下的生存能力,因此,exoc4在低温下的肾脏中会呈现高表达。
3.4 tacc2、arhgap44a和fsip1基因在低温胁迫下的表达分析我们在tacc2、arhgap44a和fsip1相关研究中发现,这3种基因都与细胞的增殖和凋亡相关。TACC2的RNA干扰可显著降低MCF-7和MDA-MB-453乳腺癌细胞系的增殖活性(Onodera et al, 2016)。ARHGAPs通过RHO蛋白失活抑制细胞的增殖和迁移(陶丽等, 2018)。纤维鞘相互作用蛋白1 (fibrous sheath interacting protein 1, FSIP1)在肿瘤的发生和进展中起着至关重要的作用(Gamallat et al, 2021),FSIP1能够促进乳腺癌细胞增殖和存活(Yan et al, 2019)。因此,tacc2和fsip1基因能够促进细胞的增殖,而arhgap44a基因抑制细胞的增殖。本研究结果显示,在心脏和肾脏中,tacc2和fsip1基因在低温胁迫后的表达均显著升高,二者表达规律相似,可能是低温胁迫会造成心脏和肾脏的损伤,引起细胞凋亡,为了在低温下维持正常的细胞和组织功能,需要促进细胞增殖来应对细胞凋亡的产生,因此,这2个基因会在低温下的心脏和肾脏中呈现高表达。随着时间的延长,2个基因都呈下降趋势,这可能是鱼体逐渐适应低温环境后凋亡现象减轻的结果。在肝脏中,2个基因在低温胁迫后均呈下降趋势,同时,arhgap44a基因呈相反趋势,这也与3个基因的不同功能相吻合,说明3个基因在肝脏组织中并不发挥促进细胞增殖的作用,也从侧面反映低温胁迫可能不会造成肝脏细胞强烈的凋亡现象。由于这3个基因在鱼类中鲜有研究,其中,arhgap44a在哺乳动物中都尚未有报道,因此,3个基因在低温应答中具体的调控方式还需要进一步研究。
本研究通过qRT-PCR检测了红鳍东方鲀肝脏、心脏和肾脏中6个与低温相关的基因。结果显示,6个基因在各组织中均有不同程度的表达,说明这6个基因都在红鳍东方鲀耐低温过程中发挥着重要作用。pde10a可能与红鳍东方鲀在低温中耗能的相关通路存在密切联系,unc5b可能会在低温下抑制红鳍东方鲀组织炎症和损伤的发生,exoc4可调节低温中红鳍东方鲀鱼体代谢,tacc2、arhgap44a、fsip1与红鳍东方鲀耐低温机制中细胞的增殖与凋亡密切相关。未来在红鳍东方鲀耐低温筛选和新品种选育中,这6个基因可以作为响应低温胁迫的潜在标志物,用来评价选育子代的耐低温能力。
ARAKAWA H. Netrin-1 and its receptors in tumorigenesis. Nature Reviews Cancer, 2004, 4(12): 978-987 DOI:10.1038/nrc1504 |
ATKINSON D, SIBLY R M. Why are organisms usually bigger in colder environments? Making sense of a life history puzzle. Trends in Ecology and Evolution, 1997, 12(6): 235-239 DOI:10.1016/S0169-5347(97)01058-6 |
BARTON B A. Stress in fishes: A diversity of responses with particular reference to changes in circulating corticosteroids. Integrative and Comparative Biology, 2002, 42(3): 517-525 DOI:10.1093/icb/42.3.517 |
CHANG Y M, XU L H, LI S G, et al. Isolation and characterization of full length cDNA sequence of a stearoyl- CoA desaturase gene responding to low temperature from common carp (Cyprinus carpio). Chinese Journal of Fisheries, 2012, 25(3): 1-6 [常玉梅, 徐丽华, 李世国, 等. 鲤耐低温候选基因CcSCD全长cDNA的克隆及功能预测. 水产学杂志, 2012, 25(3): 1-6] |
CHEN X M, LI J K, WANG Z Y, et al. Genome-wide association study of thermal tolerance in large yellow croaker Larimichthys crocea based on SLAF-seq technology. Acta Hydrobiologica Sinica, 2017, 41(4): 735-740 [陈小明, 李佳凯, 王志勇, 等. 基于简化基因组测序的大黄鱼耐高温性状全基因组关联分析. 水生生物学报, 2017, 41(4): 735-740] |
CHENG C H, GUO Z X, WANG A L. The protective effects of taurine on oxidative stress, cytoplasmic free-Ca2+ and apoptosis of pufferfish (Takifugu obscurus) under low temperature stress. Fish and Shellfish Immunology, 2018, 77: 457-464 DOI:10.1016/j.fsi.2018.04.022 |
CHI X C, WANG J, SONG S Y, et al. Study on breeding selection of thermal tolerance flounder (Paralichthys olivaceus) by a molecular maker. Journal of Xiamen University (Natural Science), 2007, 46(5): 693-696 [池信才, 王军, 宋思扬, 等. 耐温牙鲆分子标记辅助选育研究. 厦门大学学报(自然科学版), 2007, 46(5): 693-696] |
GAMALLAT Y, FANG X, MAI H, et al. Bi-allelic mutation in Fsip1 impairs acrosome vesicle formation and attenuates flagellogenesis in mice. Redox Biology, 2021, 43: 101969 DOI:10.1016/j.redox.2021.101969 |
GAO G Q, CHANG Y M, HAN Q X, et al. Screening of microsatellite markers associated with cold tolerance of large yellow croaker (Pseudosciaena crocea R. ). Hereditas (Beijing), 2010, 32(3): 248-253 [高国强, 常玉梅, 韩启霞, 等. 大黄鱼耐低温性状相关微卫星标记的筛选. 遗传, 2010, 32(3): 248-253] |
GROSS-LANGENHOFF M, HOFBAUER K, WEBER J, et al. cAMP is a ligand for the tandem GAF domain of human phosphodiesterase 10 and cGMP for the tandem GAF domain of phosphodiesterase 11. Journal of Biological Chemistry, 2006, 281(5): 2841-2846 DOI:10.1074/jbc.M511468200 |
HANKIR M K, KRANZ M, GNAD T, et al. A novel thermoregulatory role for PDE10A in mouse and human adipocytes. EMBO Molecular Medicine, 2016, 8(7): 796-812 DOI:10.15252/emmm.201506085 |
HU Z G, LIU J Y, YUAN R P, et al. Analysis of combining ability of survival of imported Litopenaeus vannamei populations under temperature and salinity stress. Marine Sciences, 2016, 40(1): 25-31 [胡志国, 刘建勇, 袁瑞鹏, 等. 3个凡纳滨对虾引进群体对温度和盐度耐受力的配合力分析. 海洋科学, 2016, 40(1): 25-31] |
JESUS T F, INACIO A, COELHO M M. Different levels of hsp70 and hsc70 mRNA expression in Iberian fish exposed to distinct river conditions. Genetics and Molecular Biology, 2013, 36(1): 61-69 DOI:10.1590/S1415-47572013000100009 |
JGER R, RUSSWURM C, SCHWEDE F, et al. Activation of PDE10 and PDE11 phosphodiesterases. Journal of Biological Chemistry, 2012, 287(2): 1210-1219 DOI:10.1074/jbc.M111.263806 |
JUSZCZAK G R, STANKIEWICZ A M. Glucocorticoids, genes and brain function. Progress in Neuro-Psychopharmacology and Biological Psychiatry, 2018, 82: 136-168 DOI:10.1016/j.pnpbp.2017.11.020 |
LARAMIE J M, WILK J B, WILLIAMSON S L, et al. Polymorphisms near EXOC4 and LRGUK on chromosome 7q32 are associated with Type 2 diabetes and fasting glucose; the NHLBI Family Heart Study. BMC Medical Genetics, 2008, 9: 46 |
LARRIVEE B, FREITAS C, TROMBE M, et al. Activation of the UNC5B receptor by Netrin-1 inhibits sprouting angiogenesis. Genes and Development, 2007, 21(19): 2433-2447 DOI:10.1101/gad.437807 |
LI W Y, LUO H Z, YIN X L, et al. Effects of low temperature stress on expression of MT, AQP1, and TCP1 genes in low temperature-resistant and non-low temperature-resistant strains of large yellow croaker Larimichthys crocea. Journal of Dalian Ocean University, 2021, 36(1): 38-43 [李伟业, 罗海忠, 殷小龙, 等. 低温胁迫对耐低温和非耐低温品系大黄鱼MT、AQP1、TCP1基因表达的影响. 大连海洋大学学报, 2021, 36(1): 38-43] |
LIU C, DING J, GAO X M, et al. Effects of acute low temperature stress on the hormones and gene expression of glucocorticoid receptor of large yellow croaker Larimichthys crocea. Journal of Thermal Biology, 2021, 99: 103018 DOI:10.1016/j.jtherbio.2021.103018 |
LIU X F, MA A J, HUANG Z H, et al. Expression characteristics analysis of major QTL candidate genes in response to high temperature stress in turbot (Scophthalmus maximus). Journal of Fisheries of China, 2019, 43(6): 1407-1415 [刘晓菲, 马爱军, 黄智慧, 等. 大菱鲆高温胁迫应答主效QTL候选基因的表达特性分析. 水产学报, 2019, 43(6): 1407-1415] |
MA A J, LI W Y, WANG X A, et al. Research progress and outlook of Takifugu rubripes culture techniques. Marine Sciences, 2014, 38(2): 116-121 [马爱军, 李伟业, 王新安, 等. 红鳍东方鲀养殖技术研究现状及展望. 海洋科学, 2014, 38(2): 116-121] |
MA A J, XU K, HUANG Z H, et al. Screening of microsatellite molecular marker associated with heat-resistance of turbot (Scophthalmus maximus L.). Advances in Marine Science, 2011, 29(3): 370-378 [马爱军, 许可, 黄智慧, 等. 大菱鲆与耐高温性状相关的微卫星标记筛选. 海洋科学进展, 2011, 29(3): 370-378] |
MU F S, MIAO L, LI M Y, et al. Screening of microsatellite markers associated with cold tolerance of large yellow croaker (Pseudosciaena crocea). Journal of Biology, 2017, 34(1): 34-38 [穆方申, 苗亮, 李明云, 等. 微卫星技术筛选大黄鱼耐低温标记. 生物学杂志, 2017, 34(1): 34-38] |
MUKHOPADHYAY B, CHATTERIEE A, BHATTACHARYA S, et al. Intracellular events in response to GnRH causing gonadotropin release from pituitary cells of a channid fish, Channa punctatus (Bloch). Comparative Biochemistry and Physiology Part C Toxicology and Pharmacology, 1997, 118(2): 129-136 |
ONODERA Y, TAKAGI K, MIKI Y, et al. TACC2 (transforming acidic coiled-coil protein 2) in breast carcinoma as a potent prognostic predictor associated with cell proliferation. Cancer Medicine, 2016, 5(8): 1973-1982 |
PAN X, XU Y J, NING Y, et al. Effects of temperature stress on genes transcription and expression in juvenile Hippocampus kuda Bleeker. Journal of Nuclear Agricultural Sciences, 2020, 34(7): 1421-1431 [潘霞, 徐永健, 宁燕, 等. 温度胁迫对幼体大海马基因转录表达的影响. 核农学报, 2020, 34(7): 1421-1431] |
QIAN Y X. Nutritional effects of vitamin K on fish. Reservoir Fisheries, 2003, 23(6): 58-59 [钱云霞. 维生素K对鱼类的营养作用. 水利渔业, 2003, 23(6): 58-59] |
QIANG J, YANG H, WANG H, et al. Interacting effects of water temperature and dietary protein level on hematological parameters in Nile tilapia juveniles, Oreochromis niloticus (L.) and mortality under Streptococcus iniae infection. Fish and Shellfish Immunology, 2013, 34(1): 8-16 |
SHARDA A V, BARR A M, HARRISON J A, et al. VWF maturation and release are controlled by 2 regulators of Weibel-Palade body biogenesis: Exocyst and BLOC-2. Blood, 2020, 136(24): 2824-2837 |
SHEN P J, YAN R L, WANG C M, et al. Role of Netrin-1 in inflammation-based diseases. Progress in Modern Biomedicine, 2015(3): 551–553, 568 [沈丕杰, 颜荣林, 王长明, 等. Netrin-1在炎症相关疾病中的作用. 现代生物医学进展, 2015(3): 551–553, 568] |
TAO L, ZHU Y J, GU Y, et al. Research progress of the relationship between ARHGAPs and the invasion and metastasis of colorectal cancer. Journal of Modern Oncology, 2018, 26(9): 1450-1454 [陶丽, 朱莹杰, 顾缨, 等. ARHGAPs分子与结直肠癌侵袭及转移关系的研究进展. 现代肿瘤医学, 2018, 26(9): 1450-1454] |
WALSH T G, YONG L, WILLIAMS C M, et al. Loss of the exocyst complex component EXOC3 promotes hemostasis and accelerates arterial thrombosis. Blood Advances, 2021, 5(3): 674-686 |
WEN L L, WANG Z J. Preliminary study on organic fishxs urinary system. Journal of Zunyi Normal University, 2007, 9(2): 61-65 [温龙岚, 王志坚. 鱼类泌尿系统组织学研究概况. 遵义师范学院学报, 2007, 9(2): 61-65] |
WEN X, CHU P, XU J J, et al. Combined effects of low temperature and salinity on the immune response, antioxidant capacity and lipid metabolism in the pufferfish (Takifugu fasciatus). Aquaculture, 2021, 531: 735866 |
YAN J H, SHENG Q C, WANG Z. Research progresses of phosphodiesterase 10A. Journal of Shanghai Jiaotong University (Medical Science), 2015, 35(12): 1904-1910 [闫军浩, 沈倩诚, 王争. 磷酸二酯酶10A及其研究进展. 上海交通大学学报(医学版), 2015, 35(12): 1904-1910] |
YAN M S, WANG J S, REN Y L, et al. Over-expression of FSIP1 promotes breast cancer progression and confers resistance to docetaxel via MRP1 stabilization. Cell Death and Disease, 2019, 10(3): 204 |
YUAN C H, LIU Z F, MA A J. Screening and identification of microsatellite markers related to low temperature tolerance in Takifugu rubripes. Marine Sciences, 2022, 46(2): 97-104 [袁晨浩, 刘志峰, 马爱军. 红鳍东方鲀(Takifugu rubripes)耐低温相关微卫星标记的初步筛选. 海洋科学, 2022, 46(2): 97-104] |
YUAN C H. Screening of low temperature tolerance markers and transcriptome analysis of Takifugu rubripes. Masterxs Thesis of Zhejiang Ocean University, 2021 [袁晨浩. 红鳍东方鲀耐低温标记筛选及转录组分析. 浙江海洋大学硕士研究生学位论文, 2021]
|
ZHANG D, YANG Z Y, ZHANG Y L. Development status and countermeasures of Chinese puffer fish culture industry. Scientific Fish Farming, 2017(12): 1-3 [张迪, 杨正勇, 张英丽. 中国河鲀养殖产业发展现状与发展对策. 科学养鱼, 2017(12): 1-3] |
ZHANG J R, KONG C Z, GAO Z P. The research of carcinoma biological function of UNC5B. Journal of Modern Oncology, 2017, 25(18): 3023-3026 [张佳润, 孔垂泽, 高植鹏. UNC5B癌生物学功能的研究进展. 现代肿瘤医学, 2017, 25(18): 3023-3026] |



