2. 中国水产科学研究院黄海水产研究所 山东 青岛 266071;
3. 崂山实验室 山东 青岛 266237
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China;
3. Laoshan Laboratory, Qingdao 266237, China
随着水产养殖业向高效、节能、绿色方向发展,循环水养殖模式日益受到研究者和从业者的关注。循环水养殖系统(recirculating aquaculture system, RAS)主要由生物养殖和水质净化两部分组成,养殖用水经过水质净化后循环到养殖池重复利用,不仅可以降低水资源的消耗、减少水产养殖的污染物排放,还可以实现水质的精准化和智能化调控、有效提高养殖密度,从而提升水产养殖的经济效益,降低其环境风险(Verdegem et al, 2006; Zohar et al, 2005)。在水产养殖过程中,饲料中的氮通过饵料残留、养殖生物排泄等途径进入水体,并在微生物的作用下进行形态转化(Stewart et al, 2006)。由于游离氨和亚硝酸盐对养殖生物具有很强的毒性(Schuler et al, 2010; 樊海平等, 2018),其在养殖水体中的浓度水平需要得到严格控制。因此,有效去除氨氮(NH4+-N)和亚硝酸氮(NO2–-N)成为RAS水质净化模块的必备功能。
相较于物理和化学处理方法,基于微生物硝化作用的生物处理法可以将NH4+-N和NO2–-N转化为低毒性的硝酸氮(NO3–-N),具有处理效果好、运行成本低、无二次污染等优点,已经被用于生活污水、工业废水、农业废水、地下水等多种类型水体的净化处理(Kuhn et al, 2010)。与基于微生物悬浮生长的活性污泥法相比,基于微生物附着生长的生物膜法具有运行简单、易于维护管理、抗冲击负荷能力强、动力消耗少等特点(刘晃等, 2008),更适用于污染物负荷较低且波动较大的循环水处理。迄今为止,国内外研究者已经开发出了多种类型的生物膜工艺,如固定床生物膜反应器(fixed-bed biofilm reactor, FBBR)、移动床生物膜反应器(moving-bed biofilm reactor, MBBR)、流化床生物膜反应器、生物膜转盘、膜曝气生物膜反应器和电化学生物膜反应器等(Crab et al, 2007)。
FBBR (如普通生物滤池、高负荷生物滤池、曝气生物滤池等)在养殖水体NH4+-N和NO2–-N污染控制中已经得到了较为广泛的研究和应用。王光玉等(2009)通过FBBR连续运行可以将进水NH4+-N浓度控制在0.6 mg/L以下,NH4+-N去除率接近100%。李倩等(2017)将FBBR接入罗氏沼虾RAS中,经过34 d自然挂膜启动后,使得养殖池中的NH4+-N和NO2–-N始终保持在较低水平。张健龙等(2017)探究了凡纳滨对虾(Litopenaeus vannamei)循环水养殖塘FBBR微生物的多样性,发现FBBR各部位微生物物种多样性丰富,且微生态系统稳定,可有效维持RAS水质。近些年来,MBBR因其不易堵塞、无需反冲、比表面积大等特点逐渐成为循环水养殖系统水质净化领域的研究热点。赵越等(2018)将MBBR引入到大西洋鲑(Salmo salar) RAS中,并考察了MBBR的最佳池体尺寸、填料填充率、曝气量等重要参数。目前,关于RAS中FBBR和MBRR的对比研究仍然较为有限,而且对于二者在循环水处理中表现的优劣尚无定论(Greiner et al, 1998; Guerdat et al, 2010; Suhr et al, 2010; Pedersen et al, 2015)。Fernandes等(2017)研究表明,虽然FBBR和MBBR都可以将虹鳟(Oncorhynchus mykiss) RAS水体中的NH4+-N和NO2–-N浓度控制在较低水平,但MBBR处理的水体中NH4+-N和NO2–-N浓度明显高于FBBR。Pulkkinen等(2019)将二级串联FBBR和二级串联MBBR用于虹鳟RAS的循环水净化,结果显示,经过2种反应器处理后的水体中NH4+-N浓度无明显差别,但前者处理的水体中NO2–-N浓度高于后者;二级串联MBBR的硝化速率高于二级串联FBBR。Pedersen等(2015)考察了并联于虹鳟RAS中的FBBR和MBBR的水质净化性能,结果显示,FBBR的NH4+-N表面比去除速率明显大于MBBR;FBBR可以去除水体中NO2–-N,MBBR则会产生NO2–-N;FBBR对于消毒剂的干扰具有更强的抵抗力。而且,相关研究大多在小试或者中试规模的模拟RAS中完成,基于实际生产的RAS中FBBR和MBBR同步运行的对比研究较少。
因此,本研究将FBBR和MBBR并联于实际生产规模的墨瑞鳕(Macculochella peeli) RAS中,通过二者的同步连续运行,对比分析其出水水质变化和微生物群落结构,以期为循环水养殖水质生物净化技术选择提供指导。
1 材料与方法 1.1 实验系统组成如图 1所示,本研究采用的墨瑞鳕RAS主要由养殖池和循环水处理设施组成。养殖池由相同规格的8个水泥池构成;每个池体长7.0 m、宽7.0 m、深1.1 m,有效容积为49 m3;在各池底部均匀布设4根曝气管(长4 m、内径2 cm)。采用罗茨鼓风机和液氧为养殖池增氧;养殖池上方棚顶设置采光口,光照度约为1 000~1 500 lx。水处理设施包括转鼓式微滤机(1.3 kW,雅亿,南京)、泡沫分离器(0.55 kW,海兴,青岛)、变频式离心泵(5.5 kW,银河,南通)、FBBR、MBBR、增氧池(陶瓷纳米曝气板,益品德,苏州)和紫外消毒器(2.5 kW,海兴,青岛)。采用经过沉淀和过滤处理的地下深井水作为养殖用水。
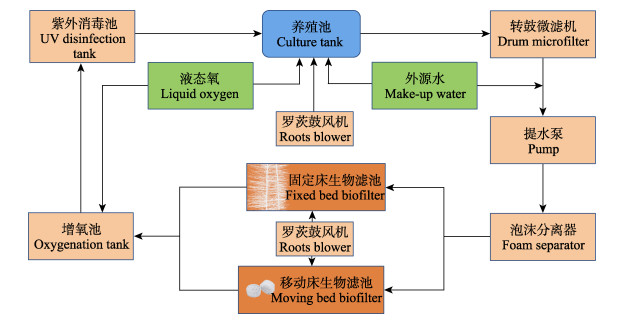
|
图 1 墨瑞鳕循环水养殖系统工艺流程图 Fig.1 Flow chart of recirculating aquaculture system for M. peelii |
FBBR和MBBR均为推流式反应器,其主体为相同规格的水泥池(长18 m、宽3.33 m、高2.5 m,水体有效容积为120 m3)。FBBR采用悬挂在不锈钢支架上的弹性滤料(每根滤料丝条直径为20 cm,中心绳长为2 m,比表面积≥360 m2/m3)作为填料,池体内滤料的布设密度为16根/m2。MBBR采用PVC多孔环作为填料(直径4 cm,厚度25 mm,比表面积≥1 036 m2/m3),池体内PVC多孔环的填充率为40% (体积比),在出水口设置填料拦截网。FBBR和MBBR底部均匀布设曝气管,通过罗茨鼓风机进行曝气。FBBR和MBBR并联接入墨瑞鳕RAS中。
1.2 实验设计本实验连续进行35 d。实验开始前,向养殖池中投放墨瑞鳕苗种,放养密度为200尾/m3。墨瑞鳕苗种采用由仔鱼培育而成的大规格幼体(平均体重为36.02 g,长江渔业渔歌,安徽)。实验过程中,每天08:00和16:00各向养殖池中投喂一次商品鱼专用配合饲料,每日饲料投喂量约占鱼体总重的1.2%~ 1.5%;养殖水体温度和溶解氧质量浓度分别控制在28 ℃左右和6.0 mg/L以上;每天向养殖池中补充养殖用水,日补水量约占养殖池有效容积的10%。养殖池出水依次经过微滤机和泡沫分离器处理后分成相同的两部分,分别进入FBBR和MBBR进行生物净化,二者出水经过增氧和紫外线消毒后回流到养殖池中。实验期间养殖池内水体的循环频次控制在12次/d。FBBR和MBBR的进水流量均为2 352 m3/d,空床水力停留时间为1.63 h,反应器内温度和溶解氧浓度保持与养殖池内相同水平。FBBR和MBBR采用自然挂膜形式启动,不向其中投加种泥(朱建新等, 2014)。实验过程中,每天监测FBBR和MBBR中的水温和溶解氧浓度,并采集出水样品,测定其中水体中溶解性无机氮(DIN)浓度(即NH4+-N、NO2–-N和NO3–-N浓度);实验结束时,从反应器的进水端、中部和出水端采集等量的填料,混合均匀后用于微生物群落结构检测,每个生物膜反应器采集3个平行样(即n=3)。
1.3 分析方法 1.3.1 水质分析利用YSI水质分析仪(OH,美国)对生物膜反应器中的水温和溶解氧进行原位检测。水样经过0.45 μm玻璃纤维滤膜过滤后,分别采用pH计(pHS-3C,雷磁,上海)、靛酚蓝分光光度法、盐酸萘乙二胺分光光度法和锌镉还原法对pH、NH4+-N、NO2–-N和NO3–-N的浓度进行测定。具体参照《海洋监测规范-第4部分海水分析(GB17378-2007)》。
1.3.2 微生物高通量测序按照E.Z.N.A.® soil DNA Kit (Omega Bio-tek,Norcross,美国)的操作程序提取填料样品表面的基因组DNA,并通过1%琼脂糖凝胶电泳检测所提取DNA的质量。利用带有标签(Barcode)的特异性引物(515F和806R)对基因组DNA中16S rRNA基因的V4多变区进行PCR扩增。PCR产物经过检测、回收纯化后,使用TruSeq® DNA PCR- Free Sample Preparation Kit (Illumina,美国)进行文库构建。文库合格后,使用HiSeq 2500 PE250平台进行高通量测序。截取下机数据中的标签和引物序列后,使用FLASH 1.2.7软件对样品读长(reads)进行拼接,得到原始数据(raw tags);利用QIIME 1.9.1软件对原始数据进行过滤处理,得到高质量数据(clean tags);通过UCHIME Algorithm将高质量序列与Gold Database数据库进行比对,去除其中的嵌合体序列,得到有效数据(effective tags)。使用Uparse v7.0.1001软件将所有有效数据聚类(相似度97%)成为操作分类单元(operational taxonomic units, OTUs);使用Mothur方法将各个OTU的代表序列与SILVA的SSUrRNA数据库进行对比分析,获取样品中微生物分类注释信息。利用R语言工具计算样品的α多样性指数(Chao1指数、ACE指数、Shannon指数、Simpson指数和测序覆盖率)。
2 结果与讨论 2.1 墨瑞鳕RAS中FBBR和MBBR出水水质变化图 2为FBBR和MBBR出水水质指标随实验时间的变化。对FBBR和MBBR出水中NH4+-N、NO2–-N、NO3–-N的浓度及pH分别进行单因素方差分析,P值分别为0.547、0.984、0.953和0.154,均大于0.05,表明FBBR出水中各指标与MBBR无显著差异。然而,本结果与以往研究结果不完全相同。Fernandes等(2017)研究显示,FBBR水体中NH4+-N和NO2–-N浓度均与MBBR存在明显差异。Pulkkinen等(2019)研究表明,FBBR水体中NH4+-N浓度与MBBR无明显差异,但二者NO2–-N浓度的差异显著。这可能是由养殖动物种类、饲料类型、投喂方式、反应器构造、环境条件、运行参数等方面的差异造成的。而且,两反应器出水中NH4+-N、NO2–-N、NO3–-N浓度以及其在DIN中的占比呈现出相似的变化趋势。总体上看,DIN浓度随实验时间延长而逐渐升高,表明养殖过程中投喂的饲料可以向养殖水体中释放DIN,并且DIN会在RAS中逐渐积累。NH4+-N和NO2–-N浓度及其在DIN中的占比均呈现先上升后下降的趋势;NO3–-N浓度逐渐上升,而NO3–-N在DIN中的占比则先逐渐降低而后逐渐升高。FBBR和MBBR出水中各指标的具体变化过程如下:

|
图 2 FBBR和MBBR出水中pH和NH4+-N、NO2–-N、NO3–-N浓度的变化(a和c)以及其在DIN中的占比(b和d) Fig.2 Variation of pH and the concentrations of NH4+-N, NO2–-N and NO3–-N (a and c) and their proportions to the DIN in FBBR and MBBR effluents (b and d) |
第1―5天,FBBR和MBBR出水NH4+-N、NO2–-N和NO3–-N浓度均保持相对稳定,表明这一阶段内投喂饲料未导致RAS中明显的DIN积累;而且,此阶段内FBBR和MBBR不具备硝化能力,这是因为自然挂膜的速率较慢,在实验初期形成的生物膜很少,其中硝化菌的丰度也很低,导致生物膜难以表现出显著的硝化能力,相对稳定的pH值也印证了这一点。此外,NH4+-N、NO2–-N和NO3–-N在FBBR出水DIN中的占比分别在14.83%~22.56%、4.66%~9.75%和68.54%~77.35%范围内波动,在MBBR出水DIN中的占比分别在14.36%~20.27%、4.66%~10.46%和71.73%~75.62%范围内波动,表明NO3–-N是预处理后深井水中DIN的主要形态。第6―11天,FBBR和MBBR出水DIN浓度缓慢上升,表明RAS中出现了DIN积累,而且以往研究表明,饲料释放到养殖水体中的DIN通常以NH4+-N的形式存在(Dauda et al, 2019)。FBBR水体中NH4+-N和NO2–-N浓的度分别由0.35和0.14 mg/L上升到1.28和1.14 mg/L,MBBR出水NH4+-N和NO2–-N浓度分别由0.35和0.15 mg/L上升到1.17和1.16 mg/L,而且NH4+-N和NO2–-N在两反应器出水DIN中的占比快速升高。FBBR和MBBR水体的NO3–-N浓度分别在0.94~1.29 mg/L和1.04~1.62 mg/L范围内波动,NO3–-N在DIN中的占比则快速降低。由此可见,第6―11天,FBBR和MBBR中的生物膜逐渐形成并具备了一定的硝化能力,但此阶段的硝化作用以氨氧化为主,亚硝酸氮氧化并不明显。这可能是因为,在生物膜形成前期,充足的NH4+-N有利于氨氧化菌的较快生长,使其在FBBR和MBBR中已达到一定数量,可以将NH4+-N转化为NO2–-N,但其氨氧化能力仅能部分去除养殖过程中产生的NH4+-N,从而导致NH4+-N的积累;然而,NO2–-N匮乏对亚硝酸氧化菌的生长不利,致其在FBBR和MBBR中的数量很低,难以将NO2–-N有效转化为NO3–-N,从而导致NO2–-N的积累。第12―19天,NH4+-N和NO2–-N浓度均缓慢下降,其在FBBR出水DIN中的占比分别由38.23%和25.68%快速下降至14.88%和7.36%,在MBBR水体中DIN中的占比分别由34.76%和25.21%快速下降至14.20%和6.65%;NO3–-N浓度逐渐升高,其在FBBR和MBBR出水DIN中的占比分别由36.09%和40.04%快速上升至77.76%和79.15%。因此,此阶段内两反应器中的生物膜渐趋成熟,氨氧化能力进一步增强,NH4+-N去除速率逐渐超过养殖过程中NH4+-N的释放速率,从而使得养殖水体中的NH4+-N逐渐减少;而且,亚硝酸氧化菌也达到了一定数量,可以将NO2–-N转化为NO3–-N,解除了NO2–-N的积累。
可以推测,第19天之后,在运行状态不受到明显干扰的情况下,FBBR和MBBR中的生物膜将完全成熟,形成稳定的硝化能力,使NO3–-N成为养殖水体中DIN的主要形态,NH4+-N和NO2–-N浓度始终保持在很低水平。然而,第20―28天,NO2–-N浓度及其在DIN中的占比呈先快速上升而后逐渐下降的趋势;NO3–-N浓度逐渐升高,但其在DIN中的占比先快速降低而后逐渐升高。产生这一波动的原因在于,从第20天开始,根据养殖需求提高了饲料投喂量,导致FBBR和MBBR的氮负荷增加,对其运行状态造成一定干扰。第20―28天,两反应器出水NH4+-N浓度并未出现明显的升高,表明生物膜的氨氧化能力较为稳定,具有一定的抗冲击负荷能力;然而,生物膜亚硝酸氮氧化能力尚未稳定,抗冲击负荷能力较差,需要进一步强化。第29―35天,两反应器出水NH4+-N和NO2–-N浓度以及其在DIN中的占比均缓慢降低;NO3–-N浓度及其在DIN的占比仍然逐渐升高。实验结束时,FBBR出水NH4+-N、NO2–-N和NO3–-N浓度分别为0.32、0.27和29.75 mg/L,在DIN中的占比分别为1.05%、0.90%和98.05%;MBBR出水NH4+-N、NO2–-N和NO3–-N浓度分别为0.29、0.22和29.76 mg/L,在DIN中的占比分别为0.96%、0.72%和98.32%。因此,可以认为FBBR和MBBR中的生物膜基本成熟,具备了稳定的硝化能力,可以有效去除养殖水体中的NH4+-N和NO2–-N。此外,第6―35天,FBBR和MBBR水体pH分别由7.62和7.59逐渐下降至7.25和7.22,与FBBR和MBBR硝化能力的形成过程吻合。
综上所述,FBBR和MBBR的硝化能力均经历了逐渐成熟的过程,可以有效控制养殖水体中NH4+-N和NO2–-N的浓度,但会导致NO3–-N积累和pH降低;本研究条件下,2种反应器的硝化效率无显著差异。
2.2 墨瑞鳕RAS中FBBR和MBBR微生物群落分析 2.2.1 FBBR和MBBR微生物多样性FBBR和MBBR样品高通量测序的原始数据经过预处理后分别获得51 614和43 156条有效序列,然后将其按照97%相似性阈值聚类为不同的OTU。图 3和表 1分别为基于FBBR和MBBR样品中微生物OTU的韦恩图和α多样性指数。FBBR和MBBR样品的测序覆盖率均超过了0.98,表明测序结果可以较好地反映样品中微生物群落的物种组成情况。从FBBR样品中共获得2 088个OTU,多于从MBBR样品中获得的OTU总数(1 852),二者共有的OTU数目为1 174 (图 3);而且FBBR样品的Chao1指数和ACE指数均大于MBBR (表 1)。因此,FBBR填料表面微生物群落的物种丰富度高于MBBR。此外,FBBR样品的Shannon指数高于MBBR,Simpson指数则低于MBBR,表明FBBR填料表面微生物群落多样性高于MBBR,与李倩等(2016)的研究结果相吻合。虽然FBBR和MBBR的进水流量、水质特征和运行条件均相同,但相较于FBBR,MBBR内的扰动更加剧烈(如水流和气流的剪切冲刷、填料之间的碰撞和摩擦等)。这种反应器内部环境的差异会对微生物起到一定的筛选作用(例如,附着能力较差的物种难以在MBBR中生长,但FBBR可以为其提供适宜的生长环境),从而导致FBBR和MBBR填料表面微生物群落的物种丰富度和多样性存在差异(Ruan et al, 2015)。
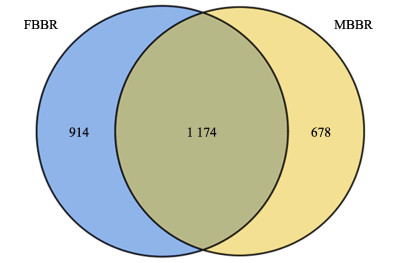
|
图 3 基于FBBR和MBBR中微生物OTU的韦恩图(n=3) Fig.3 Venn diagram based on microbial OTUs in FBBR and MBBR (n=3) |
|
|
表 1 FBBR和MBBR填料表面微生物群落的α多样性指数(n=3) Tab.1 α diversity indexes of microbial communities on the surfaces of fillers from FBBR and MBBR (n=3) |
图 4为FBBR和MBBR填料表面微生物在门、纲和属水平上的群落结构。从FBBR样品中共注释出16个门,相对丰度较高的有变形菌门(69.42%)、疣微菌门(Verrucomicrobia,14.17%)、浮霉菌门(Planctomycetes,6.09%)、拟杆菌门(Bacteroidetes,3.61%)、硝化螺菌门(Nitrospiraceae,2.19%)、酸杆菌门(Acidobacteria,1.34%)和厚壁菌门(Firmicutes,1.28%);从MBBR样品中共注释出19个门,相对丰度较高的有变形菌门(86.92%)、拟杆菌门(5.12%)、浮霉菌门(1.77%)、疣微菌门(1.70%)、厚壁菌门(1.33%)、酸杆菌门(1.10%),因此,变形菌门成为FBBR和MBBR填料表面生物膜中相对丰度最高的细菌门类,这与蔺凌云等(2017)的研究结果一致。在FBBR样品中共注释出28个纲,其中,γ-变形菌纲、α-变形菌纲、疣微菌纲(Verrucomicrobiae)、海藻球形菌纲(Phycisphaerae)、浮霉菌纲(Planctomycetia)、硝化螺菌纲(Nitrospira)、鞘脂杆菌纲(Sphingobacteriia)、β-变形菌纲(β-proteobacteria)、芽孢杆菌纲(Bacilli)和Acidobacteria-Gp6纲的相对丰度较高,分别为40.71%、26.58%、13.89%、3.29%、2.71%、2.19%、1.88%、1.56%、1.26%和1.11%;在MBBR样品中共注释出31个纲,其中,γ-变形菌纲、α-变形菌纲、黄杆菌纲(Flavobacteriales)、疣微菌纲、浮霉菌纲和芽孢杆菌纲的相对丰度较高,分别为64.36%、21.74%、3.86%、1.53%、1.43%和1.31%。由此可见,γ-变形菌纲和α-变形菌纲为在FBBR和MBBR生物膜中占主导地位的菌纲,这与Wietz等(2009)的研究结果吻合。值得注意的是,本研究结果与以往研究报道不完全相同。例如,李倩等(2016)研究发现,FBBR和MBBR中的相对丰度最高的细菌门类分别为变形菌门(34.78%)和厚壁菌门(61.62%)。蔺凌云等(2017)研究表明,β-变形菌纲是FBBR和MBBR中相对丰度最高的优势菌纲。这可能是由实验系统构成、运行条件、养殖动物种类、饲料种类和投喂方式等方面的差异造成的(Schreier et al, 2010)。在FBBR样品中共注释出149个属,主要有不动杆菌属(27.50%)、黄体菌属(Luteolibacter,12.67%)、罗氏杆菌属(Rhodobacter,5.67%)、芽孢杆菌属(Gemmobacter,5.05%)、海仙菌属(Haliea,3.61%)、脱氟单胞菌属(Defluviimonas,3.50%)、气单胞菌属(Aeromonas,3.10%)、中高温球形菌属(Tepidisphaera,2.90%)、硝化螺菌属(2.19%)、假单胞菌属(Pseudomonas,2.07%)、假黄单胞菌属(Pseudoxanthomonas,1.20%)、柠檬酸杆菌属(Citrobacter,1.17%)、葡萄球菌属(Staphylococcus,1.15%)、生丝微菌属(Hyphomicrobium,1.13%)、Gp6 (1.11%)和副土壤杆菌属(Parasegetibacter,1.07%);在MBBR样品中共注释出155个属,主要有不动杆菌属(53.29%)、气单胞菌属(6.22%)、鞘脂单胞菌属(Novosphingobium,3.91%)、罗氏杆菌属(3.51%)、脱氟单胞菌属(3.22%)、芽孢杆菌属(2.29%)、金黄杆菌属(Chryseobacterium,2.16%)、假单胞菌属(1.66%)、黄杆菌属(Flavobacterium,1.60%)、生丝微菌属(1.21%)、鞘氨醇杆状菌属(Sphingorhabdus,1.06%)和柠檬酸杆菌属(1.01%)。因此,不动杆菌属在FBBR和MBBR生物膜中均是优势菌属。而且,MBBR生物膜中不动杆菌属的相对丰度远高于FBBR中,印证了前面关于生物膜反应器内环境不同导致其微生物多样性差异的论断。不动杆菌属具有良好的附着生长特性,容易在填料表面形成生物膜(Fang et al, 2002; Wagner et al, 2002)。因此,MBBR中剧烈的扰动提高了不动杆菌属对其他菌属的竞争优势,使其在生物膜中占有很高的比例;FBBR相对温和的扰动也可为其他菌属提供适宜的生长环境,导致不动杆菌属的竞争压力增大。
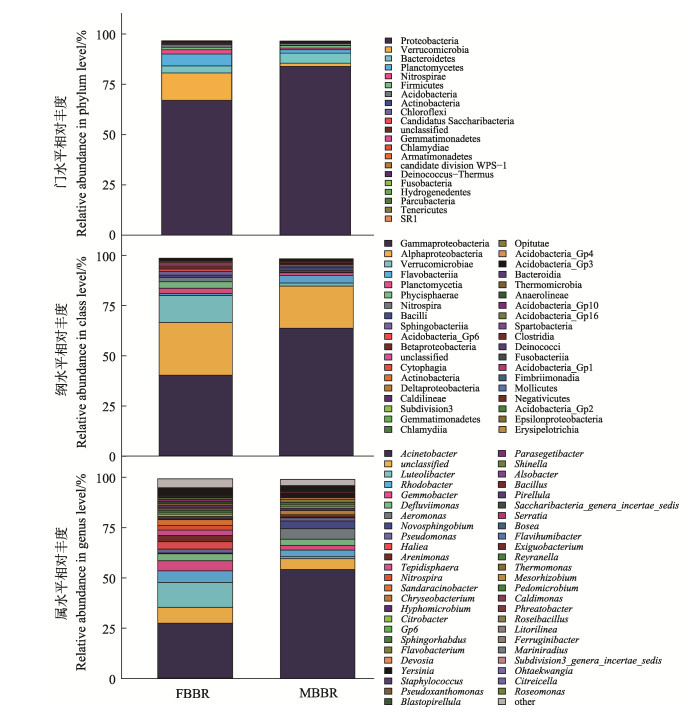
|
图 4 FBBR和MBBR的微生物群落结构(n=3) Fig.4 Microbial community structures in FBBR and MBBR (n=3) |
FBBR和MBBR生物膜中硝化菌相对丰度如表 2所示。2种生物膜反应器样品中注释出的硝化菌均为亚硝化单胞菌属和硝化螺菌属,这与蔺凌云等(2017)和张皓天等(2020)的研究结果一致。可以看出,FBBR和MBBR生物膜中硝化菌相对丰度都较低,这是因为硝化菌属于化能自养菌,生长较缓慢,且对环境因子比较敏感(Chen et al, 2006)。但是,反应器的运行效果(图 2)表明,在生物膜中硝化菌可以与其他菌和谐共存,并发挥稳定的硝化能力。MBBR生物膜中硝化菌的相对丰度明显低于FBBR,但二者的硝化效果较为接近(图 2)。这可能是因为,虽然MBBR中较为剧烈的扰动不利于硝化菌的附着生长,但可以增强溶解氧、NH4+-N等在生物膜内的传质,对硝化反应有利。作为典型的氨氧化菌和亚硝酸氧化菌,亚硝化单胞菌属与硝化螺菌属广泛存在于各种自然环境及人工硝化系统中(Ge et al, 2015)。传统的硝化理论认为,NH4+-N先被氨氧化菌转化为NO2–-N,而后被亚硝酸氧化菌转化为NO3–-N;根据硝化过程中的电子转移可以估算,正常运行的硝化系统中氨氧化菌和亚硝酸氧化菌的理论数量比为2 (Winkler et al, 2012)。但在FBBR和MBBR生物膜中,亚硝化单胞菌属与硝化螺菌属的数量占比分别为0.04和0.07,远小于理论值,这是通过传统硝化理论难以解释的。近几年研究发现,硝化螺菌属中的一些种类(如Candidatus Nitrospira inopinata、Candidatus Nitrospira nitrosa和Candidatus Nitrospira nitrificans)能够独立完成从NH4+-N到NO2–-N再到NO3–-N的氧化过程(即完全氨氧化)(Ren et al, 2020)。因此,在FBBR和MBBR生物膜中可能存在能够进行完全氨氧化的硝化螺菌属种类,其可以与亚硝化单胞菌属竞争NH4+-N基质,从而导致硝化螺菌属数量明显高于亚硝化单胞菌属。两生物膜反应器生物膜中完全氨氧化菌的种类和丰度仍需进一步探究。此外,在水产养殖过程中,弧菌往往作为致病菌或者条件致病菌存在,因而成为一项备受关注的微生物指标。在FBBR和MBBR生物膜中均未检测到弧菌属,表明2种生物膜反应器都不存在弧菌积累的风险。由表 2可知,FBBR和MBBR生物膜中均存在一定数量的蛭弧菌属(Bdellovibrio)。
|
|
表 2 FBBR和MBBR填料表面硝化菌和蛭弧菌属的相对丰度(n=3) Tab.2 Relative abundance of nitrifiers and Bdellovibrio on the surfaces of fillers from FBBR and MBBR (n=3) |
综上所述,在微生物群落方面,FBBR和MBBR的相同点在于具有相似的优势菌群,硝化菌由亚硝化单胞菌属与硝化螺菌属构成,且硝化螺菌属的相对丰度高于亚硝化单胞菌属;不同点在于FBBR微生物群落的丰富度和多样性以及硝化菌的相对丰度高于MBBR。
3 结论在自然挂膜过程中,FBBR和MBBR中氨氧化能力的形成快于亚硝酸氮氧化能力,硝化能力渐趋成熟,可以有效控制养殖水体中的NH4+-N和NO2–-N浓度,但会产生养殖水体中NO3–-N积累和pH下降;FBBR和MBBR出水中的NH4+-N、NO2–-N、NO3–-N浓度和pH无显著差异,两反应器的硝化效率相似。
在微生物群落方面,FBBR和MBBR不同点为FBBR中微生物群落的丰富度和多样性均高于MBBR;FBBR和MBBR相同点为优势菌群相似,优势菌门为变形菌门,优势菌纲为γ-变形菌纲和α-变形菌纲,优势菌属为不动杆菌属;硝化菌均由亚硝化单胞菌属和硝化螺菌属构成,且硝化螺菌属的相对丰度远高于亚硝化单胞菌属。
4 展望目前,对于RAS中FBBR和MBBR水质净化表现的优劣问题尚未形成统一认识。本研究水质分析结果表明,FBBR和MBBR的硝化效率无明显差异,都可以有效控制实际生产的墨瑞鳕RAS水体中NH4+-N和NO2–-N浓度。然而,微生物群落分析表明,FBBR的微生物丰富度和多样性均明显高于MBBR。由此可以推测,FBBR对于污染物和有毒物质的冲击负荷具有较强抵抗力(Pedersen et al, 2015)。但是,FBBR容易受到水动力特征和堵塞的影响(Pulkkinen et al, 2019),而MBBR对于水力冲击具有很好的适应性,不易堵塞。因此,在养殖实践中,应在综合考虑养殖动物种类、饲料类型和投喂方式、水质要求、环境条件、场地和设备限制等因素的基础上,选择采用FBBR或MBBR。在本研究中,FBBR和MBBR均在相对稳定的工况下运行,水质特征(污染物浓度、颗粒物含量、有毒物质含量等)和运行参数(HRT、温度等)对其净化效能的影响尚不清楚,有待于进一步研究。此外,FBBR和MBBR会导致养殖水体中NO3–-N积累和pH降低;过高浓度的NO3–-N会对鱼类的摄食、死亡、繁殖和内分泌系统产生重要影响(Guillette et al, 2005; Hamlin et al, 2008; Good et al, 2016),而且NO3–-N排放可能导致或者加剧受纳水体的富营养化;过低的pH不仅会抑制微生物硝化反应(Chen et al, 2006),还会严重威胁养殖鱼类的健康。因此,NO3–-N的高效去除和水体pH的稳定调控值得深入研究。
因此,下一步研究工作将围绕以下四方面展开:研究水质条件和运行参数对FBBR和MBBR净化效能的影响,重点关注两反应器对冲击负荷的抵抗力;明确FBBR和MBBR填料表面完全氨氧化菌的种类和丰度;在FBBR和MBBR后接入适当的微生物反硝化工艺,去除硝化反应产生的NO3–-N,实现对养殖水体总氮的有效控制;探究适用于FBBR和MBBR的碱度缓冲剂,抵消硝化反应产生的酸度,实现对养殖水体pH的稳定调控。
CHEN S L, LING J, BLANCHETON J P. Nitrification kinetics of biofilm as affected by water quality factors. Aquacultural Engineering, 2006, 34(3): 179-197 DOI:10.1016/j.aquaeng.2005.09.004 |
CRAB R, AVNIMELECH Y, DEFOIRDT T, et al. Nitrogen removal techniques in aquaculture for a sustainable production. Aquaculture, 2007, 270(1/2/3/4): 1-14 |
DAUDA A B, AJADI A, TOLA-FABUNMI A S, et al. Waste production in aquaculture: Source, components and managements in different culture systems. Aquaculture and Fisheries, 2019, 4: 81-88 DOI:10.1016/j.aaf.2018.10.002 |
FAN H P, XUE L Z, CHEN Y H, et al. Acute toxicity of ammonia nitrogen and nitrite to juvenile spiny eel Mastacembelue armatus (Lacepe'de, 1800). Chinese Journal of Fisheries, 2018, 31(3): 25-28 [樊海平, 薛凌展, 陈玉红, 等. 氨氮及亚硝酸盐对大刺鳅幼鱼的急性毒性. 水产学杂志, 2018, 31(3): 25-28 DOI:10.3969/j.issn.1005-3832.2018.03.006] |
FANG H H P, ZHANG T, LIU Y. Characterization of an acetate-degrading sludge without intracellular accumulation of polyphosphate and glycogen. Water Research, 2002, 36(13): 3211-3218 DOI:10.1016/S0043-1354(02)00027-1 |
FERNANDES P M, PEDERSEN L F, PEDERSEN P B. Influence of fixed and moving bed biofilters on micro particle dynamics in a recirculating aquaculture system. Aquacultural Engineering, 2017, 78: 32-41 DOI:10.1016/j.aquaeng.2016.09.002 |
GE S J, WANG S Y, YANG X, et al. Detection of nitrifiers and evaluation of partial nitrification for wastewater treatment: A review. Chemosphere, 2015, 140: 85-98 DOI:10.1016/j.chemosphere.2015.02.004 |
GOOD C, DAVIDSON J. A review of factors influencing maturation of Atlantic salmon, Salmo salar, with focus on water recirculation aquaculture system environments. Journal of the World Aquaculture Society, 2016, 47(5): 605-632 DOI:10.1111/jwas.12342 |
GREINER A D, TIMMONS M B. Evaluation of the nitrification rates of microbead and trickling filters in an intensive recirculating tilapia production facility. Aquacultural Engineering, 1998, 18(3): 189-200 DOI:10.1016/S0144-8609(98)00030-2 |
GUERDAT T C, LOSORDO T M, CLASSEN J J, et al. An evaluation of commercially available biological filters for recirculating aquaculture systems. Aquacultural Engineering, 2010, 42(1): 38-49 DOI:10.1016/j.aquaeng.2009.10.002 |
GUILLETTE Jr L J, EDWARDS T M. Is nitrate an ecologically relevant endocrine disruptor in vertebrates?. Integrative and Comparative Biology, 2005, 45(1): 19-27 DOI:10.1093/icb/45.1.19 |
HAMLIN H J, MOORE B C, EDWARDS T M, et al. Nitrate-induced elevations in circulating sex steroid concentrations in female Siberian sturgeon (Acipenser baeri) in commercial aquaculture. Aquaculture, 2008, 281(1/2/3/4): 118-125 |
KUHN D D, SMITH S A, BOARDMAN G D, et al. Chronic toxicity of nitrate to Pacific white shrimp, Litopenaeus vannamei: Impacts on survival, growth, antennae length, and pathology. Aquaculture, 2010, 309(1/2/3/4): 109-114 |
LI Q, HU T J, LIU S L, et al. Depuration of the aquaculture wastewater by three kinds of biological fillers in recirculating aquaculture system. Jiangsu Agricultural Sciences, 2017, 45(1): 243-245 [李倩, 胡廷尖, 刘士力, 等. 循环水养殖系统中3种生物填料对水质的净化作用. 江苏农业科学, 2017, 45(1): 243-245 DOI:10.15889/j.issn.1002-1302.2017.01.067] |
LI Q, HU T J, XIN J M, et al. Analysis of bacterial community compositions in three biological filter media by 16S rRNA gene library. Journal of Dalian Ocean University, 2016, 31(4): 384-389 [李倩, 胡廷尖, 辛建美, 等. 应用16SrRNA基因文库技术分析3种生物填料上生物膜的细菌群落组成. 大连海洋大学学报, 2016, 31(4): 384-389] |
LIN L Y, YIN W L, PAN X Y, et al. The study of natural biofilm formation for nitrogen removal from aquaculture wastewater and analysis on microbial community in biofilm. Acta Hydrobiologica Sinica, 2017, 41(6): 1327-1335 [蔺凌云, 尹文林, 潘晓艺, 等. 自然微生物挂膜处理水产养殖废水的效果及微生物群落分析. 水生生物学报, 2017, 41(6): 1327-1335] |
LIU H, GUAN C W, NI Q, et al. Analysis of factors of water treatment with biofilm sequence batch reactor in recirculating aquaculture systems. South China Fisheries Science, 2008, 4(4): 55-59 [刘晃, 管崇武, 倪琦, 等. 生物膜法SBR (BSBR)在循环养殖水处理中影响因素分析. 南方水产, 2008, 4(4): 55-59 DOI:10.3969/j.issn.2095-0780.2008.04.010] |
PEDERSEN L F, OOSTERVELD R, PEDERSEN P B. Nitrification performance and robustness of fixed and moving bed biofilters having identical carrier elements. Aquacultural Engineering, 2015, 65: 37-45 DOI:10.1016/j.aquaeng.2014.10.005 |
PULKKINEN J T, ERIKSSON-KALLIO A M, AALTO S L, et al. The effects of different combinations of fixed and moving bed bioreactors on rainbow trout (Oncorhynchus mykiss) growth and health, water quality and nitrification in recirculating aquaculture systems. Aquacultural Engineering, 2019, 85: 98-105 DOI:10.1016/j.aquaeng.2019.03.004 |
REN Y, NGO H H, GUO W S, et al. New perspectives on microbial communities and biological nitrogen removal processes in wastewater treatment systems. Bioresource Technology, 2020, 297: 122491 DOI:10.1016/j.biortech.2019.122491 |
RUAN Y J, GUO X S, YE Z Y, et al. Bacterial community analysis of different sections of a biofilter in a full-scale marine recirculating aquaculture system. North American Journal of Aquaculture, 2015, 77(3): 318-326 DOI:10.1080/15222055.2015.1017128 |
SCHREIER H J, MIRZOYAN N, SAITO K. Microbial diversity of biological filters in recirculating aquaculture systems. Current Opinion in Biotechnology, 2010, 21(3): 318-325 DOI:10.1016/j.copbio.2010.03.011 |
SCHULER D J, BOARDMAN G D, KUHN D D, et al. Acute toxicity of ammonia and nitrite to Pacific white shrimp, Litopenaeus vannamei, at low salinities. Journal of the World Aquaculture Society, 2010, 41(3): 438-446 DOI:10.1111/j.1749-7345.2010.00385.x |
STEWART N T, BOARDMAN G D, HELFRICH L A. Characterization of nutrient leaching rates from settled rainbow trout (Oncorhynchus mykiss) sludge. Aquacultural Engineering, 2006, 35(2): 191-198 DOI:10.1016/j.aquaeng.2006.01.004 |
SUHR K I, PEDERSEN P B. Nitrification in moving bed and fixed bed biofilters treating effluent water from a large commercial outdoor rainbow trout RAS. Aquacultural Engineering, 2010, 42(1): 31-37 DOI:10.1016/j.aquaeng.2009.10.001 |
VERDEGEM M C J, BOSMA R H, VERRETH J A J. Reducing water use for animal production through aquaculture. International Journal of Water Resources Development, 2006, 22(1): 101-113 DOI:10.1080/07900620500405544 |
WAGNER M, LOY A. Bacterial community composition and function in sewage treatment systems. Current Opinion in Biotechnology, 2002, 13(3): 218-227 DOI:10.1016/S0958-1669(02)00315-4 |
WANG G Y, MA F, LI W G, et al. Removal of ammonium-N from marine recirculating aquaculture by immobilized nitrifiers. Journal of Harbin Institute of Technology, 2009, 41(10): 78-81 [王光玉, 马放, 李维国, 等. 固定化硝化菌在养鱼废水处理中的应用. 哈尔滨工业大学学报, 2009, 41(10): 78-81] |
WIETZ M, HALL M R, HØJ L. Effects of seawater ozonation on biofilm development in aquaculture tanks. Systematic and Applied Microbiology, 2009, 32(4): 266-277 DOI:10.1016/j.syapm.2009.04.001 |
WINKLER M K H, BASSIN J P, KLEEREBEZEM R, et al. Unravelling the reasons for disproportion in the ratio of AOB and NOB in aerobic granular sludge. Applied Microbiology and Biotechnology, 2012, 94: 1657-1666 DOI:10.1007/s00253-012-4126-9 |
ZHANG H T, SONG X F, LIU X Z, et al. Dynamic response of microbial community to water quality change in biofilter for recirculating aquaculture system of Oplegnathus punctatus. Chinese Journal of Environmental Engineering, 2020, 14(8): 2176-2185 [张皓天, 宋协法, 刘兴震, 等. 斑石鲷循环水养殖系统生物滤池微生物群落对水质变化的动态响应. 环境工程学报, 2020, 14(8): 2176-2185] |
ZHANG J L, JIANG M, WANG C F, et al. Microbial diversity in bio-filter of the recirculating aquaculture system for Litopenaeus vannamei. Progress in Fishery Sciences, 2017, 38(5): 73-82 [张健龙, 江敏, 王城峰, 等. 凡纳滨对虾(Litopenaeus vannamei)循环水养殖塘挂膜式生物滤器内微生物的多样性. 渔业科学进展, 2017, 38(5): 73-82] |
ZHAO Y, LIU Y, LI X, et al. Optimization design and experiment of moving bed biofilm reactor in industrialized recirculating aquaculture system. Journal of Dalian Ocean University, 2018, 33(5): 639-643 [赵越, 刘鹰, 李贤, 等. 工业化循环水养殖系统移动床生物膜反应器的设计. 大连海洋大学学报, 2018, 33(5): 639-643] |
ZHU J X, LIU H, XU Y, et al. Dual-culture techniques for the rapid start-up of recirculating aquaculture system. Progress in Fishery Sciences, 2014, 35(4): 118-124 [朱建新, 刘慧, 徐勇, 等. 循环水养殖系统生物滤器负荷挂膜技术. 渔业科学进展, 2014, 35(4): 118-124] |
ZOHAR Y, TAL Y, SCHREIER H J, et al. Commercially feasible urban recirculating aquaculture: Addressing the marine sector. Urban Aquaculture, 2005, 159 |



