2. 山东省海洋资源与环境研究院 山东 烟台 264006
2. Shandong Marine Resource and Environment Research Institute, Yantai 264006, China
许氏平鲉(Sebastes schlegelii)俗称黑鲪,隶属鲉形目(Scorpaeniformes)、鲉科(Scorpaenidae)、平鲉属(Sebastes),为冷温性近海底层卵胎生鱼类,广泛分布于我国黄、渤海以及韩国和日本沿海(刘阳等, 2019; Feng et al, 2014)。其肉质鲜嫩味美、营养丰富、药用价值高,是我国北部沿海地区海水鱼类中最重要的经济种类之一(王腾腾, 2017)。近年来,我国深水网箱养殖发展较为迅速,在适合我国北方网箱养殖的经济鱼种中,许氏平鲉是最为重要且具备优良品质和特性的本土养殖品种。但随着养殖产业规模的扩大,养殖病害时有发生,以细菌性疾病居多,如哈维氏弧菌(Vibrio harveyi) (李赟等, 2021)、鳗弧菌(Vibrio anguillarum) (Mohamad et al, 2019)、美人鱼发光杆菌(Photobacterium damselae subsp. damselae) (Takahashi et al, 2008)等,这些病原菌侵染后会导致鱼体皮肤溃疡、体表充血,严重时会引发大量死亡,造成较大的经济损失,严重制约了许氏平鲉养殖产业的健康发展。开展细菌感染与免疫的分子机制研究,可以清楚地认识机体对抗细菌感染的应答机制,对许氏平鲉细菌性疾病的防治有重要意义。
蛋白激酶B (protein kinase B, PKB),又称Akt蛋白,是一种丝氨酸(Ser)或苏氨酸(Thr)蛋白激酶,它主要通过磷酸化其他蛋白质进行信号传导(Koul et al, 2006; Jones et al, 1991),是重要的细胞信号转导分子,在细胞存活、细胞代谢、转录调控、细胞周期调控、免疫防御、胚胎发育等多种生物过程中发挥重要作用(姜华等, 2004)。活化的Akt可以通过磷酸化作用激活或抑制其下游靶蛋白Bad、GSK-3、Caspase9、FoxO1、NF-KB和mTOR等,进而调节细胞的增殖、分化、凋亡及迁移等过程(徐丹丹等, 2014; 刘荣雕等, 2013)。目前,有关水产生物Akt基因的研究主要集中在细胞存活和免疫防御方面,如Zhou等(2020)对水蚤(Daphnia pulex) Akt基因处理后发现,其成活率和繁殖能力显著降低;刘丽等(2020)研究发现,仿刺参(Apostichopus japonicus) Akt基因的转录表达水平在受到灿烂弧菌(Vibrio splendidus)感染刺激后显著上调;明月等(2021)使用传染性脾肾坏死病毒(ISKNV)侵染鳜(Siniperca chuatsi),发现ScAkt2表达可抑制ISKNV的增殖,对病原的复制、增殖具有抑制作用。这些研究表明,Akt基因可能在水生动物的病原胁迫调控中发挥重要作用。陈钰臻(2021)利用分离自患病许氏平鲉病灶处的哈维氏弧菌P5W开展了许氏平鲉应答弧菌胁迫后脾脏的转录组分析,发现Akt是应答弧菌胁迫过程中的免疫差异基因。目前,尚无有关许氏平鲉Akt基因(SsAkt)序列特征和蛋白结构与功能研究的报道。
本研究基于前期转录组数据,应用PCR技术克隆SsAkt基因的编码区序列,对其序列特征进行生物信息学分析,并应用实时荧光定量PCR (RT-qPCR)技术分析其mRNA在健康许氏平鲉各组织和响应细菌胁迫后的表达规律,旨在探究SsAkt在许氏平鲉抵御细菌入侵过程中发挥的作用,为许氏平鲉免疫机理研究提供基础信息。
1 材料与方法 1.1 实验材料生长健康、活力良好的许氏平鲉幼鱼192尾,体长为(18.25±0.52) cm,体重为(41.83±3.57) g,购于山东威海圣航海洋科技有限公司,运至山东省海洋资源与环境研究院进行实验。实验鱼暂养于15~17 ℃海水7 d后用于实验。随机选取12尾幼鱼个体,麻醉后分别取血液、鳃、肝脏、肌肉、肾脏、脾脏、肠、脑和心脏组织,液氮速冻后保存于−80 ℃冰箱备用。180尾幼鱼随机分为3组,每组3个平行,每个平行20尾;3组实验鱼分别腹腔注射100 μL藤黄微球菌(Micrococcus luteus) (0.5×108 CFU/mL)、鳗弧菌(0.5×108 CFU/mL)和磷酸缓冲盐溶液(PBS),分别在0、6、12、24、48、72和96 h选取6尾个体,麻醉后采集肝脏、血液和肾脏组织,液氮速冻后保存于−80 ℃冰箱备用。
1.2 总RNA的提取及cDNA的合成采用Trizol法提取许氏平鲉各组织的总RNA,通过1.0%琼脂糖凝胶电泳和NanoDrop OneC超微量分光光度计(Thermo, 美国)检测RNA完整性和浓度,质量合格的总RNA保存于−80 ℃冰箱备用。用于SsAkt基因核心序列克隆的cDNA采用TransScript® First-Strand cDNA Synthesis SuperMix试剂盒合成,反应体系(20 μL):1 μL Oligo dT Primer,10 μL 2× ES Reaction Mix,1 μL EasyScript® RT/RI,1 μL模板RNA,7 μL RNase-free H2O;反应程序:42 ℃ 15 min;85 ℃加热5 s失活EasyScript®RT/RI,合成后的cDNA −20 ℃条件下保存备用。用于荧光定量分析的cDNA使用PrimeScriptTM RT Reagent Kit with gDNA Eraser (TaKaRa)合成,反应体系为20 μL:初始反应体系为2 μL 5×gDNA Eraser Buffer、1 μL gDNA Eraser、1 μL Total RNA和6 μL RNase-free H2O,42 ℃反应2 min;后在反应液中依次加入1 μL PrimeScript RT Enzyme MixⅠ、1 μL RT PrimerMix、4 μL 5×PrimeScript Buffer 2和4 μL RNase-free H2O,37 ℃ 15 min,85 ℃ 5 s,反应样品4 ℃保存。
1.3 SsAkt基因核心序列的克隆根据本实验室构建的许氏平鲉转录组预测的注释信息,比对获取SsAkt的预测序列,使用Primer Premier 5.0软件设计引物(表 1)。以头肾的cDNA为模板,进行PCR扩增,获取SsAkt基因的ORF。PCR体系为25 μL:1 μL cDNA模板,正反向引物各0.5 μL,2×TransStart® FastPfu Fly PCR SuperMix 12.5 μL,ddH2O补足到25 μL。PCR扩增条件:94 ℃变性5 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸2 min,35个循环;72 ℃延伸10 min;4 ℃保存。扩增完成后,通过琼脂糖凝胶电泳检测扩增条带,将大小与目的片段一致的扩增条带使用TaKaRa MiniBEST AgaroseGel DNA Extraction Kit V4.0 (TaKaRa, 中国)切胶回收,将回收产物连接pEASY-E1载体(全式金, 北京)后,转化到Trans-T1感受态细胞(全式金, 北京)中,加入无抗LB液体培养基振荡培养1 h后涂平板(含氨苄青霉素),37 ℃过夜培养,挑取8个阳性克隆扩大培养,PCR验证合格后将产物送至生工生物工程(上海)股份有限公司青岛测序实验室测序。
|
|
表 1 SsAkt基因克隆扩增引物 Tab.1 Amplification primers used for cloning SsAkt genes |
使用NCBI ORF Finder (https://www.ncbi.nlm.nih. gov/orffinder/)确定SsAkt的开放阅读框,使用NCBI Blastx程序(https://blast.ncbi.nlm.nih.gov/Blast.cg)进行同源分析,使用ExPASy程序(http://web.expasy.org/compute_pi/)预测其相对分子量和理论等电点,使用SMART软件(http://smart.embl-heidelberg.de/)预测氨基酸结构和功能结构域,使用DNAMAN对同源蛋白进行多序列比对,使用MEGA 7.0软件以邻接法(neighbor-joining)构建系统进化树,利用Phyre2软件预测蛋白质二级结构(Kelley et al, 2015);利用SWISS-MODEL软件(https://swissmodel.expasy.org/)预测三级结构,利用pyMOL软件展示。
1.5 实时荧光定量PCR根据SsAkt基因的核心序列,使用Primer Premier 5.0软件设计一对荧光定量特异性引物SsAkt-RT-F1和SsAkt-RT-R1用于RT-qPCR检测;以许氏平鲉β-actin为内参基因(表 1),使用TB GreenTM Premix Ex TaqTM (TaKaRa, 中国)试剂和LightCycler® 480ⅡReal Time instrument (Roche, 瑞士)进行RT-qPCR,每个cDNA样品设置3个技术重复。反应体系为20 μL:10 μL 2× TB Green Premix Ex Taq,7.2 μL RNase-free H2O,0.4 μL正向引物和0.4 μL反向引物,2 μL cDNA模板。反应程序:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,40个循环,95 ℃ 5 s;60 ℃ 1 min;95℃,50 ℃ 30 s。所得实验数据采用相对CT法(2–ΔΔCt)计算SsAkt基因mRNA相对表达量,所得数据结果均以平均值±标准差(Mean±SD)表示,使用SPSS 17.0软件进行单因素方差分析(one-way ANOVA),设定P < 0.05为差异显著,P < 0.01为差异极显著,使用Origin Pro 8.0软件对定量结果作图。
2 结果与分析 2.1 SsAkt基因核心序列的克隆及氨基酸序列分析SsAkt基因的开放阅读框(ORF)长度为1 440 bp,编码479个氨基酸,蛋白相对分子质量为55.80 kDa,预测理论等电点(pI)为5.64 (图 1)。蛋白结构域预测分析显示,SsAkt蛋白包含3个保守结构域:PH结构域(6~109 aa),丝氨酸/苏氨酸蛋白激酶催化(S_TKc)结构域(148~405 aa),丝氨酸/苏氨酸型蛋白激酶(S_TK_X)结构域(406~475 aa) (图 2)。保守的氨基酸位点出现在S_TKc结构域的中心处以及S_TK_X结构域的末端:Thr305和Ser472。

|
图 1 SsAkt基因核苷酸序列及其编码的氨基酸序列 Fig.1 The nucleotide and deduced amino acid sequences of SsAkt 波浪下划线表示PH结构域;阴影表示S_TKc结构域;下划线表示S_TK_X结构域;红框表示保守的磷酸化位点。 Wavy underline represents PH domain; S_TKc domain is shaded, the underline shows S_TK_X domain, and the conserved phosphorylation sites are displayed in red frame. |

|
图 2 SsAkt蛋白结构域预测 Fig.2 Structure prediction of SsAkt domains 水平灰条表示预测没有功能域的氨基酸序列,框内则表示预测有功能域的区域。SsAkt包含3个结构域:PH结构域,S_TKc结构域,S_TK_X结构域。 Horizontal gray bars represent amino acid sequences predicted to have no functional domains, and boxes represent regions predicted to have functional domains. SsAkt contains three domains: PH domain, S_TKc domain, and S_TK_X domain. |
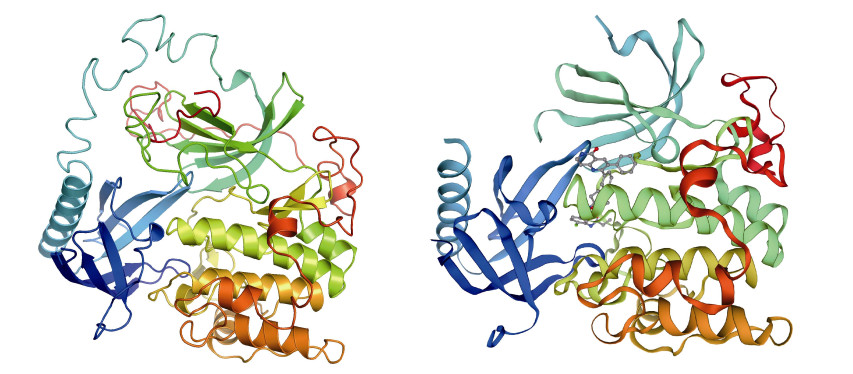
蛋白质二级结构预测结果显示,SsAkt由α-螺旋和β-折叠以及TM螺旋组成(图 3),其中含有31%的α-螺旋和19%的β-折叠及3%的TM螺旋,其余为无序结构。同源建模工具预测的三维结构模型显示,SsAkt与其他物种Akt的三维结构具有较高相似度,与智人(Homo sapiens) Akt蛋白(Swiss-model模板号:6hhg.1.A)的一致性较高,为81.18% (图 4)。

|
图 3 SsAkt蛋白的二级结构预测 Fig.3 Secondary structure prediction of the SsAkt 绿色螺旋表示α-螺旋,蓝色箭头表示β-折叠,金色螺旋表示TM螺旋。 Green helices indicate α-helices, blue arrows indicate β-sheets, and golden helices indicate TM helices. |
|
图 4 SsAkt蛋白的三级结构预测(左)和智人Akt蛋白三级结构(右) Fig.4 The predicted spatial structure of SsAkt (left) and the predicted 3D structure of human Akt protein (right) |
通过NCBI的BLAST比对,发现SsAkt蛋白序列与其他物种的Akt蛋白序列有较高的相似性(图 5)。将SsAkt氨基酸序列与青鳉(Oryzias latipes)(XP_ 023819560.1:1-479)、斑马鱼(Danio rerio)(NP_ 001268730.1)、凡纳对虾(Penaeus vannamei) (AHY28871.1)、黑腹果蝇(Drosophila melanogaster) (CAA81204.1)、非洲爪蟾(Xenopus laevis)(XP_ 018087413.1)、贻贝(Mytilus edulis) (CAG2211774.1)大黄鱼(Larimichthys crocea) (XP_010744471.1:1-479)、尖吻鲈(Lates calcarifer) (XP_018552530.1:1-479)、鲤(Cyprinus carpio) (CAA81204.1)、智人(KAI4085561.1)和小鼠(Mus musculus) (NP_ 001159366.1)的Akt氨基酸序列进行同源性比对,发现SsAkt蛋白序列与其他物种的Akt有较高的相似性,相似性范围为55.84%~99.37%。其中,SsAkt与尖吻鲈的相似性最高,为99.37%;而与凡纳对虾的相似性最低,为55.84%。

|
图 5 许氏平鲉与其他物种Akt氨基酸序列的多重比对 Fig.5 Multiple alignment of the deduced amino acids of Akt among S. schlegelii and other different species |
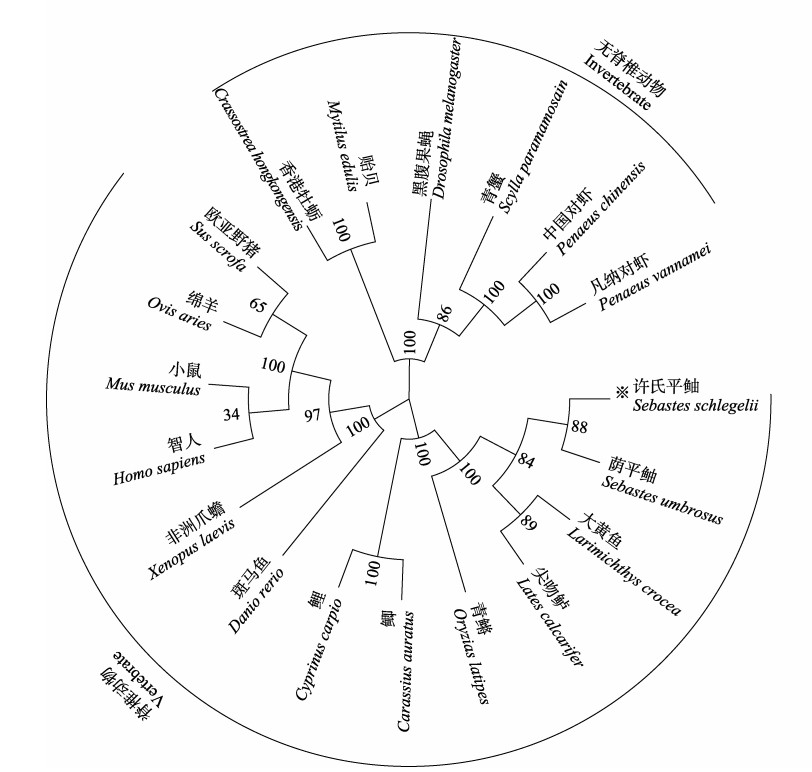
根据SsAkt和荫平鲉(Sebastes umbrosus) (XP_037639240.1:1-479)、尖吻鲈(XP_018552530.1:1- 479)、大黄鱼(XP_010744471.1:1-479)、鲤(XP_ 042624730.1:1-479)、鲫(Carassius auratus) (XP_ 026079993.1:1- 479)、斑马鱼(NP_001268730.1)、青鳉(XP_023819560.1:1-479)、非洲爪蟾(XP_018087413.1)、中国对虾(Penaeus chinensis) (AHY28871.1)、凡纳对虾(AHY28871.1)、青蟹(Scylla paramamosain) (ASF83356.1)、黑腹果蝇(CAA81204.1)、香港牡蛎(Crassostrea hongkongensis) (ALN96976.1)、贻贝(CAG2211774.1)、智人(XP_047287031.1)、小鼠(NP_001159366.1)、绵羊(Ovis aries) (NP_001155329.1)和欧亚野猪(Sus scrofa) (BAH57696.1)的Akt氨基酸序列,以MEGA 7.0软件采用邻接法构建SsAkt的系统进化树。结果显示,19种Akt主要分成脊椎动物和无脊椎动物两大分支:脊椎动物中,SsAkt先与亲缘关系相近的荫平鲉、大黄鱼以及尖吻鲈等海水鱼的Akt氨基酸聚群,然后与青鳉、鲤、鲫、斑马鱼、非洲爪蟾、欧亚野猪、绵羊、小鼠和智人的Akt聚集在一支;无脊椎动物的Akt,包括中国对虾、凡纳对虾、青蟹、黑腹果蝇、香港牡蛎和贻贝等聚为一个分支,表明该基因的系统进化关系与传统的物种进化地位基本一致(图 6)。
|
图 6 基于SsAkt氨基酸序列构建的NJ系统进化分析 Fig.6 Neighbor-joining phylogenetic tree based on Akt amino acid sequence from S. schlegelii 用“※”标记SsAkt;树节点上的数字表示1 000次重复之后的百分比。 The SsAkt of S. schlegelii is marked with "※", and the number on the tree nodes indicate the percentage after 1 000 replicates. |
SsAkt基因的mRNA在健康许氏平鲉不同组织中的表达分析结果显示,SsAkt在血液、鳃、肝脏、肌肉、肾脏、脾脏、肠和心脏中均有表达,但表达水平各不相同。其中,肾脏中相对表达量最高,是肌肉中的50倍(P < 0.05);在脑、血液、脾脏和心脏中表达量较高;在肠道、鳃和肝脏中的表达较低;在肌肉中的表达量最低(图 7)。

|
图 7 SsAkt基因在不同组织中的相对表达量 Fig.7 Relative expression level of SsAkt gene in different tissues of S. schlegelii 不同小写字母表示组间差异显著(P < 0.05)。M:肌肉;L:肝脏;G:鳃;I:肠道;H:心脏;S:脾脏;B:血液;Br:脑;K:肾脏 Different lower-case letters indicate significant differences between groups (P < 0.05). M: Muscle; L: Liver; G: Gill; I: Intestine; H: Heart; S: Spleen; B: Blood; Br: Brain; K: Kidney |
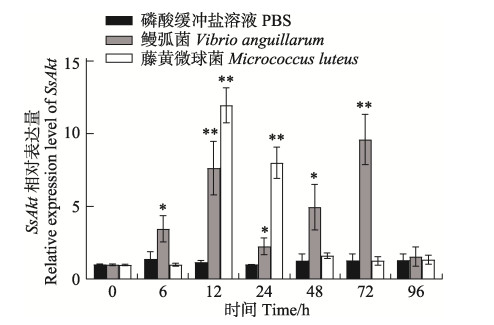
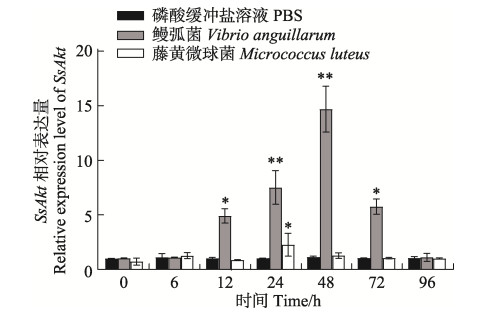
藤黄微球菌、鳗弧菌感染后,SsAkt在肾脏、血液和肝脏中均有显著性表达差异。在肾脏中,藤黄微球菌和鳗弧菌刺激后,SsAkt的表达模式不同:藤黄微球菌刺激后,SsAkt的表达呈先上升后下降的趋势,具体表现为12 h时相对表达量显著升高(P < 0.01),达到表达量的峰值,24 h时表达量显著下降,48 h时恢复至对照组水平;鳗弧菌刺激后,SsAkt的表达呈先上升后下降又上升再下降的规律,具体表现为6 h时SsAkt的相对表达量开始显著升高(P < 0.05),至12 h时升到最高,24 h时显著下降(P < 0.01),48 h再次显著升高(P < 0.05),于72 h到达峰值(P < 0.01),96 h时恢复至原有对照组水平(图 8)。在血液和肝脏中,藤黄微球菌和鳗弧菌刺激后,SsAkt的表达模式相似,均呈先上升后下降的趋势。在血液中,2种细菌刺激后,24 h时SsAkt的相对表达量均显著升至最高(P < 0.05),48 h时鳗弧菌刺激组恢复至对照组水平,而藤黄微球菌组48 h时依然保持显著高表达(P < 0.05),72 h时恢复至对照组水平(图 9);在肝脏中,藤黄微球菌刺激后,SsAkt的相对表达量在24 h时显著升至最高(P < 0.05),至48 h时恢复至对照组水平;而鳗弧菌刺激后,SsAkt的相对表达量在12、24、48 h时显著持续升高(P < 0.01),48 h时到达最高峰,72 h时表达量显著下降(P < 0.05),至96 h恢复至对照组水平(图 10)。整个实验过程中,磷酸缓冲盐溶液刺激后,SsAkt在肾脏、血液和肝脏中的相对表达量均未发生显著变化(P > 0.05)。
|
图 8 细菌感染下许氏平鲉肾脏中SsAkt基因mRNA的相对表达量 Fig.8 Relative expression level of SsAkt mRNA in kidney of S. schlegelii after pathogens infection *:差异显著(P < 0.05);**:差异极显著(P < 0.01)。下同。 *: Significant difference (P < 0.05); **: Highly significant difference (P < 0.01). The same below. |

|
图 9 细菌感染下许氏平鲉血液中SsAkt基因mRNA的相对表达量 Fig.9 Relative expression level of SsAkt mRNA in blood of S. schlegelii after pathogens infection |
|
图 10 细菌感染下许氏平鲉肝脏中SsAkt基因mRNA的相对表达量 Fig.10 Relative expression level of SsAkt mRNA in liver of S. schlegelii after pathogens infection |
PI3K-Akt信号通路是细胞内重要信号转导通路之一,在维持细胞增殖、存活和凋亡中发挥关键作用。Akt作为PI3K-Akt信号通路中的核心分子,能够通过磷酸化其他蛋白质的方式传导多种信号产生的刺激,参与细胞增殖、细胞代谢、细胞凋亡等多种细胞过程,在生物的生长发育、免疫应答过程中发挥重要作用(刘丽等, 2019)。因此,深入开展Akt基因在水产动物生长发育、免疫防御等过程中所介导或参与的主要细胞通路及调控网络研究,对于水产动物种质保护、分子辅助育种及病害防控具有重要意义。本研究以许氏平鲉为研究对象,成功克隆了SsAkt基因的核心片段,预测了其编码蛋白的分子量为55.81 kDa,与已报道的牙鲆(Paralichthysolivaceus) Akt分子量(55.76 kDa) (刘丽等, 2019)、草鱼(Ctenopharyngodon idella) Akt3分子量(55.76 kDa) (于鸿燕, 2015)、九孔鲍(Haliotis diversicolor) Akt分子量(55.35 kDa) (刘丽等, 2019)、仿刺参Akt分子量(55.57 kDa) (刘丽等, 2020)大小相近,与中国对虾Akt (迟艳红等, 2013)的分子量(58.92 kDa)相差较大。研究表明,斑马鱼(谌爽等, 2011)、中华绒螯蟹(Eriocheir sinensis) (田志环等, 2018)、香港牡蛎(Wang et al, 2015)等不同种类的水产动物的Akt蛋白氨基酸序列中均存在PH结构域、激酶催化结构域(S_TKc)和调节结构域(S_TK_X),且具有相同的排列顺序(刘丽等, 2019)。本研究发现,许氏平鲉SsAkt同样包含3个典型的保守结构域,分别为PH结构域(6~109 aa)、丝氨酸/苏氨酸蛋白激酶催化(S_TKc)结构域(148~405 aa)和丝氨酸/苏氨酸型蛋白激酶(S_TK_X)结构域(406~475 aa)。其中,PH结构域可介导蛋白质–蛋白质或蛋白质–脂质之间的相互作用(Bottomley et al, 1998);S_TKc结构域具有Akt活化所必需的Thr305位点,是催化丝氨酸/苏氨酸磷酸化活性的区域;激酶S_TK_X结构域具有Akt完全活化所必需的第2个磷酸化位点Ser47 (Wang et al, 2015)。保守的Akt结构组成特征决定了该蛋白在水产动物体内发挥相同或相似的生物学特征(Ruan et al, 2014)。氨基酸序列比对显示,SsAkt的S_TKc结构域与其他生物的S_TKc结构域高度保守,说明SsAkt与大多数生物的Akt同源性较高。值得注意的是,SsAkt的氨基酸序列与尖嘴鲈Akt的相似度最高,达99.37%,与大黄鱼、青鳉、鲤的相似度高于95%,与哺乳动物智人和小鼠的相似度高于75%,与无脊柱动物凡纳对虾、贻贝的相似度高于55%,说明亲缘关系越近的物种,同源性越高。许氏平鲉SsAkt的系统进化分析显示,SsAkt先与尖吻鲈、大黄鱼、青鳉等鱼类聚为一类,再与小鼠、智人等哺乳动物聚为一支,最后与无脊椎动物聚为一支,这与传统的许氏平鲉进化和分类地位一致,也在一定程度上为许氏平鲉的进化位置提供了证据。
斑马鱼(谌爽等, 2011)、仿刺参(刘丽等, 2020)、中华绒螯蟹(田志环等, 2018)等水生生物Akt基因的组织表达具有广泛分布的特点,与以上研究结果相似,本研究发现,许氏平鲉SsAkt在所检测的9种组织中均有分布,表明Akt可能广泛参与机体各种生理活动。但SsAkt在不同组织中的表达存在显著的差异性,在许氏平鲉肾脏中的表达水平最高,在血液、脾脏等鱼类重要的免疫器官(Zapata et al, 2006)中表达水平也相对较高,推测其可能在免疫调控中发挥重要作用,相同的推论在智人(Meier et al, 1997)、白绒山羊(cashmere goat)(杨娇馥等, 2011)、长白猪(Landrace pig) (钟宇等, 2014; 刘庆礼等, 2014)、凡纳对虾(刘荣雕, 2013)等生物Akt基因的组织表达谱中也能得出,不同的是它们呈现高表达量的组织部位不同。此外,本研究显示,SsAkt在许氏平鲉脑组织中也呈现较高的表达量,在9种检测组织中位居第二,表明该基因与神经发育和神经细胞存活的维持等过程密切相关,这与斑马鱼(谌爽等, 2011)、小鼠(Yang et al, 2003)的研究结果相似。Akt在不同物种各组织中的广泛分布和表达特异性,表明该基因在不同物种和不同组织中的表达都是相对保守的,证实了其功能的重要性(杨娇馥等, 2011)。
为了进一步探究SsAkt参与的免疫防御机制,本研究使用藤黄微球菌(G+)和鳗弧菌(G−)感染许氏平鲉,定量检测了肾脏、血液和肝脏中SsAkt的表达变化。结果发现,经外源微生物刺激后,3个组织中SsAkt的表达水平相较于对照组(PBS)均呈显著上调趋势,这与大菱鲆(Scophthalmus maximus) (Wei et al, 2020)、半滑舌鳎(Cynoglossus semilaevis) (孙璐明等, 2016)等海水鱼Akt基因受外源微生物刺激后的表达模式相似,表明Akt参与了海水鱼抵御外源微生物的过程。虽然2种细菌刺激后SsAkt的表达均呈显著上调趋势,但SsAkt的表达模式、应答时间以及应答周期等方面存在差异,表明SsAkt对革兰氏阳性菌和革兰氏阴性菌的响应机理不同。通过比较2种细菌刺激许氏平鲉后SsAkt的表达趋势发现:鳗弧菌刺激后,SsAkt在肾脏中的表达相较于藤黄微球菌刺激的时间早、周期长、模式复杂,在血液中达到峰值时表达量高,在肝脏中表达时间早、周期长,达到峰值时表达量高,这些现象说明,SsAkt更容易被革兰氏阴性菌诱导,且对革兰氏阴性菌刺激的应答更迅速。在分析SsAkt应答外源微生物刺激后的响应趋势时,发现2种细菌刺激后血液和肝脏中SsAkt的表达模式相似,均呈先上升后下降的趋势;但在肾脏中,2种细菌刺激后SsAkt的表达模式不同:藤黄微球菌刺激后,SsAkt的表达先上升后下降趋势,而鳗弧菌刺激后,SsAkt的表达呈先上升后下降又上升再下降的趋势,表明许氏平鲉的肾脏是SsAkt发挥免疫防御功能的重要场所,这一结论在许氏平鲉SsAkt不同组织的表达谱中同样可以被证实。鱼类抵抗病原的免疫应答中,先天性免疫在感染初期发挥主要作用,由肾脏、脾脏及黏膜相关淋巴组织执行(Ellis, 2001),这可能是SsAkt在肾脏中响应细菌胁迫时间早于血液和肝脏的原因。灿烂弧菌感染仿刺参后,体腔细胞中AjAkt的表达趋势(刘丽等, 2020)以及鳗弧菌感染中国对虾后头胸部FcAkt的表达呈先上升后下降又上升再下降的趋势,与本研究中鳗弧菌刺激后肾脏SsAkt的表达趋势一致,但鳗弧菌感染香港牡蛎后,血细胞中ChAkt1的表达趋势未出现二次上升和下降的趋势,而真菌刺激后,Akt却表现出先上升后下降又上升再下降的趋势(Wang et al, 2015),这表明Akt在不同生物中应答外源微生物刺激的响应方式不尽相同,在外源微生物胁迫和适应中具有种间差异性。
综上所述,本研究报道了许氏平鲉Akt基因的核心序列,预测了SsAkt蛋白的结构和功能,揭示了SsAkt进化的保守性,分析了SsAkt在许氏平鲉不同组织以及细菌胁迫后的表达规律,进一步丰富了海水鱼类Akt同源基因的研究数据。但SsAkt蛋白对外源微生物的作用方式尚不明确,后续将进一步构建SsAkt编码蛋白的重组载体,获取重组蛋白,制备重组蛋白抗体,进一步分析SsAkt编码蛋白的功能,为研究Akt的免疫防御功能提供理论指导,为许氏平鲉病害防控提供分子生物学数据参考。
BOTTOMLEY M J, SALIM K, PANAYOTOU G. Phospholipid-binding protein domains. Biochimica et Biophysica Acta, 1998, 1436(1/2): 165-183 |
CHEN S, ZHOU J F, LU L, et al. Molecular cloning, expression and overexpression analysis of AKT3 (PKBγ) in zebrafish. Acta Hydrobiologica Sinica, 2011, 35(5): 717-726 [谌爽, 周建峰, 卢玲, 等. 斑马鱼akt3基因的克隆及其表达图谱与过表达分析. 水生生物学报, 2011, 35(5): 717-726] |
CHEN Y Z. Isolation and characterization of Vibrio harveyi P5W and transcriptome analysis of its infections in Sebastes schlegelii. Masterxs Thesis of Shanghai Ocean University, 2021 [陈钰臻. 哈维氏弧菌P5W的分离鉴定、特性分析及其感染后许氏平鲉的转录组分析. 上海海洋大学硕士研究生学位论文, 2021]
|
CHI Y H, LI S H, WANG D D, et al. Expression and function analysis of Akt/PKB in pathogens-challenged Chinese shrimp Fenneropenaeus chinensis. Oceanologia et Limnologia Sinica, 2013, 44(3): 611-617 [迟艳红, 李诗豪, 王冬冬, 等. 中国明对虾(Fenneropenaeus chinensis) Akt/PKB基因在病原刺激下的表达和功能分析. 海洋与湖沼, 2013, 44(3): 611-617] |
ELLIS A E. Innate host defense mechanisms of fish against viruses and bacteria. Developmental and Comparative Immunology, 2001, 25(8/9): 827-839 |
FENG J, LIU L, JIANG H, et al. Histological observation of germ cell development and discovery of spermatophores in ovoviviparous black rockfish (Sebastes schlegeli Hilgendorf) in reproductive season. Journal of Ocean University of China, 2014, 13(5): 830-836 DOI:10.1007/s11802-014-2265-6 |
JIANG H, ZHANG X J. PKB/Akt: A protein kinase with multiple functions. Chinese Bulletin of Life Sciences, 2004, 16(3): 148-153, 164 [姜华, 张学军. PKB/Akt: 一个具有多种功能的蛋白激酶. 生命科学, 2004, 16(3): 148-153, 164 DOI:10.3969/j.issn.1004-0374.2004.03.005] |
JONES P F, JAKUBOWICZ T, PITOSSI F J, et al. Molecular cloning and identification of a serine/threonine protein kinase of the second-messenger subfamily. Proceedings of the National Academy of Sciences, 1991, 88(10): 4171-4175 DOI:10.1073/pnas.88.10.4171 |
KELLEY L A, MEZULIS S, YATES C M, et al. The Phyre2 web portal for protein modeling, prediction and analysis. Nature Protocols, 2015, 10(6): 845-858 DOI:10.1038/nprot.2015.053 |
KOUL D, SHEN R, BERGH S, et al. Inhibition of Akt survival pathway by a small-molecule inhibitor in human glioblastoma. Molecular Cancer Therapeutics, 2006, 5(3): 637-644 DOI:10.1158/1535-7163.MCT-05-0453 |
LI Y, XU Y, CHEN W B, et al. Pathogen identification of bacterial disease in marine cage cultured Sebastes schlegelii and the study of pathogenicity. Journal of Aquaculture, 2021, 42(2): 18-23 [李赟, 许岩, 陈文博, 等. 海水网箱养殖许氏平鲉细菌性疾病病原鉴定及致病性研究. 水产养殖, 2021, 42(2): 18-23 DOI:10.3969/j.issn.1004-2091.2021.02.004] |
LIU L, CHEN Y, REN L Y, et al. Cloning, expression and biological function analysis of Akt gene from Apostichopus japonicus. Genomics and Applied Biology, 2020, 39(12): 5705-5717 [刘丽, 陈阳, 任丽媛, 等. 仿刺参Akt基因的克隆及其表达和生物功能分析. 基因组学与应用生物学, 2020, 39(12): 5705-5717] |
LIU L, SUN J X, CHANG Y Q, et al. Research progress on Akt gene in aquatic animals: A review. Journal of Dalian Fisheries University, 2019, 34(4): 602-609 [刘丽, 孙景贤, 常亚青, 等. 水产动物Akt基因研究进展. 大连海洋大学学报, 2019, 34(4): 602-609] |
LIU Q L, LI J, WANG Y J, et al. Molecular cloning, sequence analysis and tissue expression of Akt3 gene in pigs (Sus scrofa). Journal of Sichuan University (Natural Science), 2014, 51(4): 815-820 [刘庆礼, 李娟, 王亚军. 猪Akt3基因克隆、序列分析及组织表达图谱研究. 四川大学学报(自然科学版), 2014, 51(4): 815-820 DOI:10.3969/j.issn.0490-6756.2014.04.030] |
LIU R D, RUAN L W. PI3K-Akt signaling pathway and viral infection. Biotechnology Bulletin, 2013(6): 53-62 [刘荣雕, 阮灵伟. PI3K-Akt信号通路与病毒感染. 生物技术通报, 2013(6): 53-62] |
LIU R D. Characterization of immune-related genes, LVAKT and LVFLOT, from shrimp Litopenaeus vannamei. Masterxs Thesis of Third Institute of Oceanography, 2013 [刘荣雕. 凡纳滨对虾免疫相关分子LVAKT与LVFLOT的初步研究. 国家海洋局第三海洋研究所硕士研究生学位论文, 2013]
|
LIU Y, HAN H Z, WANG T T, et al. Phenotypic analysis of the main morphological traits and body weight of black rockfish (Sebastes schlegelii). Progress in Fishery Sciences, 2019, 40(5): 117-125 [刘阳, 韩慧宗, 王腾腾, 等. 许氏平鲉体质量与形态性状的表型特征分析. 渔业科学进展, 2019, 40(5): 117-125] |
MEIER R, ALESSI D R, CRON P, et al. Mitogenic activation, phosphorylation, and nuclear translocation of protein kinase B. Journal of Biological Chemistry, 1997, 272(48): 30491-30497 DOI:10.1074/jbc.272.48.30491 |
MING Y, NIU Y J, FU X Z, et al. Role of Siniperca chuatsi AKT2 in proliferation of infectious spleen and kidney necrosis virus. Journal of Northwest A & F University (Natural Science), 2021, 49(2): 14-22 [明月, 牛银杰, 付小哲, 等. 鳜AKT2在传染性脾肾坏死病毒增殖中的作用. 西北农林科技大学学报(自然科学版), 2021, 49(2): 14-22] |
MOHAMAD N, AMAL M N A, YASIN I S M, et al. Vibriosis in cultured marine fishes: A review. Aquaculture, 2019, 512: 734289 DOI:10.1016/j.aquaculture.2019.734289 |
RUAN L W, LIU R D, XU X, et al. Molecular cloning and characterization of a threonine/serine protein kinase lvakt from Litopenaeus vannamei. Journal of Oceanology and Limnology, 2014, 32(4): 792-798 DOI:10.1007/s00343-014-3295-z |
SUN L M, YU M J, CHEN Y D, et al. AKT-interacting protein gene cloning and its expression profile in response to pathogen infection in half smooth tongue sole (Cynoglossus semilaevis). Acta Hydrobiologica Sinica, 2016, 40(3): 467-473 [孙璐明, 于孟君, 陈亚东, 等. 半滑舌鳎AKT-ineracting protein基因的克隆及免疫应答表达分析. 水生生物学报, 2016, 40(3): 467-473] |
TAKAHASHI H, MIYA S, KIMURA B, et al. Difference of genotypic and phenotypic characteristics and pathogenicity potential of Photobacterium damselae subsp. damselae between clinical and environmental isolates from Japan. Microbial Pathogenesis, 2008, 45(2): 150-158 |
TIAN Z H, JIAO C Z, CHENG Y X, et al. Molecular cloning, sequence analysis and tissue expression of serine/ threoninekinases Akt from Eriocheir sinensis. Journal of Fisheries of China, 2018, 42(4): 485-494 [田志环, 焦传珍, 成永旭, 等. 中华绒螯蟹Akt基因的cDNA克隆、序列分析及表达特征. 水产学报, 2018, 42(4): 485-494] |
WANG F, XIAO S, ZHANG Y, et al. ChAkt1 involvement in orchestrating the immune and heat shock responses in Crassostrea hongkongensis: Molecular cloning and functional characterization. Fish and Shellfish Immunology, 2015, 47(2): 1015-1023 DOI:10.1016/j.fsi.2015.11.009 |
WANG T T. Identification, characterization and application of a lactic acid bacteria isolated from intestine of Sebastes schlegelii. Masterxs Thesis of Shanghai Ocean University, 2017 [王腾腾. 一株许氏平鲉肠道乳酸菌的分离鉴定、特性分析及其应用研究. 上海海洋大学硕士研究生学位论文, 2017]
|
WEI Y, LIANG M, XU H. Fish protein hydrolysate affected amino acid absorption and related gene expressions of IGF-1/AKT pathways in turbot (Scophthalmus maximus). Aquaculture Nutrition, 2020, 26(1): 145-155 |
XU D D, TANG Y J, WANG G H, et al. Research progress on Akt gene. Biotechnology World, 2014(1): 8 [徐丹丹, 唐彦君, 王桂华, 等. Akt基因的研究进展. 生物技术世界, 2014(1): 8] |
YANG J F, SHI J J, LIANG Y, et al. Cloning and expression pattern of protein kinase B/AKT gene in Inner Mongolia cashmere goat. Scientia Agricultura Sinica, 2011, 44(13): 2787-2795 [杨娇馥, 史偈君, 梁燕, 等. 内蒙古白绒山羊蛋白激酶B/AKT基因的克隆及表达模式分析. 中国农业科学, 2011, 44(13): 2787-2795] |
YANG Z Z, TSCHOPP O, HEMMINGS-MIESZCZAK M, et al. Protein kinase Bα/Akt1 regulates placental development and fetal growth. Journal of Biological Chemistry, 2003, 278(34): 32124-32131 |
YU H Y. Cloning and expression analysis of three genes involved in PI3K/AKT pathway from Ctenopharyngodon idella. Masterxs Thesis of Shanghai Ocean University, 2015 [于鸿燕. 草鱼三个PI3K/AKT通路相关基因的克隆和表达分析. 上海海洋大学硕士研究生学位论文, 2015]
|
ZAPATA A, DIEZ B, CEJALVO T, et al. Ontogeny of the immune system of fish. Fish and Shellfish Immunology, 2006, 20(2): 126-136 |
ZHONG Y, WANG Y J, LI J, et al. Molecular cloning and tissue expression of Akt1 and Akt2 gene inlandrace pigs. Journal of Sichuan University (Natural Science), 2014, 51(2): 365-370 [钟宇, 王亚军, 李娟. 猪Akt1、Akt2基因克隆与组织表达图谱分析. 四川大学学报(自然科学版), 2014, 51(2): 365-370] |
ZHOU X, CHENG S, ZHAO C, et al. Expression and functional analysis of the Akt gene from Daphnia pulex. Comparative Biochemistry and Physiology Part B Biochemistry and Molecular Biology, 2020, 248/249: 110462 |



